Determinar el estadio de fibrosis hepática es esencial en el manejo de la enfermedad hepática en pacientes con hepatitis crónica por virus C. La biopsia hepática ha sido considerada el gold standard para diagnosticar la enfermedad, la actividad necroinflamatoria y el estadio de fibrosis, pero tiene algunas limitaciones técnicas y riesgos. Teniendo en cuenta estas limitaciones, existe cierta exigencia en introducir biomarcadores séricos no invasivos para el diagnóstico de fibrosis que podrían ser capaces de reemplazar parcialmente a la biopsia hepática. El biomarcador sérico ideal debería ser específico para el hígado y fácil de determinar. Los marcadores séricos se dividen en directos e indirectos. Los directos reflejan el recambio de la matriz extracelular, mientras que los indirectos reflejan alteraciones en la función hepática. Aunque todavía está limitado el grado de implementación de los test no invasivos de fibrosis hepática, esta revisión es una visión de conjunto de los biomarcadores, índices y algoritmos diagnósticos de fibrosis hepática estudiados en hepatitis crónica C pero con un interés potencial en otras hepatopatías crónicas.
Precise staging of liver fibrosis is essential in the management of liver disease activity in chronic hepatitis C patients. Liver biopsy has been considered the reference method for diagnosing disease, grading necroinflammatory activity, and staging fibrosis, but it has some technical limitations and risks. Taking into account these limitations, there is a need to introduce non-invasive serum markers for fibrosis that would be able to partially replace liver biopsy. Ideal serum markers should be specific for the liver and easy to perform. Serum markers of hepatic fibrosis are divided into direct and indirect. Direct markers reflect extracellular matrix turnover, whereas indirect markers reflect alterations in hepatic function. The degree of implementation of non-invasive diagnostic tests for liver fibrosis still remains limited. This review provides a current overview of biomarkers, indexes and algorithms for hepatic fibrosis diagnosis in chronic hepatitis C patients.
Se define fibrosis hepática como la acumulación en exceso de proteínas de la matriz extracelular (MEC), en un proceso biosintético activo, que altera la arquitectura hepática y termina ocurriendo en la mayoría de las enfermedades hepáticas crónicas1.
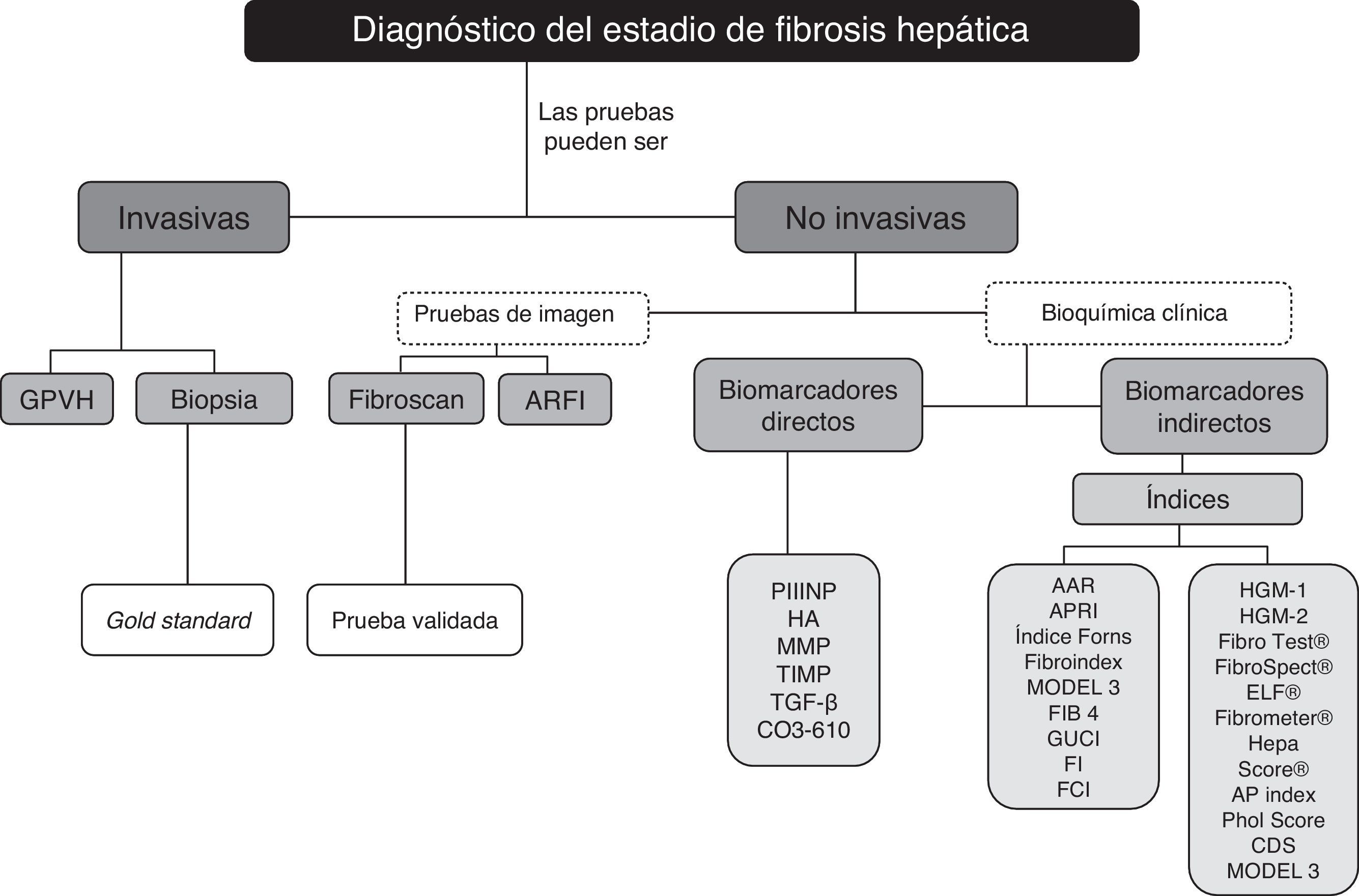
Las enfermedades hepáticas crónicas, entre las que encontramos la hepatitis por virus C, constituyen un gran problema sanitario2. El diagnóstico del estadio de fibrosis resulta primordial tanto para establecer las decisiones terapéuticas, como para el seguimiento, además del valor pronóstico y de cribado. La biopsia hepática (BH) ha sido considerada hasta la fecha como el gold standard en el diagnóstico del estadio de fibrosis hepática aunque conlleva serios inconvenientes como iatrogenia, error de muestra, gasto económico y variabilidad interobservador3. Se han desarrollado diferentes sistemas de clasificación como el sistema METAVIR, Scheuer, Knodell, o Ishak3,4. Más recientemente se están usando para el diagnóstico del estadio de fibrosis las pruebas de imagen como la elastografía de transición pero estas no son siempre accesibles. Por todo ello, resulta de gran interés clínico poder sustituirlas, al menos en parte, por pruebas no invasivas disponibles y de menor coste como los biomarcadores séricos5,6, estos pueden ser utilizados de manera individual o formando parte de diversos índices (fig. 1), además, esto tendría un impacto muy positivo en el diseño de los tan necesarios ensayos clínicos1.
Biomarcadores séricos de fibrosis hepáticaEn la actualidad se están buscando biomarcadores séricos de fibrosis hepática que permitan diagnosticar el estadio de fibrosis hepática sin necesidad de recurrir a la BH. El biomarcador ideal debería de reunir las siguientes características7:
- 1.
Ser altamente sensible y específico para identificar los diferentes estadios de fibrosis.
- 2.
Dar resultados reproducibles, ser seguro, barato y disponible.
- 3.
Ser aplicable a la monitorización de la evolución natural de la enfermedad o de la evolución con el tratamiento.
- 4.
No ser susceptible de dar falsos positivos en pacientes con otras enfermedades ni tampoco falsos negativos.
Aunque por el momento no existe el biomarcador ideal en solitario, existe un gran número de biomarcadores sometidos a estudio. Los biomarcadores han sido clasificados en directos e indirectos. Los directos están directamente relacionados con las modificaciones del recambio de la MEC que ocurren en la fibrogénesis o involucrados en el propio mecanismo fibrogénico6. Algunos de ellos son fragmentos de los componentes de la MEC producidos por las células hepáticas estrelladas (HSC), que son las principales responsables de la fibrosis hepática, durante el proceso del remodelado de la MEC. Otros son enzimas relacionadas con el proceso de síntesis-degradación de la MEC o mediadores del proceso fibrogénico7.
Los marcadores indirectos incluyen moléculas liberadas en sangre debido a la inflamación y al daño hepático y moléculas sintetizadas o metabolizadas por el hígado. Marcadores que se ven alterados debido a la afectación hepática, como por ejemplo las transaminasas, el recuento de plaquetas, etc.7. Estos marcadores, que reflejan la alteración hepática pero no están directamente relacionados con la dinámica de la MEC6, se suelen emplear para calcular índices de fibrosis (tabla 1).
Fórmulas de los índices de fibrosis hepática no patentados
| AAR=AST [IU/L]/ALT [IU/L] |
| APRI=(AST [IU/L]/ULN)/PTL [109/L] |
| Fibroindex=1,738–0,064 (PTL[104/mm3])+0,005 (AST [IU/L])+0,463(gamma globulina [g/dl])Gamma globulina [g/dl]=(area gamma%* PT[g/dl]) |
| MODEL 3=exp (logodds)/(1+exp (logodds))Logodds= - 5,56–0,0089x PTL[109/L]+1,26x AST/ALT+5,27x INR |
| Forns index=7,811–3,131x ln (PTL[109/L])+0,781x ln (GGT [IU/L])+3,467x ln(edad)–0,014x CHOL [mg/dl] |
| FIB 4= edad x AST [UI/L]/(PTL [109/L] x (ALT [UI/L])1/2) |
| GUCI=(AST [IU/L]/ULN) x INRx100/PTL [109/L] |
| FI=8–0,01x PTL [109/L]–Alb [g/dL] |
| FCI=ALP [IU/L] x Bb [mg/dL]/(Alb [g/dL] x PTL [109/L]) |
| HGM-1= 1/(1+ e (1,97+0,012x PTL [109/L] - 0,026x AST [IU/L]–0,033xGlu [mg/dL])) |
| HGM-2=1/(1+e (6,175-0,010 x ALP [IU/L]–4,8xINR+0,010x PTL [109/L]–0,007x AST [IU/L])) |
| Pohl score (positivo/negativo)AAR=AST/ALTPositivo: si AAR≥1 y PTL< 150 [109/L] |
| AP index (valor 0-10) = edad (valor)+PTL(valor)Valor de la edad: <30=0, de 30-39=1, de 40-49=2, de 50-59=3, de 60-69=4, ≥70=5Valor de PTL [109/L]: ≥225=0, de 200-224=1, de 175-199=2, de 150-174=3, de 125-149=4, <125=5 |
| CDS score (valor 0-11)=PTL(valor)+ALT/AST (valor)+INR (valor)Valor de PTL: >340=0, de 280-239=1, de 220-279=2, de 160-219=3, de 100-159=4, de 40-99=5, <40=6Valor de ALT/AST: >1,7=0, de 1,2-1,7=1, de 0,6-1,19=2, <0,6=3Valor de INR: <1,1=0, de 1,1-1,4=1, >1,4=2 |
Alb: albúmina; ALP: fosfatasa alcalina; AST: alanina aminotransferasa; AST: aspartato aminotransferasa; Bb: bilirrubina; CHOL: colesterol; GGT: gamma glutamil transferasa; Glu: glucosa; Ig: gammaglobulinas; INR: ratio internacional del tiempo de protrombina; PT: proteínas totales; PTL: plaquetas; ULN: límite alto de normalidad. En corchetes se indican las unidades de cada parámetro.
A continuación se comentan algunos de los biomarcadores directos más conocidos y algunos de los más novedosos en estudio.
Péptido amino terminal del procolágeno tipo IIIEl péptido amino terminal del procolágeno tipo III (PIIINP) es el producto de la escisión del extremo N terminal del procolágeno III, por colagenasas extracelulares en su paso a colágeno III8. En la fibrogénesis la MEC pasa a ser una matriz rica en colágeno intersticial9,10 y se incrementa el contenido en colágeno III. Este es uno de los componentes más abundantes del tejido conectivo y su incremento en la fibrogénesis se acompaña de un incremento de PIIINP en el suero11.
Ácido hialurónicoEl ácido hialurónico (HA) es un polímero lineal con unidades repetidas de disacáridos (ácido D-glucurónico [1-beta3] nacetil-Dglucosamina [1-beta4]). El HA está distribuido en el espacio extracelular, se produce por las HSC y es degradado por las células endoteliales hepáticas8. Se ha evaluado como biomarcador de fibrosis hepática y su principal utilidad diagnóstica es la capacidad de excluir fibrosis avanzada y cirrosis5.
Metaloproteasas de matriz extracelularLas metaloproteasas de matriz extracelular (MMP) son endopeptidasas dependientes de cinc, pertenecen a una familia de enzimas proteolíticas que median en la degradación de la MEC y la membrana basal12. Las MMP degradan el colágeno en zonas específicas, y las más estudiadas son la MMP-2 (gelatinasa A) y la MMP-9 (gelatinasa B). La MMP-2 es secretada por las HSC activadas y se han observado valores aumentados de MMP-2 y su proenzima en varias enfermedades hepáticas. Esta metaloproteasa es la responsable de la degradación del colágeno tipo IV, cuyo depósito se incrementa en la cirrosis13,14. La concentración de MMP-2 está incrementada en pacientes cirróticos, se cree que se eleva por compensación para degradar el exceso de colágeno tipo IV, pero aun así el balance neto es de sobreproducción de este colágeno15. El patrón de expresión de MMP-2 y MMP-9 está alterado en fibrosis hepática, ya que mientras MMP-2 se incrementa MMP-9 disminuye16. En otro estudio los niveles séricos de MMP-9 se correlacionaban negativamente con la severidad histológica de la enfermedad en hepatitis crónica por VHC17.
Inhibidores tisulares de metaloproteasas de la matriz extracelularLos inhibidores tisulares de metaloproteasas de la matriz extracelular (TIMP) son unas proteínas secretadas que interaccionan con las MMP y modulan su actividad y funcionamiento. TIMP-1 controla la actividad de la mayoría de las MMP, mientras que TIMP-2 inhibe de manera específica a la MMP-2. El incremento de la concentración o de la actividad de inhibición de las TIMP puede disminuir la degradación de la MEC promoviendo así la fibrosis hepática. Se ha observado la elevación de las TIMP en enfermedades hepáticas crónicas. Los valores de MMP-9 decrecían al incrementar el estadio de fibrosis hepática y todavía más en cirrosis, mientras que los niveles de TIMP-1 se incrementaban con la progresión de la fibrosis16,18. El incremento de TIMP-1 se considera que promueve la acumulación de MEC debido al enlentecimiento de la fibrolisis. El potencial diagnóstico de TIMP-1 es alto, detecta cirrosis y fibrosis con buena sensibilidad y especificidad16.
Factor de crecimiento transformante β1El factor de crecimiento transformante beta 1 (TGF-β1), una citoquina pleiotrópica, resulta un componente clave y central de la respuesta fibrogénica al daño hepático y está sobrerregulada en varias enfermedades1,5. TGF-β1 está directamente implicado en los mecanismos moleculares de la fibrogénesis hepática y está fuertemente sobreexpresado en el tejido hepático fibrótico. Existe correlación entre los niveles de TGF-β1 séricos y la velocidad de progresión a fibrosis. El incremento de los niveles séricos parece debido entre otras causas a la necrosis de los hepatocitos19,20.
Fragmento de degradación del colágeno tipo IIIEl fragmento de degradación del colágeno tipo III (CO3-610) se produce cuando la MMP-9 corta el colágeno tipo III en el sitio de corte KNGETGPQGP. Durante la fibrosis se produce un desequilibrio y la producción de colágeno tipo I y III sobrepasa su degradación. En un modelo de fibrosis inducida en ratas, los niveles séricos y urinarios de CO3-610 se correlacionaban de manera significativa con la progresión de fibrosis21,22. En el estudio de Segovia-Silvestre23 se demostraba la correlación del CO3-610 tanto con la fibrosis hepática como con la hipertensión portal asociada a esta.
Fragmento C-terminal de la cadena α del fibrinógenoEn un reciente estudio, en pacientes con hepatitis crónica por VHC trasplantados, se analizó el perfil proteómico por espectrometría de masas (Surface Enhanced Laser Desorption Ionization Time Of Flight Mass Spectrometry). Se identificó el déficit del fragmento C-terminal de la cadena α del fibrinógeno como un biomarcador temprano de fibrogénesis. En los cultivos celulares se observó que TGF-β, citoquina clave en la fibrogénesis, reducía la expresión del mRNA del fibrinógeno por lo que TGF-β podría regular los niveles séricos de este fragmento24.
mRNA del CCL5Un estudio que investigaba el perfil de expresión génica en HSC demostraba la implicación del mRNA del CCL5, el ligando para el receptor de quimiocinas CCR5, en la regulación fibrogénesis y lo identificaba como un biomarcador de fibrosis hepática. El tratamiento con Peg-IFN-α suprimía los niveles de mRNA CCL5 in vivo25.
Así pues, existen novedosos y prometedores biomarcadores séricos en fase de estudio. Los biomarcadores ya conocidos tienen limitaciones que hay que tener en cuenta26:
- 1.
Reflejan la velocidad de recambio de la MEC, no solo el depósito de la MEC, y tienen tendencia a ser más elevados cuando se asocian a mucha actividad inflamatoria.
- 2.
No son totalmente específicos del hígado y sus niveles séricos podrían estar elevados en presencia de inflamación u otras patologías.
- 3.
Los niveles séricos dependen del aclaramiento, que puede estar influenciado por la disfunción de las células endoteliales, la excreción biliar alterada o la disfunción renal.
Los índices o scores son fórmulas matemáticas cuyas variables pueden ser biomarcadores, directos o habitualmente indirectos y también parámetros demográficos como la edad o el sexo. Se han diseñado numerosos índices basados en biomarcadores, tanto patentados como no patentados, para obtener una eficacia diagnóstica mayor que la de los biomarcadores por separado (tabla 1)27. Así mismo, se han publicado numerosos estudios de los test séricos, pero existen algunas discrepancias en sus resultados. Existen diferencias metodológicas entre los estudios como: los sistemas de clasificación de la biopsia, el número de pacientes, tipo de población y prevalencia de los diferentes estadios de fibrosis, entre otras. Los estudios difieren también en el análisis estadístico por lo que no siempre es posible comparar el mismo tipo de resultados y sacar conclusiones. Por todo ello existe controversia sobre los mejores índices cuando se comparan en diferentes estudios28. Sin embargo, entre los índices más ampliamente estudiados y validados se encuentran el APRI, FibroTest® y el ELF®. A continuación se comentan estos y algunos otros de los índices más conocidos.
AST/ALT RatioEl AST/ALT ratio (AAR) es uno de los primeros índices publicados, se basa en la ratio entre las transaminasas, aspartato aminotransferasa (AST) y alanino aminotransferasa (ALT), enzimas clásicamente consideradas específicas de daño hepatocelular, pero que pueden elevarse en patologías no hepáticas como miopatías u otras29. Sus resultados para discriminar cirrosis (E4) son controvertidos, buenos para algunos autores30–32 mientras que otros discrepan33,34. Su capacidad de discriminar fibrosis significativa (E≥2) disminuye en todos estos estudios.
AST/PTL Ratio IndexEl AST/PTL Ratio Index (APRI) es el cociente entre la AST y el recuento de plaquetas (PTL). Es un índice sencillo, pero es de los más estudiados y obtiene buenos resultados en muchos estudios. Ha sido validado como marcador de fibrosis hepática en pacientes monoinfectados con hepatitis C (VHC) y en coinfectados VIH/VHC35. El valor del APRI se eleva en fibrosis debido al aumento sérico de AST y a la trombocitopenia. La fórmula varía según se aplique a hombres o a mujeres dado que el ULN es diferente según el género.
Para diagnosticar cirrosis (E4) obtiene buenos valores de AUROC (área bajo la curva)30,34,36-38. En un metaanálisis de 22 estudios (n=4.266) también obtenía buenos resultados, la mayor fortaleza del APRI, según este estudio, era que excluía la cirrosis (E4) con un elevado valor predictivo negativo (VPN 91-94%)36 aunque existen discrepancias con los resultados de otos autores25. Para discriminar fibrosis significativa (E≥2) también obtiene buenos resultados30,34. En el metaanálisis de Shaheen et al.36 el AUROC era más modesto, siendo todavía inferior en el estudio de Yung-Yu et al.25.
Índice FornsEl índice Forns se basa en cuatro parámetros: edad, PTL, niveles de colesterol (CHOL) y gamma-glutamil-transferasa (GGT)39. Según el estudio de Macías et al 40 se puede usar para diferenciar entre pacientes con fibrosis no significativa y fibrosis más severa.
FibroIndexEl FibroIndex fue desarrollado por Koda et al.41 para evaluar la fibrosis en hepatitis crónica por VHC. Se calcula a partir de: PTL, AST y gammaglobulinas. Según Halfon et al.42 tiene una eficacia diagnóstica menor que la de otros índices como APRI, índice Forns o el FibroTest®.
AP indexEl AP index se basa en la suma de la puntación asignada según la edad y PTL. Obtiene valores entre 0-10. Es un índice muy sencillo para predecir lesiones histológicas en pacientes con hepatitis C. Fue diseñado a partir de 500 pacientes crónicos sin tratamiento, y sin coinfección con hepatitis B ni A. Se validó con una población de 120 pacientes43.
Pohl scoreEl Pohl score es un índice dicotómico (positivo/negativo) que se basa en la ratio AST/ALT y PTL y fue diseñado para diagnosticar cirrosis y fibrosis avanzada (≥E3) en un estudio con 211 pacientes con VHC. Según sus autores obtenía una sensibilidad del 41,2% y especificidad del 99,1%44.
Cirrhosis Discriminant ScoreEl cirrhosis discriminant score (CDS) fue creado para diagnosticar cirrosis en pacientes con evidencia de hepatitis crónica C. Está basado en la suma de la puntuación de tres parámetros: PTL, la ratio de transaminasas (ALT/AST) y la ratio normalizada internacional del tiempo de protrombina (INR). Obtiene valores desde 0 hasta 11. Según sus autores el CDS es útil para confirmar cirrosis ya que pacientes con un punto de corte de CDS≥7 tienen una probabilidad muy alta de cirrosis, con una especificidad del 98%45.
Model 3El Model 3, al igual que el CDS, combina PTL, la ratio ALT/AST y el INR pero en una fórmula diseñada con un análisis de regresión logística. También se desarrolló para diagnosticar cirrosis. Se diseñó a partir de una cohorte de 783 pacientes, y se validó en 358 pacientes con hepatitis crónica C en tratamiento que participaban en un ensayo clínico conocido como Hepatitis Antiviral Long-term Treatment against Cirrhosis46.
FIB-4El índice FIB-4 combina AST, ALT, PTL y la edad. Fue originalmente desarrollado para el uso en pacientes coinfectados VHC-HIV a partir de un análisis de regresión logística47. Este modelo fue validado en una cohorte de pacientes monoinfectados por VHC48. Según el metaanálisis realizado por Poynard et al.49 a partir de tres estudios diferentes (n=1.184) el FIB-4 tiene valor pronóstico a 5 años en pacientes VHC crónicos.
Göteborg University Cirrhosis IndexEl Göteborg University Cirrhosis Index se diseñó a partir de una regresión logística que seleccionó los tres parámetros, AST, PTL e INR, como fuertemente correlacionados con la fibrosis hepática. Se realizó a partir del suero de 179 pacientes con hepatitis C crónica y la BH fue evaluada con el sistema Ishak. Los autores obtuvieron valores del AUROC, sensibilidad y especificidad, ligeramente superiores a los del APRI, para diagnosticar cirrosis y fibrosis avanzada50.
Fibrosis IndexEl Fibrosis Index (FI) es un índice sencillo de calcular que tiene como parámetros PTL y la albúmina sérica, biomarcadores seleccionados por regresión logística múltiple. El FI se diseñó con 368 pacientes con hepatitis crónica C para la cohorte de estimación y 249 para la de validación. Según sus autores el FI se correlacionaba bien con los estadios de fibrosis en la cohorte inicial y en la de validación, obteniendo buenos valores de sensibilidad y especificidad para predecir fibrosis y cirrosis51.
Fibrosis-Cirrhosis IndexEl Fibrosis-Cirrhosis Index (FCI) se basa en la fosfatasa alcalina (ALP), la bilirrubina (Bb), albúmina sérica y PTL. El estudio en el que se diseñó el FCI se realizó en 157 pacientes infectados con VHC y se determinaron además los valores de los índices AAR, APRI, FI y FIB-4. Según sus autores, el FCI predecía de forma fiable la fibrosis en pacientes infectados con VHC y era más eficiente que los otros índices mencionados33.
HGM-1 y HGM-2Estos índices HGM-1 y HGM-2 fueron desarrollados en el Hospital Gregorio Marañón (Madrid). El HGM-1 se basa en PTL, la AST y la glucosa y fue diseñado para predecir específicamente fibrosis significativa; el HGM-2 basado en PTL, la INR, la ALP y la AST para diagnosticar fibrosis avanzada. Se diseñaron para ser usados en pacientes coinfectados con VHC y HIV sin tratamiento anti-VHC. El grupo total fue de 296 pacientes y se asignaron de manera aleatoria al grupo de estimación 226 pacientes y 70 al grupo de validación52.
FibroTest® o FibroSure®El FibroTest® (FT®) o FibroSure®, nombre europeo o americano respectivamente, es el test patentado más estudiado para evaluar la fibrosis y la necroinflamación. El FibroTest® combina: haptoglobina, alfa 2 macroglobulina, apoA1, GGT y Bb, edad y género. El valor obtenido en el índice se correlaciona con la fibrosis hepática de diferentes etiologías53. Su valor diagnóstico ha sido validado en estudios multicéntricos en pacientes con hepatitis C crónica48. En un metaanálisis multicéntrico (n=2. 396) realizado por Poynard et al.49 el FibroTest® obtenía valor pronóstico a 5 años en pacientes con hepatitis crónica por VHC.
FIBROSpect II®El FIBROSpect II® es un test patentado que combina HA, TIMP-1 y alfa 2 macroglobulina. Este test fue diseñado para diferenciar fibrosis leve (METAVIR E0-1) de fibrosis severa (METAVIR E2-4) y se ha estudiado en cohortes de pacientes con hepatitis crónica C54.
Enhanced Liver Fibrosis®Enhanced Liver Fibrosis (ELF)® es un test patentado que deriva del Original European Liver Fibrosis, diseñado para el diagnóstico de enfermedades hepáticas55. El ELF®, diseñado para pacientes con hepatitis C, usa biomarcadores directos: TIMP-1, HA, y el PIIINP. Este índice muestra buena fiabilidad diagnóstica en la detección de fibrosis significativa y avanzada según Parkes et al.56. En el metaanálisis de Xie et al.57 (n=1826) ELF obtiene valores de AUROC mayores de 0,8 para discriminar fibrosis significativa, avanzada y cirrosis en pacientes de diferente etiología, entre ellas VHC. Según el estudio de Carrión et al.58 en pacientes con VHC y sometidos a trasplante hepático en el que también estudiaban TIMP-1, HA, y el PIIINP, concluían que estos eran capaces de discriminar entre pacientes con recurrencia del VHC leve o moderada a los 6 meses de la operación.
FibroMeter®El FibroMeter® tiene en cuenta los siguientes parámetros sanguíneos: PTL, índice de protrombina, AST, alfa-2 macroglobulina, HA, urea sérica, y edad59,60.
HepaScore®El HepaScore® combina las siguientes variables: edad, género, Bb, GGT, HA, y alfa 2 macroglobulina; el modelo fue validado en 104 pacientes61. En una cohorte de 512 pacientes el HepaScore® mostraba buenos resultados para predecir la fibrosis significativa (E≥2)62.
Algoritmos para el diagnóstico de fibrosis hepáticaRecientemente se han desarrollado algoritmos para el diagnostico de fibrosis hepática en estudios multicéntricos con un gran número de pacientes. Estos algoritmos combinan diferentes índices o pruebas de imagen de manera secuencial o en paralelo para mejorar la sensibilidad y la especificidad, aumentando así el rendimiento diagnóstico de las pruebas no invasivas.
El algoritmo de LeroyEs un algoritmo para la detección de fibrosis significativa (E≥2) que consiste en el uso simultáneo, en paralelo, de APRI, FibroTest® y la biopsia hepática. Está basado en la concordancia entre el APRI y el FibroTest®. Cuando la clasificación del APRI y del FibroTest® coinciden se evita la realización de la biopsia, cuando los resultados de los índices dan valores intermedios que tienen una seguridad diagnóstica inadecuada se tiene que realizar la biopsia hepática63.
Los algoritmos de BourliereBourliere et al. 64 proponen cinco combinaciones optimizadas del FibroTest® y APRI, y estos con el Forns index o Hepascore® para mejorar el rendimiento diagnóstico. Una de esas combinaciones llamada FibroPaca es un algoritmo para la detección de fibrosis significativa y cirrosis basado en el uso simultáneo, en paralelo, de APRI, Forns index, FibroTest® y la BH. Está basado en la concordancia entre el APRI, el Forns index y el FibroTest® y limita el uso de la biopsia hepática a los casos discordantes64.
El algoritmo de CasteraEste algoritmo propuesto por Castera et al.65 combina la elastografía de transición (FS) y el FibroTest® (FT) como primera línea de evaluación de la fibrosis. La elastografía hepática transitoria [FibroScan® (FS), Echosens, París, Francia] es un método que permite evaluar de forma rápida y no invasiva el grado de rigidez hepática. El sistema FS está basado en la propagación de una onda elástica a través de los tejidos que se relaciona de manera inversa con la fibrosis66. Ha demostrado su utilidad en diferentes enfermedades hepáticas pero tiene también limitaciones que pueden afectar a su fiabilidad como en pacientes con espacios intercostales estrechos, alto índice de masa corporal, en hepatitis aguda o colestasis extrahepáticas67. Cuando los resultados de la FS y el FibroTest® coinciden, no es necesaria la biopsia hepática pero cuando los resultados de ambos resultan discordantes se realiza la biopsia hepática65.
ELF combinado con ARFI o FibroScan®La combinación del test ELF®, basado en biomarcadores directos, con técnicas de imagen como Acoustic Radiation Force Impulse o FibroScan® incrementa la eficacia diagnóstica de estos por separado, y es capaz de diagnosticar fibrosis significativa (E≥2) y cirrosis tanto en pacientes trasplantados como en immunocompetentes67. Acoustic Radiation Force Impulse es una tecnología basada en una radiación acústica que detecta el grado de elasticidad de los tejidos68. En el estudio de Crespo et al.67, 2012, ARFI resultaba tan eficaz como el FibroScan® o el test ELF®.
Sequencial Algorithm for Fibrosis EvaluationOtros autores69, proponen un algoritmo donde combinan APRI, Forns index y FibroTest® para reducir la necesidad de biopsia hepática, en pacientes VHC, en un 50-70%. Más adelante estos mismos autores han combinado APRI con FibroTest® y han validado este método conocido como Sequencial Algorithm for Fibrosis Evaluation en una cohorte de pacientes de hepatitis C (n=2035)70. En Sequencial Algorithm for Fibrosis Evaluation se usa el APRI como primera línea seguido del FibroTest® y la biopsia hepática para los casos sin clasificar.
ConclusionesLa aplicación de todos estos métodos no invasivos en la práctica clínica de forma rutinaria sigue siendo limitada a pesar de los numerosos estudios realizados y de sus ventajas como: la reproducibilidad, no ser invasivos y su bajo coste. Pero es probable que en un futuro algunos biomarcadores séricos se conviertan en una herramienta importante en la práctica clínica, junto con las técnicas de imagen como la elastografía, para la detección de fibrosis.
El uso de biomarcadores o índices permitirá estudiar de forma continua a los pacientes, permitiendo el seguimiento de la evolución de su enfermedad (progresión/regresión de la fibrosis) y facilitará el diseño de los tan necesarios ensayos clínicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.