Las muestras de orina son las más frecuentemente procesadas en los laboratorios de microbiología clínica. Teniendo en cuenta que del 60 al 80% de las muestras proporcionan resultados negativos, es recomendable realizar un cribado de las orinas para disminuir los gastos y la carga de trabajo, y adelantar los resultados negativos. El objetivo del trabajo fue evaluar el rendimiento del recuento de leucocitos y de bacterias en el analizador Sysmex UF-1000i para discriminar qué muestras debían ser procesadas para el cultivo convencional.
Material y métodosMediante el procesamiento de una muestra representativa de la población de 922muestras de orina, se calcularon, mediante curvas ROC, los puntos de corte óptimos de recuento bacteriano y de recuento de leucocitos con la finalidad de obtener la mejor sensibilidad para la mayor especificidad y, utilizando estos valores, se calcularon las características operacionales del cribado. Los cálculos estadísticos fueron realizados mediante los programas Analyze-it v.2.11 para Microsoft Excel y SPSS v.20.0.
ResultadosLa mejor sensibilidad para la mayor especificidad se obtuvo con los puntos de corte de 247.850bacterias/ml o 31.800leucocitos/ml. Utilizando estos puntos de corte, se obtuvo una sensibilidad del 90,6% (IC 95%: 86,7-94,6), una especificidad del 66,3% (IC 95%: 62,9-69,9), un valor predictivo de la prueba positiva del 47,8% (43,0%-52,1%) y un valor predictivo de la prueba negativa del 95,4% (IC 95%: 93,4-97,4).
ConclusiónEl Sysmex UF-1000i muestra unas características operacionales adecuadas para su incorporación en los laboratorios de microbiología clínica.
Urine samples are those most commonly processed in clinical microbiology laboratories. Given that around 60-80% of samples are negative, a screening urine samples is recommended for reducing costs of and technical staff workload, and for anticipating negative results. The aim of the work was to evaluate the Sysmex UF-1000i performance obtained from bacterial counts and leukocyte counts in order to discriminate samples must be cultured.
Material and methodsBy processing a representative sample of the population of 922urines samples, an optimization of the screening was performed through calculating the optimal thresholds of the equipment through ROC curves in order to obtain the best sensitivity for the best specificity. Using these values, the operational characteristics of the screening were calculated. Statistical calculations were performed using the softwares Analyze-it v.2.11 for Microsoft Excel and SPSS v.20.0.
ResultsThe best sensitivity for the best specificity was obtained with the cut-offs 247,850bacteria/mL and 31,800 leukocytes/mL. By using these cutoffs, a 90,6% sensitivity (95% CI: 86.7-94.6), 66.3% specificity (95% CI: 62.9-69.9), 47.8% positive predictive value (95% CI: 43.0-52.1) and 95.4% negative predictive value (95% CI: 93.4-97.4) were obtained.
ConclusionThe Sysmex UF-1000i shows suitable operational characteristics for its incorporation into clinical microbiology laboratories.
Las muestras de orina para cultivo son las más frecuentemente recibidas y procesadas en los laboratorios de microbiología clínica. Dado que entre el 60 y el 80% de las muestras proporcionan resultados negativos de crecimiento en placa1, para reducir el tiempo en la emisión de informes y poder disminuir la carga de trabajo del personal técnico, se recomienda realizar un cribado de las orinas que llegan al laboratorio2.
Para realizar un cribado de las muestras de orina se han utilizado diferentes metodologías, como son la bioluminiscencia, la nefelometría y la citometría de flujo, además de utilizar analizadores del sedimento urinario que se basan en imágenes de microscopía automatizada3-6. El gold standard del diagnóstico microbiológico de las infecciones del tracto urinario (ITU) es el cultivo de la orina. En función de los criterios de interpretación del cultivo que se adoptan en cada caso, cada laboratorio establece unos valores de corte de los parámetros de los diferentes equipos que llevan a cabo el cribado de las muestras de orina; estos valores condicionan el rendimiento de los analizadores de sensibilidad, especificidad, valor predictivo de la prueba positiva y valor predictivo de la prueba negativa de los equipos. En una prueba de cribado interesa que la técnica tenga elevada sensibilidad y elevado valor predictivo negativo con el fin de minimizar el número de falsos negativos. En este sentido, la Oficina Europea de Directrices recomienda que una prueba rápida de cribado de orinas debe presentar una sensibilidad del 90 al 95%7. De esto modo, el objetivo del trabajo fue evaluar el rendimiento del recuento de leucocitos y de bacterias en el analizador Sysmex UF-1000i para discriminar qué muestras debían ser procesadas para el cultivo convencional.
Material y métodosEl estudio fue realizado en el servicio de microbiología del Hospital Clínico Universitario de Valladolid, que durante 2013 procesó un total de 22.243muestras de orina (grupo poblacional). Teniendo previsto un porcentaje de reposiciones del 10% y una estimación de muestras positivas del 30%±3%, se precisó, con una confianza del 95%, una muestra representativa de la población de 922orinas (datos obtenidos de la calculadora de tamaño muestral GRANMO versión 7.12 abril 2012). El periodo de estudio comprendió desde el uno de noviembre de 2013 hasta el uno de diciembre de 2013. Durante este periodo, en el servicio de microbiología se recibieron un total de 1.001orinas. Así, las orinas incluidas en el estudio supusieron un 92,1% sobre el total de orinas recibidas. Estas fueron recogidas mediante micción espontánea, instruyendo previamente a los pacientes para que recogiesen el chorro medio. Las orinas de pacientes menores de 5años y las que fueron obtenidas por punción suprapúbica, sondaje o nefrostomía fueron excluidas del estudio.
Las muestras de orina que llegaron al laboratorio se analizaron mediante el citómetro de flujo Sysmex UF-1000i. El equipo Sysmex UF-1000i utiliza 0,8ml de muestra en modo manual y 1,2ml en modo automático, y puede procesar hasta 100muestras/h8. Una vez la muestra es introducida en el equipo, se tiñe mediante colorantes de polimetina en 2 canales analíticos separados, uno para las bacterias y otro para las otras partículas de la orina. A continuación, la muestra se transfiere a una celda de flujo, en la cual, mediante el enfoque hidrodinámico, se alinean las partículas a analizar, consiguiendo así que el haz de láser incida sobre cada una. La luz dispersada por cada partícula es detectada en 2 direcciones diferentes: la misma que el haz incidente y la que forma un ángulo de 90¿ con el mismo haz incidente. Combinando esta información, el Sysmex UF-1000i puede clasificar y cuantificar bacterias, levaduras, hematíes, leucocitos, células epiteliales, células redondas pequeñas, cilindros, espermatozoides, cristales y moco. Para realizar el análisis cuantitativo de las bacterias, el equipo utiliza, como estándares de calibración, microesferas o micropartículas que incorporan un marcador fluorescente, y compara la señal de estos estándares con las de la muestra. El fluorocromo utilizado tiñe tanto las bacterias vivas como las muertas9. El rango de linealidad para el recuento microbiano comprende de 1·104unidades formadoras de colonias (UFC)/ml a 1·108UFC/ml10.
Seguidamente, las orinas se sembraron con un asa calibrada, en placas de agar Columbia suplementado con el 5% de sangre de carnero (bioMérieux, Marcy l’Etoile, Francia) y medio de MacConkey (bioMérieux, Marcy l’Etoile, Francia). Posteriormente, las placas se incubaron a 37°C durante 24h. En aquellas en las que se observó crecimiento se realizó el recuento de las colonias, considerando como criterio indicativo de positividad un recuento microbiano ≥1·105UFC/ml (gold standard). De este modo, las orinas con recuentos <1·105UFC/ml fueron informadas como negativas. Para recuentos ≥1·105UFC/ml se realizó la identificación bacteriana mediante el sistema de espectrometría de masas MALDI-TOF (MALDI Microflex LT, Bruker Daltonics, Bremen, Alemania); las orinas en las que se obtuvo un crecimiento de más de 2 microorganismos se consideraron como positivas a los efectos de este trabajo, pero se informaron a los pacientes como contaminadas.
El rendimiento del Sysmex UF-1000i para las variables recuento de bacterias y recuento de leucocitos se analizó mediante el análisis de curvas receiver operating characteristics (ROC) y se calcularon, para ambas variables, los puntos de corte óptimos que proporcionasen la mejor sensibilidad y especificidad en la clasificación de las muestras. Dicho análisis fue realizado mediante el programa Analyze-it v.2.11 para Microsoft Excel. Una vez obtenidos estos puntos de corte óptimos, se calculó la sensibilidad, especificidad, valor predictivo positivo y negativo que proporcionaron dichos puntos de corte mediante el programa estadístico SPSS v.20.0.
ResultadosEl número de muestras incluidas en el estudio fue de 922. De ellas, 627 (68%) correspondían a orinas de mujeres y 295 (32%), a hombres. Del total, el 82% procedían de centros de salud y consultas hospitalarias, y el 28%, de pacientes ingresados. La edad de los pacientes estuvo comprendida entre 7 y 94años, con una mediana de 68años y una amplitud intercuartil de 21años.
En el cultivo de orinas, considerando como criterio indicativo de positividad un recuento microbiano ≥1·105UFC/ml, se obtuvieron 234orinas positivas, lo que supone un 25,4% del total. Entre las muestras positivas, hubo 179 (82,1%) en las que se aislaron microorganismos gramnegativos y 29 (6,8%) en las que se aislaron microorganismos grampositivos. Los microorganismos más frecuentemente aislados fueron Escherichia coli (62,3%), Enterococcus faecalis (7,7%), Klebsiella pneumoniae (5,1%) y Proteus mirabilis (4,7%). Por último, hubo 26orinas (11,1%) que proporcionaron un crecimiento de más de 2 microorganismos, las cuales fueron informadas como contaminadas.
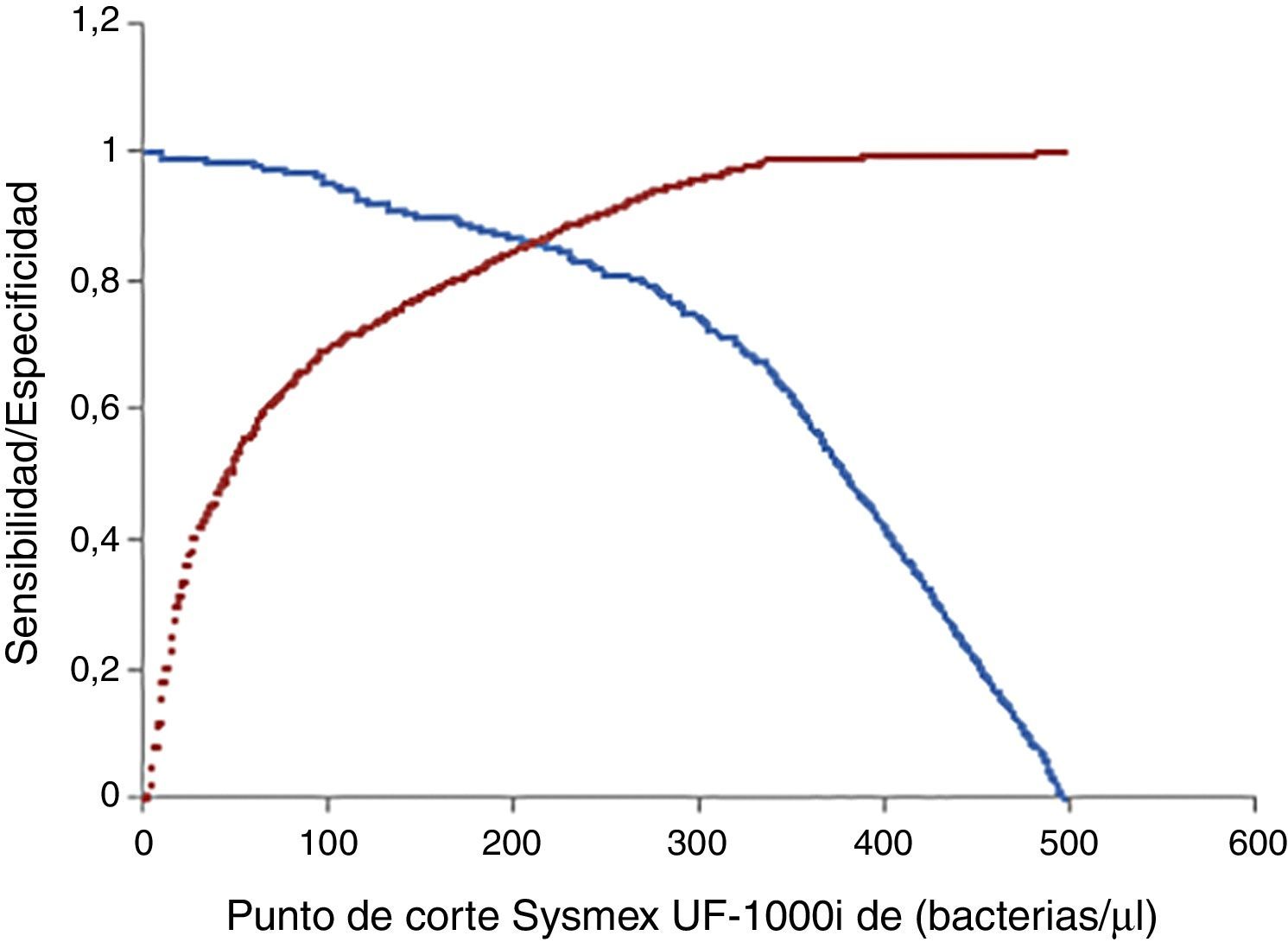
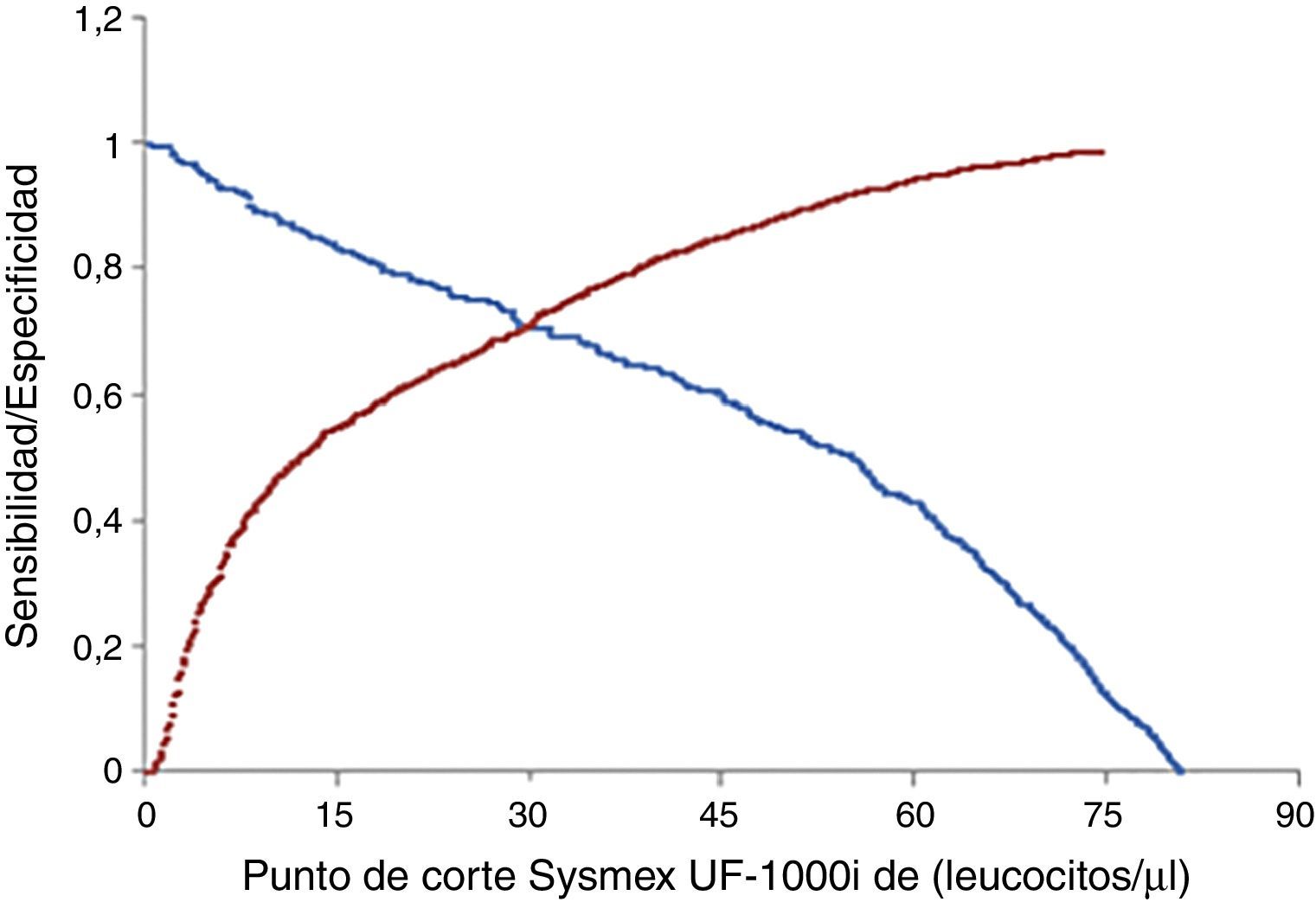
En la optimización del cribado, teniendo en cuenta únicamente el recuento bacteriano para discriminar entre orinas positivas y negativas, el punto de corte hallado mediante curvas ROC que proporcionó la mejor sensibilidad para la mayor especificidad fue de 247.850 bacterias/ml (fig. 1) ya que, por debajo de este valor, en el Sysmex UF-1000i el cultivo proporcionó recuentos en placa <1·105UFC/ml. Cuando se consideraron en el cribado únicamente los leucocitos, el punto de corte hallado fue de 31.800 leucocitos/ml (fig. 2), ya que, por debajo de este valor, en el Sysmex UF-1000i el cultivo proporcionó recuentos en placa <1·105UFC/ml.
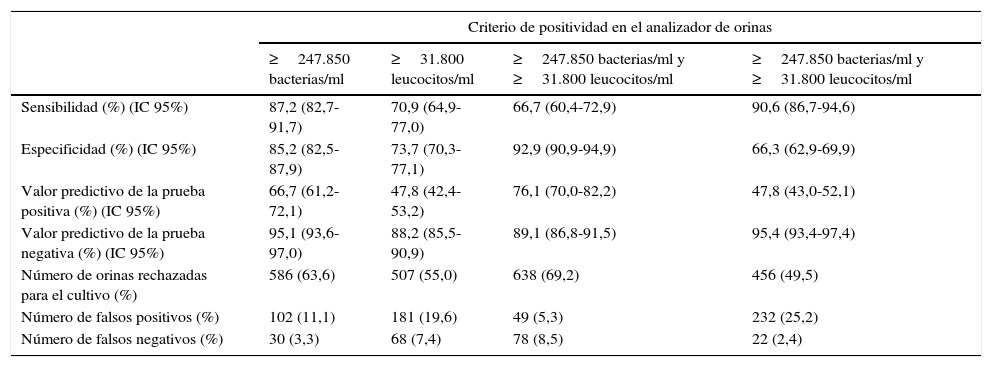
En la tabla 1 se muestra el rendimiento del analizador de orinas Sysmex UF-1000i en función de la combinación de estos 2 parámetros utilizados en el cribado para discriminar entre orinas positivas y negativas, exponiéndose también, para cada combinación, el número de orinas que se dejan de procesar para el cultivo y el número de falsos positivos y negativos en el cribado. De las distintas combinaciones de los puntos de corte utilizados, el único criterio que aportó una sensibilidad adecuada para el cribado fue el que incluyó el recuento de bacterias o de leucocitos. Excluyendo las orinas informadas como contaminadas y utilizando en el cribado los puntos de corte de 247.850 bacterias/ml o 31.800 leucocitos/ml para discriminar entre orinas positivas y negativas, los microorganismos aislados en muestras con cultivo positivo con un resultado negativo en el cribado previo fueron los siguientes: E. coli en 9 casos, E. faecalis en 5, P. mirabilis en 3, y K. pneumoniae, Streptococcus agalactiae, Enterococcus faecium y Candida albicans en un caso, respectivamente.
Rendimiento del analizador Sysmex UF-1000i en función de los parámetros utilizados en el cribado de orinas
| Criterio de positividad en el analizador de orinas | ||||
|---|---|---|---|---|
| ≥247.850 bacterias/ml | ≥31.800 leucocitos/ml | ≥247.850 bacterias/ml y ≥31.800 leucocitos/ml | ≥247.850 bacterias/ml y ≥31.800 leucocitos/ml | |
| Sensibilidad (%) (IC 95%) | 87,2 (82,7-91,7) | 70,9 (64,9-77,0) | 66,7 (60,4-72,9) | 90,6 (86,7-94,6) |
| Especificidad (%) (IC 95%) | 85,2 (82,5-87,9) | 73,7 (70,3-77,1) | 92,9 (90,9-94,9) | 66,3 (62,9-69,9) |
| Valor predictivo de la prueba positiva (%) (IC 95%) | 66,7 (61,2-72,1) | 47,8 (42,4-53,2) | 76,1 (70,0-82,2) | 47,8 (43,0-52,1) |
| Valor predictivo de la prueba negativa (%) (IC 95%) | 95,1 (93,6-97,0) | 88,2 (85,5-90,9) | 89,1 (86,8-91,5) | 95,4 (93,4-97,4) |
| Número de orinas rechazadas para el cultivo (%) | 586 (63,6) | 507 (55,0) | 638 (69,2) | 456 (49,5) |
| Número de falsos positivos (%) | 102 (11,1) | 181 (19,6) | 49 (5,3) | 232 (25,2) |
| Número de falsos negativos (%) | 30 (3,3) | 68 (7,4) | 78 (8,5) | 22 (2,4) |
IC: intervalo de confianza.
El cribado de las orinas presenta una serie de ventajas, como son disminuir la carga de trabajo, ahorrar dinero y adelantar los resultados. Sin embargo, su principal utilidad es evitar la administración de antibióticos que no son necesarios11. Uno de los avances del Sysmex UF-1000i respecto a su anterior modelo, el UF-500i (Sysmex Corporation, Kobe, Japón), es que posee 2 canales, de los que uno de ellos está dedicado exclusivamente a la determinación de bacterias, y el otro se usa para el resto de analitos12. De esta forma se mejora el recuento de microorganismos y se evita la interferencia de los hematíes con las bacterias, pudiéndose eliminar el recuento de los hematíes como parámetro para discriminar entre orinas positivas y negativas. El Sysmex UF-1000i también permite discriminar entre cocos y bacilos en una infección monomicrobiana, mediante el histograma en el que se representa la luz dispersa hacia delante en función de la señal de fluorescencia8. Además, también ha mostrado buenos resultados en el cribado de orinas con levaduras13.
En el cribado de orinas realizado mediante el Sysmex UF-1000i no existe acuerdo en la utilidad del recuento de leucocitos como parámetro para discriminar entre orinas positivas y negativas. En algunos trabajos en los que se tuvieron en cuenta, se observó una mejora de las características operacionales8,12,14; en otros casos, los recuentos de los leucocitos no mejoraron las características operacionales con respecto a las obtenidas cuando se consideró únicamente el recuento bacteriano para discriminar entre orinas positivas y negativas, de tal forma que diversos autores concluyeron que no debían ser considerados en el cribado15,16. En nuestro laboratorio consideramos el recuento de los leucocitos en el cribado, aunque su inclusión solo aumenta ligeramente la sensibilidad con respecto a la obtenida utilizando únicamente el recuento bacteriano en el cribado; utilizando el recuento bacteriano como único parámetro para discriminar entre orinas positivas y negativas en el cribado, la sensibilidad obtenida fue del 87,2% y, considerando el recuento de bacterias y leucocitos, la sensibilidad obtenida fue del 90,6%. Así, los recuentos bacterianos como único criterio considerado en el analizador para discriminar entre orinas positivas y negativas proporcionaron una sensibilidad <90%, no aceptada por la Oficina Europea de Directrices7, que recomienda que una prueba de cribado de orinas debe presentar una sensibilidad del 90 al 95%. Sin embargo, al incluir el recuento de leucocitos en el cribado, la sensibilidad fue del 90,6%, consiguiéndose así un valor aceptable. Por otra parte, nosotros consideramos que los recuentos de los leucocitos deben ser incluidos en el cribado porque este es un parámetro indicativo de posible infección urinaria14. De este modo, en nuestro laboratorio las orinas con leucocitos se cultivan siempre, aunque el recuento bacteriano en el Sysmex UF-1000i haya sido muy bajo. Además, si el cultivo bacteriano es negativo, a partir de estas muestras se aplican técnicas moleculares para la detección de otros agentes infecciosos como Chlamydia trachomatis, etc.
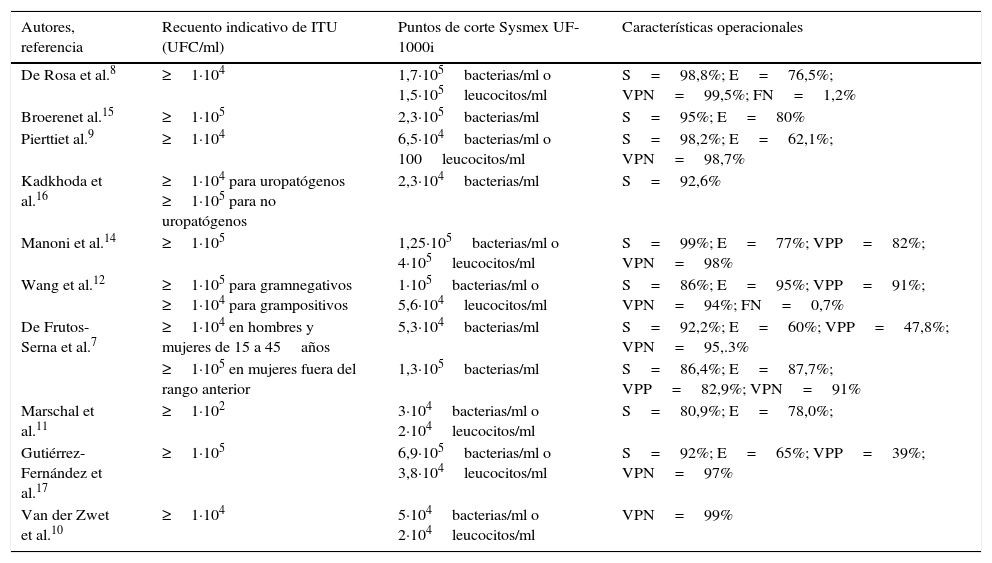
Respecto a las características operacionales del cribado de orinas realizado mediante el Sysmex UF-1000i, se ha observado que, con independencia de los valores de los parámetros utilizados en el cribado, a medida que aumenta el número de bacterias que se consideran en el gold standard (cultivo) la sensibilidad aumenta y la especificidad disminuye. Así, Marschal et al.11, tomando como criterio indicativo de ITU un recuento en placa ≥1·102UFC/ml y utilizando puntos de corte muy bajos en el cribado que deberían proporcionar un mínimo de falsos negativos, obtuvieron una sensibilidad del 80,9% y una especificidad del 78,0%; en cambio, Manoni et al.14, tomando como criterio indicativo de infección urinaria un recuento en placa ≥1·105UFC/ml y utilizando puntos de corte en el cribado más elevados, obtuvieron una sensibilidad del 99% y una especificidad del 77%. Nosotros hemos obtenido una sensibilidad ligeramente inferior a la obtenida por otros autores14,15,17, que también consideraron recuentos significativos en el cultivo los ≥1·105UFC/ml (tabla 2).
Características operacionales del cribado de orinas realizado mediante el Sysmex UF-1000i
| Autores, referencia | Recuento indicativo de ITU (UFC/ml) | Puntos de corte Sysmex UF-1000i | Características operacionales |
|---|---|---|---|
| De Rosa et al.8 | ≥1·104 | 1,7·105bacterias/ml o 1,5·105leucocitos/ml | S=98,8%; E=76,5%; VPN=99,5%; FN=1,2% |
| Broerenet al.15 | ≥1·105 | 2,3·105bacterias/ml | S=95%; E=80% |
| Pierttiet al.9 | ≥1·104 | 6,5·104bacterias/ml o 100leucocitos/ml | S=98,2%; E=62,1%; VPN=98,7% |
| Kadkhoda et al.16 | ≥1·104 para uropatógenos ≥1·105 para no uropatógenos | 2,3·104bacterias/ml | S=92,6% |
| Manoni et al.14 | ≥1·105 | 1,25·105bacterias/ml o 4·105leucocitos/ml | S=99%; E=77%; VPP=82%; VPN=98% |
| Wang et al.12 | ≥1·105 para gramnegativos ≥1·104 para grampositivos | 1·105bacterias/ml o 5,6·104leucocitos/ml | S=86%; E=95%; VPP=91%; VPN=94%; FN=0,7% |
| De Frutos-Serna et al.7 | ≥1·104 en hombres y mujeres de 15 a 45años | 5,3·104bacterias/ml | S=92,2%; E=60%; VPP=47,8%; VPN=95,.3% |
| ≥1·105 en mujeres fuera del rango anterior | 1,3·105bacterias/ml | S=86,4%; E=87,7%; VPP=82,9%; VPN=91% | |
| Marschal et al.11 | ≥1·102 | 3·104bacterias/ml o 2·104leucocitos/ml | S=80,9%; E=78,0%; |
| Gutiérrez-Fernández et al.17 | ≥1·105 | 6,9·105bacterias/ml o 3,8·104leucocitos/ml | S=92%; E=65%; VPP=39%; VPN=97% |
| Van der Zwet et al.10 | ≥1·104 | 5·104bacterias/ml o 2·104leucocitos/ml | VPN=99% |
E: especificidad; FN: falsos negativos; S: sensibilidad; VPN: valor predictivo de la prueba negativa; VPP: valor predictivo de la prueba positiva.
En cuanto a la proporción de orinas rechazadas en el cribado para el cultivo, con los puntos de corte hallados podemos rechazar el 49,5% de las orinas que llegan al laboratorio. Este porcentaje es más alto que los obtenidos por Pieretti et al.9, Gutiérrez-Fernández et al.17 y De Frutos-Serna et al.7, que rechazaron en el cribado un 43, un 45,7 y un 46% de orinas, respectivamente.
El porcentaje de falsos negativos del cribado de orinas en este trabajo ha sido del 2,4%, valor ligeramente superior al obtenido por otros autores8,12, que gira en torno al 1% (tabla 2). En cuanto a los microorganismos aislados a partir de las muestras que han proporcionado los falsos negativos, en algunos trabajos7 y en el nuestro, E. coli aparece en primer lugar, debido a que es el principal agente causal de ITU. Dentro de las causas de falsos negativos, cabe destacar los agregados bacterianos, que son más frecuentes en cocos grampositivos15. De este modo, Wang et al.12 aislaron en sus 2 muestras con falsos negativos un enterococo y un estafilococo, y Manoni et al.14 apuntaron que la mitad de los aislamientos obtenidos a partir de orinas con falsos negativos se correspondían con cocos grampositivos. En nuestro caso, E. faecalis ha sido el segundo microorganismo aislado a partir de estas muestras.
La mayoría de orinas procesadas en este trabajo fueron de origen extrahospitalario. Teniendo en cuenta que E. coli es el primer agente causal de las ITU extrahospitalarias, este microorganismo representó más del 60% de los aislamientos en las orinas procesadas. De Frutos-Serna et al.7, De Rosa et al.8 y Manoni et al.14 también procesaron en el cribado de orinas un mayor porcentaje de muestras de origen extrahospitalario. En estos trabajos, E. coli también presentó un importante porcentaje de aislamiento, siendo superior al 50% en todos los casos. Además, en estos estudios y en el nuestro, el porcentaje de orinas contaminadas ha sido muy próximo al 11%, con la excepción del referido por De Rosa et al.8, que fue del 4,5%. Por otra parte, Broeren et al.15 procesaron un mayor porcentaje de orinas de origen intrahospitalario. En su estudio, E. coli también fue el microorganismo aislado con mayor frecuencia, pero su porcentaje se redujo hasta el 37%. Sin embargo, también encontraron un porcentaje de orinas contaminadas del 11%.
Una limitación de este estudio es haber considerado el mismo criterio indicativo de ITU en mujeres que en varones, dado que, según la Sociedad Española de Microbiología Clínica18, en varones en los que la obtención de orina es menos susceptible de contaminarse, pueden ser significativos los recuentos ≥1·103UFC/ml. Sin embargo, en nuestro laboratorio no establecemos unos puntos de corte para el cribado de orinas que provienen de varones por varios motivos. Estas muestras representan un bajo porcentaje sobre el total de orinas recibidas. Además, considerando que las orinas de origen intrahospitalario proceden de pacientes muy heterogéneos y que en las peticiones faltan datos clínicos, nosotros hemos optado por sembrar la mayoría de estas muestras con independencia del resultado del cribado. Por otra parte, la mayoría de las ITU adquiridas en la comunidad pueden ser tratadas de forma empírica, sin la necesidad de llevar a cabo el cultivo de la orina. Otra limitación del trabajo consiste en que las orinas obtenidas por punción suprapúbica, sondaje o nefrostomía no se incluyeron en el estudio, por lo que, en el trabajo de rutina del laboratorio, estas orinas deberán sembrarse. El motivo de esto es que estas orinas presentan unos criterios de interpretación del cultivo diferentes a los que presentan las orinas obtenidas por micción espontánea18. Sin embargo, cabe destacar que estas orinas constituyen un porcentaje escaso sobre el total de orinas recibidas. Finalmente, tampoco incluimos en el estudio las orinas obtenidas de pacientes menores de 5años para evitar los falsos negativos en este grupo de pacientes.
ConclusionesConsiderando como recuentos bacterianos significativos de ITU los ≥1·105UFC/ml y utilizando los puntos de corte hallados en este trabajo, el Sysmex UF-1000i muestra unas características operacionales adecuadas para su incorporación en los laboratorios de microbiología clínica para llevar a cabo un cribado de las muestras de orina, evitándose el cultivo de la mitad de las muestras de orina que llegan a dichos laboratorios. Además, en el cribado de orinas realizado mediante el Sysmex UF-1000i, la utilización del recuento de leucocitos incrementa ligeramente la sensibilidad del método con respecto al recuento de bacterias. Por lo tanto, nosotros recomendamos que, si el recuento de leucocitos no es utilizado para el posterior procesamiento de la orina, este no debe ser empleado en el cribado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.