La vitamina E es un nutriente esencial para el ser humano, pero a diferencia de la mayoría de los nutrientes no tiene un papel específico en las funciones metabólicas. Su principal función biológica es actuar como un antioxidante no específico capturando radicales libres y de este modo interrumpir la propagación de las reacciones oxidantes. Numerosos estudios han mostrado una asociación directa entre la ingesta de vitamina E y disminución del riesgo de diversas enfermedades crónicas. El α-tocoferol podría actuar de forma directa, inhibiendo la oxidación de las lipoproteínas de baja densidad (LDL) y, de forma indirecta a través de funciones moleculares específicas relacionadas con la modulación de la actividad de enzimas y de moléculas que participan en la señalización celular y expresión génica, como son la inhibición de la actividad de la proteína quinasa C, –implicada en la proliferación y diferenciación de las células musculares lisas, las plaquetas y los monocitos–, la activación de la fosfolipasa A2 citosólica y la ciclooxigenasa-1 que estimula la liberación de prostaciclina (potente vasodilatador e inhibidor de la agregación plaquetaria)1,2.
Los síntomas y signos clínicos de la deficiencia de vitamina E, como las alteraciones neurológicas, son muy raros y solo se encuentran en niños y en adultos con síndromes de malabsorción grasa o con enfermedad hepática, en sujetos con trastornos genéticos del transporte o de la unión de proteínas y en los niños prematuros3. Esta vitamina presenta concentraciones superiores a las habituales en la leche de las madres que tienen partos prematuros, y esto permite prevenir o limitar algunos de los problemas de salud asociados con la prematuridad (p. ej. la anemia hemolítica), principal causa de muerte infantil en las primeras cuatro semanas de vida, cuya incidencia va en aumento4. No se ha descrito una sintomatología evidente de deficiencia en los individuos que consumen dietas con bajo contenido en vitamina E1,3. Por el contrario, el consumo de elevadas cantidades de esta vitamina puede llevar a múltiples cambios metabólicos y celulares en humanos1,5. Así, tanto concentraciones séricas bajas de nutrientes antioxidantes, entre ellos de vitamina E, como elevadas, a partir de cierto valor umbral alcanzable mediante un aporte extra a la dieta, se han asociado con un mayor riesgo de mortalidad. Este hecho sugiere que la suplementación puede ser útil solo para aquellos sujetos con deficiencias nutricionales6.
Objeto del documento y campo de aplicaciónEl objeto de este documento es revisar los aspectos principales de la evaluación del estatus de vitamina E desde un punto de vista nutricional y analítico, proponiendo unas recomendaciones sobre el procedimiento de medida e indicando las principales limitaciones existentes en la interpretación de resultados. Este documento pretende complementar el documento disponible «Procedimiento recomendado para la determinación de α-tocoferol en suero»7, actualizando dicha información e incorporando aspectos no tratados anteriormente. El documento está dirigido a los especialistas del laboratorio clínico, clínicos y profesionales dedicados al estudio, diagnóstico y tratamiento de las alteraciones en el estatus nutricional de la vitamina E.
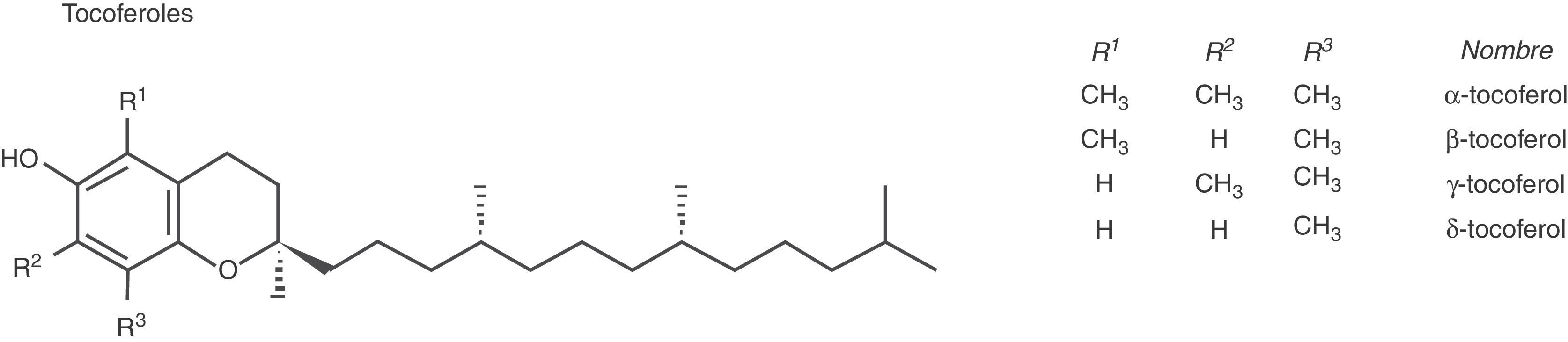
Naturaleza y fisiología de la vitamina EEl término vitamina E engloba a una familia de ocho compuestos homólogos, cuatro tocoferoles y cuatro tocotrienoles, que se encuentran de forma natural en las plantas, donde son sintetizados a partir del ácido homogentísico. Todos derivan del 6-cromanol y se denominan alfa (α), beta (β), gamma (γ) y delta (δ) en función del número y posición de los grupos metilos en el anillo cromanol. Los cuatro tocoferoles homólogos tienen una cadena lateral saturada de 16 átomos de carbono, mientras que los cuatro tocotrienoles tienen tres dobles enlaces en la cadena lateral (fig. 1). El grupo hidroxilo del cromanol puede donar un átomo de hidrógeno y reducir radicales libres y la cadena saturada lipófila le permite atravesar las membranas biológicas. Según la configuración R o S de los carbonos quirales 2’, 4’ y 8’ de los tocoferoles pueden existir 8 esteroisómeros, pero de forma natural solo se encuentran como RRR. La vitamina E en forma sintética (dl-α-tocoferol o all-rac- α-tocoferol), preparada a partir de la unión de la trimetilhidroquinona con el isofitol, es una mezcla de los ocho esteroisómeros de α-tocoferol, y se encuentra en los alimentos enriquecidos y en los complementos alimenticios. La vitamina E es insoluble en agua y soluble en disolventes orgánicos y es susceptible de oxidarse frente al aire y la luz1.
Las diversas formas de la vitamina E están presentes en diferentes proporciones en los alimentos. Se encuentran de forma natural en los alimentos de origen vegetal, en mayor cantidad en aquellos que contienen grasa (aceites, frutos secos). Por otra parte, la vitamina E en forma sintética es añadida a alimentos tanto de origen animal como vegetal, estando también disponible en forma de complementos alimenticios.
La vitamina E es liposoluble por lo que su absorción dependerá de la absorción de lípidos en el lumen intestinal. Además, requiere de las secreciones pancreáticas y biliares y de la formación de micelas para su absorción. Los esteres de tocoferol, presentes en los alimentos procesados (a los que se ha añadido vitamina E) y en complementos alimenticios, son hidrolizados por esterasas de la mucosa intestinal antes de su absorción. En el enterocito, la vitamina E es incorporada a los quilomicrones, los cuales son secretados por vía linfática a la circulación sistémica. Todas las formas de la vitamina E muestran una eficiencia de absorción estimada entre 51 – 86% y subsecuente secreción en quilomicrones aparentemente similares. La absorción de las distintas formas de la vitamina E parece ser independiente entre sí y no se modifica por la presencia de una mayor cantidad de alguna de ellas. Tampoco parece existir discriminación entre los distintos vitámeros (p.ej. α- y γ-tocoferol) durante la absorción8.
Para que las diferentes formas moleculares de vitamina E, como el γ-tocoferol, puedan ser transferidas a los tejidos periféricos es necesario que los quilomicrones se hidrolicen progresivamente bajo la acción de la lipoproteinlipasa endotelial (LPL). Los quilomicrones remanentes, que contienen la mayor parte de la vitamina E recién absorbida, son captados por el hígado, donde el α-tocoferol es específicamente reconocido por la proteína de transferencia de α-tocoferol (α-TTP) y de esta forma puede ser incorporado casi exclusivamente en las lipoproteínas de muy baja densidad (VLDL) secretadas por el hígado. El α-tocoferol es intercambiado entre las diferentes lipoproteínas, y son las lipoproteínas de baja densidad (LDL) y las lipoproteínas de alta densidad (HDL) las que contienen más de 90% de α-tocoferol, que es captado por los tejidos periféricos, principalmente durante la lipólisis mediada por la LPL de las VLDL, por la captación de LDL por la vía del LDL-receptor y por la captación del α-tocoferol unido selectivamente a receptores SR-BI (scavenger receptor class B tipo I) de HDL1,8. Por tanto, es el hígado, por la función discriminatoria de la α-TTP, y no el intestino, el responsable de la presencia preferencial en sangre del α-tocoferol en el periodo posprandial1.
No hay una proteína específica para el transporte de vitamina E, por tanto, es probable que la distribución de la vitamina E a los tejidos esté determinada por los mecanismos del metabolismo de las lipoproteínas.
El exceso de α-tocoferol, no unido a α-TTP, y las formas no α-tocoferol, con baja afinidad por la α-TTP, son eliminados por la bilis o catabolizados en el hígado por la vía del citocromo P450 generándose, como metabolito final, el compuesto carboxietil hidroxicromano (CEHC) que puede conjugarse y eliminarse por la bilis o por la orina. Debido a la acción antioxidante de la vitamina E, los primeros metabolitos estudiados fueron los derivados de la oxidación del anillo cromanol. El α-tocoferol puede ser oxidado a radical tocoferilo y, desde este a tocoferilquinona que es posteriormente reducido a tocoferilhidroquinona. Estos productos son conjugados con el ácido glucurónico y eliminados por la bilis o por la orina donde la tocoferilquinona es degradada a ácido tocoferónico. El radical tocoferilo puede ser reducido a la forma no oxidada por medio de los agentes reductores como la vitamina C. La principal vía de excreción de la vitamina E son las heces1,9.
Desde el punto de vista nutricional, la vitamina E contempla solo las formas 2R-estereoisómeras del α-tocoferol, ya que las formas 2S y la forma sintética all-rac-α-tocoferol no se encuentran en el plasma y tejidos humanos1. La concentración de vitamina E en sangre varía poco frente a un amplio rango de ingesta dietética3.
Con fines dietéticos, la actividad de la vitamina E se expresa como equivalentes de α-tocoferol (Eα-T), siendo 1 Eα-T la actividad de 1mg RRR-α-tocoferol. Para estimar el Eα-T en una dieta variada que contenga distintas formas naturales de vitamina E, los miligramos de β-tocoferol se deben multiplicar por 0,5, los de γ-tocoferol por 0,1 y los de α-tocotrienol por 0,3. Un miligramo de RRR- α-tocoferol en forma acetato es equivalente a 1 UI de vitamina E3 y para convertir UI a EαT, las formas sintéticas all-rac se multiplican por 0,45 y las formas RRR-α-tocoferol por 0,671.
La ingesta media recomendada (RDA) de vitamina E para ambos sexos es de 15mg de α-tocoferol al día, en base a la estimación de los requerimientos medios necesarios para prevenir la hemólisis inducida por el peróxido de hidrógeno (12mg/día) más un coeficiente de variación del 10%. La ingesta dietética de ácidos grasos poliinsaturados (AGPI) se ha utilizado para adecuar la ingesta de vitamina E en diversos países (p. ej. EE. UU., España), ya que los AGPI son muy susceptibles a la oxidación y un aumento en su ingesta, sin un simultáneo aumento en la ingesta de vitamina E, puede dar lugar a una disminución de las concentraciones de vitamina E en el plasma y a elevaciones en algunos índices de daño oxidativo. Sin embargo, las dietas con elevado contenido en AGPI suelen contener también una gran cantidad de vitamina E1.
No hay pruebas de que el envejecimiento altere la absorción y utilización de la vitamina E, por ello la ingesta estimada para personas mayores de 51 años es la misma que para adultos jóvenes. Al contrario de lo que sucede con la mayoría de los nutrientes, la concentración de α-tocoferol en sangre aumenta durante el embarazo, de igual forma que aumenta la de los lípidos totales1.
La ingesta máxima tolerable (UL, por sus siglas en inglés) es de 1.000mg/día para cualquier forma de suplementación de α-tocoferol en base al efecto adverso de un aumento en la tendencia hemorrágica1 o de 300mg/día según la Agencia Española de Seguridad Alimentaria y Nutrición10.
La vitamina E es conocida por su papel como potente antioxidante, y como tal, ayuda a mantener la integridad de las membranas mediante su capacidad para inhibir la propagación de las reacciones peroxidativas en cadena que se producen en los lípidos poliinsaturados. De esta forma protege a los componentes de las membranas celulares y a las LDL de la oxidación producida por radicales libres1,3. Además, la vitamina E, independientemente de su acción antioxidante, está implicada en la función inmune, como se ha observado en estudios in vitro en células, y en la modulación de la señalización celular y la regulación de la expresión génica por interacción directa y específica o a través de la regulación del estado redox de enzimas implicadas en la señalización celular o de factores de transcripción2. Por otra parte, en el origen y desarrollo de diversas enfermedades crónicas se considera que está implicado el daño oxidativo producido por radicales libres y por tanto, la vitamina E podría jugar un papel protector. Así, en diversos estudios se ha observado que el α-tocoferol mantiene la función normal de los componentes tisulares implicados en la aterogénesis y la trombosis (endotelio, células musculares lisas, plaquetas y monocitos) y por tanto, el α-tocoferol podría tener un papel crítico en la prevención y atenuación del daño cardiovascular11.
Métodos para la evaluación del estatus nutricional de vitamina EEn la valoración del estatus nutricional de vitaminas, se considera el equilibrio entre su ingreso y gasto, y se estudia con el objetivo de detectar la prevalencia e incidencia de situaciones tanto por defecto como por exceso. En general, esta valoración se puede realizar por métodos dietéticos, clínicos y bioquímicos. Los métodos dietéticos y los clínicos son menos específicos y sensibles que los bioquímicos. Los métodos dietéticos se suelen utilizar para valorar el nivel de riesgo nutricional en las poblaciones y los métodos clínicos para establecer la existencia de deficiencia o toxicidad, aunque no hay descritos cuadros clínicos específicos para todas las vitaminas12. Cada uno de los métodos directos de evaluación (medidas antropométricas, examen clínico, evaluación dietética y marcadores bioquímicos) presenta ventajas e inconvenientes respecto a su viabilidad, aplicabilidad en individuos y poblaciones y costes asociados.
En la selección de un método de evaluación nutricional, es imprescindible considerar el contexto en el cual se van a utilizar los datos: ámbito clínico (p. ej. evaluación de la adecuación nutricional de una dieta individualmente o valoración de riesgos en población), ámbito de salud pública (p. ej. monitorización de poblaciones y vigilancia de poblaciones en riesgo) o de ámbito de investigación (p. ej. estudios epidemiológicos, de casos-controles)13.
La valoración del estatus nutricional de vitamina E mediante el examen clínico es de limitada utilidad ya que los síntomas y signos clínicos de deficiencia en los seres humanos son muy escasos y solo se manifiestan en ciertas enfermedades hereditarias en las que el metabolismo de la vitamina E está alterado, en síndromes de malabsorción (p. ej. enfermedad hepática colestásica, fibrosis quística, resecciones gastrointestinales, enfermedad inflamatoria intestinal, abetalipoproteinemia) y en niños prematuros o malnutridos. Por otra parte, los problemas musculares y neurológicos que pueden estar asociados a la deficiencia de vitamina E, no son síntomas específicos y pueden tardar años en manifestarse, particularmente en los individuos adultos con una ingesta extremadamente baja de vitamina E3.
La evaluación dietética consiste en medir el consumo de alimentos y calcular la ingesta de nutrientes que contienen esos alimentos utilizando tablas de composición de alimentos, para finalmente compararla con las ingestas dietéticas recomendadas para evitar la deficiencia en vitamina E. Para el establecimiento de recomendaciones de ingesta se utilizan biomarcadores como indicativos de inadecuación ante los cambios de un nutriente, que en el caso de la vitamina E se basan en estudios de depleción y repleción en individuos usando la hemólisis de los eritrocitos como biomarcador11.
En la valoración del estatus nutricional, la utilización de marcadores bioquímicos es esencial, ya que son medidas objetivas y pueden ser exactas. No obstante, muchos marcadores solo reflejan débilmente la ingesta dietética (p. ej. la concentración de colesterol en plasma) o el estatus nutricional debido al control metabólico (p. ej. la concentración de calcio en plasma) o a otros factores no dietéticos que pueden afectar a sus valores (p. ej. biomarcadores relacionados con las lipoproteínas que transportan tocoferoles y carotenoides en sangre)13.
La valoración del estatus nutricional de vitamina E utilizando marcadores bioquímicos se realiza habitualmente mediante la medición de la concentración de α-tocoferol en el plasma. Dicha concentración de tocoferol en sangre no refleja necesariamente su ingesta ni las reservas corporales, ya que en la sangre solo se encuentra el 1% del tocoferol presente en el organismo y por otra parte, la cantidad circulante está fuertemente relacionada con la concentración de los lípidos circulantes. Por ello, la concentración de vitamina E relativa a la de lípidos (p. ej. razón tocoferol/colesterol en plasma) podría ser más representativa del estatus nutricional de vitamina E. Otro marcador bioquímico (funcional) para valorar el estatus de esta vitamina, se basa en la presencia de tocoferol en los eritrocitos y se mide la tendencia a la hemólisis cuando se expone a agentes oxidantes3. Sin embargo, los mencionados marcadores no sirven para determinar un estatus nutricional de vitamina E adecuado debido a los numerosos factores que en ellos influyen (p. ej. edad, concentración de lípidos en el plasma). Un marcador que podría aportar una adecuada información es la excreción urinaria del metabolito α-carboxietil hidroxicromanol, pero se precisan estudios más amplios en relación con el estatus de vitamina E o con los beneficios esperados11,14. Finalmente, también podría ser valorado el estatus de vitamina E mediante la medición de diversas magnitudes relacionadas con los productos de peroxidación lipídica (p. ej. malondialdehido, productos reactivos al ácido tiobarbitúrico –TBARS–, etano, pentano e isoprostanos F2), pero no son específicos para la vitamina E1 y podrían reflejar además de un estatus de vitamina E deficiente, un aumento en la peroxidación lipídica debido a diversas patologías.
Método recomendado; medición de α-tocoferol por cromatografía líquida de alta eficaciaPara poder predecir clínicamente si existe una deficiencia de vitamina E es esencial que el procedimiento de medida empleado para medir su concentración en el suero o en el plasma sea robusto y se ajuste al propósito del estudio. Sin embargo, a pesar de las aparentes similitudes existentes entre la mayoría de los procedimientos utilizados en los laboratorios, existen factores de confusión que dificultan la emisión de resultados y la estandarización de los procedimientos empleados para medir las magnitudes relacionadas con las vitaminas15.
Actualmente, el biomarcador más frecuentemente utilizado para evaluar el estatus nutricional de vitamina E es la concentración de α-tocoferol en el suero o en el plasma y el procedimiento de medida de elección emplea la cromatografía líquida de alta eficacia (HPLC) como principio de medición. Este procedimiento proporciona una elevada especificidad y sensibilidad, y permite la medición simultánea, a partir de un volumen reducido de muestra, de la concentración de varios micronutrientes liposolubles (p. ej. tocoferoles, retinol y carotenoides). La HPLC se ha aplicado utilizando sistemas en fase normal y en fase reversa en combinación con los sistemas de detección simples, como los detectores ultravioleta y de red de diodos o mediante espectrometría de masas en tándem. Otros sistemas de detección incluyen los detectores electroquímicos (permiten detectar el potencial de reducción de los compuestos) o los detectores fluorimétricos, que tiene la ventaja de usar la capacidad fluorescente propia del compuesto permitiendo así una detección más selectiva y sensible5.
Consideraciones preanalíticasTipo de espécimenEn la valoración del estatus nutricional de la vitamina E por procedimientos de medida directos, se ha medido la concentración de α-tocoferol en muestras de suero o de plasma, así como en los eritrocitos, los linfocitos y las plaquetas. En el caso de utilizar plasma como espécimen es importante la selección del anticoagulante ya que este puede interferir en el análisis. Por ejemplo, en muestras de plasma que contienen citrato u oxalato como anticoagulante se obtienen concentraciones más bajas de α-tocoferol que al usar muestras de suero o de plasma con heparina7. Así mismo, no existen diferencias entre los resultados obtenidos cuando se emplean muestras de suero o de plasma con heparina de litio16.
Aunque las concentraciones de vitamina E en los eritrocitos y las plaquetas pueden ser un indicador más sensible (reflejan estatus/exposición a más largo plazo) del estatus de vitamina E que las medidas en el suero o en el plasma, o en los linfocitos, los procedimientos empleados para su medición son más laboriosos de realizar y se utilizan con menos frecuencia. La medición de la concentración de vitamina E en el suero o en el plasma es la más empleada15. No existen diferencias entre las concentraciones de α- y γ-tocoferol en el suero y en el plasma (con heparina de litio) en valores que están comprendidos en sus respectivos intervalos de referencia16.
Las reservas de vitamina E, en el hígado y en el tejido adiposo, se estiman mediante la realización de biopsias en dichos tejidos ya que, debido a su recambio más lento pueden reflejar el estatus nutricional de vitamina E a largo plazo. Pese a ello, aunque pueden aportar información de interés, no son procedimientos muy habituales ya que son invasivos17.
Recogida de la muestra y estabilidadEn general, la muestra de sangre debe obtenerse en estado de ayuno. Aunque los valores de la concentración de α-tocoferol son independientes de la ingesta reciente de alimentos (aunque sí que dependen los valores de la concentración de γ-tocoferol), hay que considerar que la vitamina E es transportada por lipoproteínas y los valores de las magnitudes lipídicas sí que se pueden alterar tras la ingesta. Por ello, un estado posprandial puede alterar la valoración del estatus nutricional de vitamina E cuando se emplea la relación entre las concentraciones de vitamina E y de la mayoría de los lípidos en la sangre15.
Tras la obtención del suero o del plasma de la sangre para la determinación de α-tocoferol, las muestras pueden ser procesadas durante un período de tiempo máximo de 23 h a temperatura ambiente y en la oscuridad18, o bien, pueden congelarse a – 20°C para su posterior procesamiento. Si no se separa el suero o el plasma en una muestra de sangre se recomienda que, en caso de que transcurran más de 24 h desde su extracción, la muestra se mantenga refrigerada a 4°C (hasta un máximo de 4 días). Por otra parte, aunque no hay información sobre cómo puede afectar la luz en la estabilidad de la concentración de la vitamina E, las muestras se suelen mantener protegidas de la luz cuando en estas se vaya a determinar también la concentración de retinol15.
La concentración de vitamina E en el suero o en el plasma se mantiene estable tras varios ciclos de congelación - descongelación15. Adicionalmente, la utilización de nitrógeno antes de la congelación de las muestras no añade beneficios. Aunque está descrito que la concentración de α-tocoferol en plasma es estable cuando las muestras se almacenan a – 70°C durante 28 meses o a – 20°C durante cinco meses18, una reciente guía establece que las muestras (suero o plasma) pueden ser almacenadas a – 20°C durante un periodo máximo de 6 semanas y a – 70°C durante un tiempo no superior a un año15.
Fase analíticaExtracción de la muestraPara llevar a cabo la medición de la concentración de la vitamina E en el suero o en el plasma (conjuntamente o no con la concentración de retinol y de carotenoides), solo es necesario un volumen de muestra de suero o de plasma comprendido entre 200 – 1000μL. Como estas vitaminas son liposolubles (E y K) y además, se encuentran unidas a las lipoproteínas plasmáticas por interacciones hidrofóbicas, se necesita llevar a cabo una extracción líquido-líquido con un solvente orgánico (generalmente metanol o etanol). Por otro lado, es práctica habitual tratar, durante todo el proceso, a los materiales de calibración y de control de igual forma que las muestras a analizar. Tras el procedimiento de extracción, que en algunos casos ha de ser repetido varias veces, las fases orgánicas se recogen y evaporan hasta sequedad bajo atmósfera de nitrógeno (a temperatura ambiente o hasta una temperatura <40°C). Seguidamente, se reconstituye el residuo con un solvente que permita su adecuada solubilidad (p. ej. la propia fase móvil u otro solvente que sea compatible con ella). El volumen de solvente a añadir ha de ser el suficiente para asegurar dicha reconstitución (p. ej. un volumen equivalente al de la muestra inicial). Posteriormente, el residuo reconstituido debe ser protegido de la luz hasta su análisis5,15.
Dado que las vitaminas liposolubles se separan por partición entre dos fases, su recuperación variará dependiendo de la cantidad de solvente polar añadido a la muestra de suero o plasma (generalmente 1:1) y el volumen del solvente no polar utilizado en la extracción, que varía entre los métodos desde 2,5 a 15 veces el volumen de la muestra/mezcla del solvente polar15. Por ello, es útil incorporar un estándar interno (p. ej. acetato de tocoferilo) y posteriormente, extraer la fracción lipídica con solventes orgánicos (p. ej. hexano o mezclas que contengan dietiléter) para controlar la pérdida o concentración de analitos durante la manipulación de la muestra, pero sin olvidar que su recuperación tras la extracción no es, necesariamente, equiparable al rendimiento del proceso. Además, durante el proceso de extracción se pueden añadir compuestos estabilizadores (ej. hidroxibutiltolueno o ascorbato) aunque las ventajas que esto pueda aportar no son claras15.
Cromatografía líquida de alta eficaciaLa HPLC es el método de elección para el análisis de los micronutrientes liposolubles por su elevado rendimiento y su capacidad para cuantificar, de forma individualizada, las diversas formas de esos compuestos presentes en bajas concentraciones en el suero o en el plasma. Por otra parte, esta cromatografía es una técnica altamente sensible y reproducible, que puede ser utilizada con diversos métodos de detección y fase móvil (para más información, ver la revisión de Lai y Frankle, 2013)5, que permiten aumentar su sensibilidad y especificidad.
La correcta selección de la columna cromatográfica y de la fase móvil son aspectos importantes a tener en cuenta si se desea obtener una separación cromatográfica adecuada de diferentes micronutrientes (p. ej. vitaminas A, E y D). Esta separación puede realizarse utilizando una elución isocrática, siendo rápida, fiable y relativamente barata. Uno de los tipos de columnas cromatográficas más ampliamente utilizadas son las columnas en fase reversa del tipo octadecilsilano o C-18. Conjuntamente con la columna es recomendable emplear una precolumna para alargar la vida útil de la columna. En referencia a la fase móvil, suele emplearse una mezcla de metanol: agua (en unas proporciones del 99 - 90/1-10, v/v). Cabe destacar que este tipo de fase móvil no sería apropiada para resolver los compuestos más hidrófobos (p.ej. β-caroteno). Actualmente se han desarrollado procedimientos de medida basados en la cromatografía líquida de alta y rápida eficacia o UHPLC que permiten trabajar con columnas con un tamaño de partícula < 2μm. Este tipo de columnas, proporcionan una mayor resolución y eficacia cromatográficas en un menor tiempo, permitiendo acortar los tiempos de retención. Además, este menor tamaño de partícula permite que se precise una menor cantidad de muestra para obtener la misma relación señal/ruido aumentando así la capacidad de detección del sistema cromatográfico, el rendimiento y los costes asociados19.
El sistema de detección más común es la espectroscopia de absorción en el ultravioleta -visible (UV/Vis), a longitudes de onda fijas o como red de diodos (PDP). La longitud de onda de elección para detectar, en metanol, el α-tocoferol es 292nm, la del β-tocoferol es 296nm, y para el γ- y δ-tocoferol es de 298nm. Otros sistemas de detección utilizan los detectores electroquímicos y fluorimétricos, sin embargo, aunque inicialmente se consideró que aportaban una mayor sensibilidad que el UV/Vis, en la práctica clínica el UV/Vis y el PDP permiten un nivel de sensibilidad adecuado.
La identificación de los tocoferoles se puede realizar mediante la coincidencia entre el tiempo de retención del patrón y la muestra, la coelución de ambos (muestras con patrón añadido), la comparación de espectros de absorción, la inyección en distintos sistemas cromatográficos (fase móvil y columna) o mediante sistemas acoplados de espectrometría de masas. La cuantificación se realiza mediante curvas de calibración (4 - 6 puntos) o por factor respuesta, calculando las concentraciones por áreas o por altura de los picos, con o sin corrección por estándar interno, y/o aplicando el porcentaje de recuperación durante el proceso de extracción.
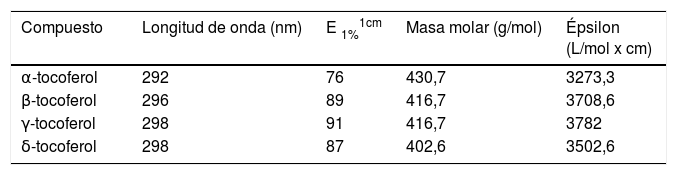
Actualmente, existen kits comerciales que permiten la medición de la concentración de α-tocoferol (p.ej. Teknokroma, Leti-diagnosticos, Chromsystems, Recipe, Biorad) que utilizan protocolos de extracción y patrones de concentración conocida para calibrar los sistemas. No obstante, cuando la calibración se realiza en el laboratorio, es recomendable corregir la medida gravimétrica de los patrones por la absorción espectrofotométrica (Ley de Lambert-Beer) y esta, a su vez, por la pureza cromatográfica. En la tabla 1 se indican algunos datos espectrales útiles en el análisis de la vitamina E20–22. Actualmente existen los sistemas de extracción en fase sólida (cartuchos) que permiten un mayor grado de automatización de esta etapa y su acoplamiento directo al sistema cromatográfico.
Datos espectroscópicos y coeficientes de absorción de diversos compuestos del grupo de la vitamina E
| Compuesto | Longitud de onda (nm) | E 1%1cm | Masa molar (g/mol) | Épsilon (L/mol x cm) |
|---|---|---|---|---|
| α-tocoferol | 292 | 76 | 430,7 | 3273,3 |
| β-tocoferol | 296 | 89 | 416,7 | 3708,6 |
| γ-tocoferol | 298 | 91 | 416,7 | 3782 |
| δ-tocoferol | 298 | 87 | 402,6 | 3502,6 |
El control de calidad interno debe ser una práctica habitual del laboratorio y debe ser incluido en cada medición analítica y valorado frente a los criterios de aceptabilidad previamente establecidos. Es conveniente que este procedimiento sea repetido a diferentes valores de concentración de los analitos.
La participación en los programas de calidad externos permite valorar el dominio de esos procedimientos analíticos. Actualmente, existen diversos programas de evaluación externa de la calidad (French Society of Vitamins and Biofactors, United Kingdom National External Quality Assessment Service, National Institute of Standards and Technology [NIST, EE. UU.], entre otros)5 mediante los cuales se puede conocer y controlar de forma periódica la precisión y exactitud de los métodos utilizados. Asimismo, el NIST comercializa los materiales de referencia para vitamina E en suero (SRM-968e) con valores certificados a tres niveles fisiológicos. Por otro lado, existen casas comerciales que ofrecen calibradores y controles con valores asignados que son trazables a los sistemas de referencia.
Interpretación de datosAl igual que para otros micronutrientes, la interpretación del estatus de vitamina E depende de la variabilidad metodológica del procedimiento de medida empleado, la variabilidad de los resultados obtenidos entre los laboratorios, de la variabilidad biológica (para la concentración del α-tocoferol medido en suero, la variación intraindividual es del 13,8% y la interindividual del 15%)23, de los valores de referencia y de los puntos de corte establecidos. En este sentido, la variabilidad atribuible a la utilización de los distintos métodos de análisis y los análisis entre diferentes laboratorios es baja para el α-tocoferol (<5%), tal como indican algunos programas de control de calidad como el del NIST (EE. UU.).
Valores de referenciaUna concentración de α-tocoferol en sangre de 20μmol/l (0,8mg/dl) se considera adecuada para los sujetos adultos aparentemente sanos que consumen una dieta variada11, mientras que un valor inferior a 12μmol/l (0,5mg/dl) se considera como indicativo de una deficiencia1,24. Sin embargo, la concentración de α-tocoferol circulante en sangre es difícil de interpretar por diversas razones, entre las que se encuentran el hecho de que el α-tocoferol es transportado en sangre por las lipoproteínas y por tanto puede depender de su concentración (aunque un metabolismo anormal de las lipoproteínas no conlleva necesariamente un aumento en la distribución de α-tocoferol hacia los tejidos). Por otra parte, el α-tocoferol en sangre no muestra una buena correlación con su ingesta dietética11. Por ello, se han propuesto diversas razones de α-tocoferol/lípidos sanguíneos para facilitar la identificación de la deficiencia en vitamina E, de los cuales, la razón tocoferol/(colesterol + triglicéridos) es casi tan potente como la razón de tocoferol/lípidos totales para identificar la deficiencia en vitamina E y tiene la ventaja de que la mayoría de los hospitales no necesitan instalar métodos adicionales para su estimación25. También se recomienda la razón α-tocoferol/colesterol (μmol/mmol) por su mayor sensibilidad26. Sin embargo, cuando tanto la concentración de los lípidos plasmáticos como la del α-tocoferol están anormalmente bajas, la corrección de la concentración de α-tocoferol circulante dará lugar a una razón α-tocoferol: lípidos normal y, asumir que esas condiciones reflejan un estatus de vitamina E adecuado es probablemente inválido porque una concentración baja de lípidos refleja unos inadecuados transportadores plasmáticos de la vitamina E a los tejidos11. También, en el caso de que la concentración de los lípidos plasmáticos sea elevada es útil expresar la concentración de α-tocoferol en relación con la concentración de lípidos para valorar el estatus nutricional de la vitamina E, el cual se considera adecuado si es mayor de 2,2μmol α-tocoferol/mmol colesterol25,27.
La deficiencia de vitamina E es poco común en los seres humanos. En los adultos y los niños, dicha deficiencia puede causar trastornos neuromusculares y hemólisis1. En general, una concentración de α-tocoferol en el suero o en el plasma inferior a 12μmol/l (0,5mg/dl) se asocia con un aumento de infecciones, anemia, retraso en el crecimiento y alteraciones en el embarazo con consecuencias para el niño y la madre. Una concentración de α-tocoferol en el suero o en el plasma entre los 12μmol/l (0,5mg/dl) y los 20μmol/l (0,8mg/dl) pueden aumentar mediante un aumento en la ingesta dietética de vitamina E, lo que sugiere que en ese intervalo de valores, la α-TTP hepática no está saturada11. No obstante, ante ingestas medias de vitamina E, la falta de correlación entre la cantidad ingerida y la concentración del α-tocoferol en el suero o en el plasma indica que hay una regulación eficaz en el control de dichas concentraciones11.
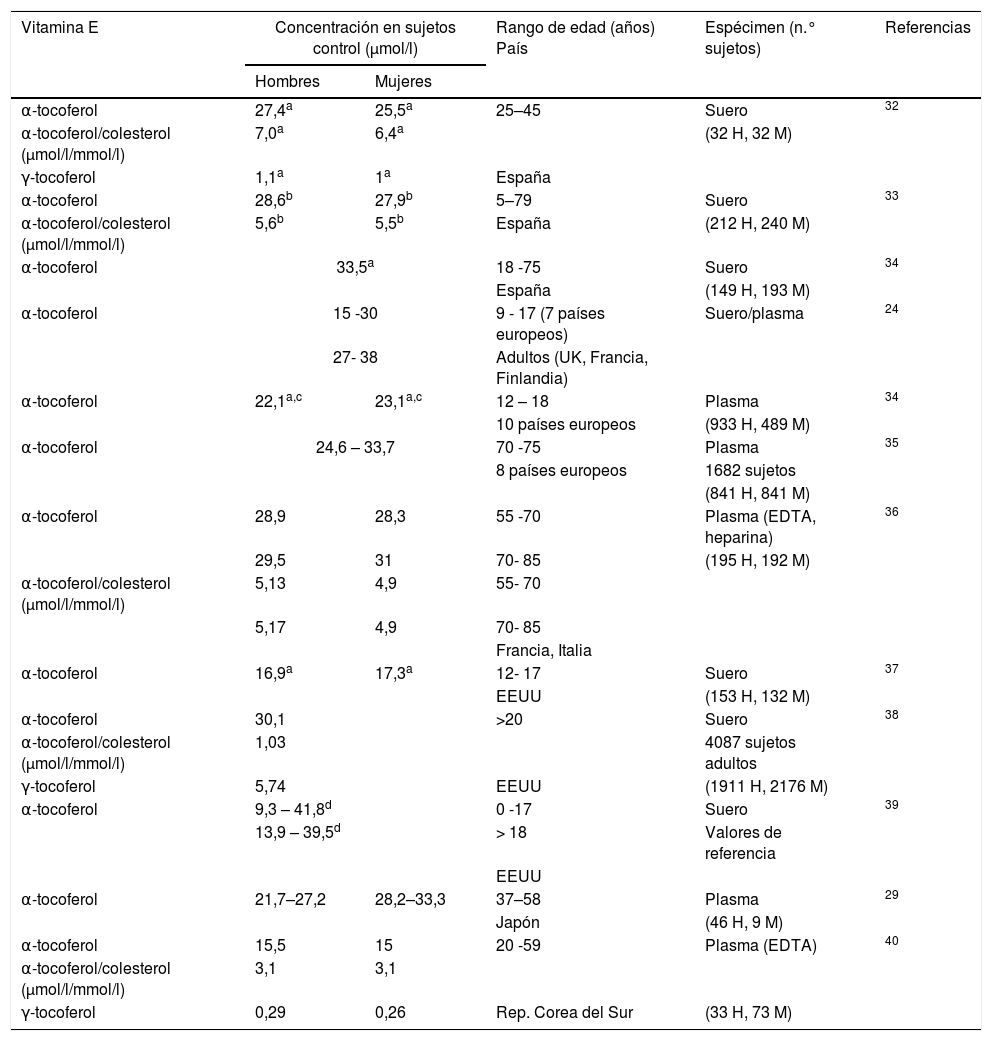
La concentración de α-tocoferol en el suero o en el plasma no muestra diferencias entre los sexos. Se han descrito variaciones estacionales en algunos grupos de población28,29 aunque no en otros30,31. En la tabla 2 se muestran las concentraciones de α-tocoferol y γ-tocoferol en el suero o plasma y de la relación de la concentración de α-tocoferol y la concentración de lípidos para distintos intervalos de edad24,29,31–40.
Concentraciones de vitamina E en sangre (suero o plasma) de sujetos control (selección de datos bibliográficos)
| Vitamina E | Concentración en sujetos control (μmol/l) | Rango de edad (años) País | Espécimen (n.° sujetos) | Referencias | |
|---|---|---|---|---|---|
| Hombres | Mujeres | ||||
| α-tocoferol | 27,4a | 25,5a | 25–45 | Suero | 32 |
| α-tocoferol/colesterol (μmol/l/mmol/l) | 7,0a | 6,4a | (32 H, 32 M) | ||
| γ-tocoferol | 1,1a | 1a | España | ||
| α-tocoferol | 28,6b | 27,9b | 5–79 | Suero | 33 |
| α-tocoferol/colesterol (μmol/l/mmol/l) | 5,6b | 5,5b | España | (212 H, 240 M) | |
| α-tocoferol | 33,5a | 18 -75 | Suero | 34 | |
| España | (149 H, 193 M) | ||||
| α-tocoferol | 15 -30 | 9 - 17 (7 países europeos) | Suero/plasma | 24 | |
| 27- 38 | Adultos (UK, Francia, Finlandia) | ||||
| α-tocoferol | 22,1a,c | 23,1a,c | 12 – 18 | Plasma | 34 |
| 10 países europeos | (933 H, 489 M) | ||||
| α-tocoferol | 24,6 – 33,7 | 70 -75 | Plasma | 35 | |
| 8 países europeos | 1682 sujetos | ||||
| (841 H, 841 M) | |||||
| α-tocoferol | 28,9 | 28,3 | 55 -70 | Plasma (EDTA, heparina) | 36 |
| 29,5 | 31 | 70- 85 | (195 H, 192 M) | ||
| α-tocoferol/colesterol (μmol/l/mmol/l) | 5,13 | 4,9 | 55- 70 | ||
| 5,17 | 4,9 | 70- 85 | |||
| Francia, Italia | |||||
| α-tocoferol | 16,9a | 17,3a | 12- 17 | Suero | 37 |
| EEUU | (153 H, 132 M) | ||||
| α-tocoferol | 30,1 | >20 | Suero | 38 | |
| α-tocoferol/colesterol (μmol/l/mmol/l) | 1,03 | 4087 sujetos adultos | |||
| γ-tocoferol | 5,74 | EEUU | (1911 H, 2176 M) | ||
| α-tocoferol | 9,3 – 41,8d | 0 -17 | Suero | 39 | |
| 13,9 – 39,5d | > 18 | Valores de referencia | |||
| EEUU | |||||
| α-tocoferol | 21,7–27,2 | 28,2–33,3 | 37–58 | Plasma | 29 |
| Japón | (46 H, 9 M) | ||||
| α-tocoferol | 15,5 | 15 | 20 -59 | Plasma (EDTA) | 40 |
| α-tocoferol/colesterol (μmol/l/mmol/l) | 3,1 | 3,1 | |||
| γ-tocoferol | 0,29 | 0,26 | Rep. Corea del Sur | (33 H, 73 M) | |
H: hombres; M: mujeres.
Una ingesta excesiva de la vitamina E a partir de la dieta es poco frecuente y no están descritas situaciones de toxicidad. La ingesta recomendada para la población adulta en España es de 12mg vitamina E/día41 y la UL es de 300mg/día10. En cuanto a los riesgos derivados de los aportes extra de vitamina E a la dieta, un estudio de metaanálisis de 19 ensayos clínicos en los que se valoró la relación entre dosis de vitamina E (16,5 - 2.000 UI/día o 11 - 1.334mg/día) y respuesta de mortalidad global, mostró un aumento del riesgo de mortalidad por cualquier causa cuando la ingesta era ≥400 UI/día (267mg/día)42.
InterferenciasEn la medición del estatus en vitamina E no hay descritas interferencias analíticas a excepción de la posible sobreestimación en la concentración de α-tocoferol cuando se utiliza HPLC (p.ej. isocráticos) debida a la presencia de concentraciones elevadas de β-criptoxantina, que es extraída de forma simultánea. Con algunos métodos de análisis pueden coeluir y aunque la detección de ambos compuestos se realiza a diferentes longitudes de onda (p. ej. 290-295nm el α-tocoferol y 450nm la β-criptoxantina), cuando la concentración de β-criptoxantina es alta, esta también presenta absorción en la longitud de onda seleccionada para el α-tocoferol33.
Análisis DAFO: debilidades, amenazas, fortalezas, oportunidadesDebilidades- -
Se desconoce la concentración mínima de vitamina E en el suero o en el plasma que esté asociada con una posible toxicidad.
- -
No hay síntomas clínicos específicos que se relacionen con un estatus nutricional de α-tocoferol inadecuado.
- -
La concentración de α-tocoferol en el suero o en el plasma parece estar regulada (para evitar su aumento) mediante un incremento del metabolismo hepático y su excreción.
- -
No se ha valorado la estabilidad de la concentración de α-tocoferol en el suero o en el plasma cuando se almacena a temperatura ambiente o a 4°C durante cortos periodos de tiempo (ej. 1 - 2 semanas).
- -
No hay marcadores bioquímicos específicos (p.ej. metabolitos) de toxicidad.
- -
Los procedimientos de medida empleados actualmente en el laboratorio no están totalmente automatizados.
- -
Los sistemas de medida basados en la HPLC presentan un elevado coste y es necesaria experiencia técnica para su manejo.
- -
Existe un mercado de suplementos (complementos alimenticios) con un limitado control (p.ej. en Internet). Hay venta sin prescripción.
- -
Existe una inadecuada identificación de los grupos en riesgo de déficit subclínico de vitamina E (p.ej. por embarazo, lactancia, obesidad, cirugía bariátrica, edad avanzada, niños/adultos en exclusión social, inmigrantes).
- -
Existen una multitud de procedimientos para evaluar el estatus nutricional, tanto a nivel individual como poblacional.
- -
Existen procedimientos de medida (p.ej. HPLC) específicos, robustos, estandarizables y trazables para evaluar el estatus nutricional de la vitamina E.
- -
Existe la posibilidad de automatizar los procedimientos de medida, incluidos los procedimientos de preparación o de extracción de las muestras.
- -
Hay disponibilidad de programas de evaluación externa de la calidad y de materiales de referencia en suero.
- -
La metabolómica permitiría una mejor interpretación del estatus nutricional de vitamina E.
- -
El conocimiento de los polimorfismos genéticos como determinantes de niveles circulantes de biomarcadores.
- -
La medición simultánea de la concentración de diversos micronutrientes relacionados (p.ej. vitaminas A y D, carotenoides) en el plasma o en el suero puede ser de interés en determinadas situaciones clínicas en las que haya malabsorción de grasas (por ej. fibrosis quística, enfermedad inflamatoria intestinal).
Los métodos bioquímicos son objetivos, específicos y sensibles, están exentos de los errores asociados a otros tipos de abordajes, como puede ser la evaluación dietética. El biomarcador más frecuentemente utilizado para evaluar el déficit de vitamina E es la concentración de α-tocoferol en el suero o el plasma, aunque su interpretación presenta limitaciones debido a su relación con los lípidos plasmáticos y la influencia de otros factores.
Actualmente, para la medición de la concentración de α-tocoferol en el suero o el plasma, los procedimientos de medida de elección son aquellos que están basados en la HPLC ya que proporciona una elevada especificidad y sensibilidad. Para llevar a cabo una correcta medición de la concentración de α-tocoferol en el suero o el plasma y realizar una adecuada interpretación de los resultados obtenidos, se establecen las siguientes recomendaciones:
- -
La extracción de la muestra debe realizarse en estado de ayuno.
- -
Las muestras de sangre deben recogerse en un tubo sin aditivos o con gel separador (suero) o en un tubo que contenga heparina de litio como anticoagulante (plasma).
- -
Manejar las muestras (extracción) en condiciones de luz tenue.
- -
Procesar la muestra en el día de su recogida o mantenerla refrigerada si se van a procesar en un periodo de tiempo < 24 h. En su defecto, almacenar el suero o el plasma a ≤ 20°C (estable durante un periodo de tiempo < 5 meses) o a – 70°C (estable durante un periodo de tiempo < 12 meses) hasta su procesamiento.
- -
Incluir un estándar interno (p.ej. acetato de tocoferilo, si la detección es UV/Vis) para corregir las posibles pérdidas o concentración de la muestra durante la manipulación.
- -
Realizar una preparación de la muestras mediante una precipitación de proteínas (p.ej. con etanol) y una extracción líquido-líquido con solventes orgánicos. Seguidamente, evaporar la fase orgánica a <40°C y reconstituir el extracto con un solvente adecuado (p.ej. la fase móvil).
- -
El análisis cromatográfico se puede realizar en columnas C18, fases móviles con metanol (90-100%) y elución isocrática. No obstante, existen múltiples aplicaciones que combinan otro tipo de columnas, tamaño de partícula y fase móvil, tanto en modo isocrático como gradiente. Realizar la detección de tocoferol y acetato de tocoferilo (estándar interno) a 292nm.
- -
Utilizar calibradores (patrones) comercialmente disponibles. Se recomienda al menos corregir las medidas gravimétricas por lectura espectrofotométrica para confirmar la pureza. Realizar calibraciones de 4 - 6 puntos.
- -
Se recomienda la utilización periódica de materiales de referencia y la participación en programas externos de control de calidad analítico.
- -
Expresar la concentración de tocoferol en unidades internacionales (μmol/l). No obstante, muchos laboratorios y programas de control de calidad utilizan otras unidades de medida (μg/dl, ng/mL).
- -
Para la interpretación de los resultados: es recomendable calcular la relación entre la concentración de vitamina E y la concentración de lípidos en el suero o el plasma (p. ej.: la concentración de colesterol en el suero), así como estratificar los valores de referencia por intervalos de edad.
Los autores declaran no tener ningún conflicto de intereses.
La mención específica en el presente texto a equipos, marcas comerciales o programas de supervisión externa de la calidad con objeto de proporcionar información sobre recursos y procedimientos analíticos no implica recomendación por parte de la Comisión de Nutrición y Vitaminas.
Composición de la Comisión de Nutrición y Vitaminas: Cristina Córdoba Chicote, Ramón Deulofeu Piquet, Fernando Granado Lorencio, Emma Lara Navarro, Begoña Olmedilla Alonso, María Victoria Pardos Barra, José Ruiz Budría (Presidente).
Este documento fue publicado en su primera versión en Documentos de la revista Química Clínica 1996; 15(6): 445-449. La presente versión revisa dicha información, introduce aspectos nutricionales no tratados anteriormente e incorpora un análisis DAFO de la situación actual respecto a la evaluación del estatus de vitamina E.
Este documento tiene la conformidad de las otras dos Sociedades (AEBM-ML y AEFA) como Recomendación profesional en el ámbito del Laboratorio Clínico.
Los nombres de los componentes de la Comisión de Nutrición y Vitaminas pueden consultarse en el anexo 1.