efectuar la evaluación completa del nuevo analizador Sperm Class Analyzer® (SCA v.3.2.0) para la realización del seminograma en sus apartados de recuento y movilidad y de la morfología espermática, que incorpora las últimas mejoras en tecnología y software a este sistema de análisis de semen tipo CASA (Computer-Assisted Sperm Analysis).
Material y métodosse procesaron 150 muestras de semen provenientes de las áreas clínicas de esterilidad y urología. Se analizaron 42 muestras en el módulo de concentración del SCA y 65 muestras en el módulo de movilidad, utilizando en ambos la cámara de Leja desechable de 10μm de profundidad. Paralelamente se realizó el recuento manual de los sémenes por duplicado en cámara de Neubauer Improved y el estudio de la movilidad por el método manual, en porta y cubre 22×22mm a 37°C, en 200 espermatozoides y se estudió la imprecisión, la linealidad y la exactitud del SCA con el método manual. El análisis de la morfología espermática se efectuó procesando un total de 50 muestras por el módulo de morfología del SCA; las mismas extensiones ya teñidas fueron evaluadas manualmente a 200 células por un facultativo titulado en EHSRE y calculando su coeficiente de correlación.
Resultadosel recuento del SCA ha presentado una imprecisión media intradía del 10,13%, con un rango de entre el 3,2 y el 17,1%, dependiendo de la cifra de recuento y su correlación con el método manual ha sido de r=0,98 (p=0,001). Se ha comprobado la linealidad en el recuento con el SCA entre 190 millones de espermatozoides hasta 0,5millones/ml. La movilidad ha presentado una imprecisión mayor en los clasificados como b% y c% de la OMS, con un valor medio de 21,81%, que los a% y d% OMS, con un valor medio del 10,32%, dependiendo también del recuento de la muestra y se ha comprobado la fiabilidad de la medición del parámetro de movilidad hasta una concentración máxima de 120 millones/ml. La morfología utilizando el criterio personal de configuración del SCA, ha presentado una correlación positiva significativa r=0,899 (p=0,0001), con el método manual de referencia.
Conclusionesse ha validado positivamente el recuento y la movilidad efectuadas con el SCA, utilizando la cámara de Leja desechable de 10μm de profundidad. Se establecen una serie de premisas para la utilización de la morfología automatizada realizada por el SCA, y se plantea también la utilidad clínica de algunos de los nuevos parámetros cinéticos y morfométricos del espermatozoide que proporciona el analizador de semen.
Evaluation of the efficiency of the New Sperm Class Analyzer® (SCA v.3.2.0) in sperm automated analysis for the calculation of the motility, concentration and morphology parameters using the latest CASA (Computer-Assisted Sperm Analysis) technology in software for spermiogram analysis.
Materials and methodsAnalysis of 150 semen samples from the clinical areas of Fertility and Urology, 42 samples were analyzed with the SCA concentration module and 65 samples were analyzed with the SCA motility module using a disposable 10 micron deep Leja Chamber in both. At the same time the samples were analyzed by the manual method using the Neubauer Improved chamber for counting and slides with 22×22mm cover slip heated to 37°C with an average of 200 spermatozoa for motility, in order to test the precision, linearity and accuracy of SCA system compared with the manual method. The morphology analysis was evaluated using 50 pre-stained slides and evaluating 200 cells both manually by an ESHRE qualified technician and the SCA method and then calculating the correlation coefficient.
ResultsThe counting with SCA system compared with the manual method has shown a within-day imprecision of 10.13% with a range between 3.2% and 17.1% depending on the count level; correlation with the manual method was r=0.98 (P=0.001). The linearity of the SCA was shown to be linear between 0.5 million and 190 million sperm/ml. The motility module showed a higher within-day imprecision in counting WHO “type b” and “type c” spermatozoa (21.81%) than the “type a” and “type d”, with an average value of 10.32%, also depending on the count rate. The reliability of the motility parameter was evaluated up to a of 120 million sperm/ml. The morphology module, with a customised configuration of parameters, had a significant positive correlation (r=0.899; P=0.0001) compared with the manual method.
ConclusionsThe comparison of the concentration and motility of spermatozoa between the manual method and the SCA modules using 10 microns deep Leja chambers was positively evaluated. A series of premises are established for using the automated morphology performed on the Sperm Class Analyzer. The clinical usefulness of some of the new kinetic and morphometric parameters of sperm provided by the semen analyser is also established.
La presión asistencial que ha comportado el aumento de la demanda del perfil analítico del seminograma al área de andrología, debido al auge de las técnicas de reproducción asistida en nuestros hospitales, ha creado al laboratorio la necesidad de la automatización del seminograma, escogiendo en nuestro caso los denominados métodos CASA (Computer-Assisted Sperm Analysis), para dar la adecuada respuesta a este aumento de la demanda analítica1–3. Estos métodos CASA deben cumplir las premisas de homologación establecidas por el grupo especial de andrología de la ESHRE4 y el instrumento debe estar conectado a un sistema de computación que permita la organización de datos y su análisis estadístico, así como el cálculo de los nuevos parámetros cinéticos que define la Organización Mundial de la Salud (OMS) en su manual de laboratorio para el examen del semen humano5.
Se ha efectuado la evaluación del nuevo analizador Sperm Class Analyzer® (SCA V.3.2.0)6 durante 1 año, en una muestra de 150 sémenes de los que se procesaron 42 muestras de recuento, 65 de movilidad y 50 muestras de la morfología espermática. El analizador no contempla aún la realización automatizada de la vitalidad espermática.
Se han evaluado los módulos del SCA que se citan a continuación: a) el recuento de espermatozoides, su correlación con el método de referencia manual, la linealidad y los coeficientes de variación; b) la movilidad, su correlación con el método manual, la linealidad y sus coeficientes de variación; c) en el módulo de la morfología, el parámetro de porcentaje de normalidad, sus coeficientes de variación y su correlación con el método manual, realizado por un facultativo con titulación EHSRE (European Society of Human Reproduction and Embriology) y avalado por la experiencia del procesamiento del control externo español (Ceifer) los últimos 2 años y d se plantea finalmente, la utilidad clínica de los nuevos parámetros cinéticos y morfológicos que presenta el SCA6.
Material y métodosInstrumentaciónSperm Class Analyzer® (SCA)El SCA es un equipo que permite analizar el semen de manera precisa y objetiva6 y pertenece a la generación de los sistemas de análisis de semen tipo CASA, integrado por los siguientes componentes:
- 1.
Hardware: ordenador, cámara digital Basler (Vision-Technology) 312 FC/C, 25 imágenes/s, microscopio Nikon B-200 con platina termostatizada, placa calefactora Omron.
- 2.
Software: SCA. Es un programa informático compuesto por los siguientes módulos:
- –
Módulo de movilidad y concentración: es el módulo para analizar la movilidad y la concentración espermática que se realiza utilizando las cámaras desechables de Leja, aconsejadas por el fabricante del analizador y utilizadas por varios autores7–10. Este módulo necesita disponer de un microscopio que incorpore una platina termostatizada a 37°C para efectuar las mediciones.
- –
Módulo de morfología: es el módulo que analiza la morfología y morfometría de los espermatozoides.
- –
Otros módulos: módulo de control base de datos e informes, módulo de concentración OMS, módulo de fragmentación de ADN, módulo contador.
- –
El análisis de la concentración y la movilidad con el SCA se efectúa a la vez con la misma muestra. Se realiza tomando 1–5μl de semen, que se sitúan en alguna de las cámaras de Leja desechables de varias profundidades disponibles, previamente atemperada a 37°C en placa calefactora.
Concentración. La configuración del tipo de cámara de recuento empleada será muy importante, dado que para los cálculos finales de la concentración, el factor de cálculo empleado dependerá del grosor o profundidad de la cámara escogida. Para este fin hay, en la opción de propiedades, un campo dedicado a seleccionar la cámara de recuento que se usa. Para la realización del análisis, una vez colocada la muestra en la cámara de Leja, el usuario puede visualizar la imagen y capturar hasta 10 campos y un número ilimitado de espermatozoides, dependiendo del recuento de la muestra con un mínimo de 200–300 espermatozoides, de acuerdo con lo establecido por la OMS5, o capturar más si lo desea –en nuestro caso 1.000 espermatozoides por muestra–. Finalmente, el SCA permite una configuración personalizada del informe final (centro, NH, etc.), escogiendo los parámetros de impresión deseados.
Movilidad. Antes de la realización del análisis se escoge, en la opción de configuración del sistema, el criterio de clasificación de la movilidad según la velocidad de los espermatozoides, siguiendo los criterios prefijados o según criterios personales, para ajustar, en este último caso, el analizador a sus propios valores de referencia.
El análisis de movilidad se hace a la vez y con la misma muestra que el de concentración, y ambos resultados se imprimen en un mismo informe. En el análisis de la movilidad además de los parámetros clásicos (a%, b%, c%, d% de la OMS), el SCA obtiene los parámetros morfocinéticos que vienen definidos por el fabricante de la siguiente manera4: a) VCL: velocidad curvilínea de los espermatozoides (μm/s); b) VSL: velocidad rectilínea de los espermatozoides (μm/s); c) VAP: velocidad media de los espermatozoides (μm/s); d) STR: índice de rectitud de los espermatozoides (%); e) LIN: índice de linealidad de los espermatozoides (%); f) WOB: índice de oscilación de los espermatozoides (%); g) ALH: amplitud del desplazamiento lateral de la cabeza de los espermatozoides (μm/s), y h) BCF: frecuencia de cruce de los espermatozoides (Hz).
El SCA informa del porcentaje de espermatozoides denominados hiperactivos (ALH >2,5μm/s y STR > 85%)1,4,6.
Análisis de morfologíaEl SCA permite la elección del criterio de realización de la morfologia espermática: la OMS5, criterio de Tygerberg (Kruger)3 y personal. Los 2 primeros son criterios definidos y no se pueden modificar; además van ligados a unos valores morfométricos específicos que el fabricante refiere adoptados de las recomendaciones del Grupo de Andrología de la ESHRE en la reunión celebrada en Pisa en 19974. El criterio personal permite que el usuario pueda cambiar y ajustar los valores de clasificación y morfométricos.
La configuración de los parámetros morfométricos del analizador se realiza en la opción de configuración del módulo, escogiendo uno de los 3 criterios disponibles ya descritos.
El SCA, además del parámetro del porcentaje de espermatozoides normales, presenta el cálculo automatizado de parámetros morfológicos, como los índices de teratozoospermia, la deformidad5 y la presentación de los valores morfométricos medios de los 100 espermatozoides estudiados (longitud, anchura, tamaño del acrosoma, ángulo de inserción medio de la cola, etc.).
Indicar que en el estudio de la morfología del SCA se excluye prácticamente la cola del espermatozoide y no se contempla el análisis de células germinales y leucocitos.
Para realizar el análisis de la morfología, el usuario debe colocar, en la platina del microscopio, el porta con la muestra de semen, previamente fijada y teñida correctamente con Diff Quik (Allegiance Healthcare Corp, McGraw Park, IL, EE.UU.).
Para este análisis se utiliza el objetivo de 100x y campo claro, por lo que es necesario el cambio de filtro manual, y a continuación se centra y se enfoca la imagen en un espermatozoide y se realiza el fotograma, operación que se repite hasta que se llega a 100 espermatozoides. Para la realización de una morfología manual se precisan de 20–25min por muestra.
PacientesSe realizó un estudio transversal de 150 pacientes a los que se les había solicitado el seminograma. La normativa de recogida de las muestras se hizo siguiendo las indicaciones del documento de la SEQC11, que aconseja un período de abstinencia sexual de 3–4 días con un máximo de 7 días y procesar la muestra antes de 1h de su emisión. De los 150 pacientes procesados, 112 pacientes provenían de consultas externas de esterilidad y 38 pacientes de la consulta de urología.
Procedimiento (seminograma)Se ha realizado siguiendo la normativa de la ESHRE12,13, y se ha efectuado el recuento de espermatozoides en cámara de Neubauer Improved por duplicado contando un mínimo 200 espermatozoides. La movilidad manualmente, según la OMS, se mide en un porta con cubre 22×22mm a 37°C, también a 200 espermatozoides5. Finalmente, respecto al estudio de la morfología, la realizó un facultativo de laboratorio titulado por la ESHRE siguiendo el criterio de Kruger (valores normales [VN] >14%)3 y las tinciones fueron efectuadas con la ayuda del método rápido de tinción Diff Quick (Allegiance Healthcare Corp, McGraw Park, IL, EE.UU.) y diferenciación a 200 espermatozoides. Las extensiones se realizaron con ayuda de un extensor automático Hemaprep (Cellvision-Izasa), con el que se consiguen unas extensiones uniformes para evaluar la morfología manualmente y automáticamente con el SCA.
Métodos estadísticosEl cálculo de la correlación, la prueba de la t de Student y de la recta de regresión de Passing-Bablock, habitual en el contexto de los trabajos del laboratorio14,15, se efectuaron con ayuda de los programas estadísticos SPSS (SPSS, Chicago, IL, EE.UU.) y MedCalc (MedCalc Software, Mariakerke, Bélgica).
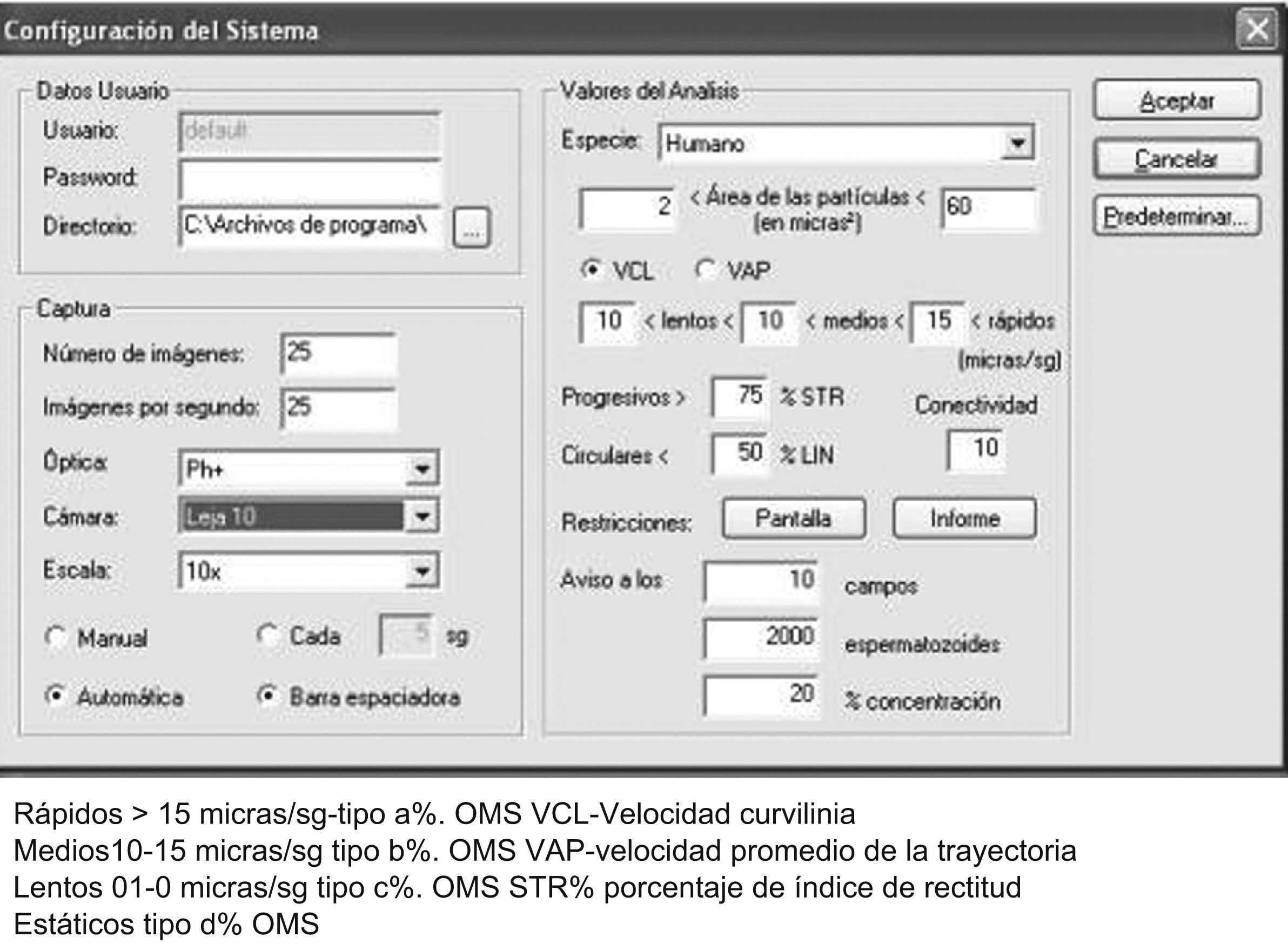
ResultadosSe ha efectuado la evaluación de los diversos módulos de trabajo de que se compone el analizador SCA. El primer módulo del SCA estudiado fue el de movilidad y concentración, módulo que permite realizar el recuento de espermatozoides y el análisis de la movilidad a la vez, con el procesamiento de una misma muestra de semen. La configuración empleada, en nuestro caso en función de la sensibilidad de nuestra cámara digital (Basler 312FC/C, Vision-technology, 25 imágenes/s) y del microscopio Nikon E-200 de que disponemos, se muestra en la figura 1. Sólo se ha validado la Leja desechable de 10μm de profundidad con 3μl de semen (equivalente en altura a la cámara de Makler), ya que en las de mayor espesor (20μm, 100μm), la cámara digital no era capaz de efectuar lecturas mínimamente coherentes en exactitud. La muestra así preparada se coloca en la platina termostatizada del microscopio, la imagen se enfoca y se ajustan el brillo (50) y el contraste ((406) a un nivel de 5 de la escala de grises del analizador –ajuste muy importante–) y se efectúan las lecturas correspondientes después de prefijados estos parámetros6.
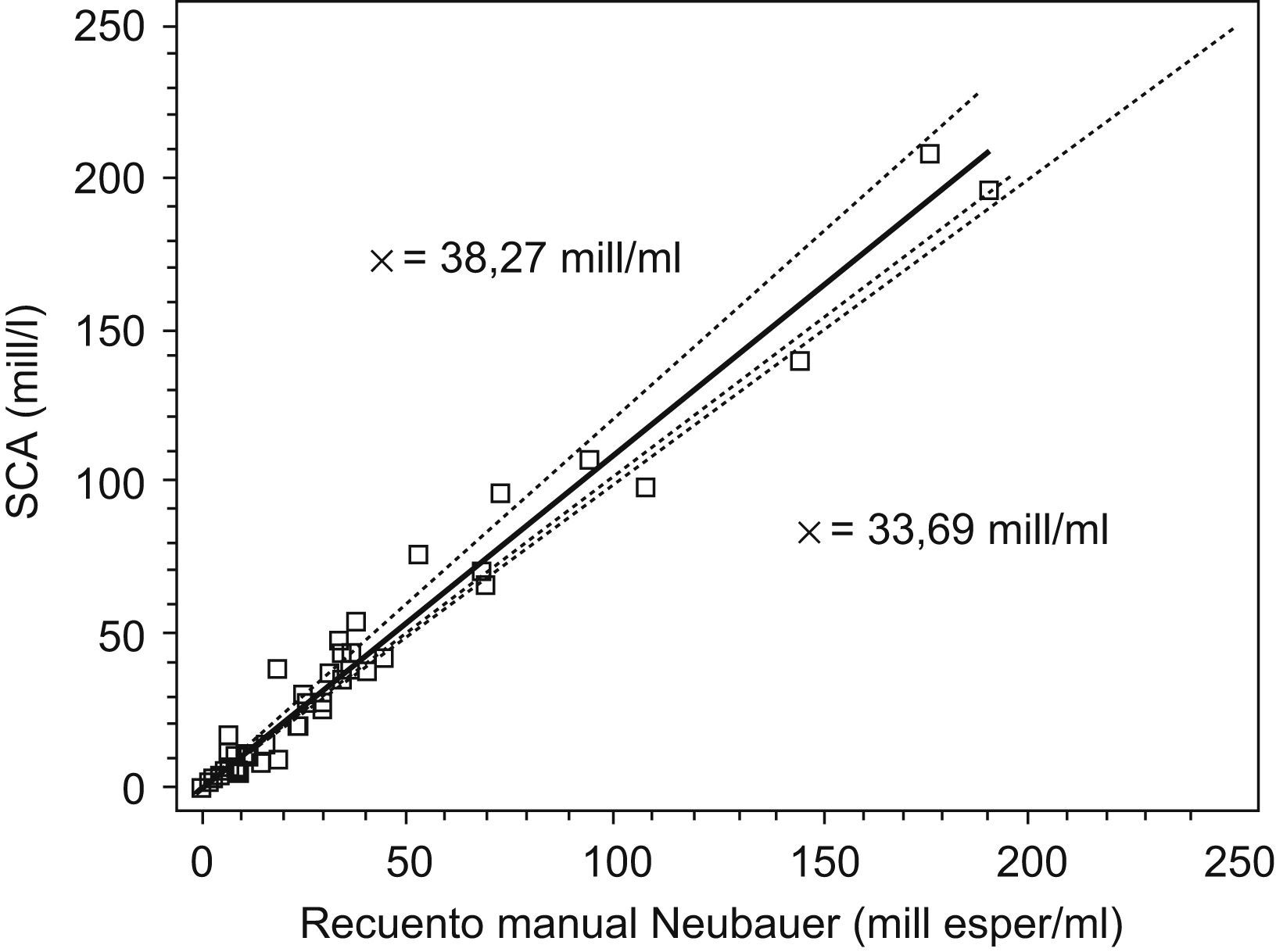
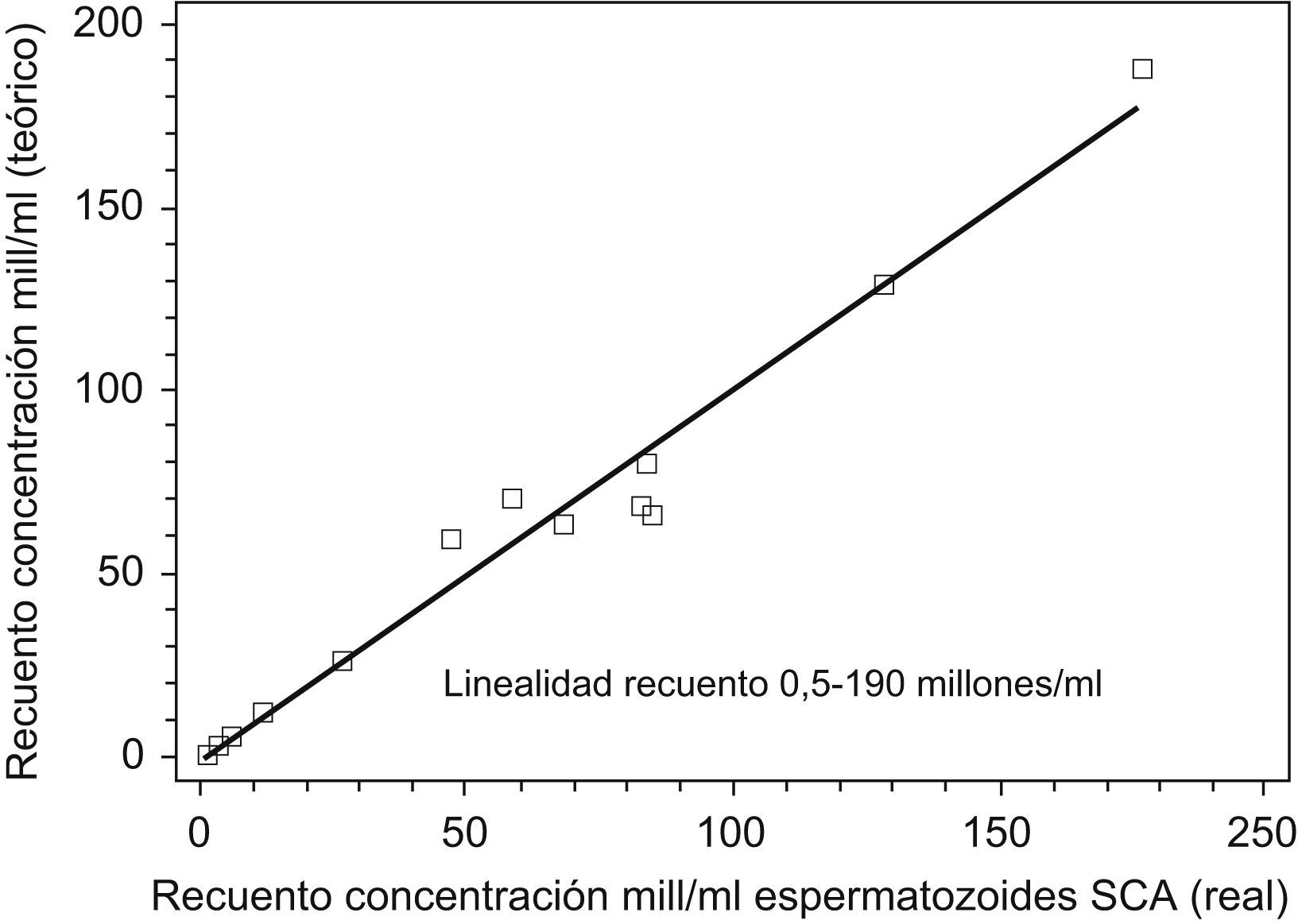
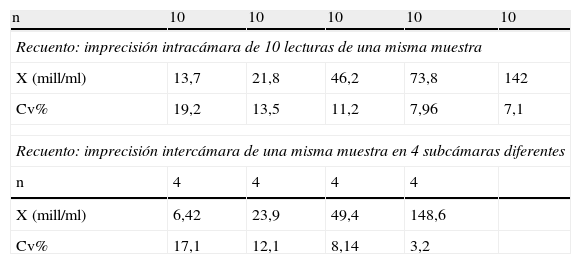
En primer lugar, hemos verificado la validez del submódulo de recuento-concentración estudiando la correlación y su linealidad. Para ello, se ha procesado en paralelo un total de 42 muestras con el método manual de recuento (dilución de la muestra, montaje en Neubauer-Improved y recuento por duplicado) y se ha efectuado el recuento automatizado por el SCA. En la figura 2 se muestra la representación de los resultados obtenidos de la recta de regresión de Passing-Bablock con una p=1,1261 (intervalo de confianza [IC] del 95%, −1,91 a 0,58) y una ordenada en el origen de b=1,1261 (IC del 95%, 1,03–1,29). Al no englobar el IC del 95% de la ordenada en el origen, el valor 1 indica, según Bablock14, que hay una media proporcionalmente más alta de los resultados del SCA (media=38,17 millones/ml) respecto al método manual de recuento (media=33,69 millones/ml), y aunque esta diferencia estadísticamente se considere significativa (11,7%) está dentro de la variación biológica del recuento intra-interindividual del 26,8 y el 56,5%, respectivamente, reseñada por varios autores16–18. El coeficiente de correlación entre ambos resultados presenta una r=0,98 con una p<0,001. Complementando la correlación se ha estudiado la linealidad del recuento del SCA con 5 sémenes, diluyendo muestras de recuentos altos, con pipeta de presión positiva Gilson con solución tampón PBS con un pH de 7,2 .Los resultados se muestran en la figura 3 y nos indican que el recuento se puede considerar lineal desde 190 millones epermatozoides/ml a 0,5 millones/ml; por debajo de esta cifra se considera que el recuento no es fiable, ya que el analizador no efectúa ningún recuento ni distingue de un blanco y por encima de 190 millones/ml es recomendable diluir la muestra multiplicando el resultado por el factor de dilución correspondiente. Complementando los estudios de fiabilidad del recuento, hemos hallado la imprecisión intracámara de un mismo recuento de diversas muestras a varias concentraciones, efectuando 10 lecturas de cada una en una misma cámara; los coeficientes de variación que se han obtenido se muestran en la tabla 1. También se ha calculado la imprecisión intercámara, procesado la misma muestra del semen de un paciente en las 4 subcámaras en que está dividida una cámara de Leja4. Los coeficientes de variación que se obtienen de 4 pacientes distintos se muestran en la tabla 1. Se ha complementado la validación de este módulo con el procesamiento este último año de las muestras de recuento del control de calidad externo de Ceifer por el SCA, y se ha obtenido una inexactitud media del −3,06%, calculada respecto al valor diana del informe Ceifer de control de calidad, que mejora notablemente la inexactitud del −18,48% de este año de nuestro laboratorio con el método manual de la cámara de Neubauer.
Imprecisión del recuento intracámara e intercámara de Leja
| n | 10 | 10 | 10 | 10 | 10 |
| Recuento: imprecisión intracámara de 10 lecturas de una misma muestra | |||||
| X (mill/ml) | 13,7 | 21,8 | 46,2 | 73,8 | 142 |
| Cv% | 19,2 | 13,5 | 11,2 | 7,96 | 7,1 |
| Recuento: imprecisión intercámara de una misma muestra en 4 subcámaras diferentes | |||||
| n | 4 | 4 | 4 | 4 | |
| X (mill/ml) | 6,42 | 23,9 | 49,4 | 148,6 | |
| Cv% | 17,1 | 12,1 | 8,14 | 3,2 | |
Seguidamente hemos estudiado la fiabilidad del submódulo de movilidad, dado que el SCA permite la clasificación a la carta de las velocidades del espermatozoide, dependiendo de la resolución de la cámara digital (número de imágenes/s) y la calidad del microscopio de que se dispone. En la figura 1 se muestra nuestra configuración personalizada ajustada la programación de estas velocidades (rápidos, medios, lentos) a nuestra cámara digital de grabación estándar (Basler, Vision-Technology, 312 FC/C, 25 imágenes/s) y microscopio Nikon E-200 con platina termostatizada a 37°C para que los clasifique como los tipos a%, b% y c% de la OMS.
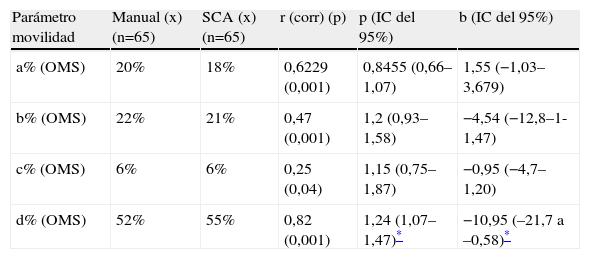
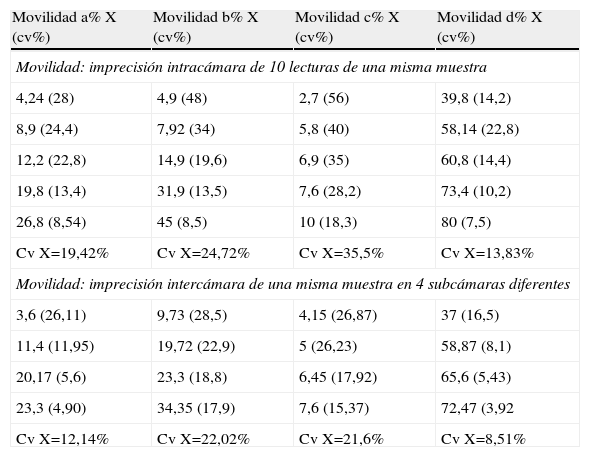
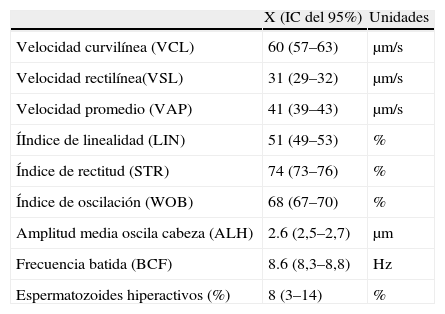
En primer lugar, se realizó el estudio de la correlación con el método manual de referencia (muestra termostatizada a 37°C y porcentaje de movilidad a%, b%, c%, d% de la OMS a 200 espermatozoides) realizada por un facultativo diplomado en la EHSRE que procesa el control de calidad exteno de Ceifer. En la tabla 2 se muestran los valores medios con el método manual y los obtenidos con el SCA: su correlación y los parámetros de la recta de regresión de Passing-Bablock de la muestra de 65 pacientes, de los que se deduce que el SCA sobrevalora ligeramente los espermatozoides de movilidad d%, diferencia poco trascendente desde el punto de vista clínico y que no ha sido posible ajustar más. Complementando los estudios de correlación también se han calculado los coeficientes de variación intracámara, efectuando 10 lecturas de una misma muestra en 5 pacientes distintos. Los resultados, ordenados por concentraciones crecientes, se muestran en la tabla 3. También hemos calculado el coeficiente de variación intercámara, procesando la misma muestra del semen de 4 pacientes, en las 4 subcámaras en que está dividida la cámara de Leja4. Los resultados, ordenados también en concentraciones crecientes, se muestran en la tabla 3. Hemos comprobado que en muestras con recuentos superiores a 120 millones/ml la correlación con el método manual de referencia disminuye significativamente y es aconsejable diluir estas muestras con solución tampón PBS con un pH de 7,2, para disminuir la interacción y las colisiones entre espermatozoides y reducir la sobrevaloración de los espermatozoides de tipo d% y c% de la OMS que se ha observado que se produce con la utilización de la cámara Leja de 10μm de profundidad. Respecto a los nuevos parámetros cinéticos que nos da el SCA (VCL, VSL, porcentaje de hiperactivos), en la tabla 4 se muestran las medias de los valores obtenidos con 35 pacientes de la consulta de esterilidad que presentaban una normozoospermia, según los criterios de la OMS, entre éstos destaca el parámetro de porcentaje de espermatozoides hiperactivos (STR>85% y ALH>2,5μm/s) como el parámetro con mas interés clínico, como lo reseñan varios autores1,4.
Regresión de passing-bablock movilidad manual y SCA
| Parámetro movilidad | Manual (x) (n=65) | SCA (x) (n=65) | r (corr) (p) | p (IC del 95%) | b (IC del 95%) |
| a% (OMS) | 20% | 18% | 0,6229 (0,001) | 0,8455 (0,66–1,07) | 1,55 (−1,03–3,679) |
| b% (OMS) | 22% | 21% | 0,47 (0,001) | 1,2 (0,93–1,58) | −4,54 (−12,8–1-1,47) |
| c% (OMS) | 6% | 6% | 0,25 (0,04) | 1,15 (0,75–1,87) | −0,95 (−4,7–1,20) |
| d% (OMS) | 52% | 55% | 0,82 (0,001) | 1,24 (1,07–1,47)* | −10,95 (–21,7 a –0,58)* |
Imprecisión movilidad intracámara e intercámara de Leja
| Movilidad a% X (cv%) | Movilidad b% X (cv%) | Movilidad c% X (cv%) | Movilidad d% X (cv%) |
| Movilidad: imprecisión intracámara de 10 lecturas de una misma muestra | |||
| 4,24 (28) | 4,9 (48) | 2,7 (56) | 39,8 (14,2) |
| 8,9 (24,4) | 7,92 (34) | 5,8 (40) | 58,14 (22,8) |
| 12,2 (22,8) | 14,9 (19,6) | 6,9 (35) | 60,8 (14,4) |
| 19,8 (13,4) | 31,9 (13,5) | 7,6 (28,2) | 73,4 (10,2) |
| 26,8 (8,54) | 45 (8,5) | 10 (18,3) | 80 (7,5) |
| Cv X=19,42% | Cv X=24,72% | Cv X=35,5% | Cv X=13,83% |
| Movilidad: imprecisión intercámara de una misma muestra en 4 subcámaras diferentes | |||
| 3,6 (26,11) | 9,73 (28,5) | 4,15 (26,87) | 37 (16,5) |
| 11,4 (11,95) | 19,72 (22,9) | 5 (26,23) | 58,87 (8,1) |
| 20,17 (5,6) | 23,3 (18,8) | 6,45 (17,92) | 65,6 (5,43) |
| 23,3 (4,90) | 34,35 (17,9) | 7,6 (15,37) | 72,47 (3,92 |
| Cv X=12,14% | Cv X=22,02% | Cv X=21,6% | Cv X=8,51% |
Valores de los nuevos parámetros morfocinéticos de 35 pacientes con normozoospermia
| X (IC del 95%) | Unidades | |
| Velocidad curvilínea (VCL) | 60 (57–63) | μm/s |
| Velocidad rectilínea(VSL) | 31 (29–32) | μm/s |
| Velocidad promedio (VAP) | 41 (39–43) | μm/s |
| ÍIndice de linealidad (LIN) | 51 (49–53) | % |
| Índice de rectitud (STR) | 74 (73–76) | % |
| Índice de oscilación (WOB) | 68 (67–70) | % |
| Amplitud media oscila cabeza (ALH) | 2.6 (2,5–2,7) | μm |
| Frecuencia batida (BCF) | 8.6 (8,3–8,8) | Hz |
| Espermatozoides hiperactivos (%) | 8 (3–14) | % |
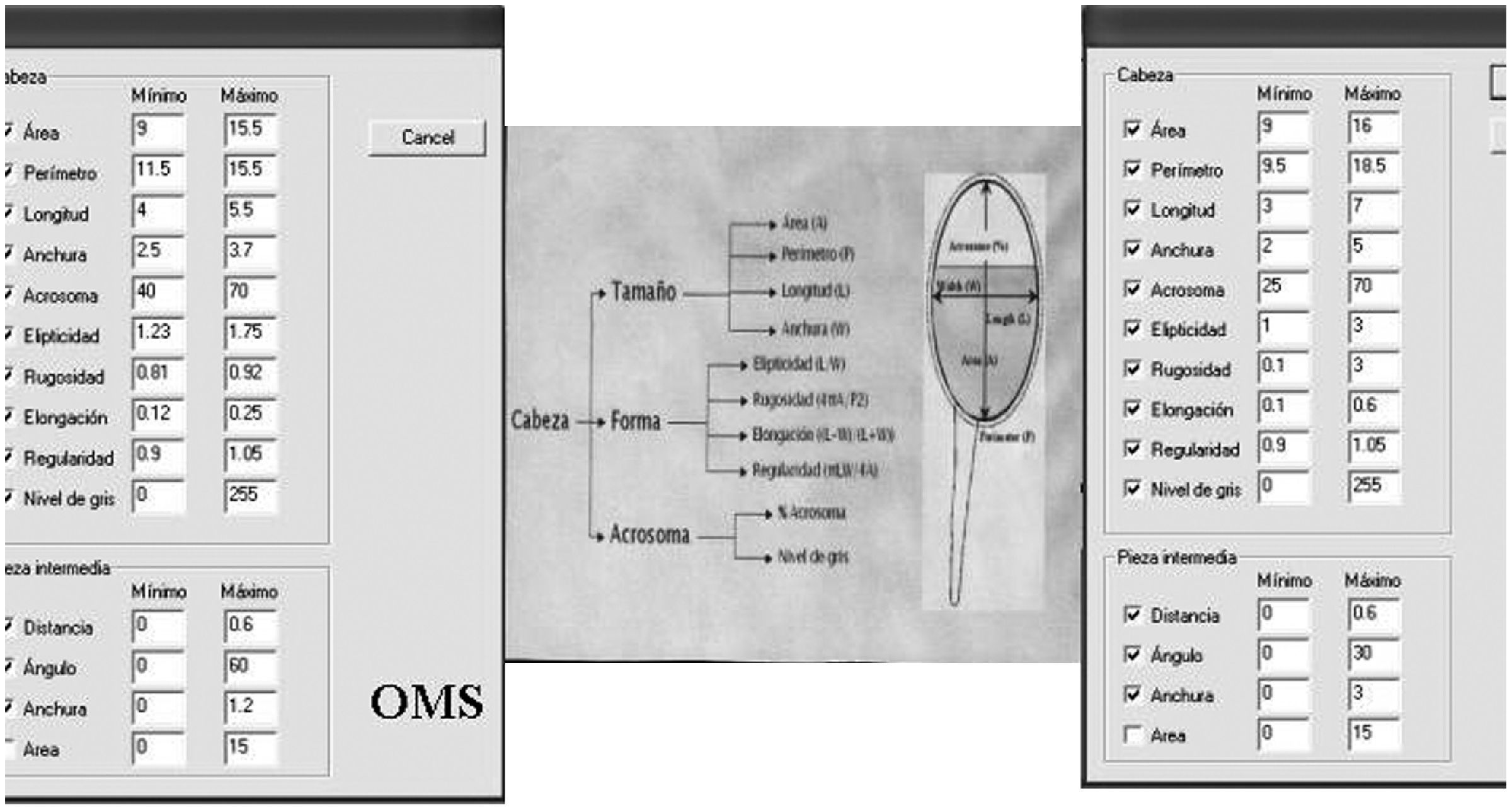
Seguidamente hemos estudiado el módulo de realización de la morfología, que se puede configurar para que realice la morfología con el criterio de la OMS5, de Kruger3 o personal, en función de la amplitud de los márgenes de los parámetros de la cabeza (tamaño, forma y acrosoma, etc.) establecidos para estos criterios, acordados por los fabricantes de sistemas CASA con el grupo de interés en andrología de la ESHRE reunido en Italia en 19974, que permite la clasificación como espermatozoides con morfología normal, si las magnitudes del mismo están dentro de estos márgenes. En la figura 4 se muestra la configuración de estos márgenes del criterio de la OMS y el cálculo de estos parámetros. Hemos efectuado un estudio preliminar escogiendo el criterio de Kruger, ya que para la realización de la morfología manual, nosotros utilizamos este criterio. El estudio mostró diferencias significativas con la aplicación de este criterio con unos valores significativamente más bajos de porcentaje de espermatozoides con morfología normal respecto a nuestro método manual. Parecidos resultados se obtuvieron escogiendo el criterio de la OMS en el SCA, lo que en principio cuestiona la realización de la morfología con el SCA con estos criterios, pero dado que este módulo permite una configuración personal, hemos optado por esta última con la ampliación proporcional de los márgenes de normalidad de los parámetros cabeza (tamaño, forma y acrosoma), y de la zona intermedia (distancia, ángulo de inserción cola, anchura) del criterio menos restrictivo de la OMS. Estos márgenes establecidos se muestran también en la figura 4; con su aplicación hemos conseguido aumentar el porcentaje de espermatozoides normales que entraban dentro de estos márgenes, hasta lograr una máxima correlación con el método manual de referencia, realizado por un facultativo diplomado en ESHRE y con la experiencia del procesamiento del control externo del semen de Ceifer.
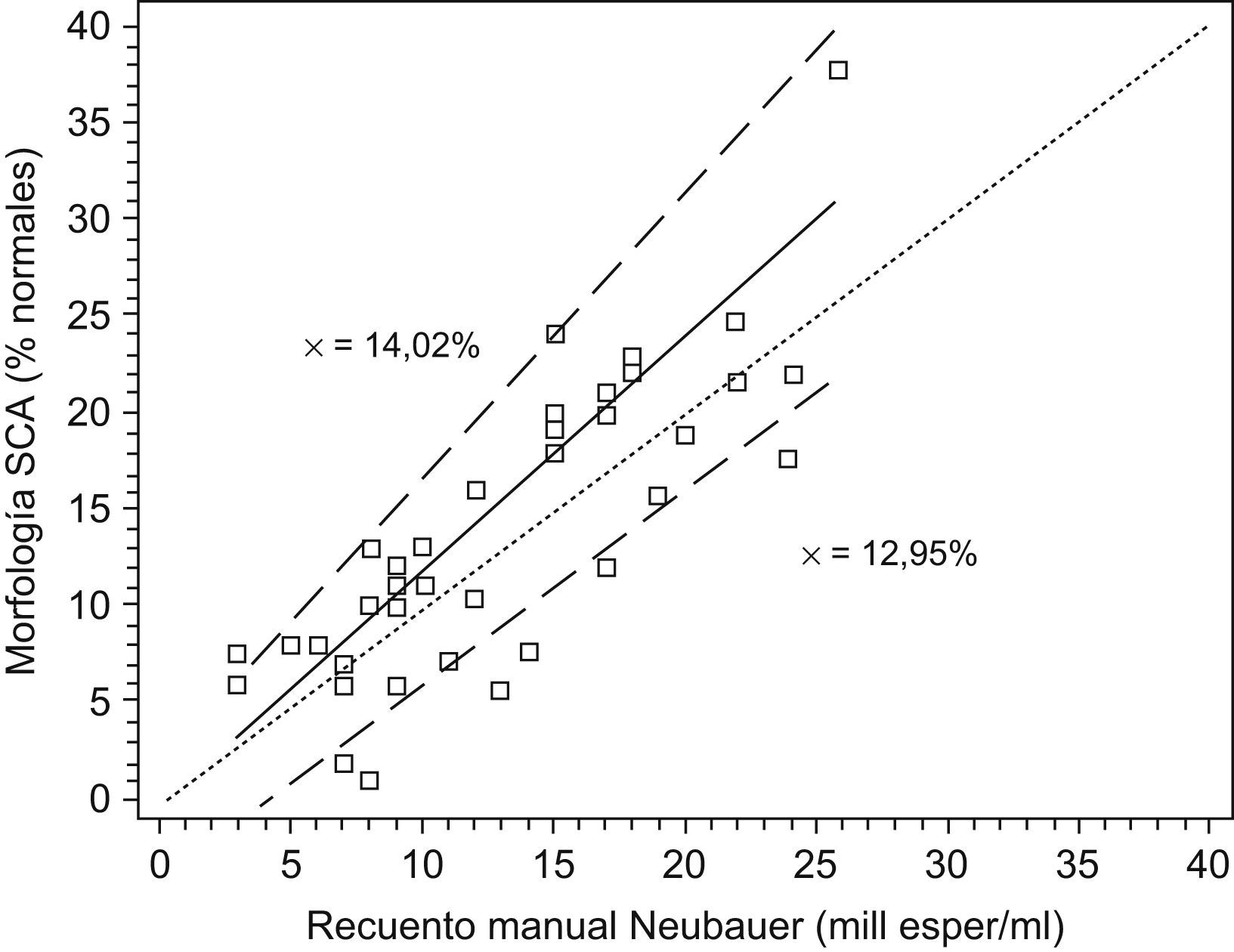
Una vez prefijados estos valores, hemos procesado un total de 41 muestras para verificar la fiabilidad de los resultados. Las medias de los resultados obtenidos con el método manual fue del 13%, con un rango del 3–26%, y la media de los resultados con el SCA, del 14%, con un rango del 1–37%. Aplicando la recta de regresión de Passing-Bablock se han obtenido los siguientes resultados que se muestran en la figura 5: p=1,2 (IC del 95%, 1–1,474) con una b=−0,001 (IC del 95%, −3,91 a 2,1), lo que según Bablock permite una intercambiabilidad de resultados y calculando la t de Student para datos apareados se obtiene una t=−1,615; p=0,1142, lo que indica que no hay diferencias significativas entre las medias de ambos resultados, lo que valida el parámetro de porcentaje de morfología normal para su utilización rutinaria con la ampliación propia de los márgenes morfométricos de normalidad de la OMS, sin descartar su ajuste, a medida que adquiramos más experiencia. Además, la realización de una morfología con el SCA, como hemos comprobado, requiere entre 20–25min por muestra dependiendo del número de espermatozoides.
Complementado estos estudios también llevamos a cabo un estudio de reproducibilidad, escogiendo 2 muestras de diferentes rangos de normalidad y procesando cada muestra 10 veces. La muestra normal con una media del 31% de los espermatozoides normales, ha presentado un coeficiente de variación del 13,06%. La segunda muestra de un rango patológico del 12% de morfología normal, ha presentado un coeficiente de variación del 27%. El conocimiento de estos coeficientes nos permite tener también una idea de la variabilidad del analizador en la realización de morfologías.
También indicar que el software del SCA no contempla el análisis de la cola del espermatozoide y no permite el recuento de células germinales ni leucocitos, recuento muy importante de la morfología espermática por sus implicaciones clínicas.
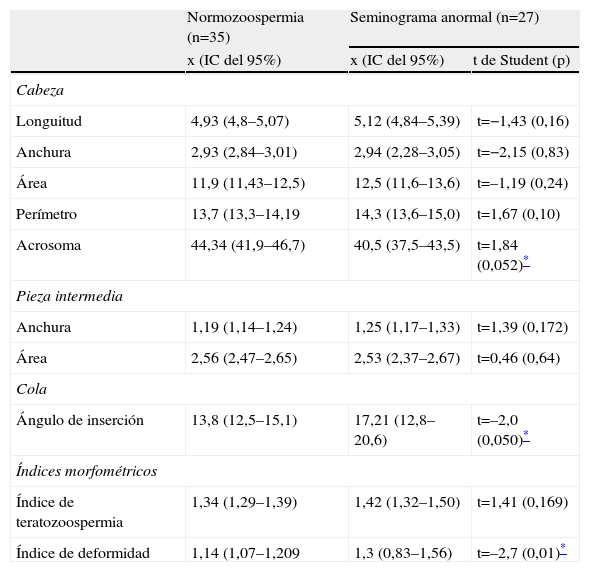
Complementando el estudio del principal parámetro de la morfología que constituye el porcentaje de espermatozoides normales, el SCA proporciona una serie de nuevos e importantes parámetros como los valores morfométricos medios de la cabeza (longuitud, anchura, área) pieza intermedia (anchura, ángulo) de los 100 espermatozoides analizados y permite la visualización de cada espermatozoide analizado con sus magnitudes correspondientes. En la tabla 5 se muestran los valores obtenidos de estos nuevos parámetros que hemos creído relevantes, hallados con los 35 pacientes de esterilidad que presentaron una normozoospermia y en esta misma tabla se presentan también los valores obtenidos de los mismos parámetros con los 27 pacientes de esterilidad que presentaron alguna anormalidad en los parámetros del seminograma. Efectuando el análisis estadístico de la t de Student entre ambos grupos, se observan diferencias significativas en el tamaño del acrosoma y el ángulo de inserción de la cola y el índice de deformación, lo que en principio nos podía indicar que estos 3 parámetros, junto con el índice de teratozoospermia de la bibliografía, podrían tener una cierta significación clínica. Finalmente, cabe indicar que este módulo es un buen instrumento de docencia para la enseñanza de la realización de la morfología espermática, hecho que hay que tener muy en cuenta como una de sus principales aplicaciones.
Valores de los nuevos parámetros en 35 pacientes con normozoospermia
| Normozoospermia (n=35) | Seminograma anormal (n=27) | ||
| x (IC del 95%) | x (IC del 95%) | t de Student (p) | |
| Cabeza | |||
| Longuitud | 4,93 (4,8–5,07) | 5,12 (4,84–5,39) | t=−1,43 (0,16) |
| Anchura | 2,93 (2,84–3,01) | 2,94 (2,28–3,05) | t=−2,15 (0,83) |
| Área | 11,9 (11,43–12,5) | 12,5 (11,6–13,6) | t=–1,19 (0,24) |
| Perímetro | 13,7 (13,3–14,19 | 14,3 (13,6–15,0) | t=1,67 (0,10) |
| Acrosoma | 44,34 (41,9–46,7) | 40,5 (37,5–43,5) | t=1,84 (0,052)* |
| Pieza intermedia | |||
| Anchura | 1,19 (1,14–1,24) | 1,25 (1,17–1,33) | t=1,39 (0,172) |
| Área | 2,56 (2,47–2,65) | 2,53 (2,37–2,67) | t=0,46 (0,64) |
| Cola | |||
| Ángulo de inserción | 13,8 (12,5–15,1) | 17,21 (12,8–20,6) | t=–2,0 (0,050)* |
| Índices morfométricos | |||
| Índice de teratozoospermia | 1,34 (1,29–1,39) | 1,42 (1,32–1,50) | t=1,41 (0,169) |
| Índice de deformidad | 1,14 (1,07–1,209 | 1,3 (0,83–1,56) | t=–2,7 (0,01)* |
El tiempo medio empleado para efectuar un recuento manual en cámara de Neubauer Improve es de 10–12min por muestra, ya que tiene que efectuarse la dilución de la muestra, montado en cámara y recuento por duplicado; la imprecisión intradía media estimada en nuestro laboratorio es del 19% y la interdía del 22%, además, está sujeto a múltiples errores. Hemos validado positivamente el recuento automatizado con el SCA efectuado en cámara de Leja desechable de 10μm de profundidad y que se realiza en menos de 3min, con una imprecisión media intradía del 10,13% con un rango de 3,2–17,1%, según el recuento. Se ha comprobado la exactitud de la medición comparando los resultados del método manual de recuento con el automatizado en una muestra de 42 pacientes y la aplicación de la recta de regresión de Passing-Bablock a estos resultados y se ha puesto de manifiesto que aunque el SCA presente unos recuentos ligeramente más altos, esta diferencia está dentro de la variación biológica del semen16 y clínicamente no es relevante, ya que se produce sobre todo en pacientes con recuentos altos. Hemos comprobado, además, la fiabilidad del recuento con el estudio de la linealidad entre 190 millones de espermatozoides/ml a 0,5 millones/ml. Es importante indicar, además, en este apartado, que la presencia de células germinales o leucocitos puede ocasionar interferencias en el recuento que deben mimetizarse, con un proceso adicional de revisión manual del recuento de cada fotograma, eliminando manualmente estas células. Finalmente, el procesamiento de los controles externos de recuento de Ceifer por el SCA este último año nos ha permitido calcular su inexactitd media con el valor diana del informe de control de calidad, que ha sido del −3,06%, lo que mejora nuestra inexactitud media del −18,48% al año con el método manual, lo que ratifica la fiabilidad del recuento automatizado.
Respecto al parámetro de la movilidad espermática, que manualmente se realiza de una manera rápida en unos 3min, es una técnica que requiere mucha experiencia para formar el personal, para que efectúe la valoración de la movilidad con una cierta fiabilidad, siendo la imprecisión media intradía del proceso estimada en nuestro laboratorio de un 22% para la movilidad progresiva. El sistema automatizado SCA con platina termostatizada presenta una imprecisión media intradía del 18%, reduciendo notablemente la variabilidad manual con un tiempo de realización de 2–3min y, además, el SCA nos permite también variar los criterios de clasificación de las movilidades para correlacionarlos con nuestra propia normalidad, cámara digital y microscopio de que dispongamos y nos proporciona una objetividad y una reproducibilidad difíciles de conseguir por métodos manuales, calculando, además, los nuevos parámetros cinéticos, como VCL, VSL, ALH, BCF, porcentaje de hiperactivos, etc., que podrían aplicarse en ayuda al diagnóstico, como ya se ha descrito para el parámetro de porcentaje de espermatozoides hiperactivos1,4.
Finalmente, hemos estudiado el módulo de morfología, el tiempo empleado para la realización de una morfología manual ya teñida es de unos 3–4min y requiere también una cierta experiencia y tiempo de formación del personal para conseguir llegar a los estándares mínimos, siendo la imprecisión intradía estimada en nuestro laboratorio procesando una extensión con un valor normal de un 18,87%. El SCA requiere de unos 20–25min para la realización de una morfología; hemos hallado el coeficiente de variación y se ha visto que se reduce la imprecisión-intradía a un 13% para valores normales respecto al manual. El SCA permite para la realización automatizada de la morfología espermática la utilización de criterios prefijados de OMS o de Kruger, y como hemos comprobado son muy estrictos y ocasiona unos valores muy bajos de normalidad respecto al método manual y no son aplicables a su utilización rutinaria, pero nosotros ampliando proporcionalmente los márgenes de normalidad establecidos para el criterio de la OMS, hemos conseguido una correlación aceptable con nuestro método manual, lo que en principio permite su utilización, pero dado que el tiempo de realización de cada muestra es de 20–25min y que prácticamente en el estudio se excluye la cola del espermatozoide y las células germinales y los leucocitos, creemos que sólo es aplicable para estudiar casos muy específicos de patología andrológica. Es importante destacar, además, que respecto a los nuevos parámetros que calcula el SCA, solamente hemos comprobado que algunos podrían tener algún significado clínico, como los índices de teratozoospermia, el índice de deformidad, el tamaño del acrosoma, el ángulo de inserción y los valores medios de los parámetros morfométricos. También es importante indicar que este módulo es un buen instrumento de docencia en el aprendizaje para la realización de la morfología espermática, lo que hay que tener muy en cuenta como una de sus principales aplicaciones.
Finalmente, cabe añadir que queda pendiente de automatización el parámetro de la vitalidad espermática y la aplicación al SCA de una platina móvil para hacer posible el análisis automatizado del control de las vasectomías que el SCA no contempla en esta versión, pero que el fabricante nos ha indicado que se han incorporado en el nuevo SCA.
En resumen, el estudio efectuado, hemos validado el SCA para realizar los recuentos y los porcentajes de movilidad a%, b%, c%, d% de la OMS, con una reducción de los coeficientes de variación respecto al método manual, lo que aumenta la fiabilidad clínica de los resultados obtenidos al reducir la variabilidad y la aplicación de la morfología en el uso rutinario queda postergada hasta que se consiga una reducción técnica del tiempo empleado para cada muestra y se mejoren las prestaciones.