El Pathfast® (Mitsubishi Kagaku Iatron) es un analizador compacto de quimioinmunoluminiscencia que puede procesar indistintamente muestras de plasma y de sangre.
ObjetivosEn este estudio se han evaluado algunas características del procedimiento: repetibilidad, reproducibilidad, comparación con otro procedimiento (Dimension® RxL, Dade Behring), límite de detección, límite de cuantificación, interferentes endógenos por triglicérido, hemoglobina y bilirrubina, y tambien se ha estudiado la presencia de falsos positivos presentes en enfermedades sin isquemia miocárdica.
Material y métodosEl diseño ha sido de un estudio multicéntrico en el que han participado los laboratorios de urgencias de 4 hospitales españoles. La magnitud biológica elegida para llevar a cabo esta evaluación ha sido la troponina I (TnI).
ResultadosLos coeficientes de variación (CV) intradía fueron inferiores al 5%, mientras que los CV interdía no superaron el 10%. El límite de detección se situó entre 0,003 y 0,008ng/ml para los laboratorios participantes. El límite de cuantificación obtenido fue de 0,025ng/ml. La regresión obtenida entre suero y plasma fue de TnI (plasma)=−0,0008+0,9499×TnI (sangre), y la regresión obtenida con el método de comparación fue de TnI (Pathfast®)=−0,0019+0,2903×TnI (Dimension® RxL). El estudio de interferencias endógenas muestra que los resultados no se alteran significativamente en presencia de triglicérido, bilirrubina o hemoglobina libre. El estudio de otras entidades clínicas (insuficiencia renal, accidente cerebrovascular y politraumatismo) no ha mostrado diferencias con el procedimiento de comparación.
DiscusiónEn resumen, el analizador Pathfast® resulta un equipo fiable, preciso y fácil de manejar, útil para laboratorios de tamaño pequeño y medio, o para laboratorios de urgencias.
The Pathfast® (Mitsubishi Kagaku Iatron) is a compact chemiluminescent immunoassay analyser that is capable of processing either plasma or blood samples.
ObjectivesIn this study we have evaluated some operational characteristics such as within assay variability, between-day variability, reference values, comparison with another method (Dimension® RxL, Dade Behring), analytical sensitivity, quantitation limits, endogenous interferences by triglycerides, haemoglobin and bilirubin, and false positives in other diseases.
Materials and MethodsThe evaluation of Troponin l was designed as a multicentre study in which the emergency laboratories of four Spanish Hospitals took part.
ResultsThe within assay coefficient of variation (CV) was lower than 5% whereas the between-day CV did not exceed 10%. The overall analytical sensitivity for the four laboratories was between 0.003 and 0.008ng/ml. The quantitation limit was 0.025ng/ml. The regression obtained between plasma and blood was Troponin I (plasma)=−0.0008+0.9499×Troponin I (blood), and between Pathfast® and the comparison method was Troponin I (Pathfast)=−0.0019+0.2903×Troponin I (Dimension RxL). Tests of endogenous interferences showed that the results are not altered significantly in the presence of triglyceride, bilirubin or free haemoglobin. The study of other clinical diseases (Renal Impairment, Stroke, Multiple trauma) did not show any differences in the method comparison.
DiscussionIn summary, the Pathfast® analyser is reliable, precise and easy to handle, useful for laboratories of small and average size, or for emergency laboratories.
La troponina I (TnI) es una proteína del músculo cardíaco1,2 con peso molecular de 22.500 daltons. En la célula muscular cardíaca3, la TnI, junto con la troponina T (TnT) y la troponina C, forma un complejo que desempeña un papel fundamental en la transmisión de la señal intracelular del calcio en la interacción actina miosina. La TnI se libera rápidamente a la circulación sanguínea4, de 4 a 6h del inicio de un infarto agudo de miocardio (IAM) y permanece elevada durante varios días posteriores. Por otra parte, la concentración de TnI es muy baja en individuos sanos e indetectable en pacientes con daño musculoesquelético, lo que muestra una clara especificidad del músculo miocárdico y una elevada sensibilidad diagnóstica para detectar necrosis de éste1. Adicionalmente, varios estudios han identificado una clara relación entre las concentraciones elevadas de TnI y una evolución adversa a largo plazo tras un episodio de dolor torácico2. La tropoinina (TnI o TnT) muestra un elevado valor predictivo4 para clasificar situaciones de alto riesgo en pacientes con angina inestable, lo que hace a esta prueba especialmente útil en la evaluación del paciente coronario antes de decidir el alta hospitalaria.
Actualmente, la troponina (TnI o TnT) se ha incorporado como criterio diagnóstico del IAM en la redefinición del síndrome coronario agudo (SCA)5–8.
Otro aspecto importante acerca de la determinación de la TnI es el de su practicabilidad y, en la actualidad, hay múltiples métodos de medida y varias plataformas que la incorporan dentro de su catálogo de pruebas. Las troponinas cardíacas poseen un valor fundamental en la toma de decisiones frente a un SCA, de manera que independientemente de su incorporación en equipos tradicionales del laboratorio de urgencias, también puede ser interesante su disponibilidad en equipos discretos dedicados que permitan ofrecer un resultado cuantitativo rápido sin interferir con el resto de las mediciones del laboratorio.
Un instrumento que cumple las características anteriormente mencionadas es el Pathfast® (Mitsubishi Kagaku Iatron, Inc., Tokio, Japón). El Pathfast® es un analizador discreto que incorpora, entre otros, un panel de marcadores cardíacos en un formato con todos los reactivos incorporados en forma de cartucho sin apenas intervención técnica (con excepción de la carga de muestra). El equipo puede medir la TnI en plasma o en sangre y puede utilizarse bien de forma complementaria al laboratorio de urgencias, bien de forma dedicada a las unidades de dolor torácico que requieran medidas rápidas de los marcadores cardíacos.
El objetivo de este trabajo ha sido el de evaluar el comportamiento del Pathfast® y sus características funcionales en la determinación específica de la TnI y comparar los resultados obtenidos con un método de comparación representado por el equipo Dimension® RxL (Dade Behring, Newark, EE. UU.).
Material y métodosEl diseño del estudio experimental es multicéntrico. En él han participado los laboratorios de urgencias de 4 centros españoles: Hospital de Galdakao (País Vasco), Hospital Germans Trías i Pujol (Cataluña), Hospital Clínico Valencia (Valencia) y Hospital Xeral Calde (Galicia). Para los distintos estudios, se ha utilizado la sangre o el plasma residual después de realizar las mediciones solicitadas de forma habitual; los resultados obtenidos en este estudio han sido siempre anónimos y no se han utilizado con ningún fin asistencial en ninguno de los centros participantes. El Comité Ético de Investigación Clínica del Hospital de Galdakao ha revisado y aprobado el protocolo de la evaluación y se ha hecho extensivo al resto de los centros participantes sin ninguna modificación sobre éste.
Instrumentación y reactivos para la determinación de la troponina IPara la presente evaluación, se han utilizado 4 unidades del equipo de medida Pathfast® distribuidos y puestos a punto por Biotécnica 2000 S.L. Se han usado 2 lotes diferentes de reactivos de TnI.
El principio de la técnica es el quimioluminoinmunoanálisis. Además, el analizador Pathfast® utiliza la tecnología Magtration® para la separación de las fases unida o libre en varios pasos de reacción.
El estuche de reactivos y calibradores del equipo de medida Pathfast® contiene una serie de cartuchos de reacción, y cada uno de éstos dispone de todos los reactivos necesarios para la medición de la TnI en compartimentos separados. El sistema usa calibración a 2 puntos, los calibradores están incluidos en el estuche.
El instrumento puede procesar simultáneamente hasta 6 cartuchos de la misma o diferente magnitud biológica del panel de pruebas disponible. En el caso de la TnI, el proceso total de análisis hasta la consecución del resultado dura 17min.
Se siguieron las instrucciones del fabricante, tanto para la calibración del instrumento como para la realización de las medidas. Para el estudio de imprecisión, se ha utilizado suero control Liquichek® Cardiac Markers Control de Bio-Rad (Bio-rad Clinical Diagnostics Group, Hercules, EE. UU.) a 2 valores de concentración.
ProcedimientoEn la presente evaluación se han estimado las siguientes características del procedimiento de medida: repetibilidad, reproducibilidad, comparación de procedimientos, límite de detección, límite de cuantificación, interferentes endógenos por triglicérido, hemoglobina y bilirrubina, y presencia de falsos positivos (para IAM) en otras entidades clínicas (insuficiencia renal, accidente cerebro vascular, politraumatismo).
Preparación de las muestrasLas muestras de sangre se obtuvieron por venopunción y se mezclaron con heparina de litio como anticoagulante. Posteriormente, se separó una alícuota de sangre para la medición de la TnI en el Pathfast® en el plazo máximo de 2h para los estudios de regresión de las medidas en plasma frente a las medidas en sangre. El resto de la muestra se centrifugó antes de transcurrida 1h tras la extracción a 2.500 o a 3.000g durante 10min. El plasma se separó y se analizó inmediatamente o se conservó en alícuotas de 0,5ml, congelado a −20°C hasta el momento de la medición de la TnI. En el caso de las muestras congeladas, se realizó la descongelación a 37°C y se invirtió el contenedor varias veces para asegurar la homogeneidad de la muestra. Antes de realizar las mediciones en las muestras se comprobó la ausencia de restos de fibrina y en este caso se realizó una nueva centrifugación. A las muestras de plasma no se les realizó más de un proceso de congelación o de descongelación durante el estudio.
Tratamiento estadísticoPara el estudio de imprecisión, se utilizó el protocolo EP5-A del NCCLS (National Committee for Clinical Laboratory Standards)9 en la variante de mediciones de diferentes muestras repetidas (duplicados) de 2 niveles del control durante un período de 21 días. De acuerdo con las instrucciones del fabricante, sólo se realizó recalibración del instrumento cuando el control de calidad lo aconsejaba, habían transcurrido 30 días desde la calibración anterior o se cambió de lote de reactivos. Para la comparación de los resultados obtenidos por cada uno de los laboratorios, se utilizó el análisis de varianza de una vía y el método de Bonferroni10 para las comparaciones múltiples entre laboratorios.
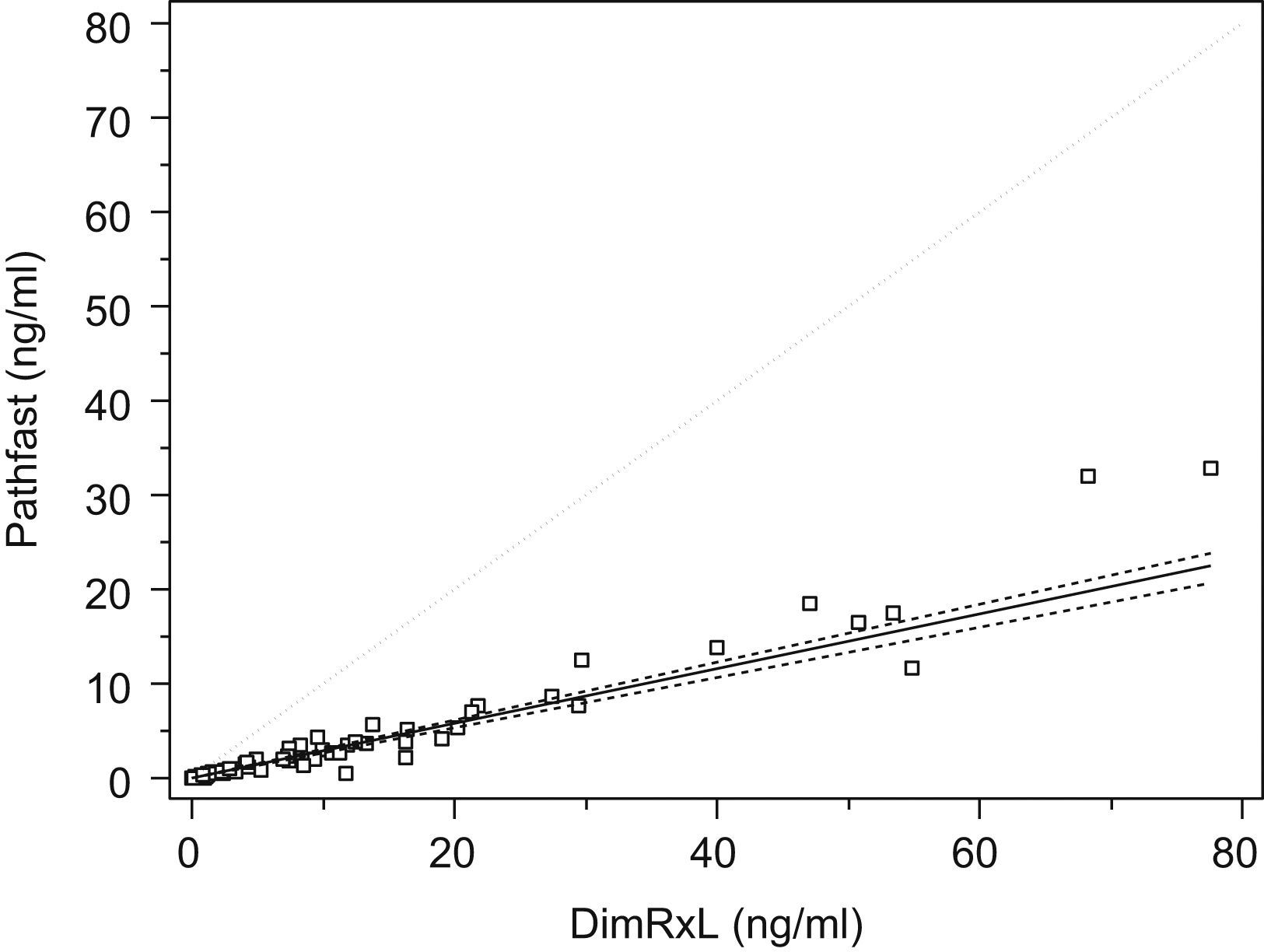
Para los análisis de regresión, se compararon los resultados obtenidos en las muestras de los pacientes a quienes se solicitaba la medición de la TnI entre el método habitual y el método del Pathfast®. Puesto que 3 de los centros utilizaban el analizador Dimension® RxL como plataforma habitual y uno el ELECSYS® 2010 (Roche Diagnostics Systems, Mannheim, Alemania) que determina la TnT, se decidió utilizar para el análisis, de forma agregada, los resultados de los 3 centros que utilizaban Dimension® RxL (148 muestras en total, con un rango para los resultados de la medición de la TnI en el analizador Dimension® RxL de éstas de entre 0,003 y 77,6ng/ml). Puesto que los instrumentos utilizados (Dimension® RxL) eran idénticos, así como los protocolos de extracción, instrucciones del fabricante (incluidas las condiciones de calibración) y rangos de referencia comunes, se asumió la transferabilidad de resultados entre éstos. El análisis de regresión se realizó mediante el método de regresión no lineal de Passing Bablok.
El análisis del límite de detección se efectuó por medición en cada centro de 20 replicados de cloruro sódico al 0,9% como muestra, y se consideró como límite de detección el de la media +3 desviaciones estándares de las mediciones.
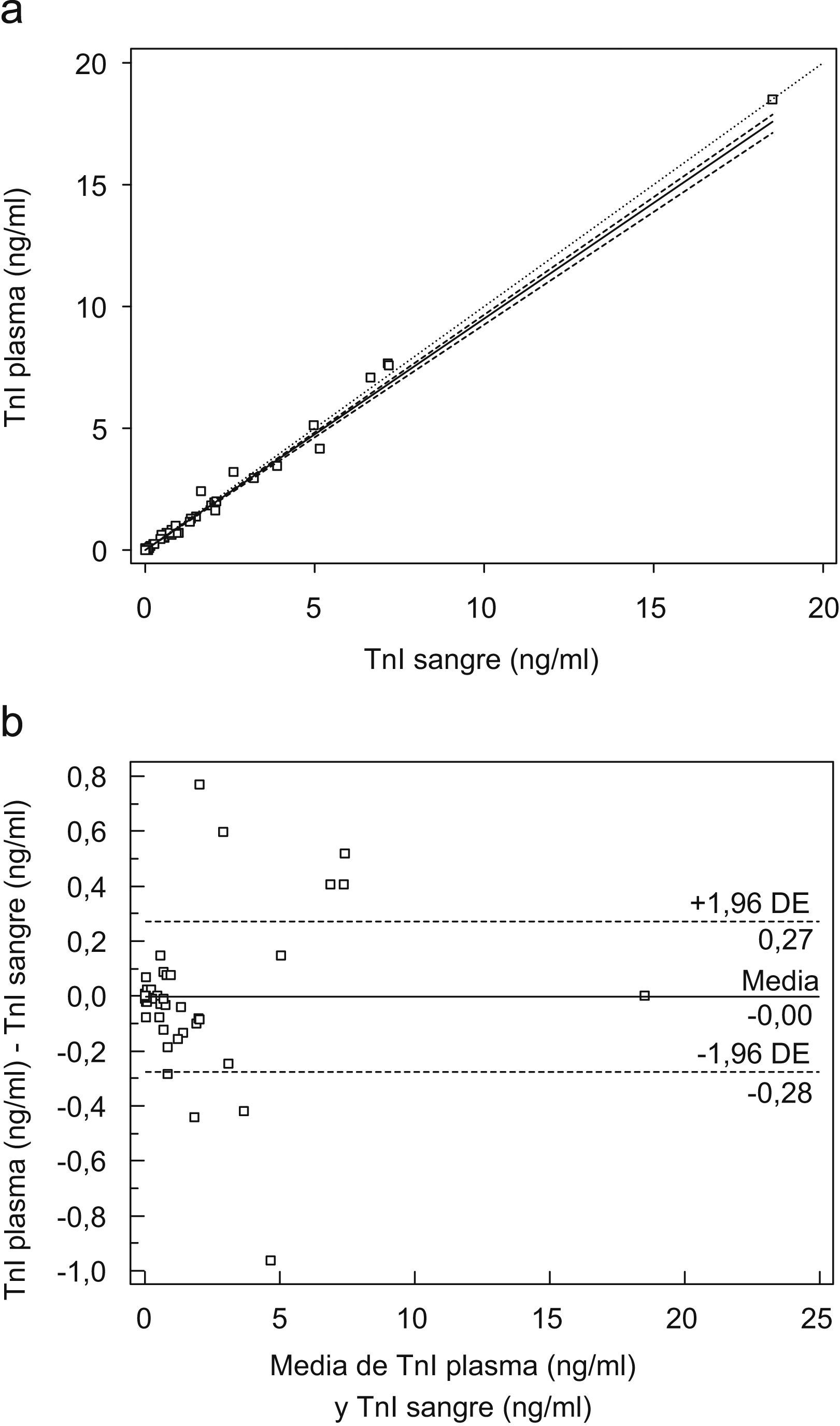
La comparación de los resultados entre plasma y sangre se efectuó sobre las mismas muestras antes (sangre) y después de centrifugar (plasma). La obtención de los especímenes y la medida de la TnI se realizó en los 3 centros. Los resultados obtenidos se agruparon y se utilizó el método de regresión no lineal de Passing Bablok para llevar a cabo la comparación11.
El grado de concordancia entre ambos especímenes se valoró mediante el análisis de Bland Altman12.
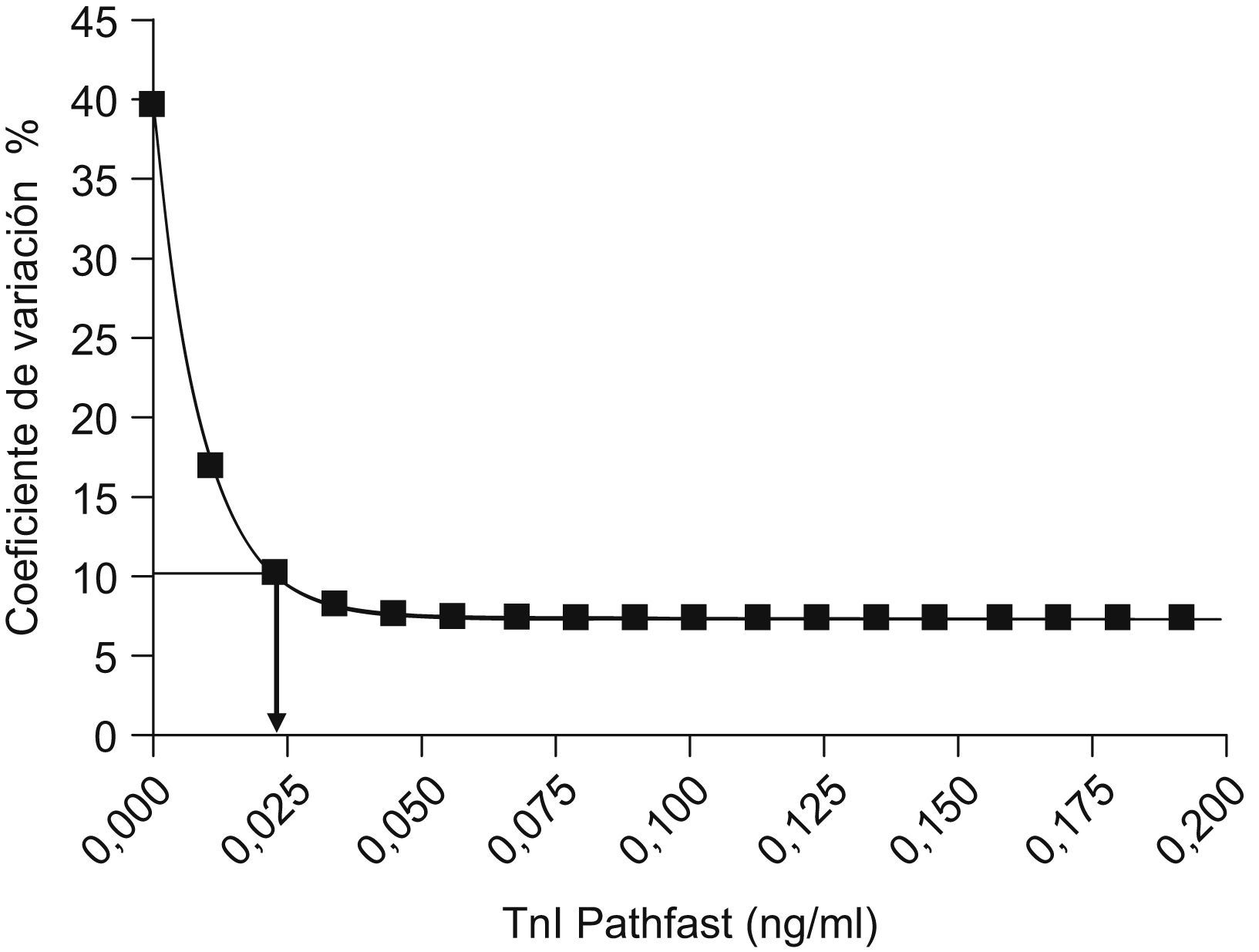
Para la estimación del límite de cuantificación, se prepararon diferentes mezclas de plasmas con concentraciones crecientes de TnI que cubrían diferentes rangos de concentraciones: se preparó una mezcla (mezcla A) con plasma de pacientes sin sospecha de enfermedad coronaria; otra mezcla (mezcla B) con plasma de pacientes con sospecha de SCA, pero en los que la determinación de la troponina por el método convencional había ofrecido resultados normales; otra mezcla (mezcla C) con plasmas con resultados cercanos al punto de corte habitual (0,2ng/ml para el Dimension® RxL), y 3 mezclas más (mezclas D, E y F) con concentraciones crecientes de TnI; de tal manera que se obtuvieron 6 mezclas con concentraciones de TnI que iban desde valores prácticamente indetectables (valor medio de la mezcla A de 0,04ng/ml) a valores claramente elevados (valor medio de la mezcla F de 5,8ng/ml). En todos los casos, los plasmas utilizados para la preparación de las mezclas fueron plasmas frescos, sobrantes tras las mediciones habituales solicitadas y seleccionados en función de los resultados obtenidos en las mediciones de la TnI. Una vez formadas las mezclas, se homogeneizaron, se repartieron en alícuotas y se congelaron a −20°C hasta el momento de realizar las mediciones de la TnI con el Pathfast®. Las mediciones se realizaron por duplicado durante 20 días consecutivos, se descongeló una alícuota de cada mezcla cada uno de los días en que se llevó a cabo el protocolo experimental. Los resultados obtenidos se analizaron mediante el programa GraphPad, con una aproximación de decaimiento no lineal (fórmula Y=A*X^B+C*X^D, donde Y es el coeficiente de variación [CV] y X es la concentración de TnI) y se extrapoló la menor concentración de TnI para la cual el CV obtenido fuera menor del 10%.
Para el análisis de linealidad, se preparó una mezcla con plasmas de elevada concentración de TnI (mayor que el límite superior del rango dinámico definido por el fabricante para el método habitual y situado en 40ng/ml), y a partir de éste se prepararon diluciones progresivas con suero fisiológico (desde 10:0 hasta 2:8, razón mezcla a suero fisiológico al 0,9%, respectivamente) que se midieron por duplicado. Los resultados teóricos (calculados a partir de la dilución de 2:8) y los resultados obtenidos se analizaron mediante regresión de Passing Bablok y se estimó si había desviación de la linealidad.
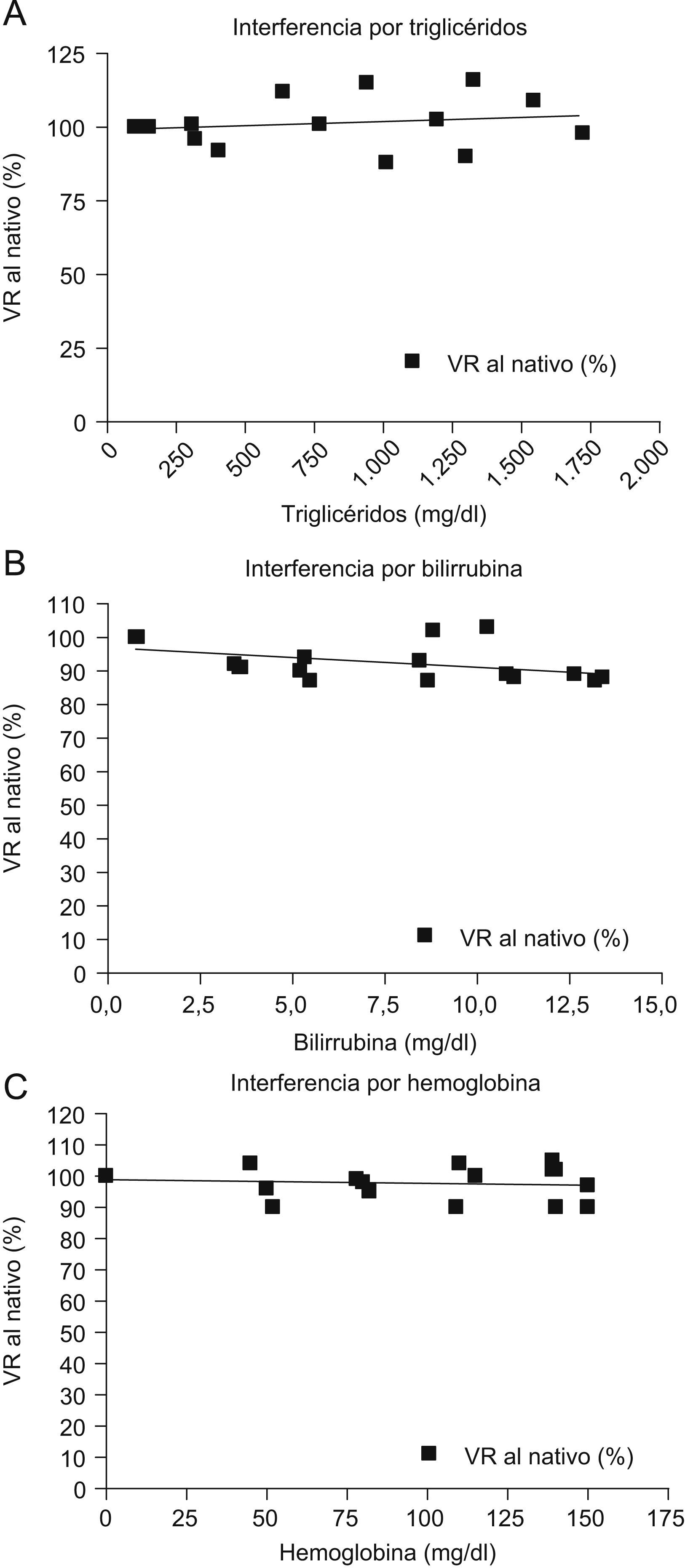
Para el análisis de las interferencias analíticas endógenas, cada uno de los laboratorios participantes preparó 3 mezclas de plasma con concentraciones elevadas de troponina (superiores a 10ng/ml cuando las mezclas se midieron con el instrumento habitual). La primera de éstas se mezcló en diferentes proporciones (desde 1:9 hasta 9:1, razón mezcla a plasma lipidémico, respectivamente) con un plasma fuertemente lipidémico (aproximadamente 2.000mg/dl de triglicérido); a la segunda mezcla se le adicionó un hemolizado obtenido de una sangre normal con ácido edético en cantidades crecientes desde 0 hasta 100μl, y la tercera se suplementó con diferentes volúmenes (de 5 a 25μl de una solución de 10mg/ml de dilaurato de bilirrubina). En todos los casos, el número mínimo de preparaciones realizadas fue de 5 y en todas se midió tanto la concentración de interferente como la de TnI. Los resultados obtenidos se refirieron como porcentajes de la concentración obtenida en el plasma nativo (para compensar las diferencias de concentración de interferente y de TnI entre los laboratorios) tras realizar las correspondientes correcciones por los cambios de volumen.
Para el análisis de la aparición de falsos positivos (concentración de TnI superior al límite de cuantificación en ausencia de un SCA) en otras entidades clínicas, cada uno de los centros seleccionó 10 muestras de plasma de pacientes con cada una de las siguientes entidades: insuficiencia renal, accidente cerebrovascular (ACV) y politraumatismo. Estas muestras se analizaron para obtener su concentración de TnI mediante el Pathfast®.
Para la obtención de los valores de referencia de la población, se seleccionó en cada centro a un grupo de 50 individuos sanos o que acudían al centro por enfermedades no relacionadas con un SCA. Se siguieron las recomendaciones actuales que hacen referencia al valor discriminante de las troponinas cardíacas en el diagnóstico del IAM13.
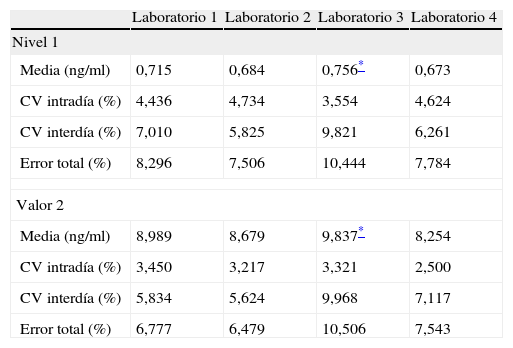
ResultadosSobre la precisión, como se ha comentado en el apartado “Material y métodos”, se aplicó el protocolo EP5-A de la NCCLS únicamente con 2 repeticiones por muestra, por lo que es posible obtener la imprecisión intradía, la interdía y la imprecisión total, pero no la imprecisión interserie. Los resultados se muestran en la tabla 1 para los 4 laboratorios participantes y 2 niveles de control. Los coeficientes de variación intradía fueron inferiores al 5%, y menores para concentraciones francamente elevadas de TnI que para concentraciones menos elevadas. Los coeficientes de variación interdía en ningún caso superaron el 10%. Sólo en uno de los laboratorios, la imprecisión total superó el 10%, además, este laboratorio es el que ofreció valores medios de TnI ligera pero significativamente superiores al resto de los laboratorios (p<0,001 en análisis de varianza).
Imprecisión de la determinación de la troponina I mediante el Pathfast®
| Laboratorio 1 | Laboratorio 2 | Laboratorio 3 | Laboratorio 4 | |
| Nivel 1 | ||||
| Media (ng/ml) | 0,715 | 0,684 | 0,756* | 0,673 |
| CV intradía (%) | 4,436 | 4,734 | 3,554 | 4,624 |
| CV interdía (%) | 7,010 | 5,825 | 9,821 | 6,261 |
| Error total (%) | 8,296 | 7,506 | 10,444 | 7,784 |
| Valor 2 | ||||
| Media (ng/ml) | 8,989 | 8,679 | 9,837* | 8,254 |
| CV intradía (%) | 3,450 | 3,217 | 3,321 | 2,500 |
| CV interdía (%) | 5,834 | 5,624 | 9,968 | 7,117 |
| Error total (%) | 6,777 | 6,479 | 10,506 | 7,543 |
CV: coeficiente de variación.
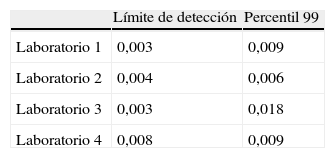
El límite de detección (media +3 desviaciones estándares de las mediciones realizadas en el diluyente) se situó entre 0,003 y 0,008ng/ml para los 4 laboratorios, mientras los valores de referencia obtenidos en individuos sin SCA marcaban un valor discriminante (percentil 99) ligeramente superior al del límite de detección (tabla 2).
Para la estimación del límite de cuantificación se trazó la curva que relacionaba los CV obtenidos para diferentes concentraciones de TnI y se buscó el punto de intersección de un CV del 10%. Se utilizaron diferentes aproximaciones matemáticas para el ajuste de la curva, se seleccionó la opción “one phase exponential decay” y se extrapoló sobre ésta el CV del 10% (fig. 1).
Según esta aproximación, el límite de cuantificación obtenido (menor concentración de TnI para la cual el CV es inferior al 10%) fue de 0,025ng/ml.
En el análisis de linealidad pudo observarse que la regresión no mostraba desviaciones de la linealidad hasta los valores más elevados medidos (40ng/ml).
En el análisis de regresión entre sangre y plasma se utilizaron los datos de sangre sin corrección de hematocrito (se asumió un hematocrito del 40%) y se compararon con los obtenidos en el plasma de las mismas muestras. En la figura 2a se representa la regresión obtenida con la ecuación de TnI (plasma)=−0,0008+0,9499×TnI (sangre), y unos intervalos de confianza (IC) del 95% para la ordenada en el origen de −0,0009 a −0,0005, y para la pendiente de 0,9256 a 0,9667. En la gráfica de Bland Altmand de los datos (fig. 2b) se observa que la dispersión de los datos se produce a ambos lados de la media, con un sesgo medio para plasma de −0,00ng/ml de los valores obtenidos en sangre.
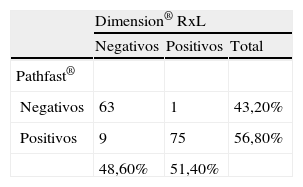
Para la comparación de los 2 procedimientos a través de la regresion lineal de Passing Bablok, sólo se utilizaron los datos de los 3 laboratorios que utilizaban Dimension® RxL (Dade Behring) y, al igual que en el caso anterior, con los datos agrupados. En la figura 3 puede observarse la recta de regresión obtenida con ambos métodos, donde la ecuación obtenida fue TnI (Pathfast)=−0,0019+0,2903 TnI Dimension® RxL, con un IC del 95% para la ordenada en el origen de −0,0047 a 0,0001, y para la pendiente de 0,2664 a 0,307. En el análisis de concordancia se utilizó 0,2ng/ml como valor discriminante para Dimension® RxL y 0,025ng/ml para Pathfast®, se obtuvo un índice kappa de 0,86; lo que indica que ambos métodos tienen una elevada concordancia. No obstante, de un total de 148 casos estudiados, se detectaron 9 casos negativos con Dimension® que a su vez eran positivos con Pathfast® (tabla 3).
Concordancia de resultados positivos y resultados negativos mediante la utilización de su límite de cuantificación como valor discriminante para cada procedimiento de medida
| Dimension® RxL | |||
| Negativos | Positivos | Total | |
| Pathfast® | |||
| Negativos | 63 | 1 | 43,20% |
| Positivos | 9 | 75 | 56,80% |
| 48,60% | 51,40% | ||
El índice kappa ofreció un resultado de 0,864.
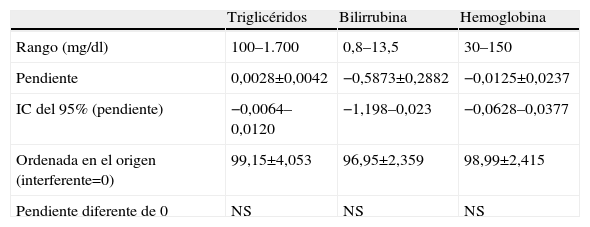
En el estudio de las interferencias analíticas endógenas no se halló ninguna pendiente significativamente diferente de 0 (tabla 4), aunque con las concentraciones más elevadas de estos interferentes endógenos se observa una ligera desviación de los valores sin interferente, que no llega a adquirir significación estadística (fig. 4).
Interferencias por lipidemia, bilirrubina y hemólisis
| Triglicéridos | Bilirrubina | Hemoglobina | |
| Rango (mg/dl) | 100–1.700 | 0,8–13,5 | 30–150 |
| Pendiente | 0,0028±0,0042 | −0,5873±0,2882 | −0,0125±0,0237 |
| IC del 95% (pendiente) | −0,0064–0,0120 | −1,198–0,023 | −0,0628–0,0377 |
| Ordenada en el origen (interferente=0) | 99,15±4,053 | 96,95±2,359 | 98,99±2,415 |
| Pendiente diferente de 0 | NS | NS | NS |
IC: intervalo de confianza; NS: no significativo.
En el estudio de la TnI en diversas entidades clínicas se observó que ésta se encontraba marginalmente elevada (por encima de 0,025ng/ml) en 5 de 40 casos (12,5%) con insuficiencia renal (concentración media de 0,10 ± 0,06ng/ml), de los cuales en 4 (10%) también se observaban ligeras elevaciones de las concentraciones de TnI medidas con Dimension® RxL. En el caso de pacientes con politraumatismo, se observaron elevaciones de TnI en 4 pacientes de 35 estudiados (11,4%), lo que coincidió con elevaciones del mismo rango (de intensidad muy variable) de las obtenidas con el método habitual, sin que en ninguno de los casos (todos éstos con elevaciones de creatincinasa [CK] 5 veces por encima del valor superior del intervalo de referencia) pudiera descartarse algún tipo de implicación miocárdica de tipo isquémico. En los pacientes con ACV se observaron elevaciones marginales de TnI en 3 casos de 29 pacientes (10,3%), 2 de ellos con marcadas elevaciones de CK y uno de ellos con elevación simultánea de la TnI cuantificada con el método de comparación.
DiscusiónDesde hace algunos años, la medición de la troponina se ha revelado de gran ayuda en el diagnóstico de necrosis miocárdica y ha reemplazado a otros marcadores como la CK, la isoenzima 2 de la CK o la mioglobina, y forma parte de los actuales criterios de diagnóstico del IAM6. Del conjunto de marcadores del complejo tropomiosina, la TnI es una de las más utilizadas en la actualidad.
En este trabajo se ha elegido la TnI como un marcador adecuado para la comprobación de las características funcionales del analizador Pathfast®. Los resultados obtenidos en los estudios de la imprecisión intradía e interdía demuestran una buena calidad metrológica, mientras que los resultados obtenidos para la precisión, la veracidad y el intervalo de medida revelan que el Pathfast® es un instrumento útil para la medida de los marcadores cardíacos, tanto en el laboratorio clínico como en su funcionamiento como equipo del “Point of Care Testing”. Su límite de cuantificación es de 0,025ng/ml (menor concentración con un CV inferior al 10%)8 y se acerca al percentil 99 de las medidas de la TnI realizadas en una población de referencia (entre 0,003 y 0,008ng/ml), por lo que puede considerarse que se encuadra dentro de los nuevos marcadores con una mayor sensibilidad metrológica en la detección del IAM14.
Si bien en el estudio de la linealidad se utilizó como diluyente una solución de cloruro sódico al 0,9% en lugar de una mezcla de especímenes con TnI no detectable, el efecto matriz no pareció influir en los resultados del estudio. En cualquier caso, la linealidad no pudo establecerse con seguridad, ya que el valor superior obtenido (40ng/ml) seguía mostrando una regresión sin desviación de la linealidad.
La comparación entre los procedimientos de medida ofrece unos resultados para la ordenada en el origen y la pendiente que permiten concluir que ambos procedimientos tienen el mismo error sistemático. De esta manera, probablemente la diferencia entre los resultados obtenidos a través de ambos procedimientos sea atribuible a la asignación de valores de los calibradores, y ambos procedimientos se armonicen cuando el Dimension® utilice el Standard SRM ♯2921 (ya utilizado por el instrumento Pathfast®)15–17. Este resultado concuerda con estudios previos en los que se compararon resultados entre el Pathfast® y varios analizadores para marcadores cardíacos, incluida la TnI18. Por otra parte, y a pesar de la buena concordancia entre ambos métodos, el Pathfast® es capaz de detectar necrosis miocárdica más precozmente, como demuestra la existencia de un número significativo de muestras que se categorizaron como normales con Dimension® y que superaban el valor discriminante (0,025ng/ml) con el Pathfast®; este hecho probablemente se deba a un mejor límite de cuantificación del Pathfast®, lo que aumenta su sensibilidad diagnóstica en la necrosis miocárdica.
Las interferencias endógenas, tales como triglicérido, bilirrubina y hemoglobina, no afectan de forma estadísticamente significativa. Otras entidades clínicas, como la insuficiencia renal, el politraumatismo y el ACV, no han mostrado diferencias significativas en la medida de la TnI con el método de comparación, y los casos en que la medición de la TnI con el instrumento Pathfast® resultó superior al límite de cuantificación, probablemente representan situaciones en las que se produjo liberación de TnI no relacionada con un SCA o con isquemia cardíaca.
Por último, la comparación entre plasma y sangre demuestra que el Pathfast® puede trabajar indistintamente con ambos tipos de muestra, por lo que resulta una opción aceptable para los centros que requieran resultados en corto espacio de tiempo, como pueden ser los servicios de urgencias, las unidades de dolor torácico, las unidades de cuidados intensivos y críticos de cualquier hospital.
Las ventajas adicionales frente a otros sistemas son la facilidad de uso, el mantenimiento inexistente, la ausencia de reconstitución de reactivos, la inexistencia de desechos líquidos, la utilización de sangre, la falta de necesidad de centrifugación, el análisis simultáneo de otras pruebas del panel y el reducido tamaño del analizador.
Biotécnica 2000 S.L. ha cedido gratuitamente los reactivos, los calibradores y los controles utilizados en esta evaluación.