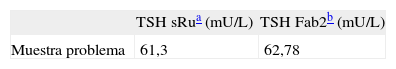Mujer que presentó un importante incremento de la hormona estimulante del tiroides (TSH) (62,2 mU/L) con hormonas tiroideas dentro de los intervalos de referencia. La paciente se encontraba eutiroidea y no presentaba bocio. Se realizó un estudio inicial para determinar la posible causa del incremento en la concentración de TSH. La recuperación de TSH tras precipitación con polietilenglicol fue del 1%, sugiriendo la presencia de alguna molécula de elevado peso molecular que podría interferir en la determinación. Mediante cromatografía de exclusión, se confirmó la presencia de macro-TSH, un complejo autoinmune formado por TSH unido a una Inmunoglobulina G que es inmunorreactivo pero biológicamente inactivo, por lo que, si no se detecta, induce a una interpretación errónea de la concentración de TSH.
Woman showing an important increase of serum TSH (62.2 mU/L) with thyroid hormones within the reference interval. The patient was clinically euthyroid and without goitre. Investigations were carried out to determine the origin of the unexpected high TSH. Polyethylene glycol precipitation test showed low TSH recovery (1%), indicating the presence of large molecules that could interfere with the measurement. The serum sample was fractionated by gel filtration chromatography and the presence of a macro-TSH form was confirmed, an immunoreactive but biologically inactive TSH-Immunoglobulin G autoantibody complex. Its detection is important to avoid a misleading interpretation of the TSH concentration.
En la actualidad, la hormona estimulante del tiroides (TSH) es la prueba de elección inicial para valorar la función tiroidea ya que ofrece una mayor sensibilidad en la detección de disfunción tiroidea siempre que se conserve intacto el eje hipotálamo-hipofisario1,2. Aunque una concentración elevada de TSH sérica generalmente está asociada a un hipotiroidismo primario, en un bajo porcentaje de pacientes puede encontrarse falsa elevación de TSH asociada a una interferencia. Las más estudiadas han sido las causadas por anticuerpos heterófilos o por anticuerpos antianimal3,4.
Presentamos el caso de una paciente con concentraciones de TSH muy elevadas en la que se confirmó la presencia de macro-TSH, un complejo autoinmune formado por TSH unido a una inmunoglobulina G (IgG) que produce una falsa elevación de la concentración de TSH biológicamente activa.
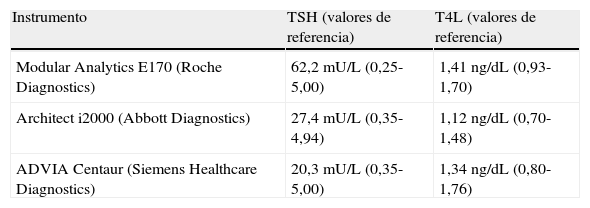
Caso clínicoMujer de 36 años, sin hijos que se remite al servicio de Endocrinología y Nutrición desde su médico de atención primaria por presentar cansancio y una concentración de TSH de 24 mU/L con niveles de hormonas tiroideas no patológicos, procesadas en otro laboratorio en un Architect i2000 (Abbott Diagnostics). Se solicitó una nueva determinación de TSH al laboratorio de referencia de nuestro hospital, cuyo resultado fue de 62,2 mUI/L (valores de referencia [VR]: 0,25-5,00) junto con concentraciones de hormonas tiroideas dentro de los intervalos de referencia: tiroxina libre (T4L) de 1,41ng/dL (VR: 0,93-1,70) y triyodotironina libre (T3L) de 3,27pg/mL (VR: 2,60-4,40). En el laboratorio de referencia las 3 determinaciones fueron procesadas en un analizador Modular Analytics E170 (Roche Diagnostics, Alemania). Estos resultados iniciales fueron confirmados con una segunda extracción realizada a los 7 días, y en esta muestra se determinaron también los anticuerpos anti-peroxidasa tiroidea (anti-TPO), que fueron negativos (<34 UI/L).
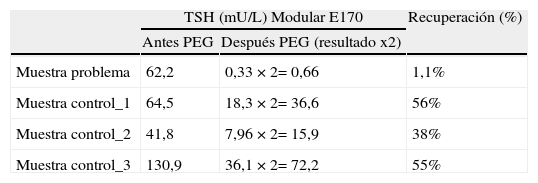
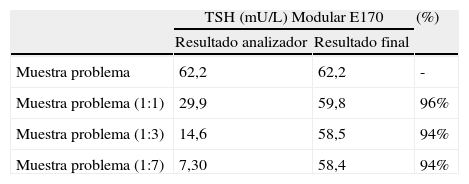
La paciente no recibía ningún tratamiento, no presentaba bocio y clínicamente se encontraba eutiroidea, por lo que, en base a los resultados obtenidos, se optó por realizar un estudio adicional para descartar una posible interferencia en la determinación de TSH. Para ello, se determinó la concentración de TSH y de T4L por otros 2 métodos analíticos diferentes (tabla 1) observándose concentraciones de TSH por encima del valor de referencia en ambos métodos, pero sin ser tan elevadas como las obtenidas con el Modular Analytics E170. También se realizó una prueba de precipitación con polietilenglicol (PEG) al 25%, de forma similar a como se realiza en el estudio de macroprolactina5, tanto en la muestra problema como en otras muestras con concentraciones de TSH elevadas que se utilizaron como control (tabla 2). El porcentaje de recuperación en la muestra problema fue del 1 frente al 38, 55 y 56% de las muestras control. Por último, se realizaron diluciones seriadas de la muestra con el diluyente Elecsys Diluent MultiAssay al 1:7, 1:3, 1:1 y se determinó la concentración de TSH (tabla 3). La concentración de TSH mantuvo la proporcionalidad en todas las diluciones.
Determinación de TSH y T4L por diferentes métodos analíticos
| Instrumento | TSH (valores de referencia) | T4L (valores de referencia) |
| Modular Analytics E170 (Roche Diagnostics) | 62,2 mU/L (0,25-5,00) | 1,41ng/dL (0,93-1,70) |
| Architect i2000 (Abbott Diagnostics) | 27,4 mU/L (0,35-4,94) | 1,12ng/dL (0,70-1,48) |
| ADVIA Centaur (Siemens Healthcare Diagnostics) | 20,3 mU/L (0,35-5,00) | 1,34ng/dL (0,80-1,76) |
Debido a que mediante la prueba de precipitación con PEG solo se recuperó el 1% de la concentración de TSH inicial, se sospechó de la presencia de alguna molécula de elevado peso molecular, como por ejemplo una inmunoglobulina, como posible interferencia en la determinación de TSH.
El método Elecsys TSH que utiliza el Modular Analytics E170 es un ensayo tipo sándwich en el que la interferencia por anticuerpos humanos anti-ratón (HAMA) es poco probable porque los anticuerpos marcados con quelato de rutenio son quiméricos de tipo humano-ratón para eliminar en lo posible esta interferencia. De todas formas, se determinaron en un laboratorio externo los HAMA, cuya concentración fue inferior al valor de referencia (<40μg/L).
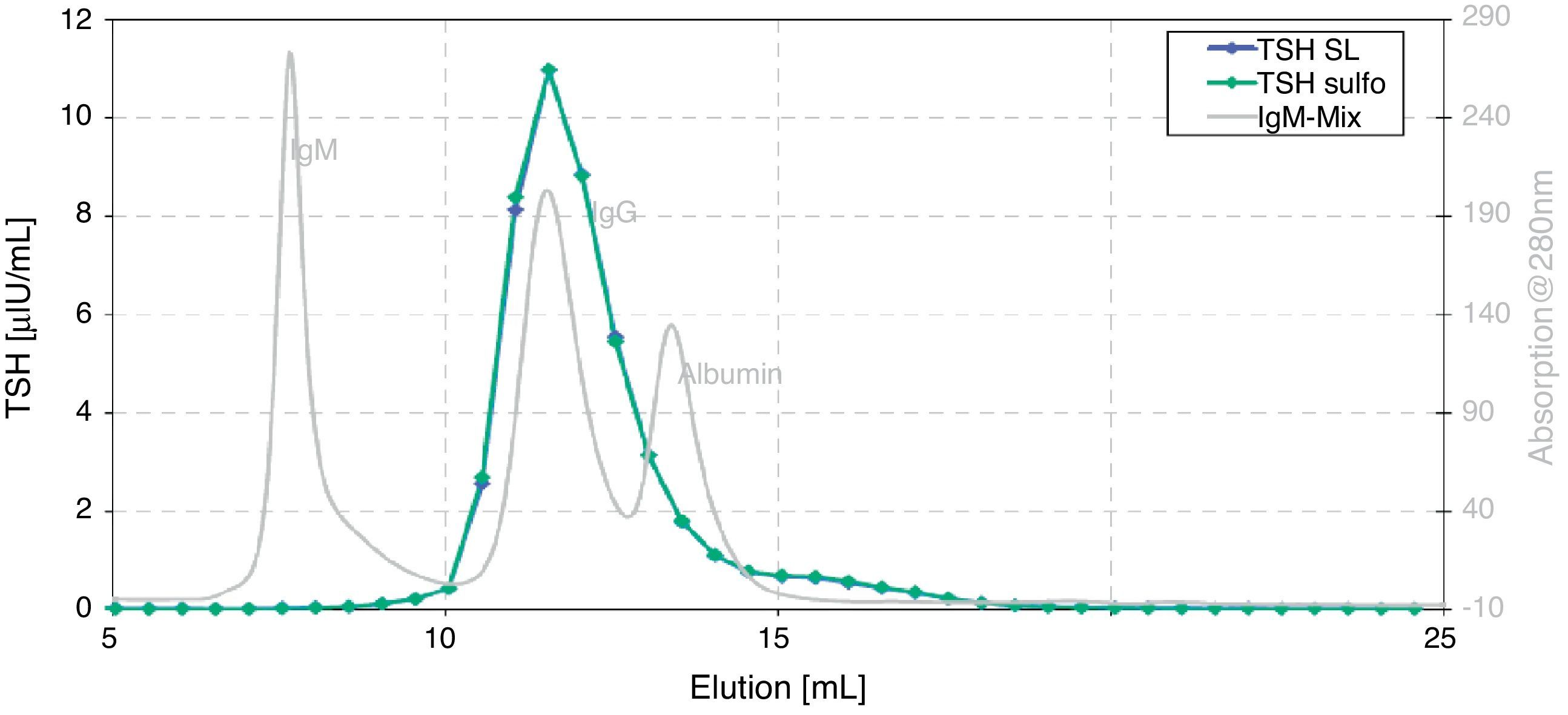
Con los resultados obtenidos hasta ese momento, la principal sospecha era una interferencia por un complejo autoinmune (macro-TSH), por lo que se envió la muestra al departamento de investigación y desarrollo de Roche Diagnostics para completar el estudio. Inicialmente se determinó la concentración de TSH con 2 procedimientos de investigación (GSS laboratory, Roche Diagnostics), uno de los cuales utiliza un conjugado modificado, para descartar interferencia por la presencia de anticuerpos específicos contra el rutenio, que ha sido previamente descrita6; el otro procedimiento emplea agentes bloqueantes para descartar interferencia en la región Fab2 del anticuerpo. En la tabla 4, se puede observar que las concentraciones de TSH fueron similares a las obtenidas con el método comercial, por lo que se descartó una interferencia tanto por anticuerpos anti-rutenio como por anticuerpos anti-Fab2. Posteriormente, se fraccionó la muestra mediante una cromatografía de exclusión (R&D Heterogenic Immunoassays, Roche Diagnostics). Para ello, 250μL de muestra se filtraron mediante filtro de jeringa acrodisc LC 13mm con membrana de difluoruro de polivinilideno (PVDF de 0,45μm; Pall) y se fraccionó mediante filtración en gel (Superdex 200™ 10/300 GL, GE Healthcare) usando un sistema purificador ÄKTA (GE Healthcare). Para la calibración se fraccionaron 100μL de una mezcla de proteínas de peso molecular conocido. En todas las fracciones recogidas en la cromatografía de exclusión se determinó la concentración de TSH mediante el método comercial y el procedimiento de investigación, que tiene un conjugado modificado. Al determinar la concentración de TSH en las diferentes fracciones recogidas, se observó que la TSH inmunorreactiva eluía en la misma región que la IgG (fig. 1), por lo que en esta muestra, finalmente, se confirmó la presencia de macro-TSH.
TSH determinada después de la realización de una cromatografía de exclusión (Superdex 200™ 10/300 GL, GE Healthcare). Para la calibración se procesaron proteínas de peso molecular conocido (línea gris).
TSH SL: TSH método comercial (Roche Diagnostics); TSH sulfo: TSH procedimiento de investigación que contiene un conjugado modificado (Roche Diagnostics); IgM-Mix: mezcla de proteínas de peso molecular conocido.
El presente caso ilustra un incremento de TSH en una paciente clínicamente eutiroidea causado por la presencia de TSH unida a IgG (macro-TSH). La molécula de TSH tiene un tamaño de 28kDa por lo que se filtra libremente en el glomérulo renal. Sin embargo, al formarse el complejo TSH-IgG, que tiene un tamaño aproximado de 180kDa, no se filtra a nivel renal y se produce una acumulación de este complejo. La forma molecular IgG-TSH es biológicamente inactiva pero inmunorreactiva de forma variable, dependiendo del método utilizado. De hecho, aunque las concentraciones de TSH obtenidas por los 3 métodos se encontraban por encima del valor de referencia, la mayor elevación se observó con el analizador Modular Analytics E170, con una concentración de 62,2 mU/L mientras que con los otros 2 métodos la concentración de TSH fue mucho menor (27,4 mU/L con el analizador Architect i2000 y de 20,3 mU/L con el ADVIA Centaur). Sakai H et al.7 describieron una discordancia similar en un paciente que presentaba una concentración de TSH de 152 mU/L (Elecsys, Roche), 20,47 mU/L (Centaur, Siemens) y 9,809 mU/L (Architect, Abbott). Las diferentes concentraciones observadas entre los 3 métodos pueden ser debidas a que, cuando se forman los macrocomplejos, los epítopos de la TSH que intervienen en la formación del sándwich, quedarán más o menos expuestos que en la TSH no complejada. Esta situación produce una diferente reactividad en función del diseño de cada ensayo.
Al realizar la precipitación con PEG solo se recuperó el 1% de la concentración de TSH. Este resultado sugirió la presencia de alguna molécula de elevado peso molecular, ya fuera HAMA u otro anticuerpo, que interfería en la determinación de TSH, La dilución seriada de la muestra permite detectar HAMA ya que las muestras con HAMA no dan resultados proporcionales8. En el presente caso, cuando se realizaron diluciones seriadas, los resultados de TSH fueron proporcionales. Sin embargo, si la interferencia es por macro-TSH resulta lógico pensar que pueda mantener la linealidad porque se está cuantificando una concentración real de TSH, aunque una parte corresponde a una TSH unida a IgG que es inmunorreactiva (macro-TSH), pero biológicamente inactiva. Además, dado que se determinaron los HAMA en un laboratorio externo y el resultado fue negativo, la principal sospecha fue una interferencia por macro-TSH. Esta interferencia fue confirmada por el departamento de investigación y desarrollo de Roche Diagnostics mediante la realización de una cromatografía de exclusión y posterior determinación de la concentración de TSH, que eluyó junto con la IgG (fig. 1). Por lo tanto, en esta paciente, la determinación de TSH no resulta adecuada para valorar la función tiroidea, porque la concentración que se cuantifica no refleja la concentración biológicamente activa que realmente presenta. La investigación exhaustiva de este caso ha permitido evitar estudios posteriores que se habrían realizado a la paciente en caso de no haber detectado la interferencia.
La presencia de autoanticuerpos contra la prolactina (macroprolactina) es sobradamente conocida y, por este motivo, en aquellas muestras con una concentración de prolactina elevada se recomienda descartar su presencia. El método más utilizado para ello es la precipitación de los inmunocomplejos con PEG5. Sin embargo, la interferencia por macro-TSH, ya sea en adultos o en neonatos, ha sido descrita en pocos casos7,9-13. En el año 1995, Tamaki et al.9 fueron los primeros en sugerir la presencia de una TSH de elevado peso molecular en una mujer y sus neonatos, los cuales presentaron una TSH elevada de forma transitoria. Esta sospecha inicial fue confirmada posteriormente por otros investigadores. Describiéndose con mayor frecuencia en neonatos, así como en sus madres, posiblemente debido a la implantación de los programas de escrutinio universal del hipotiroidismo congénito11-13. Rix M. et al.11 realizaron determinaciones seriadas de la concentración de TSH del neonato a lo largo de 8 meses y observaron un descenso paulatino de la concentración de TSH explicando este hallazgo por el paso trasplacentario de los anticuerpos anti-TSH y su posterior eliminación en el neonato de forma progresiva.
Se desconoce la prevalencia real de esta interferencia puesto que son muy pocos los casos descritos en la literatura y generalmente relacionados con hallazgos observados inicialmente en neonatos y posteriormente confirmados también en sus madres. Además, es posible que no siempre se identifique esta interferencia, sobre todo cuando el incremento de TSH sea más moderado, ya que estos pacientes presentan un patrón de hipotirodismo bioquímico.
Por lo tanto, cuando se obtiene una concentración elevada de TSH con hormonas tiroideas dentro de los intervalos de referencia, una de las posibles causas que deben considerarse es la presencia de macro-TSH y, en caso de confirmarse la presencia de este complejo, no es válido realizar la valoración de la función tiroidea del paciente mediante la determinación de la TSH.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos la colaboración de Roche Diagnostics. Agradecemos a Alejandra Fernández y Begoña Peredo la realización de la TSH por los métodos alternativos.