La Norma UNE-EN ISO 15189:2013 define los procesos preanalíticos como «Procesos que comienzan cronológicamente a partir de la petición del médico clínico e incluyen la petición de los análisis, la preparación e identificación del paciente, la toma de la muestra primaria y el transporte hasta el interior del laboratorio, y que terminan cuando comienza el proceso analítico»1.
El laboratorio clínico acreditado debe asegurar que el control y la gestión del proceso preanalítico cumple con los requisitos de la Norma UNE-EN ISO 15189:2013. Para ello, debe garantizar que todas aquellas actividades propias de la fase preanalítica no afectarán a: 1) los resultados obtenidos en el proceso analítico que se ofrecen al cliente (médico clínico peticionario), 2) la trazabilidad de las muestras primarias, ni a 3) los aspectos relativos a la interpretación de los resultados.
Objeto y campo de aplicaciónEste documento conjunto de la Comisión de Acreditación de Laboratorios y la Comisión de Calidad Extraanalítica trata de aclarar los requerimientos exigidos por la edición vigente de la Norma 15189:2013 en el apartado 5.4 correspondiente a los procesos preanalíticos pero en ningún caso substituye ni amplía a la norma, sino que debe utilizarse como apoyo a la interpretación de la misma.
Su ámbito de aplicación es el personal y las actividades del laboratorio clínico implicados en el proceso preanalítico.
RecomendacionesSe presentan una serie de recomendaciones, basadas en la experiencia adquirida en diferentes auditorías externas, que pretenden ayudar al profesional del laboratorio clínico a realizar una correcta gestión de la fase preanalítica en el proceso de acreditación.
Instrucciones de trabajo y documentaciónEl laboratorio clínico se asegurará de que estén disponibles los recursos necesarios y la organización adecuada para la realización de la actividad preanalítica, antes de dar inicio a la misma. Para el correcto desarrollo de todo el proceso preanalítico debe existir una adecuada coordinación entre todos los profesionales sanitarios (médicos clínicos, facultativos especialistas del laboratorio, enfermeros, técnicos de laboratorio, auxiliares de enfermería, etc.) y no sanitarios (transportistas, personal administrativo, etc.) que participan en el mismo, aunque no dependan directamente del laboratorio.
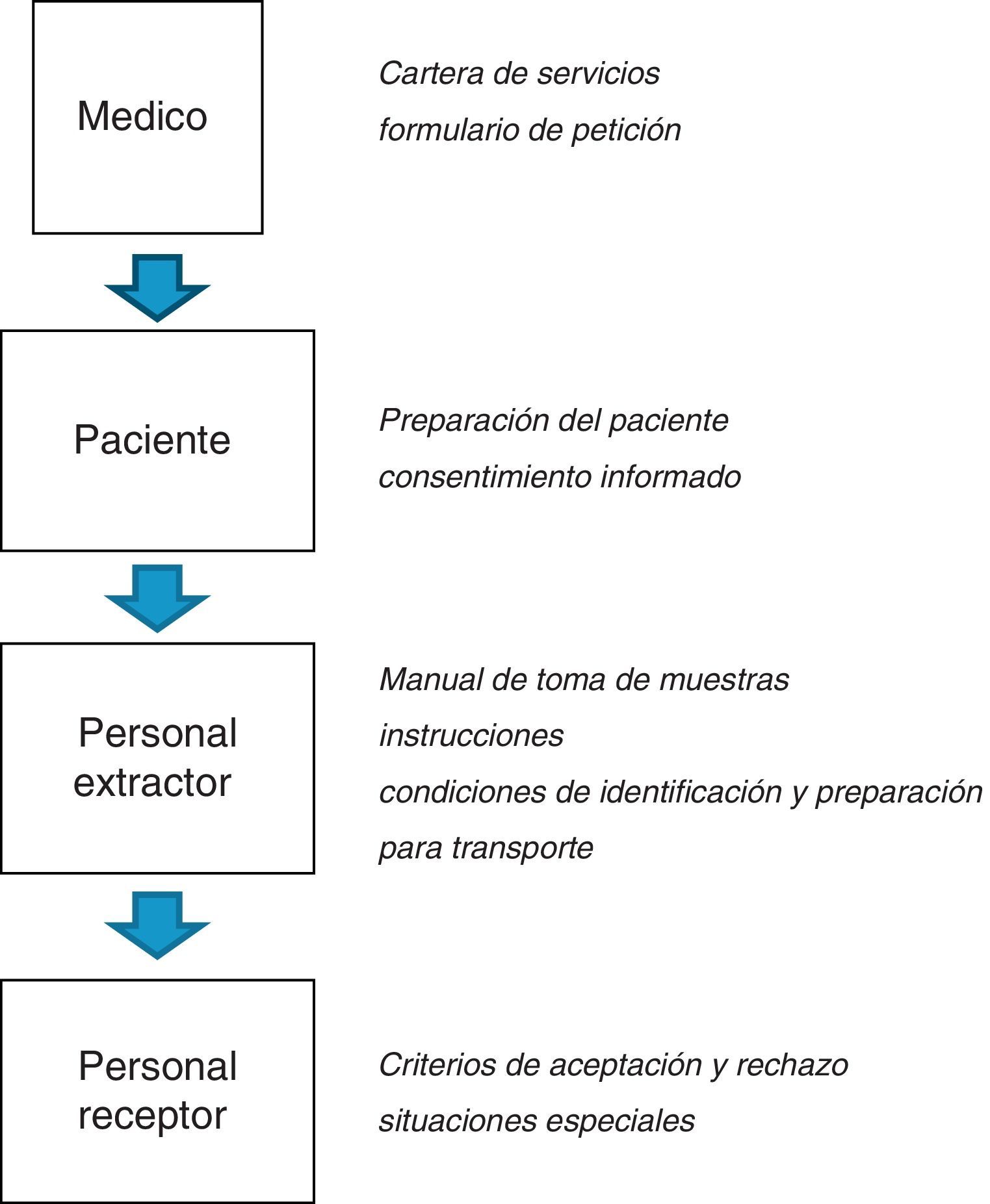
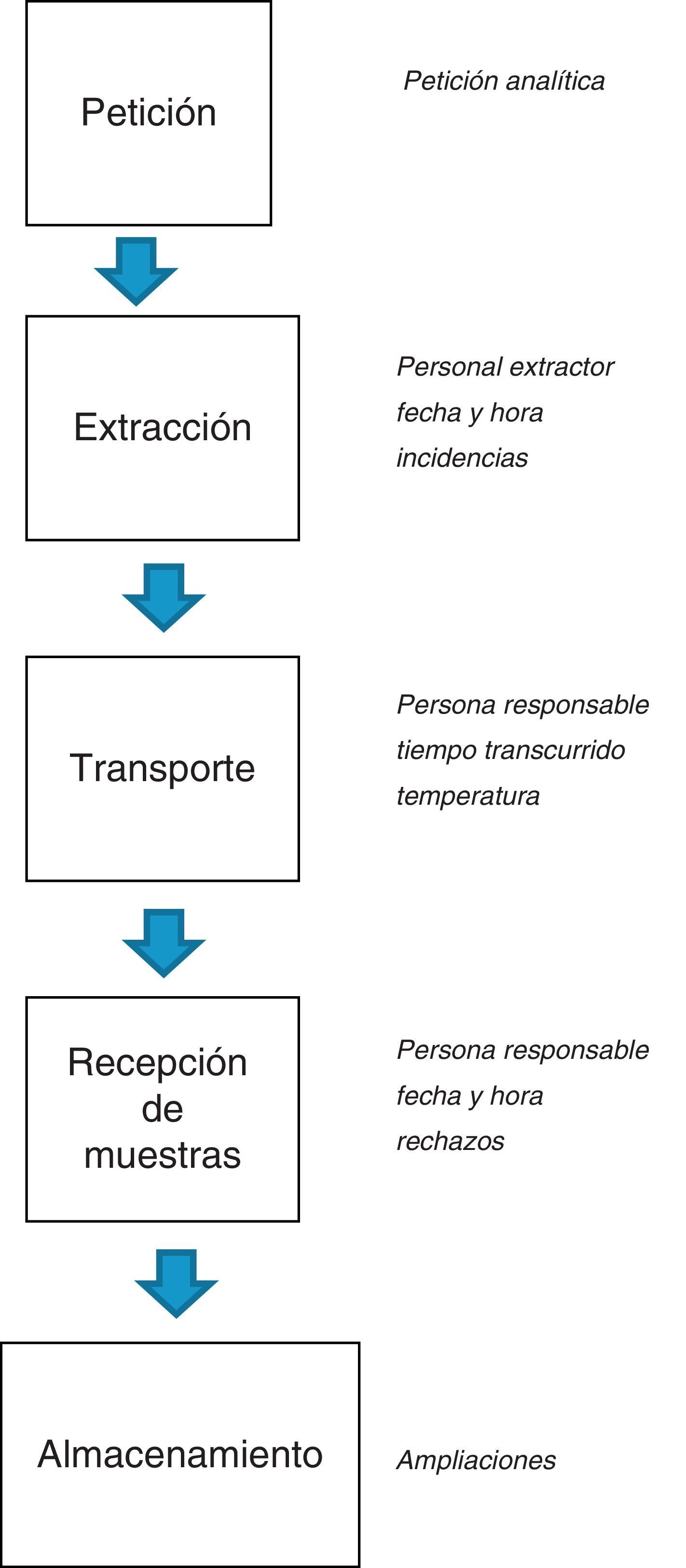
En las figuras 1 y 2 se esquematizan los documentos y registros necesarios en los procesos preanalíticos respectivamente.
Se recomienda:
- a)
Cuando sea posible, establecer un sistema de gestión documental en soporte informático, más fácil de controlar y actualizar que la información distribuida en papel.
- b)
Disponer de los documentos que describan la organización de la fase preanalítica relativa a los puntos de extracción, incluyendo instrucciones de trabajo, preparación del paciente, información sobre los tipos de muestra, los contenedores asociados, los volúmenes de muestra requeridos, etiquetado e identificación de especímenes, recogida de muestras (circuitos, horarios, centros, etc.) y preservación durante el transporte. Asimismo, el laboratorio deberá disponer de un listado de todos los centros y unidades a los que da servicio, con el nombre del responsable-coordinador de cada unidad, teléfono de contacto y dirección de correo electrónico. En este listado se indicará el personal responsable de realizar la extracción de muestras que no depende directamente del laboratorio clínico.
Este procedimiento no tiene por qué ser único. Pueden establecerse distintos procedimientos técnicos de preanalítica según la procedencia de las muestras primarias: hospitalarias, atención primaria, etc.
- c)
Disponer de información documentada que incluya la ubicación del laboratorio, horario de extracción, horario de recepción de muestras, almacenamiento de las mismas y cartera de servicios, incluyendo precauciones especiales si es necesario, plazos de entrega de resultados e intervalos de referencia, según proceda.
La cartera de servicios del laboratorio clínico debe actualizarse periódicamente, mediante consenso con los facultativos clínicos y tras la valoración de la rentabilidad diagnóstica de las pruebas a incorporar o eliminar. Se recomienda disponer de una cartera de servicios informatizada para facilitar su actualización y posterior difusión.
- d)
Establecer un sistema de petición analítica, en formato electrónico o en papel, accesible a los médicos clínicos y fijar un calendario de revisiones de la petición analítica para una actualización adecuada según las necesidades.
- e)
Establecer y documentar un programa de formación y cualificación del personal involucrado en el proceso preanalítico, así como garantizar la formación continuada y conservar registros de cualificación y de las actividades de formación.
- f)
Establecer los criterios de aceptación o rechazo de muestras, cómo se va a actuar en situaciones especiales (p. ej., qué hacer si llega poca muestra en el caso de neonatos o pacientes en edad pediátrica, etc.). Documentar cómo se van a tratar todas aquellas incidencias detectadas en cualquier fase del proceso (toma de muestras, transporte, recepción de muestras, etc.) así como la forma de comunicación a los centros implicados.
- g)
Incluir todas las actividades preanalíticas en el programa de auditoría, incluidas las desarrolladas en centros periféricos.
- h)
Registrar el seguimiento y control de las distintas actividades preanalíticas mediante el resumen de indicadores o incidencias detectados en cada centro, el resultado y seguimiento de las auditorías internas, el análisis de los resultados obtenidos tras la participación del laboratorio clínico en programas de control externo de la calidad para la fase preanalítica, etc.
- i)
Incluir en el mapa de riesgos del laboratorio los fallos potenciales que pueden producirse durante la fase preanalítica.
Ejemplo:
- -
Riesgo: Llenado incorrecto de los tubos durante la toma de muestra
- -
Impacto sobre el resultado: Moderado
- -
Probabilidad de que ocurra: Baja
- -
Control existente: Instrucciones de extracción
- -
Evaluación: Semestral
- -
Indicador: Muestras insuficientes * 100/Muestras totales
- -
En relación con la solicitud de petición analítica, el laboratorio clínico debe informar a los médicos clínicos peticionarios sobre la forma de realizarla.
Se recomienda:
- a)
Incorporar, en la petición analítica, la recogida de información clínica y demográfica relevante para la correcta interpretación de los resultados de las pruebas analíticas en el laboratorio clínico. Además, en la petición analítica deben constar los datos necesarios que se especifican:
- -
Identificación inequívoca del paciente (número de historia y de tarjeta sanitaria, género, fecha de nacimiento, etc.).
- -
Identificación del médico clínico peticionario o persona legalmente autorizada que solicita el análisis clínico.
- -
Destino del informe (lugar y persona).
- -
Tipo de muestra y su procedencia anatómica, si procede.
- -
Pruebas analíticas solicitadas.
- -
Información clínica o de diferente naturaleza (p. ej., monitorización de fármacos, tratamiento antibiótico, etc.) relativa al paciente y relevante para la correcta interpretación de los resultados.
- -
Fecha y hora de la obtención de la muestra y de la recepción de la misma en el laboratorio clínico. Asimismo, se recomienda especificar tanto la persona que obtiene la muestra como la que la recepciona.
- -
- b)
Incluir en la petición analítica un número de teléfono de contacto con el médico peticionario, con el objeto de informar precozmente los resultados que así lo requieran o para solicitar información adicional si se considera pertinente.
- c)
Disponer de modelos de consentimiento informado accesibles al peticionario en cada procedimiento diagnóstico que implique cierto nivel de riesgo (p. ej., los consentimientos informados para estudios genéticos moleculares y citogenéticos).
- d)
Realizar sesiones informativas y establecer registro de las mismas, dentro del plan de formación del personal, sobre la forma correcta de solicitar una petición: cumplimentación manual de la petición analítica, uso de la petición analítica electrónica y manejo del sistema informático.
Con relación a este apartado, se recomienda el uso de un gestor de petición electrónica ya que garantiza la obtención de todos los datos indicados anteriormente de forma segura y la trazabilidad del proceso.
Obtención de las muestrasLa acción de la extracción y obtención de muestras debe realizarse teniendo en cuenta las normas obligatorias de bioseguridad, eliminación de residuos peligrosos, accesibilidad, etc. estableciendo un procedimiento de acuerdo con recomendaciones internacionales consensuadas2. Este procedimiento debe estar disponible para la consulta por parte de los profesionales sanitarios encargados de la extracción y toma de muestras.
Se recomienda:
- a)
Registrar los datos de la identificación de la persona que realiza la extracción de la muestra, la hora y la fecha de la misma (la petición analítica electrónica facilita este registro), así como las incidencias que se hayan producido.
- b)
Utilizar un sistema de identificación inequívoca del paciente y de sus muestras primarias, alícuotas y su petición analítica de tal manera que asegure relación unívoca entre muestras y paciente, es decir, la trazabilidad de estas3,4.
- c)
Asegurar que se definen las responsabilidades en la toma de muestras y su transporte cuando la obtención de muestras se realiza por personal ajeno al laboratorio.
- d)
Documentar las situaciones posibles que se pueden plantear:
- -
La gestión de muestras recogidas por el propio paciente (orina, heces, semen, etc.).
- -
La identificación de los distintos tiempos de una prueba funcional.
- -
Extracciones en los domicilios.
- -
Se tendrán en cuenta todos los circuitos posibles de envío de muestras (puntos periféricos, domicilios, intrahospitalario, etc.), estableciendo los límites pertinentes de tiempo y temperatura para cada uno de ellos.
Para el transporte de las muestras hay que seguir la reglamentación para el transporte normalizado de las muestras clínicas, teniendo en cuenta que dichas muestras clínicas se clasifican como N.o ONU 3373, categoría B y, por lo tanto, deben ser transportadas mediante el sistema triple básico de embalaje.
Existen normas nacionales e internacionales para el transporte de muestras que deben cumplirse (carretera: ADR, envíos postales: UPU, marítimo: OMI, ferrocarril: RID, aéreo: OIAC).
En el caso de que el transporte lo realizara un celador, un familiar o el propio paciente, se le deben indicar las normas a seguir durante el mismo.
Si se utiliza un tubo neumático deben cumplirse las instrucciones del fabricante.
Se recomienda:
- a)
Disponer de registros para el control de tiempo y temperatura en los transportes realizados desde los centros periféricos. Establecer las acciones a realizar en caso de que se superen los límites de tiempo y temperatura aceptables.
- b)
El registro de la persona encargada del transporte y la hora de entrega de las muestras en el laboratorio.
- c)
Registrar las incidencias ocurridas durante el transporte.
El personal autorizado (técnico de laboratorio o personal de enfermería, que ha recibido una formación adecuada para realizar dicha tarea) debe realizar la revisión de las muestras que llegan al laboratorio. Como norma general, son criterios de rechazo de muestras: muestra con errores de identificación, muestras derramadas, muestras cuyo transporte y conservación no ha sido adecuado, etc. Las incidencias relacionadas con la recepción de las muestras deben ser registradas y en dicho registro debe figurar el profesional del laboratorio clínico que detecta la incidencia, la muestra implicada, el tipo de incidencia, la persona con la que se contacta del servicio/centro solicitante y las acciones correctivas derivadas de la incidencia así como su resolución.
El laboratorio considerará bajo su propio criterio la aceptación de muestras en circunstancias excepcionales, como es el caso de muestras difícilmente reemplazables o críticas (p. ej., líquidos biológicos, biopsias, citologías, etc.). En estos casos el laboratorio debería hacer constar en el informe, junto con los resultados de las pruebas analíticas, que la muestra es inadecuada y que los resultados deben ser interpretados por el médico clínico con precaución.
Ante una solicitud verbal por parte del médico clínico de ampliación de la petición realizada, el laboratorio debería verificar su pertinencia, comprobar si la muestra cumple las condiciones de conservación requeridas y registrar la determinación adicional, indicando la fecha de ampliación, así como el nombre del facultativo clínico que la solicita.
Se debe disponer de un sistema para monitorizar el tiempo de conservación de las muestras en el laboratorio antes de ser procesadas y para saber si en ese tiempo son correctas las condiciones de almacenamiento. Asimismo, se debe definir el tiempo durante el cual se han de conservar las muestras en el laboratorio para garantizar que cualquier problema en el procesamiento o en la interpretación de los resultados obtenidos pueda ser solucionado, recuperando la muestra para un nuevo procesamiento, si fuera necesario, o una ampliación antes de ser desechadas.
Una vez identificadas las muestras y registradas las peticiones analíticas de las mismas, serán distribuidas a la unidad o sección del laboratorio correspondiente.
Se recomienda:
- a)
Establecer un registro de las incidencias detectadas durante la recepción de las muestras.
- b)
Documentar las acciones correctivas llevadas a cabo para la resolución de las incidencias.
- c)
Establecer un mecanismo para proporcionar la información de retorno a los centros/servicios periféricos de procedencia de las muestras respecto a los diversos problemas detectados en sus centros.
- d)
Cuando se utilicen peticiones analíticas en papel, escanearlas y guardar una copia electrónica para facilitar el estudio de incidencias y garantizar la trazabilidad.
- e)
Desarrollar las instrucciones específicas para la preparación de las muestras previamente a su análisis, en función del tipo de espécimen y del analito a determinar5.
- f)
Establecer un registro de las ampliaciones de las peticiones que se han solicitado verbalmente.
- g)
Disponer de un protocolo en caso de que se procesen muestras urgentes de rutina.
- h)
Establecer el tiempo de conservación de las muestras hasta el momento del análisis y posterior al procesamiento, de forma que no supere nunca las condiciones de estabilidad de los componentes a analizar.
El proceso preanalítico, junto con los procesos analíticos y postanalíticos, deberá formar parte del sistema de gestión de la calidad del laboratorio recogido en el manual de calidad, y por tanto, deberá ser evaluado y sometido a auditorías, de forma que se asegure su conformidad y demuestre que se lleva a cabo de acuerdo a necesidades y requisitos de los usuarios, además de mejorar de forma continua su eficacia.
Han de tenerse en cuenta las actividades preanalíticas efectuadas tanto intralaboratorio como extralaboratorio, ya que en estas últimas es donde suceden habitualmente el mayor número de errores, debido a la variedad de organizaciones y el elevado número de personas involucradas no dependientes directamente del laboratorio.
Debe diseñarse un control de calidad interno que verifique si las actividades preanalíticas alcanzan la calidad esperada. Se basará fundamentalmente en la detección de errores y en el establecimiento de indicadores de la calidad.
Los indicadores reunirán una serie de características como informar de actividades importantes o críticas del proceso, ser medibles, reproducibles, comparables, etc. según se recomienda en la Norma UNE 66175 «Guía para la implantación de sistemas de indicadores»6.
La selección de indicadores a implantar se realizará por priorización de aquellos que suministren información fiable y cercana a los objetivos propuestos. Se les puede dar preferencia en función de la experiencia previa del laboratorio, o mediante un análisis previo de las incidencias más frecuentes y críticas presentes en el propio laboratorio7,8.
Se definirán las especificaciones para los indicadores, en base al estado del arte o teniendo en cuenta recomendaciones de expertos, comparación con otros grupos, etc.9–11.
Los indicadores evaluarán todas las etapas preanalíticas, desde el momento de realizar la solicitud, la preparación del paciente, la obtención o recogida de las muestras, el transporte, y la recepción, preparación y conservación de muestras hasta el comienzo del análisis. Se expresarán como el porcentaje de errores respecto a la actividad del laboratorio, siendo muy importante cómo se expresa dicha actividad (número de peticiones, de pacientes, de muestras, etc.), ya que ello permitirá o no la comparación con otros laboratorios o con las recomendaciones de las sociedades y organismos científicos12.
Ejemplos de indicadores habitualmente utilizados respecto a la solicitud de análisis serían: porcentaje de peticiones mal cumplimentadas o con errores de identificación; respecto a la calidad de la muestra obtenida: porcentaje de muestras rechazadas (preparación incorrecta de paciente, mal etiquetadas/no trazables a paciente, hemolizadas, coaguladas, anticoagulante incorrecto, contenedor inadecuado, etc.); y respecto a la cantidad: porcentaje de muestras no recibidas, volumen insuficiente…; respecto al transporte: porcentaje de muestras excediendo tiempo o temperatura; respecto a microbiología: hemocultivos contaminados, muestras inaceptables, contaminadas. En el laboratorio: centrifugación incorrecta, tiempo de conservación excedido, etc.13,14.
Una vez implantados, se revisará periódicamente si son válidos, es decir, si aportan información útil y si es rentable su cálculo en términos de recursos y esfuerzos dedicados. Pueden quedar obsoletos en el tiempo y deberá procederse a su modificación o anulación. El análisis de las tendencias indicará la evolución y el impacto de las intervenciones.
El laboratorio deberá participar asimismo en algún programa de comparación interlaboratorios. Estos programas, a pesar del elevado número de errores que ocurren a lo largo del proceso preanalítico, y del requisito de la Norma 15189 (5.6.3), no están aún muy desarrollados, pero en los últimos tiempos diversos organismos los están poniendo en práctica en paralelo a los programas de intercomparación de la fase analítica.
Existen varios tipos de programas: a) envío de cuestionarios preguntando acerca de procedimientos preanalíticos como por ejemplo los criterios de rechazo, la forma de comunicación de incidencias, etc.(Noregian Clinical Chemistry EQA Program; Quality Control Center Switzerland; WEKAS, UK; INSTAD, Alemania); b) envío de muestras simulando errores y preguntando acerca de cómo se informarían, por ejemplo hemolizadas o con otros interferentes(WEQAS, UK); c) registro de incidencias o resultados de indicadores de la calidad preanalítica(SEQC, College of American Pathologists, KIMMS QA, Australia y Nueva Zelanda)15.
El programa de preanalítica organizado por la SEQC se incluyó en el año 2001 como parte de los programas de garantía externa de la calidad para los laboratorios clínicos, y se basa en el envío de los errores que se producen en el laboratorio, calculados según unas instrucciones precisas para conseguir la intercomparabilidad. Los participantes registran e informan acerca de los rechazos más frecuentes: muestra hemolizada, coagulada, no recibida e insuficiente, por cada tipo de muestra16.
La importancia de la participación en programas de evaluación externa estriba en que una de las características de los indicadores preanalíticos es la falta de consenso actual sobre sus especificaciones de calidad, aportándonos información sobre si los resultados alcanzan por un lado las especificaciones fijadas en cada laboratorio, y permitiéndonos compararlas con el resto de los participantes17.
Se recomienda:
- a)
Diseñar un plan de control interno de la calidad del proceso preanalítico, mediante la implantación de indicadores.
- b)
Seleccionar indicadores que aporten información trasladable a los objetivos de gestión del proceso, definiendo sus especificaciones, y que tengan en cuenta los puntos críticos en relación con la seguridad del paciente.
- c)
Participar en un programa de evaluación externa de la calidad. En este sentido, se recomienda definir y realizar el cálculo de los indicadores de acuerdo al programa de evaluación externa en que se vaya a participar, para obviar el problema de estandarización que existe actualmente, además de facilitar la recogida y el envío de los datos.
Miembros de la Comisión de Calidad Extraanalítica: M.J Alsina Kirchner, V. Álvarez Funes, N. Barba Meseguer, J.M. Bauçà Roselló, R. Gómez Rioja, M. Ibarz Escuer, M. A. Llopis Díaz (Presidenta), J.J. Puente Lanzarote, D. Martínez Espartosa, Mª. Segovia Amaro, M. Ventura Alemany.
Este documento tiene la conformidad de las otras dos Sociedades (AEBM y AEFA) como Recomendación profesional en el ámbito del Laboratorio Clínico.