La enfermedad de Alzheimer (EA) es la forma más frecuente de demencia, con una prevalencia que aumenta significativamente con la edad. Durante las últimas décadas, se está produciendo un paulatino envejecimiento de nuestra sociedad que conllevará a un aumento significativo del número de casos de EA. Puesta en el punto de mira como la «epidemia silente» del siglo xxi, la EA será uno de los problemas sociosanitarios de mayor envergadura a resolver en los próximos años. Por tanto, existe la necesidad urgente de validar biomarcadores de la EA que permitan no solo detectar esta enfermedad en los estadios iniciales, sino que además permitan evaluar nuevas terapias encaminadas a detener o retrasar su evolución.
La EA es una patología neurodegenerativa de curso progresivo y, hasta ahora, incurable, que se caracteriza histopatológicamente por una acumulación extracelular, en forma de placas seniles, de la proteína β-amiloide (Aβ) y por una acumulación intracelular de la forma hiperfosforilada de la proteína tau en forma de ovillos neurofibrilares1. Su fenotipo clínico se caracteriza por un gradual deterioro cognitivo que afecta inicialmente, en su forma más típica, a la memoria y, posteriormente, a otros dominios cognitivos, generando una alteración funcional progresiva hasta conducir finalmente a la muerte.
Recientemente, se han propuesto nuevos criterios diagnósticos para la EA por parte del National Institute on Aging of the National Institutes of Health (NIA-NIH) junto con la Alzheimer's Association (AA). Los principales cambios respecto a los bien establecidos criterios del The National Institute of Neurological and Communicative Disorders and Stroke and the Alzheimer's Disease and Related Disorders Association (NINCDS-ADRDA) son la estratificación de la enfermedad en 3 fases y la incorporación de biomarcadores como potencial herramienta diagnóstica2-5. Asimismo, el nuevo consenso generado por el International Working Group for New Research Criteria for the Diagnosis of Alzheimer's Disease especifica que los marcadores más útiles para establecer el diagnóstico de la enfermedad son los denominados marcadores fisiopatológicos, entre los que se incluyen varios analitos medibles en líquido cefalorraquídeo (LCR)6. En cuanto a estos, hasta la fecha, se han establecido 3: la Aβde 42 aminoácidos (Aβ42), la proteína tau total (T-tau) y su forma fosforilada en la posición 181 (P-tau181P)7-9. Se ha descrito ampliamente que la medida conjunta de estos marcadores en el LCR permite no solo el diagnóstico temprano de la forma esporádica de EA, sino que también permite identificarla en su fase preclínica con una sensibilidad y una especificidad ≥ 85%10-13. Sin embargo, y siempre interpretándose en su contexto clínico, para extender el uso de estos marcadores en la práctica clínica es necesaria una mayor estandarización de los factores preanalíticos.
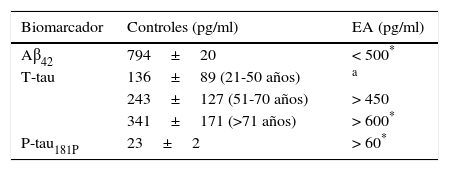
Biomarcadores de la enfermedad de AlzheimerProteína β-amiloideLa proteína Aβ42 se origina por la proteólisis por parte de secretasas (β y γ) sobre la proteína precursora de amiloide. El procesamiento de estos fragmentos a través del camino amiloidogénico acaba llevando a la formación y la agregación del péptido Aβ42 que se acumula en forma de placas seniles. El análisis en el LCR del péptido Aβ42 demuestra una reducción significativa en su concentración (tabla 1) si es comparada con la población sana10,14.
Biomarcadores en el líquido cefalorraquídeo empleados para el diagnóstico de la EA (10)
| Biomarcador | Controles (pg/ml) | EA (pg/ml) |
|---|---|---|
| Aβ42 | 794±20 | < 500* |
| T-tau | 136±89 (21-50 años) | a |
| 243±127 (51-70 años) | > 450 | |
| 341±171 (>71 años) | > 600* | |
| P-tau181P | 23±2 | > 60* |
Resultados obtenidos empleando el equipo de reactivos de Innogenetics.
La EA se caracteriza por la inclusión intraneuronal de la proteína asociada a microtúbulos tau. En la población sana, la concentración de T-tau en el LCR aumenta con la edad (tabla 1). Sin embargo, la concentración de la proteína T-tau se ve significativamente incrementada en pacientes con la EA al compararlos con sujetos controles de la misma edad7,14.
Proteína tau fosforiladaLa proteína tau está marcadamente hiperfosforilada (39 lugares de fosforilación) en la EA. Esta anormal hiperfosforilación resulta en una pérdida de su función estructural que conlleva una disfunción del transporte axonal. La detección de la forma fosforilada en la posición 181 está significativamente aumentada en la EA (tabla 1) si se compara con los controles9,14.
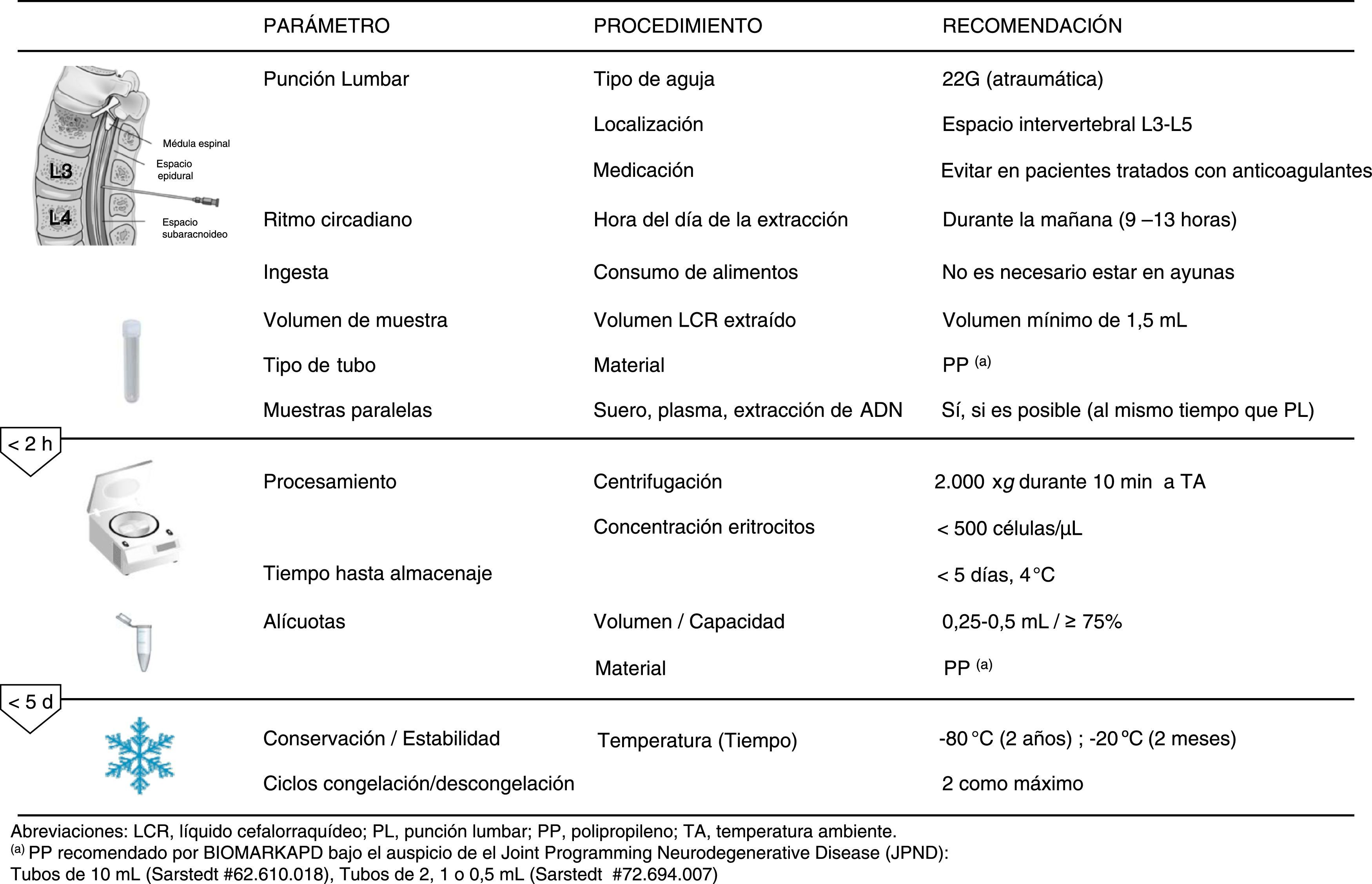
Objeto y campo de aplicaciónEl objeto de esta recomendación es establecer el procedimiento para la obtención del LCR y las condiciones para su manipulación, con el fin de estandarizar algunas variables preanalíticas asociadas a la medida de los marcadores biológicos actualmente recomendados en este fluido para el diagnóstico de la EA.
Basándose en la evidencia científica, esta recomendación pretende minimizar los errores preanalíticos con la finalidad de mejorar la transferibilidad de los resultados entre diferentes laboratorios y aumentar la validez diagnóstica de la EA.
Este documento está dirigido a todos los profesionales sanitarios que gestionen muestras de LCR y estén especialmente involucrados en el diagnóstico de la EA.
VariablesVariables relacionadas con la punción lumbarPunción lumbarEl procedimiento más habitual para la obtención del LCR es la punción lumbar (PL). El paciente se coloca en decúbito lateral, con las rodillas pegadas al pecho y el cuello flexionado, o bien sentado con el cuello flexionado anteriormente y la espalda arqueada hacia delante de modo que queden abiertos los espacios intervertebrales. La punción se realiza entre las vértebras L3-L4 o L4-L5. Trazando una línea desde las crestas ilíacas hasta la columna, se introduce una aguja biselada atraumática (0,7mm y 22 G) en el espacio intervertebral, debiéndose llegar hasta el espacio subaracnoideo para proceder a retirar el fiador interno dejando salir el líquido hasta el recipiente donde vaya a ser recogido15-18.
Ritmo circadianoNo se han demostrado variaciones intraindividuales relacionadas con la hora de extracción. Sin embargo, para facilitar la recepción, el procesamiento y el almacenamiento de la muestra, es recomendable realizar la PL entre 9 y 13 h16,18.
IngestaNo se ha demostrado que la ingesta de alimentos afecte de manera significativa a las concentraciones de Aβ42, T-tau y P-tau181P, por lo que no es necesario estar en ayunas antes de efectuar la PL16,18.
Volumen de muestraEl fraccionamiento de la muestra no es necesario cuando la punción es atraumática porque no se han encontrado diferencias secuenciales. Aunque el volumen estándar de extracción es de 10-12ml, se recomienda un volumen mínimo de 1,5ml para permitir el análisis de las muestras16,18.
Tubo de recogida de muestraUno de los factores que afecta en mayor medida a la variabilidad preanalítica en la medida de marcadores de EA es el tipo de tubo de recogida de muestra. Se ha descrito que la proteína Aβ se une inespecíficamente a la pared de los tubos de recogida de muestra, dando como resultado una infravaloración de su concentración real18,19. Para minimizar esta adsorción inespecífica, es indispensable usar tubos de propileno (PP) en el momento de recoger el LCR, evitando en todo momento el uso de tubos de vidrio o poliestireno19,20. Por otro lado, hay que mencionar que aun empleando tubos de PP, se han encontrado diferencias significativas en los valores de los biomarcadores de la EA en función del laboratorio fabricante que suministra los mismos20. Dada la importancia a la hora de escoger el tubo de PP, en la tabla 1 se incluyen la marca y la referencia de los tubos recomendados.
Variables relacionadas con la manipulación y el almacenaje de la muestraDespués de obtener el LCR mediante PL, las muestras pueden estar sujetas a distintos factores que pueden influir sobre la correcta medida de los biomarcadores de EA.
CentrifugaciónSe recomienda centrifugar las muestras antes de transcurridas 2 h de su extracción, manteniendo una velocidad de 2.000 xg durante 10 min a temperatura ambiente (en torno a 20°C). Para muestras hemorrágicas, esta centrifugación está especialmente indicada, ya que una concentración de eritrocitos superior a 500 células/μl puede interferir en la posterior medida.
Las muestras una vez centrifugadas pueden conservarse un máximo de 5 días a 4°C, aunque es recomendable preparar alícuotas lo antes posible en tubos de PP con rosca evitando el empleo de pipetas de vidrio para prevenir la adsorción del péptido Aβ42. Es recomendable emplear volúmenes pequeños (0,25 o 0,5ml) sobrepasando hasta el 75% de la capacidad del tubo para minimizar la adsorción y evaporación de la muestra.
Tiempo y temperatura hasta la conservaciónPara aquellas muestras que deban ser enviadas a otro laboratorio para su análisis, se recomienda que no transcurran más de 5 días antes de su congelación.
ConservaciónLas alícuotas de LCR deben ser congeladas a –80°C hasta su análisis, evitando más de 2 ciclos de congelación/descongelación. Las muestras de LCR conservadas a –80°C son estables hasta al menos 2 años. Por otro lado, las muestras conservadas a –20°C pueden almacenarse hasta 2 meses.
RecomendacionesVariables relacionadas con la punción lumbarPunción lumbar- –
La punción se realiza entre las vértebras L3-L4 o L4-L5.
- –
Emplear aguja biselada atraumática (0,7mm y 22 G).
- –
Realizar la PL entre 9 y 13 h.
- –
No es necesario estar en ayunas antes de efectuar la PL.
- –
Volumen estándar de extracción es de 10-12ml. Volumen mínimo de 1,5ml.
- –
Indispensable usar tubos de PP en el momento de recoger el LCR.
- –
Centrifugar las muestras antes de transcurridas 2 h de su extracción.
- –
Centrifugar a una velocidad de 2.000 xg durante 10 min a temperatura ambiente (∼20°C).
- –
Preparar alícuotas lo antes posible en tubos de PP con rosca una vez centrifugadas las muestras. Emplear volúmenes pequeños (0,25 o 0,5ml) sobrepasando hasta el 75% de la capacidad del tubo.
- –
Las muestras una vez centrifugadas pueden conservarse un máximo de 5 días a 4°C.
- –
Las alícuotas de LCR deben ser congeladas a –80°C hasta su análisis.
- –
Evitar más de 2 ciclos de congelación/descongelación.
- –
Las muestras de LCR conservadas a –80°C son estables hasta al menos 2 años.
- –
Las muestras de LCR conservadas a –20°C pueden almacenarse hasta 2 meses.
En la figura 1 se recogen, a modo de resumen, las recomendaciones establecidas para la estandarización de aspectos preanalíticos para el estudio de biomarcadores de la EA en el LCR.
A los miembros del grupo de trabajo de Neuroquímica y Enfermedades Neurológicas de la SEQC (C. Andrés Fernández, J.L. García de Veas, F. Marqués García), así como a todos los componentes de la comisión de Proteínas (M.C. Cárdenas Fernández, M. Fernández García, J. Jiménez Jiménez, G. Marcaida Benito, D. Pérez Surribas, E. Pitters Pérez, C. Valldecabres Ortiz, E. Zapico Muñiz) por su revisión crítica de la recomendación aquí presentada.
Este documento tiene la conformidad de las otras dos Sociedades (AEBM y AEFA) como Recomendación profesional en el ámbito del Laboratorio Clínico.