La hemólisis, entendida como la rotura de eritrocitos y liberación de hemoglobina y otros constituyentes intracelulares al plasma circulante, constituye una de las incidencias más frecuentes en el laboratorio, erigiéndose como una de las causas más habituales de rechazo de muestras1,2. De esta forma, la prevalencia de las muestras hemolizadas se encuentra en torno al 3,3%, constituyendo aproximadamente del 30 al 70% de las causas de rechazo en el laboratorio clínico3. Pese a que la presencia de hemólisis puede indicar un estado patológico en el paciente, se estima que en torno al 97% de los casos de hemólisis hallados en el laboratorio se originan como consecuencia de errores y actividades incorrectas durante la fase preanalítica, siendo por lo tanto evitables4. En la tabla 1 se resumen aquellas patologías y situaciones clínicas que implican una destrucción masiva de hematíes y originan hemólisis intravascular5–7. Se muestran así mismo los principales aspectos preanalíticos causantes de hemólisis artefactual e interferente, incluyendo aspectos relacionados con la extracción, transporte, procesado y almacenaje4,8.
Principales causas de hemólisis intravascular (patológica) y debida a factores preanalíticos evitables con origen en la extracción, transporte, procesado o almacenaje
| Hemólisis intravascular (patología–3% de los casos) |
| Anemia hemolítica: anemia hemolítica autoinmune, anemia hemolítica asociada a fármacos, hemoglobinuria a frigore, reacción transfusional |
| Hemoglobinuria paroxística del frío |
| Fragmentación de los hematíes: circulación extracorpórea, prótesis, valvulopatías, microangiopatías |
| Agentes químicos: venenos de serpientes y arañas, arsénico, choque osmótico (inyección o hemodiálisis con agua destilada), agentes desencadenantes de hemólisis en pacientes con déficit de G6PDH |
| Agentes infecciosos: bacterianos (sepsis por Clostridium o Bartonella), parasitarios (Plasmodium) |
| Agentes físicos: quemados |
| Hemólisis debida a factores preanalíticos (interferencia–97% de los casos) |
| Origen en la extracción |
| Obtención a partir de catéter |
| Obtención de zonas con hematomas |
| Obtención por capilar |
| Equipo de flebotomía |
| Calibre inadecuado de las agujas |
| Uso de antisépticos |
| Excesivo tiempo de torniquete |
| Punción traumática |
| Llenado insuficiente de los tubos |
| Mezclado incorrecto de los tubos |
| Transferencias desde jeringas a tubos contenedores |
| Origen en el transporte |
| Origen del espécimen: maternidad, emergencias, cuidados intensivos (con mayor frecuencia se dan condiciones inadecuadas de extracción) |
| Modalidad de transporte: transporte por carretera, tubo neumático (recorrido excesivamente largo o velocidades excesivas) |
| Condiciones de transporte: tiempo excesivo, bajas temperaturas, humedad |
| Origen en el procesado |
| Tiempo excesivo entre la obtención y/o recogida de la muestra y la centrifugación |
| Fuerza centrífuga excesiva |
| Tiempo de centrifugación excesivo |
| Centrifugación en frío |
| Baja integridad del separador |
| Recentrifugados |
| Origen en el almacenaje |
| Spin de centrífuga previo al almacenaje |
| Condiciones de almacenaje: baja temperatura y duración excesiva |
La hemólisis es visible tras la centrifugación de una muestra de sangre, adquiriendo el plasma o el suero un color que puede variar del rosado al rojo, de intensidad variable en función de la hemoglobina liberada al medio. La hemólisis es claramente detectable cuando se produce la lisis de un 0,5% de los eritrocitos, que aproximadamente equivale a unos 0,5g/l de hemoglobina libre. Sin embargo, a partir de 0,2g/l es posible detectar los primeros indicios de hemólisis en la muestra8.
La detección visual o mediante los índices de los analizadores automáticos es esencial para evitar la emisión de resultados incorrectos por parte del laboratorio. Si bien es procedimiento habitual descartar los resultados afectados por la interferencia, diversos autores han propuesto ecuaciones matemáticas que permiten realizar una corrección de la hemólisis y estimar los resultados9–14.
El objeto del presente documento es:
- a)
Reflexionar sobre el enfoque desde una perspectiva de la medicina de laboratorio y
- b)
Exponer las recomendaciones elaboradas por el Comité de Calidad, Gestión, Seguridad y Evidencia de AEBM-ML para el uso racional de estas ecuaciones.
Las recomendaciones propuestas son susceptibles de aplicación en todos aquellos laboratorios en los que se pretenda utilizar una ecuación de corrección matemática para estimar resultados que no son fiables por la presencia de interferencia por hemólisis. Esta aproximación suele tener su base en la multiplicación de la concentración de hemoglobina por la pendiente de una recta de regresión. Los métodos para el cálculo de la concentración de hemoglobina varían de unos analizadores a otros, pero frecuentemente aportan índices de hemólisis semicuantitativos basados en espectrofotometría directa, que pueden asociarse a concentraciones o rangos de concentraciones de hemoglobina15. Estos índices, sin embargo, presentan tres grandes inconvenientes:
- •
No permiten discriminar la hemólisis in vivo derivada de patologías del paciente de la hemólisis in vitro originada de forma artefactual. Los componentes de mayor peso molecular liberados por el eritrocito, tales como la lactato deshidrogenasa, permanecen durante más tiempo en la circulación, siendo indicativos de hemólisis intravascular. La disminución de haptoglobina o elevación de bilirrubina indirecta y reticulocitos son también indicativos de hemólisis in vivo7. La ausencia de anemia en el paciente sugiere por el contrario hemólisis artefactual. Sin embargo, la interpretación de estos datos no se encuentra automatizada, no se reflejan en los índices, y requieren una evaluación experta por parte del profesional del laboratorio.
- •
Las propiedades espectrales de la hemoglobina implican un pico de absorción aproximadamente a 420nm, y absorciones significativas entre 340-440nm y 540-580nm. Este espectro se solapa parcialmente con los presentes en la bilirrubina y la lipidemia, por lo que en presencia de estos constituyentes, los índices pueden verse afectados (infraestimación y sobrevaloración del grado de hemólisis respectivamente)16.
- •
No se dispone de calibradores ni controles de calidad para la evaluación de los índices, por lo que sus prestaciones analíticas no son valorables7.
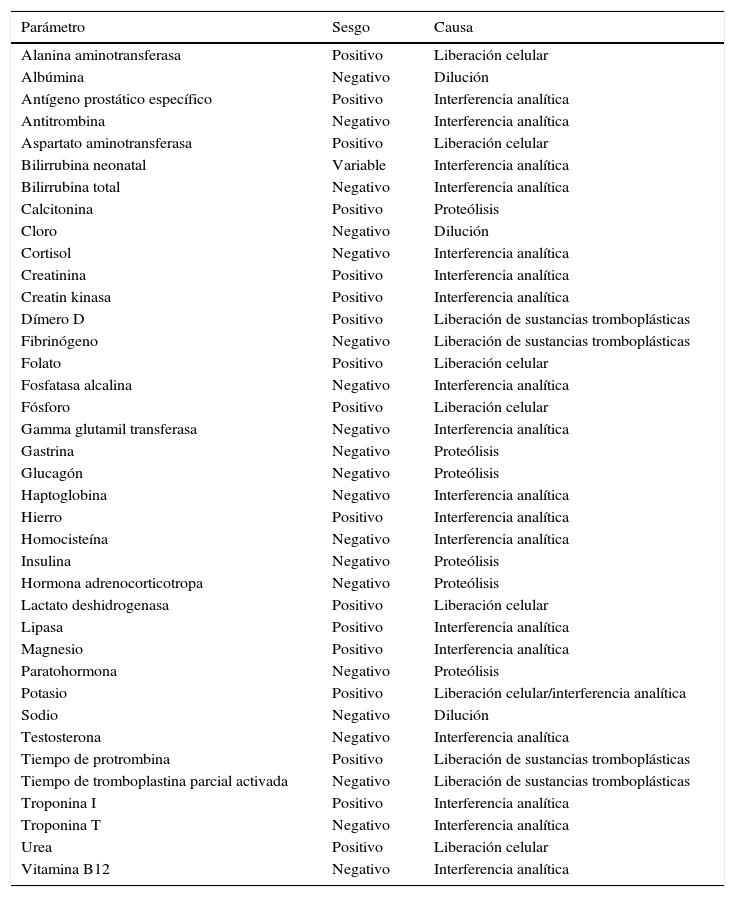
Cabe destacar por tanto que la evaluación de los índices considera que el grado de hemólisis es aproximadamente lineal con respecto a la concentración de hemoglobina libre de la muestra, generando sobreestimación (por liberación celular o interferencia analítica) en los niveles de aspartato aminotransferasa, alanina aminotransferasa, creatinina, creatinina kinasa, hierro, lactato deshidrogenasa, lipasa, magnesio, fósforo, potasio y urea entre otros. Por el contrario, debido a efectos de dilución, los niveles de albúmina, fosfatasa alcalina, bilirrubina, cloro, gamma glutamil transferasa, glucosa y sodio disminuyen. En la tabla 2 se recoge un resumen de los principales parámetros afectados por la hemólisis y sus causas17–25. Sin embargo, bajo determinadas circunstancias, la corrección de la hemólisis propuesta por ecuaciones basadas en la concentración de hemoglobina libre en el plasma presenta desviaciones y no es aplicable. Así por ejemplo, pacientes con anemia macrocítica presentan una menor concentración relativa de hemoglobina en relación con el resto de los constituyentes de la célula, por lo que los datos de corrección aportados serán erróneos. De forma similar, las muestras conservadas en frío alteran la difusión de la membrana del eritrocito. De esta forma, sin que se produzca rotura de la membrana, la inhibición de la bomba Na+/K+ induce una hiperpotasemia artificial, que no podrá ser evaluada de forma adecuada mediante las ecuaciones de corrección basada en índices de hemólisis26.
Parámetros de laboratorio afectados por la hemólisis in vitro
| Parámetro | Sesgo | Causa |
|---|---|---|
| Alanina aminotransferasa | Positivo | Liberación celular |
| Albúmina | Negativo | Dilución |
| Antígeno prostático específico | Positivo | Interferencia analítica |
| Antitrombina | Negativo | Interferencia analítica |
| Aspartato aminotransferasa | Positivo | Liberación celular |
| Bilirrubina neonatal | Variable | Interferencia analítica |
| Bilirrubina total | Negativo | Interferencia analítica |
| Calcitonina | Positivo | Proteólisis |
| Cloro | Negativo | Dilución |
| Cortisol | Negativo | Interferencia analítica |
| Creatinina | Positivo | Interferencia analítica |
| Creatin kinasa | Positivo | Interferencia analítica |
| Dímero D | Positivo | Liberación de sustancias tromboplásticas |
| Fibrinógeno | Negativo | Liberación de sustancias tromboplásticas |
| Folato | Positivo | Liberación celular |
| Fosfatasa alcalina | Negativo | Interferencia analítica |
| Fósforo | Positivo | Liberación celular |
| Gamma glutamil transferasa | Negativo | Interferencia analítica |
| Gastrina | Negativo | Proteólisis |
| Glucagón | Negativo | Proteólisis |
| Haptoglobina | Negativo | Interferencia analítica |
| Hierro | Positivo | Interferencia analítica |
| Homocisteína | Negativo | Interferencia analítica |
| Insulina | Negativo | Proteólisis |
| Hormona adrenocorticotropa | Negativo | Proteólisis |
| Lactato deshidrogenasa | Positivo | Liberación celular |
| Lipasa | Positivo | Interferencia analítica |
| Magnesio | Positivo | Interferencia analítica |
| Paratohormona | Negativo | Proteólisis |
| Potasio | Positivo | Liberación celular/interferencia analítica |
| Sodio | Negativo | Dilución |
| Testosterona | Negativo | Interferencia analítica |
| Tiempo de protrombina | Positivo | Liberación de sustancias tromboplásticas |
| Tiempo de tromboplastina parcial activada | Negativo | Liberación de sustancias tromboplásticas |
| Troponina I | Positivo | Interferencia analítica |
| Troponina T | Negativo | Interferencia analítica |
| Urea | Positivo | Liberación celular |
| Vitamina B12 | Negativo | Interferencia analítica |
El presente documento puede ser de aplicación para otros parámetros, pero pone el foco en las ecuaciones propuestas para la corrección del potasio, al ser estas las más habitualmente desarrolladas7,27.
Existen analizadores cuyas determinaciones son susceptibles de interferencia por hemólisis, pero que carecen de sistemas de evaluación de la misma. Sirvan como ejemplo representativo los actuales gasómetros, que permiten en muchos casos la evaluación de iones, bilirrubina y lactato. Ante sospecha de hemólisis, se recomienda la centrifugación de la muestra y la evaluación visual o mediante técnica automatizada del grado de interferencia.
Tras lo expuesto, es importante resaltar que el proceso de toma de decisiones debe ser abordado desde un punto de vista integral, considerando no solo la metrología sino también la perspectiva clínica. Por lo tanto:
- 1)
El facultativo del laboratorio debe disponer de un sistema que le permita:
- •
Valorar el grado de hemólisis, preferentemente mediante sistemas automatizados que permitan estandarizar el proceso.
- •
Determinar si se trata de una hemólisis in vitro o in vivo.
- •
Garantizar una calidad metrológica en sus resultados.
- •
- 2)
El facultativo del laboratorio ha de conocer y valorar el motivo que origina la petición. La validación y toma de decisiones por parte del facultativo requiere conocer si la solicitud posee una cualidad diagnóstica, de monitorización o de ajuste del tratamiento, o si por el contrario se incluye en el seno de perfil genérico.
Todo este proceso plantea un dilema al profesional del laboratorio, siendo el facultativo el que adquiere la responsabilidad de responder a la siguiente pregunta: considerando el contexto particular del paciente, ¿es mejor un mal resultado o la ausencia del mismo?
Para decidir el enfoque y el ámbito de aplicación frente a este dilema, las preguntas a responder son:
- •
¿El resultado es fiable?
- •
¿Con qué margen de fiabilidad?
- •
¿Qué daño puede causar la literalidad del dato?
- •
¿Qué daño puede causar solicitar una nueva muestra?
- •
¿Qué daño puede causar no informar?
Por este motivo la validación no es automatizable y el resultado y la acción deben ser valoradas siempre por el especialista del laboratorio.
Si el dilema es solo metrológico, la opción cuando la fiabilidad del resultado sea cuestionable es anular el resultado de potasio (no podemos dar el valor) y sustituirlo por un informe técnico (informe fisiopatológico de laboratorio) que pondera y valida los riesgos y es capaz de suministrar el máximo de información fiable, separando de esa manera los aspectos metrológicos de los de información.
Si finalmente se informa el valor, es necesario habilitar algún criterio que permita conocer, en edición seriada de resultados, que este valor no es comparable al resto de la serie.
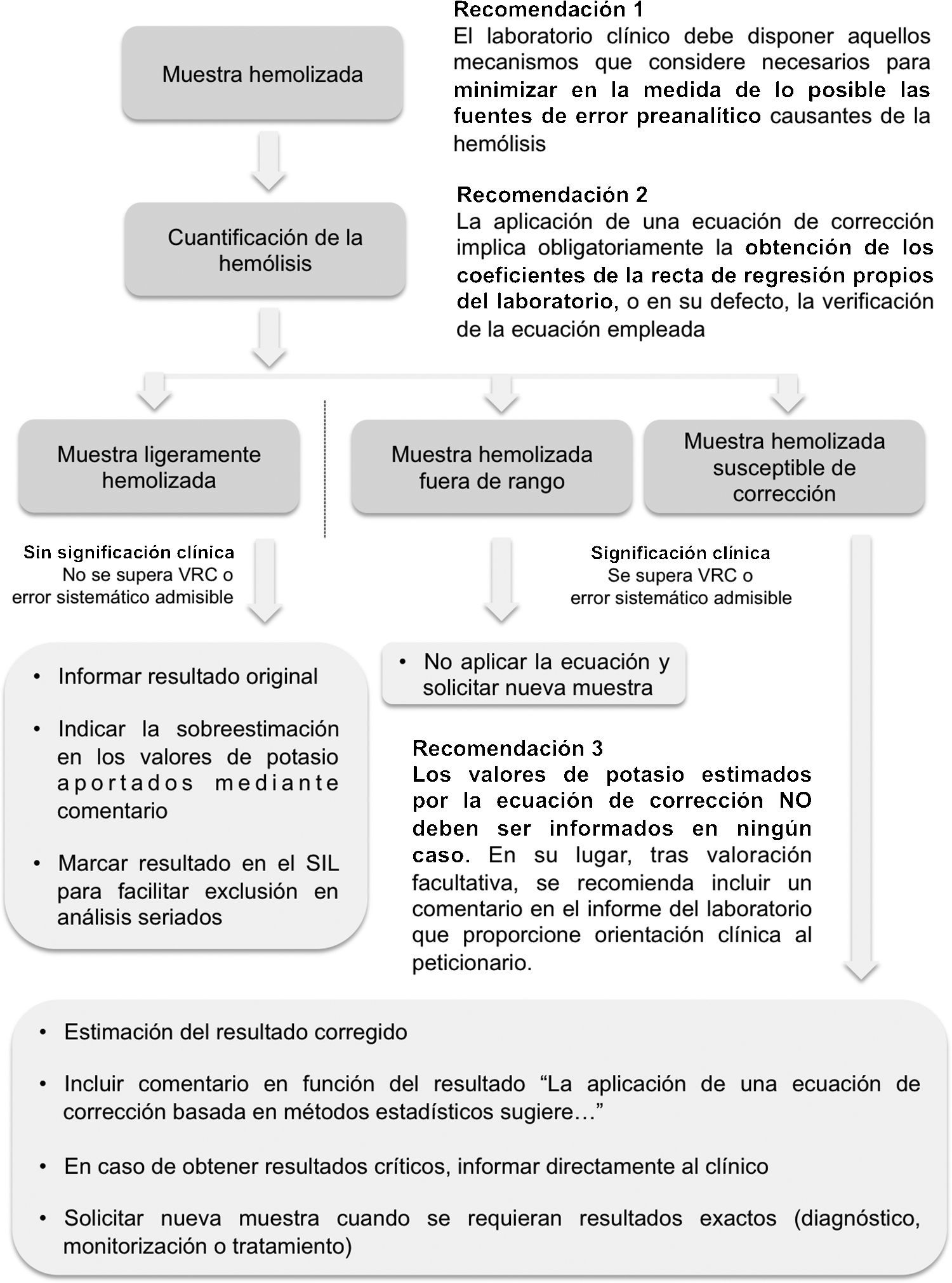
RecomendacionesRecomendación 1. Actuación preventiva- Previo al planteamiento de utilización de ecuaciones de corrección de la hemólisis, el laboratorio clínico debe disponer de aquellos mecanismos que considere necesarios para minimizar, en la medida de lo posible, las fuentes de error preanalítico causantes de la hemólisis. Estos mecanismos deben incluir la formación/capacitación del personal responsable de la extracción y manejo de las muestras y la elaboración de circuitos preanalíticos adecuados que permitan el adecuado transporte, conservación y procesado de las muestras.
Asimismo, el laboratorio debe ser capaz de identificar los centros de extracción o profesionales con un porcentaje de error superior al grupo para tomar medidas específicas que minimicen esa fuente de error.
Además es recomendable que el laboratorio integre un indicador del tipo (n.° muestras hemolizadas/total de muestras) en su sistema de gestión de la calidad donde se recojan este tipo de incidencias preanalíticas para tener un control exhaustivo del proceso y poder realizar un seguimiento del mismo.
Recomendación 2.- La aplicación de una ecuación de corrección9–14implica obligatoriamente la obtención de los coeficientes de la recta de regresión propios del laboratorio, o en su defecto, la verificación de la ecuación empleada. Las ecuaciones de corrección propuestas en la bibliografía suelen basarse en rectas de regresión elaboradas bajo las condiciones concretas y específicas de un laboratorio. La combinación formada por analizadores, reactivos, calibradores y personal implicado son propias de cada laboratorio, por lo que pese a que una ecuación cuente con un diseño experimental adecuado y una funcionalidad óptima en el laboratorio que la diseñó, su aplicación no puede ser extrapolada de forma directa al resto, siendo necesaria su verificación. No es el objetivo del presente documento el elaborar una guía detallada del proceso de diseño o verificación de ecuaciones. Sin embargo, en líneas generales, se proponen dos posibles opciones:
- •
Opción 1. Diseño de la ecuación por parte del laboratorio (recomendada). La obtención de los parámetros de la recta de regresión puede ser realizada mediante la replicación completa de la experimentación propuesta por alguno de los trabajos originales. La realización de este procedimiento permite obtener una ecuación con parámetros adaptados a las condiciones particulares del laboratorio, basada en métodos reconocidos y aceptados por la comunidad científica.
- •
Opción 2 (aceptada). Verificar que los resultados derivados de la aplicación de la corrección en sueros/plasmas hemolizados coinciden con los resultados obtenidos en estas mismas muestras en ausencia de interferencia. Se debe tener en cuenta que:
- ∘
El análisis ha de realizarse con pares de muestras hemolizada/no hemolizada. La obtención de estos pares puede ser obtenida partiendo de muestras sin interferencia, a partir de las cuales se obtienen alícuotas que se hemolizan «in vitro» por medios mecánicos o químicos (puede emplearse la metodología propuesta por los autores originales de la ecuación). Otra alternativa es la elaboración de una base de datos reales a partir de muestras hemolizadas posteriormente reclamadas por el laboratorio.
- ∘
El número mínimo de pares de muestras hemolizada/no hemolizada que deben ser incluidos en el estudio de verificación es de 40.
- ∘
El conjunto de muestras deben incluir el rango completo de hemólisis para el que la ecuación ha sido propuesta.
- ∘
Se considera que un resultado estimado por la ecuación es aceptable cuando la diferencia con el resultado no hemolizado es inferior al error total admisible definido por el laboratorio para la determinación en cuestión. Si tomamos como ejemplo el potasio, según las especificaciones mínimas de consenso propuestas por AEBM, AEFA, SEHH y SEQC, la diferencia ha de ser inferior al 8%28.
- ∘
Para que la verificación sea aprobada, al menos el 95% de los resultados estimados han de ser aceptables.
- ∘
Recomendación 3.- Los valores de potasio estimados por la ecuación de corrección no deben ser informados en ningún caso. En su lugar, tras valoración facultativa, se recomienda incluir un comentario en el informe del laboratorio que proporcione orientación clínica al peticionario. Un posible abordaje ante las diversas situaciones se expone a continuación, teniendo en consideración el grado de hemólisis de la muestra:
3.1.- Muestras ligeramente hemolizadas. Se considera que una muestra se halla ligeramente hemolizada cuando el grado de interferencia no implica la superación del valor de referencia del cambio o del error sistemático deseable20,25,29. El resultado original (sin corrección) puede ser informado, ya que su desviación con respecto al valor verdadero en ausencia de interferencia no es clínicamente significativa. En este caso, no procede la aplicación de una ecuación de corrección, pero es necesario sin embargo indicar en el informe de laboratorio que existe una sobreestimación en los niveles de potasio por presencia de hemólisis en la muestra, y si es posible, marcar ese resultado para que no pueda ser incluido en estudios seriados del paciente.
3.2.- Muestras hemolizadas susceptibles de corrección. En aquellas muestras que presenten un grado de hemólisis dentro de los límites de corrección propuestos para la ecuación, y que supongan una alteración significativa del resultado, se procederá de la siguiente manera:
3.2.1.- En caso de que el motivo de solicitud sea rutinario, no exista riesgo para el paciente y sea posible obtener una nueva muestra, el resultado original (sin corrección) debe ser eliminado del informe en todos los casos. No se solicitara directamente el envío de nueva muestra, pudiendo sin embargo sugerirse la posibilidad a criterio del peticionario.
3.2.2.- En caso de que nos encontremos ante una petición explícita del potasio (fines diagnósticos, monitorización o tratamiento), se actuará como sigue en función del resultado del potasio obtenido a través de la ecuación de corrección:
Si los resultados derivados de la corrección son inferiores al rango de referencia para el potasio, eliminar el resultado original e incluir un comentario:
- ∘
Suero/plasma hemolizado. Se solicita el envío de nueva muestra para evaluación de la concentración de potasio. La aplicación de una ecuación de corrección basada en métodos estadísticos sugiere la presencia de hipopotasemia, por lo que se recomienda la evaluación clínica del paciente y remitir nueva muestra con la mayor brevedad.
Si los resultados derivados de la corrección están dentro del rango de referencia para el potasio, eliminar el resultado original e incluir un comentario:
- ∘
Suero/plasma hemolizado. La aplicación de una ecuación de corrección basada en métodos estadísticos sugiere la presencia de niveles dentro del rango de referencia. Se recomienda la evaluación clínica del paciente y remitir nueva muestra en caso de discrepancia entre el estado de salud del paciente y el resultado estimado.
Si los resultados derivados de la corrección exceden el rango de referencia para el potasio, eliminar el resultado original e incluir un comentario:
- ∘
Suero/plasma hemolizado. Se solicita el envío de nueva muestra para evaluación de la concentración de potasio. La aplicación de una ecuación de corrección basada en métodos estadísticos sugiere la presencia de hiperpotasemia, por lo que se recomienda la evaluación clínica del paciente y remitir nueva muestra con la mayor brevedad.
Si los resultados derivados de la corrección muestran un resultado crítico para el potasio, eliminar el resultado original y se recomienda comunicación telefónica con el clínico (según protocolo de resultados críticos o valores de pánico establecidos por el laboratorio) e inclusión de un comentario:
- ∘
Suero/plasma hemolizado. Se solicita el envío de nueva muestra para evaluación de la concentración de potasio. La aplicación de una ecuación de corrección basada en métodos estadísticos sugiere un resultado muy elevado, por lo que se recomienda evaluar la clínica del paciente y remitir nueva muestra con la mayor brevedad.
- ∘
La definición del grado de hemólisis, así como el rango de corrección válido para la ecuación aplicada han de ser claramente definidos por el laboratorio.
- ∘
3.3.- Muestras hemolizadas fuera de rango. En aquellas muestras que presenten un grado de hemólisis superior a los límites de corrección propuestos para la ecuación, esta no podrá ser aplicada. Procede en este caso la eliminación del resultado original (sin corrección) y la solicitud de una nueva muestra.
En caso de que el motivo de solicitud sea urgente y/o exista riesgo para el paciente, la información es más importante que el dato. Debe valorarse la posibilidad de comprobar con otra muestra distinta de la que dispongamos. Se debe contactar directamente con el peticionario para exponerle el problema y analizar con él la obtención de una nueva muestra de manera inmediata o diferida en función de la situación del paciente. Un resumen de las recomendaciones y propuesta de algoritmo de actuación se muestra en la figura 1.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.