La resistencia a hormonas tiroideas, descrita por Refetoff en 1967, es un desorden genético autosómico dominante. Se caracteriza por una respuesta reducida de los tejidos blandos a la hormona tiroidea con incremento de niveles de tiroxina libre sin inhibición de la hormona tirotropa, como consecuencia de mutaciones presentes en el gen receptor beta de la hormona tiroidea (rTHβ) en el 85% de los casos. Es una entidad poco frecuente y el diagnóstico definitivo se basa en el estudio genético.
Presentamos el caso de una probable nueva mutación en el gen rTHβ.
Resistance to thyroid hormone, described by Refetoff in 1967, it is an autosomic dominant genetic disorder. It is characterised by a reduced soft-tissue response to thyroid hormone action, associated with increased free thyroxin (FT4) levels with no thyrotrophic hormone inhibition, as a consequence of mutations present in thyroid hormone receptor beta gen (rTHβ) in 85% of cases. It is a rare disease and the definitive diagnostic is based on a genetic study.
A report is presented on a possible new mutation case of the rTHβ gene.
La resistencia a hormonas tiroideas (RHT) es un desorden genético de transmisión dominante. Se caracteriza por una disminución en la sensibilidad tisular a la acción de las hormonas tiroideas. A nivel bioquímico se manifiesta por concentraciones elevadas de tiroxina libre (FT4) junto con concentraciones medibles de tirotropina (TSH)1. Los niveles de triyodotironina libre (FT3) suelen encontrarse también elevados y la relación FT3:FT4 está conservada, a diferencia de lo que ocurre en la tirotoxicosis autoinmune2. Está causado en el 85% de los casos por mutaciones en el gen receptor beta de las hormonas tiroideas (rTHβ). Es una entidad poco frecuente, aproximadamente 1:40.000 nacidos vivos, y su prevalencia es igual en ambos sexos, afectando a todos los grupos étnicos3. Fue descrita por Refetoff en 1967 y a partir de 1990 se empiezan a detectar las diferentes mutaciones en el receptor β como responsables de la enfermedad4. Una de las manifestaciones clínicas más frecuentes es la presencia de bocio, que se encuentra en el 95% de los pacientes, como consecuencia de los niveles elevados o de la mayor bioactividad de TSH. Pese a ello, no hay síntomas patognomónicos asociados a esta entidad y su presentación clínica es un tanto variable. Se pueden encontrar manifestaciones clínicas compatibles con defecto o exceso hormonal que afecte a distintos órganos, pero en la mayoría de los casos la elevación de las concentraciones de fracciones libres de las hormonas tiroideas compensa completamente la resistencia y los individuos aparecen clínicamente eutiroideos logrando crecimiento y desarrollo normal5.
Es preciso realizar el diagnóstico diferencial con otros procesos, como el hipertiroidismo debido a enfermedad de Graves, bocio autónomo uninodular o multinodular, las anomalías de las proteínas transportadoras de hormonas tiroideas y, principalmente, con el tumor hipofisario productor de TSH (TSHoma). La RHT y la enfermedad de Graves pueden estar presentes en el mismo paciente. En estos casos se necesitan dosis elevadas de hormona tiroidea para mantener el eutiroidismo tras la ablación tiroidea. Las alteraciones de las proteínas transportadoras pueden dar lugar a aumento selectivo de la tiroxina sérica total (T4) en presencia de una TSH y FT4 dentro del intervalo de referencia. En los adenomas secretores de TSH existe un incremento de la subunidad alfa de la misma y el diagnóstico de adenoma se establece tras la exploración radiológica5,6.
El diagnóstico definitivo de RHT se basa en el estudio genético. Se han descrito, fundamentalmente, mutaciones en los exones 7 a 10 del gen rTHβ y en la actualidad hay documentadas más de 100 mutaciones de este gen6. No obstante, hay que recordar que el 15% de los pacientes no presenta mutaciones en el receptor, por lo que la ausencia de mutaciones no descarta la resistencia, pero su identificación la confirma7.
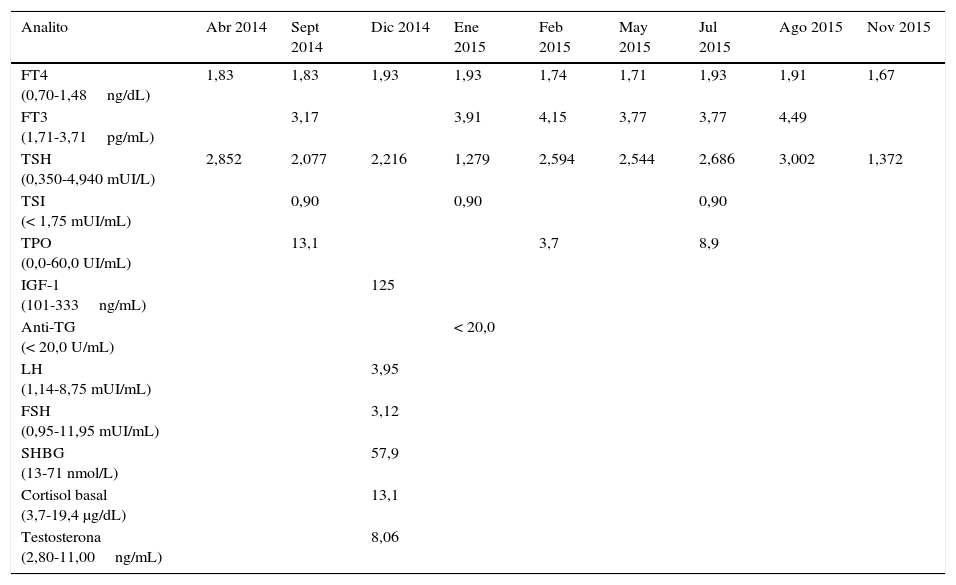
Caso clínicoPresentamos el caso de un varón de 22 años con trastorno de la personalidad y en tratamiento con risperidona, que es remitido desde Psiquiatría al Servicio de Endocrinología por presentar elevación de FT4: 1,87ng/mL (0,70-1,48) con un valor normal de TSH: 2,650 mUI/L (0,350-4,940) en una analítica de rutina. Semanas después se realiza una nueva determinación de hormonas tiroideas incluyendo FT3, observándose valores dentro de rango. Se obtuvieron resultados similares de TSH: 1,742 mUI/L (0,550-4,780) y de FT4: 2,01ng/dL (0,89-1,76) por otro método quimioluminiscente, por lo que es improbable asociarlo a una interferencia analítica con el método en uso. El resto de la analítica, sin alteraciones. La anamnesis no detectó elementos sospechosos de disfunción tiroidea y la exploración física fue normal. No se palpó bocio, objetivándose condición clínica de eutiroidismo. Se realizó una nueva analítica añadiendo anticuerpos antitiroideos para descartar patología autoinmune que resultaron negativos. Se constató un valor dentro de rango para la subunidad α de la TSH: 0,4 mUI/mL (≤ 0,8) y el estudio hormonal complementario fue normal (tabla 1). La realización de una TAC craneal y una RM de hipófisis descartó la presencia de adenoma hipofisario productor de TSH. La ecografía de tiroides reflejó un ligero aumento de la glándula, no visualizándose nódulos, ni imágenes quísticas ni adenopatías.
Pruebas de laboratorio realizadas durante el seguimiento
| Analito | Abr 2014 | Sept 2014 | Dic 2014 | Ene 2015 | Feb 2015 | May 2015 | Jul 2015 | Ago 2015 | Nov 2015 |
|---|---|---|---|---|---|---|---|---|---|
| FT4 (0,70-1,48ng/dL) | 1,83 | 1,83 | 1,93 | 1,93 | 1,74 | 1,71 | 1,93 | 1,91 | 1,67 |
| FT3 (1,71-3,71pg/mL) | 3,17 | 3,91 | 4,15 | 3,77 | 3,77 | 4,49 | |||
| TSH (0,350-4,940 mUI/L) | 2,852 | 2,077 | 2,216 | 1,279 | 2,594 | 2,544 | 2,686 | 3,002 | 1,372 |
| TSI (< 1,75 mUI/mL) | 0,90 | 0,90 | 0,90 | ||||||
| TPO (0,0-60,0 UI/mL) | 13,1 | 3,7 | 8,9 | ||||||
| IGF-1 (101-333ng/mL) | 125 | ||||||||
| Anti-TG (< 20,0 U/mL) | < 20,0 | ||||||||
| LH (1,14-8,75 mUI/mL) | 3,95 | ||||||||
| FSH (0,95-11,95 mUI/mL) | 3,12 | ||||||||
| SHBG (13-71 nmol/L) | 57,9 | ||||||||
| Cortisol basal (3,7-19,4 μg/dL) | 13,1 | ||||||||
| Testosterona (2,80-11,00ng/mL) | 8,06 |
Anti-TG: anticuerpos antitiroglobulina; FSH: hormona foliculoestimulante; FT3: triyodotironina libre; FT4: tiroxina libre; IGF-1: factor crecimiento tisular; LH: hormona luteinizante; TPO: anticuerpo antiperoxidasa tiroidea; TSH: hormona estimulante del tiroides; TSI: inmunoglobulina estimulante del tiroides; SHBG: globulina fijadora de hormonas sexuales.
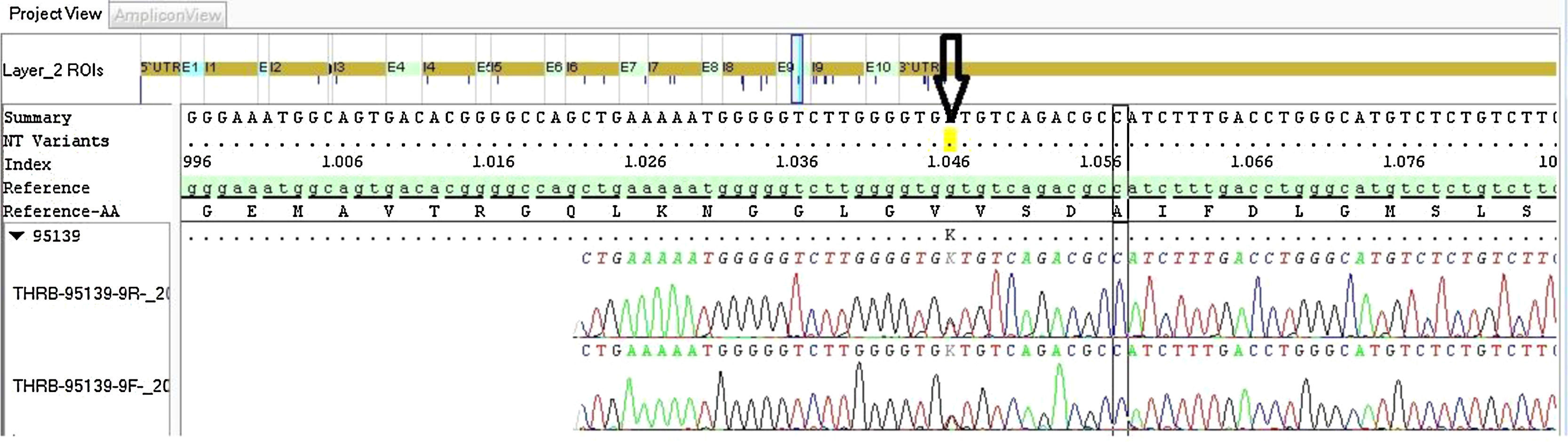
Ante la sospecha de RHT, se realizó estudio genético del gen rTHβ (exones 7-10) por secuenciación, encontrando una variante de significado clínico incierto en heterocigosis (c.1045G>T), desconocida hasta el momento. Este cambio es una mutación missense que conduce a la sustitución de un aminoácido de valina por leucina en la posición 349: p.Val349Leu. Esta variante no se encuentra descrita en la bibliografía ni en las bases de datos consultadas (fig. 1). En Human Gene Mutation Database hay descrita una mutación patogénica que afecta al mismo codón pero que provoca otro cambio aminoacídico (p.Val349Met), asociada a RHT8.
El hallazgo del mismo patrón de laboratorio en familiares del caso índice es prácticamente confirmatorio de RHT y el estudio genético revela el trastorno molecular subyacente, así que se recomienda el estudio de la variante encontrada en los progenitores del paciente. En nuestro caso, no existe relación de consanguinidad entre el paciente y sus padres, así que no fue posible continuar el estudio en el resto de familiares. Por ello, se realizó la secuenciación completa del gen rTHβ a fin de analizar la presencia de otra alteración en el resto del gen y poder corroborar que la mutación encontrada es la causante de la patología. En el análisis del gen completo no se identificó la presencia de otras variantes.
DiscusiónEn la actualidad no se puede considerar que la mutación p.Val349Leu sea la causante de la RHT del caso expuesto al ser una variante de significado clínico incierto, pero es probable que según se vayan completando las bases de datos de alteraciones genéticas causantes de RHT, se llegue a confirmar la posible patogenicidad de la variante encontrada.
El diagnóstico de RHT no es sencillo. La sensibilidad de la hormona tiroidea en los diferentes órganos es variable y la presentación clínica heterogénea. En la resistencia central aislada existe una falta de supresión de la secreción de TSH por la hipófisis anterior ocasionando elevación de T3 y T4, originando síntomas de tirotoxicosis. En la resistencia generalizada, la mayoría de los tejidos no responden a las hormonas tiroideas y se presenta eutiroidismo o hipotiroidismo dependiendo del grado de compensación logrado con el aumento de las hormonas tiroideas.
Debido a que el origen diagnóstico de este caso surgió del estudio del cuadro psiquiátrico, en un primer momento se valoró la posibilidad de una interferencia entre la risperidona y las pruebas de laboratorio, ya que los psicofármacos y las hormonas tiroideas poseen mecanismos de acción comunes, pero se descartó dado que los antipsicóticos atípicos no tienen efecto en la determinación de las concentraciones de FT3 y TSH, y pueden disminuir o no alteran los valores de FT4, al contrario de lo que ocurre en nuestro paciente9.
Se ha demostrado que la RHT tiene relación con trastornos del ánimo, depresión y, sobre todo, con cuadros de hiperactividad y déficit de atención10. Pero, en nuestro caso, no se observó una relación directa entre RHT y el trastorno de personalidad que presenta el paciente.
Al ser una entidad poco habitual, si no se detecta precozmente puede llevar a tratamientos terapéuticos erróneos. En la actualidad, en pacientes clínicamente eutiroideos no existe ningún tratamiento que corrija por completo el defecto que origina la RHT. La mayoría de los pacientes sin tratamiento consigue compensar su rTHβ defectuoso mediante un aumento de las hormonas tiroideas11.
ConclusionesEn el caso expuesto se confirmó que el paciente no presentaba enfermedad tiroidea autoinmune ni tumor secretor de TSH y ha permanecido con valores similares de TSH, elevación de FT4 y ligero incremento de FT3, estando clínicamente eutiroideo.
El hallazgo e identificación de las mutaciones asociadas a RHT es fundamental ya que permite ofrecer a los pacientes un adecuado tratamiento y consejo genético, dada la importancia de la hormona tiroidea y su receptor en el desarrollo y mantenimiento de la homeostasis corporal12.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNo se ha recibido financiación.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Nuestro agradecimiento a Reference Laboratory SA por su colaboración.