La hemólisis es un efecto preanalítico evitable en la mayoría de los casos. Su aparición se debe a la técnica de extracción empleada y a las condiciones de transporte y preparación de las muestras. Su presencia produce error en muchas determinaciones habituales en química clínica, en muchos casos por la mezcla del contenido intraeritrocitario y en algún caso por el efecto interferente de componentes del hematíe, como la hemoglobina. En los laboratorios es necesario detectar y cuantificar la hemólisis en las muestras de forma estandarizada. La mayoría de los analizadores de bioquímica actuales incorporan sistemas de cuantificación espectrofotométrica de la hemoglobina. La influencia de la hemólisis en una magnitud depende de la metodología empleada, por lo que se debería solicitar a los fabricantes de equipos la realización de estudios y una información detallada sobre la influencia de la hemólisis en sus determinaciones, para que cada laboratorio pueda establecer el grado de hemólisis que supone error significativo para una magnitud, de acuerdo con sus especificaciones de calidad.
In most cases, hemolysis is an avoidable preanalytical effect. It can appear as a result of the procedure used during blood specimen collection and also due to transport conditions and sample preparation. Hemolysis can lead to errors in many common determinations in clinical chemistry, mostly due to the leakage of cellular contents into the plasma, and in some cases, by the interfering effect of red blood cells components, such as hemoglobin. Laboratories need to be able to detect and measure hemolysis by a standardized procedure. The majority of current biochemistry analyzers can measure hemolysis by a spectrophotometric method. Nevertheless, the influence of hemolysis depends on the measurement method employed. Laboratories should demand that manufacturers give detailed information and make exhaustive studies regarding the influence of hemolysis on each analyte. This would allow each laboratory to establish the degree of hemolysis that produces a significant error in an analysis and in accordance with the laboratory's quality specifications.
La hemólisis en las muestras para diagnóstico puede generar resultados erróneos en muchas de las determinaciones habituales en química clínica y puede, en algún caso, tener repercusión grave para el paciente. Algunas revisiones recientes del tratamiento de estas muestras en el laboratorio1–3 evidencian grandes discrepancias respecto a la forma de detección, a la consideración del grado de hemólisis que afecta significativamente a los resultados y a la actuación del laboratorio ante estas muestras. Varios grupos científicos han publicado recomendaciones4–6 para intentar estandarizar el tratamiento de estas muestras entre los laboratorios.
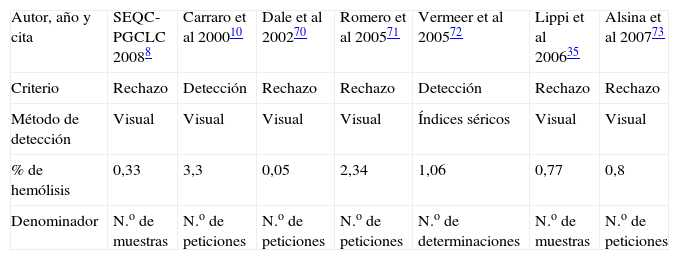
La hemólisis es la principal causa de rechazo preanalítico de muestras de suero, como ponen de manifiesto los programas de evaluación externa de la calidad preanalítica7,8. La prevalencia de muestras hemolizadas constituye uno de los indicadores de calidad más utilizados en esta fase. Sin embargo, el porcentaje de muestras hemolizadas en diversos estudios es muy variable, oscila entre el 0,05 y el 3,3% (tabla 1). Esta variabilidad puede deberse realmente a diferencias en la forma de obtener y procesar la muestra, pero también a diferencias de criterio en la definición de muestra hemolizada. En la mayoría de los estudios, la detección de la hemólisis es visual, lo que implica cierta subjetividad, y el criterio de inclusión es el rechazo de la muestra para una magnitud determinada y no la detección de hemólisis por sí misma. Se observa, además, que la expresión del indicador no es uniforme, puede informarse como porcentaje respecto al número de peticiones, muestras o determinaciones.
Prevalencia de muestras hemolizadas en distintos estudios y programas externos de control de calidad de la fase preanalítica. (SEQC-PGCLC; Programa de Garantía de la Calidad para el Laboratorio Clínico de la Sociedad Española de Bioquímica Clínica y Patología Molecular)
| Autor, año y cita | SEQC-PGCLC 20088 | Carraro et al 200010 | Dale et al 200270 | Romero et al 200571 | Vermeer et al 200572 | Lippi et al 200635 | Alsina et al 200773 |
| Criterio | Rechazo | Detección | Rechazo | Rechazo | Detección | Rechazo | Rechazo |
| Método de detección | Visual | Visual | Visual | Visual | Índices séricos | Visual | Visual |
| % de hemólisis | 0,33 | 3,3 | 0,05 | 2,34 | 1,06 | 0,77 | 0,8 |
| Denominador | N.o de muestras | N.o de peticiones | N.o de peticiones | N.o de peticiones | N.o de determinaciones | N.o de muestras | N.o de peticiones |
Es imprescindible mejorar la información de los profesionales del laboratorio acerca de este problema para estandarizar la actuación frente a estas muestras. En esta revisión se intenta recopilar información sobre los mecanismos de producción de la hemólisis, los métodos de detección y las recomendaciones de las sociedades científicas relacionadas con el laboratorio clínico.
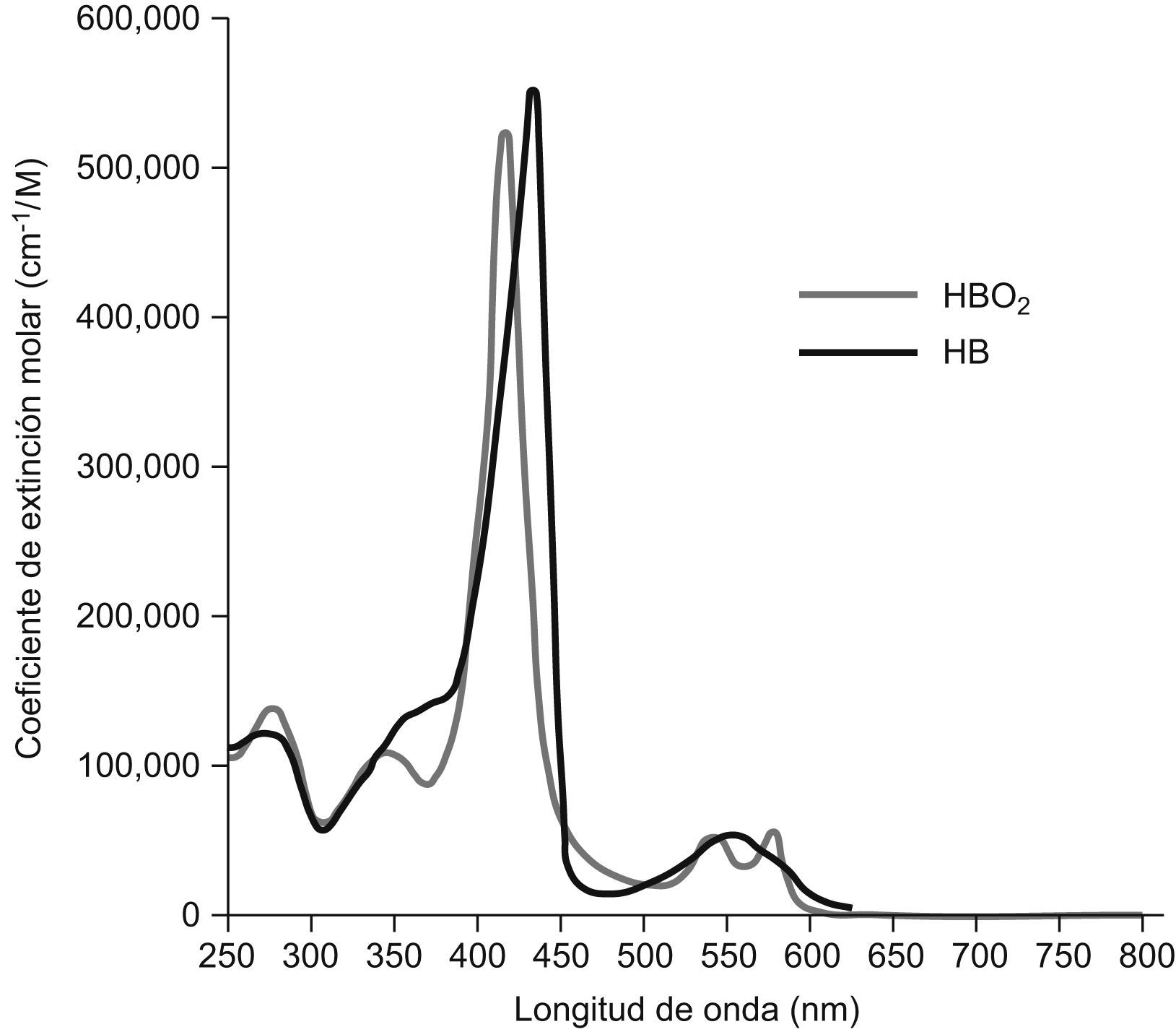
Definición de la hemólisisLa hemólisis es el proceso de destrucción de los hematíes, que conlleva la liberación del contenido intraeritrocitario en el plasma alterando su composición. La principal molécula intraeritrocitaria es la hemoglobina, que tiene un espectro de absorción característico del grupo Hem, con un pico de 405nm y varios picos entre 500–600nm, lo que produce un color rojizo en el plasma proporcional a la hemoglobina liberada (fig. 1). Se suele definir la hemólisis como la aparición en plasma de más de 0,3g/l de hemoglobina, que se considera la concentración mínima detectable visualmente4. En la práctica, la variedad en la coloración del plasma normal debido a la presencia de otros pigmentos (bilirrubina, carotenos, etc.) hace muy difícil la detección fiable de hemoglobina de forma visual cuando su concentración es inferior a 2g/l9.
La hemólisis junto a la ictericia y la lipemia se denominan habitualmente interferencias endógenas, en tanto que se trata de constituyentes que aparecen de forma natural en la sangre, pero su elevación excesiva puede alterar la exactitud de la determinación de otro constituyente. Terminológicamente, la hemólisis no es una interferencia, sino un efecto preanalítico, definido como los cambios que se producen en la concentración de uno o más constituyentes biológicos, debido a factores preanalíticos como la forma de obtención o las condiciones patológicas del paciente en el momento de la obtención.
Cabe distinguir las situaciones en que la hemólisis es un componente de variabilidad biológica no controlable, cuando se debe a un proceso patológico en el paciente, de las ocasiones en que es un componente controlable, producido a consecuencia de la técnica de obtención o procesamiento de la muestra. En una revisión de Carraro et al en pacientes hospitalizados10, de un total de 505 muestras hemolizadas, el 97% de los casos se debía a obtención incorrecta (controlable) y el 3% a causas in vivo (no controlable).
Causas de la hemólisisEn la mayoría de las enfermedades que cursan con destrucción acelerada de los hematíes, ésta se produce en la red microvascular y en las áreas especializadas en la recuperación de los elementos intraeritrocitarios, como el bazo (hemólisis extravascular). Solamente en las enfermedades que producen una destrucción masiva, que sobrepasa la capacidad de los sistemas de recuperación, se encuentra hemoglobina libre en el plasma (hemólisis intravascular). En este último caso, el resto de los componentes eritrocitarios se distribuyen igualmente en el líquido extracelular. Los de mayor tamaño, como la lactato deshidrogenasa (LDH), se mantienen durante más tiempo en la circulación, lo que permite su utilización como indicador de la presencia de hemólisis intravascular. El descenso de haptoglobina sérica, el incremento de bilirrubina indirecta o el aumento de reticulocitos pueden utilizarse también como indicadores de hemólisis in vivo2. En la tabla 2 se presentan las principales enfermedades causantes de hemólisis intravascular.
Causas de hemólisis intravascular (adaptado de Blank49)
|
G6PDH: glucosa 6 fosfato deshidrogenasa; HELLP: Hemolysis, Elevatd liver enzymes and low platelets.
Con gran diferencia, la causa más frecuente de aparición de muestras hemolizadas es el deterioro producido en la fase preanalítica extralaboratorio, principalmente durante la obtención de las muestras, pero también durante su transporte y procesamiento. Las causas más estudiadas están en relación con estos procesos:
Flebotomía
- •
Tipo del dispositivo de acceso vascular (catéteres frente a agujas). En las unidades hospitalarias de urgencias es muy frecuente aprovechar la colocación de un catéter para obtener muestras de laboratorio11. Éste es el principal factor mencionado en la literatura médica como causa de la alta incidencia de hemólisis en estas unidades (hasta un 13% de rechazo de muestras por el laboratorio12). En los estudios publicados, el incremento de muestras hemolizadas en relación con el uso de catéter frente a aguja es muy variable, pero claramente significativo; el 20 frente al 1%12; el 5,6 frente al 0,3%13; el 3,2 frente al 0,3%14; el 13,7 frente al 3,8%15 y el 14,01 frente al 2,01%16. El material del catéter se ha relacionado con mayor aparición de hemólisis en los de poliuretano o vialón frente a los de teflón16.
- •
Calibre de la aguja. La disminución del diámetro del dispositivo produce un aumento del flujo y de la fricción causante de la hemólisis. Experimentalmente es posible definir el flujo a partir del cual se producirá hemólisis17. El grado de hemólisis es inversamente proporcional al diámetro del catéter entre 14 y 24 G (hemólisis del 100% con 24 G15 y del 20% con 22 G18). No se observa mayor hemólisis por el uso de dispositivos de tipo “palomilla” del mismo calibre19. En hemodiálisis y otros usos de bombas de infusión deben establecerse la presión y el diámetro de la aguja que puede utilizarse sin producir hemólisis20–22.
- •
Punción con jeringa y trasvase a tubo de vacío. El uso de jeringa para la extracción y la necesidad posterior de trasvasar a tubos de vacío se ha identificado como causa de hemólisis en algún estudio9. La hemólisis se produce por la fricción en la aguja debido a excesiva presión en el émbolo durante la extracción o el trasvase y por la presencia de fugas o mal acoplamiento en las conexiones que generan flujo turbulento. El trasvase al tubo con aguja produce hasta 4 veces más hemólisis23. Los sistemas sin aguja, útiles para evitar riesgos biológicos, también pueden producir hemólisis3. Sin embargo, algunos estudios demuestran que en la extracción con catéter se observa menos incidencia de hemólisis utilizando jeringa frente a la conexión directa del catéter al tubo de vacío12,24.
- •
Lugar de la punción. La fosa antecubital es el lugar donde menos incidencia de hemólisis ocurre. La punción en mano o antebrazo aumenta su incidencia más de 3 veces18,23.
- •
Antiséptico. El alcohol utilizado en la desinfección puede provocar hemólisis25. Debe dejarse evaporar totalmente antes de la punción.
- •
Tiempo de torniquete. El torniquete debe mantenerse el tiempo indispensable para la punción y hay que evitar el aumento de presión venosa y la hemoconcentración en la muestra.
- •
Punción traumática. La punción a través de hematomas puede contaminarse con la hemoglobina liberada en los tejidos. La dificultad en canalizar la vena o el desgarro de ésta son complicaciones de la venopunción que producen deterioro de la muestra.
- •
La punción capilar siempre supone un trauma, especialmente si se masajea la zona para obtener hemorragia. La hemoglobina libre media en muestras de punción capilar en neonatos es de 2,8g/l26. El uso de dispositivos de punción automatizados disminuye el grado de hemólisis27.
- •
Tipo de tubo. Las muestras obtenidas adecuadamente mediante tubos de vacío presentan concentraciones de hemoglobina libre menores de 0,2g/l (media 0,03g/l)28. En los tubos de vacío se observa mayor incidencia de hemólisis en los tubos de mayor volumen (10ml). El uso de tubos de menor tamaño disminuye su aparición29,30.
- •
Tubo de vacío incompleto. Los tubos de vacío deben llenarse completamente para eliminar la presión negativa en su interior. Los tubos incompletos se hemolizan con más frecuencia31, especialmente durante el transporte o centrifugación32,33.
- •
Mezclado excesivo o escaso. Todos los tubos con aditivos deben mezclarse en el momento de su obtención para asegurar la correcta mezcla del aditivo (anticoagulante o procoagulante). Los fabricantes recomiendan el número de inversiones para cada tipo de tubo. El movimiento debe ser suave y los tubos de suero deben reposar posteriormente hasta su completa coagulación.
- •
Experiencia del personal que realiza la venopunción. El personal de sala hospitalaria o de las unidades de urgencias produce hasta 9 veces más hemólisis que el personal de unidades de extracción dependientes de laboratorio13,23,34,35.
Transporte
- •
Tubo neumático. El uso de tubo neumático siempre se asocia a cierto grado de hemólisis (aumento de hemoglobina de 0,04 a 0,16g/l34). Sin embargo, la mayoría de los estudios no encuentran alteración significativa en los resultados analíticos32,33,36,37 y sí una mejora notable en el tiempo de respuesta. La muestra más susceptible de hemólisis en el tubo neumático es la de suero38.
- •
Transporte por carretera. Deben asegurarse las condiciones de bioseguridad en el transporte y a la vez evitar la agitación de las muestras y los cambios bruscos de temperatura que podrían ser causa de hemólisis. Esto podría evitarse si se transportan las muestras de suero ya centrifugadas desde el lugar de origen.
Procesamiento
- •
Tiempo entre recogida y centrifugación. El contacto de los hematíes con el suero en las muestras sin separar produce un deterioro en la muestra, debido al consumo de metabolitos por las células (glucosa u oxígeno), a la difusión de líquido intracelular por el fallo de los sistemas de membrana y a la aparición de hemólisis, con un aumento de hemoglobina libre de 0,4 a 0,9g/l para suero y de 0,5 a 1,1g/l para plasma en 56h39. Los tubos de vacío con llenado incompleto son más susceptibles de experimentar deterioro31.
- •
Temperatura de centrifugación. La centrifugación en frío produce la aparición de hemólisis40, por lo que sólo debe utilizarse para las determinaciones que la precisen.
- •
Fuerza centrífuga. Los tubos deben centrifugarse según las indicaciones del fabricante para conseguir una adecuada separación, especialmente cuando se utilizan barreras de gel. Debe establecerse la fuerza y el tiempo adecuados para conseguir una correcta separación sin provocar hemólisis, así como asegurar un correcto mantenimiento de las centrífugas.
- •
Fallos en la barrera de separación. En algunos casos se han documentado fallos en el funcionamiento del gel separador, por ejemplo, debido a hiperproteinemia o presencia de contrastes yodados que provocan la falta de separación efectiva del suero con el consiguiente riesgo de deterioro.
- •
Centrifugación de muestras parcialmente coaguladas. Debe esperarse a que las muestras de suero estén completamente coaguladas antes de centrifugar (15min en tubos con aditivo de sílice).
- •
Recentrifugación. Nunca debe recentrifugarse una muestra, ya que se produce el ascenso del suero retenido en el paquete celular41.
Las guías de práctica clínica y las revisiones disponibles2,42,43 pueden ser de gran utilidad a la hora de estandarizar estos procedimientos. En la tabla 3 se resumen, a modo de ejemplo, las recomendaciones específicas para evitar hemólisis, recogidas en los documentos H3 y H18 del Clinical and Laboratory Standards Institute (CLSI)44,45.
Tabla 3.Resumen de recomendaciones del Clinical and Laboratory Standards Institute para evitar la aparición de hemólisis durante la toma de muestras
Documento H3-A6. Procedimiento para la toma de muestras de sangre por venopunción44 - •
Después de limpiar con antiséptico, dejar secar el sitio al aire
- •
Nunca extraer sangre a través de un hematoma
- •
Si se usa jeringa/aguja, asegurar que están acopladas adecuadamente para evitar formación de espuma.
- •
Si se usa jeringa, evitar tirar con excesiva fuerza del émbolo
- •
Invertir suavemente los tubos para mezclar los aditivos. No agitar
- •
Si se utilizan dispositivos de acceso vascular, asegurar la compatibilidad de los componentes para evitar fugas, que producen hemólisis y error en el volumen de los tubos.
Documento H18-A3. Procedimiento para el tratamiento y procesamiento de muestras de sangre45 - •
Se recomienda un límite máximo de 2 h para la centrifugación de muestras de suero o plasma.
- •
Todos los tubos que contengan aditivos deben invertirse suavemente para mezclar el contenido
- •
Las muestras de suero deben estar completamente coaguladas antes de centrifugar. Los especímenes anticoagulados pueden centrifugarse de inmediato.
- •
No deben refrigerarse/recogerse en frío las muestras para electrólitos.
- •
El transporte debe efectuarse a temperatura ambiente (excepto muestras en frío), en posición vertical y sin agitar para minimizar la hemólisis.
- •
Se recomienda evaluar en cada laboratorio el efecto del transporte en tubo neumático.
- •
Criterios para el rechazo de tubos según el criterio profesional (supervisor/director de laboratorio)
- ○
Hemólisis. Teniendo en cuenta la posibilidad de hemólisis in vivo que debe notificarse si la hemólisis persiste en varias extracciones.
- ○
- •
No se recomienda usar aplicadores para desprender coágulos, ya que provoca hemólisis en la muestra.
- •
Centrifugación. Atender a las recomendaciones del fabricante. No recentrifugar (elevación de potasio)
- •
La legislación europea (Council Directive 98/79/EC46) indica que el fabricante debe incluir de manera obligatoria en la documentación de los productos para diagnóstico in vitro la información acerca de las interferencias relevantes. La guía del CLSI, Interference Testing in Clinical Chemistry (CLSI EP07-A247), es la principal fuente de estandarización para la evaluación de las interferencias por parte de los proveedores de equipos de laboratorios. Respecto a la hemólisis, recomienda evaluarla siempre, al menos en 2 concentraciones distintas, ya que la interferencia por hemólisis puede provocarse por varios mecanismos sobrepuestos, y efectuar estudios dosis-respuesta (interferogramas) si se detecta un efecto significativo.
Debe tenerse en cuenta que en la hemólisis se libera un conjunto de sustancias, que en algunos casos no tienen efecto interferente conocido aunque se altere notoriamente su concentración en plasma (por ejemplo el potasio [K], un analito que está donde no debe, pero que no tiene interferencia en su detección ni la produce en la de otros), si bien es cierto que en otros casos se comportan como verdaderos interferentes. La hemoglobina puede producir interferencia química o espectrofotométrica en muchas determinaciones. El magnesio interfiere con algunos métodos de determinación de calcio o el adenosin monofosfato cíclico (AMPc) con la determinación de creatinfosfocuinasa (CPK).
Es importante tener en cuenta que cuando se valora el grado de hemólisis por la concentración de hemoglobina libre sérica, la hemoglobinemia no siempre es proporcional a la aparición de otro contenido eritrocitario en plasma. Hay 3 aspectos para tener en cuenta:
- •
En la hemólisis in vivo sólo aparecen en plasma los componentes de alto peso molecular (hemoglobina o LDH). En la hemólisis in vitro el contenido intraeritrocitario íntegro se diluye en el plasma de la muestra.
- •
La concentración de hemoglobina intraeritrocitaria es un parámetro variable en la población. La misma cantidad de hemoglobina liberada puede acompañarse de una concentración variable de otros componentes. Los hematíes de un paciente con anemia macrocítica contienen menor proporción de hemoglobina en relación con el resto de los constituyentes.
- •
Hay condiciones que pueden producir una difusión de componentes eritrocitarios, sin rotura del hematíe. El frío altera el funcionamiento de la bomba sodio (Na)/K en la membrana del hematíe y produce hiperpotasemia ficticia en las muestras conservadas en frío48.
Por estos motivos sería especialmente recomendable efectuar siempre estudios dosis-respuesta para evaluar la interferencia por hemólisis, efectuando estudios separados de la influencia de la hemólisis (útiles para valorar el efecto producido durante la hemólisis in vitro) y de la hemoglobina (que simula el efecto de la hemólisis in vivo). Blank49 estudia la interferencia que provoca la adición de hemoglobina purificada y encuentra interferencia en proteínas, albúmina, aspartato-aminotransfersa (AST) y bilirrubina directa, pero no en K o LDH.
En los interferogramas realizados con adición de hemolizado es importante tener en cuenta la forma de preparación, que debe simular la rotura de una cierta cantidad de hematíes previa a la centrifugación de la muestra. Esto produce tanto la aparición de componentes intracelulares como un aumento del volumen plasmático. El CLSI recomienda un experimento que utiliza hemolizado, producido por congelación-descongelación de hematíes lavados que se añade a una mezcla de suero. Para conseguir varios grados de hemólisis se hacen diluciones proporcionales entre la mezcla sin hemolizado y la mezcla con hemolizado. En esta preparación, la mezcla libre de hemolizado se iguala en volumen con utilización de solución salina isotónica. Esto supone cierta distorsión respecto al proceso de hemólisis in vitro. Otros autores50 hacen experimentos a partir de hemolizado de sangre total y generan distintos grados de hemólisis al mezclar con suero obtenido en la misma extracción. Este procedimiento imita de forma más adecuada el fenómeno de hemólisis in vitro.
Métodos de detección de la hemólisisComo se ha comentado anteriormente, la detección visual de hemoglobina libre es poco fiable. Tanto para la realización de estudios de interferencia, como para la detección y cuantificación de hemólisis en las muestras para diagnóstico, sería recomendable utilizar sistemas automatizados que permitan la estandarización del procedimiento.
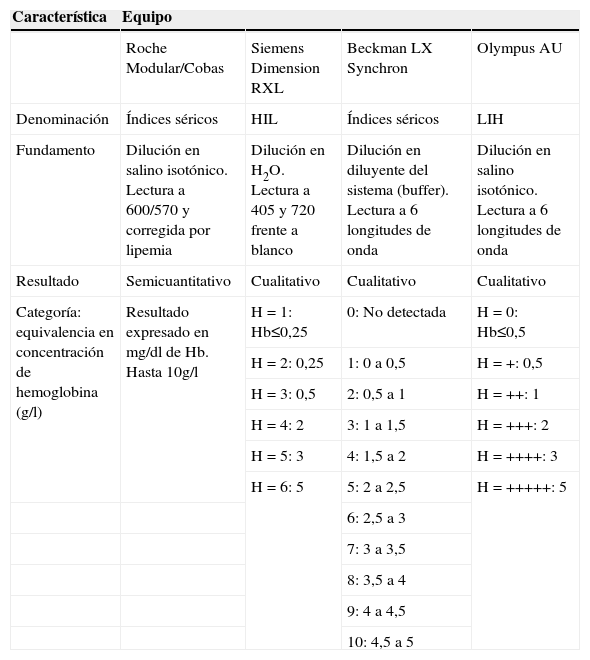
El método de referencia para la determinación de hemoglobina es el cianometahemoglobina (HiCN). Existe un estándar internacional de HiCN y se mantiene la recomendación de utilizarlo para evaluar métodos alternativos, aunque la mayoría de los analizadores hematológicos utilizan en la actualidad métodos sin cianuro. El característico espectro de absorción de la hemoglobina (fig. 1) permite la cuantificación espectrofotométrica directa29, utilizada ampliamente en cooximetría51. Basados en estas técnicas, la mayoría de los autoanalizadores de química clínica disponen de sistemas para estimar la concentración de hemoglobina en la muestra a partir de mediciones a distintas longitudes de onda. El término “índices séricos” engloba distintos sistemas patentados para valorar la presencia de hemólisis, ictericia o turbidez en la muestra. En el caso de la hemoglobina, múltiples estudios han demostrado la concordancia de esta determinación con la hemoglobina medida por otros métodos40,49,52. En general, los índices séricos ofrecen una información cualitativa o semicuantitativa a partir de la medición de una alícuota de la muestra diluida. Las muestras se clasifican en categorías numéricas correspondientes a un intervalo de concentración de hemoglobina estimada que generalmente cubre el rango entre 0,25 a 10g/l. En la tabla 4 se recogen las características de los “índices séricos” en los equipos más utilizados según el programa de garantía de la calidad para los laboratorios clínicos de la Sociedad Española de Bioquímica Clínica y Patología Molecular (SEQC). Los índices séricos tienen algunas limitaciones:
- •
Ningún fabricante suministra calibradores y controles para el índice sérico, lo que impide valorar sus prestaciones analíticas.
- •
Existen interferencias cruzadas. Tanto las muestras ictéricas como las lipémicas interfieren en el índice de hemólisis; en general, la ictericia intensa hace que se infraestime y la lipemia que se sobrestime.
- •
Consumo de tiempo de proceso del analizador y necesidad de reactivos específicos en algún caso.
Características del método de cuantificación de hemoglobina en plasma en los analizadores de química clínica más referidos en el programa de evaluación de la calidad de la Sociedad Española de Química Clínica
| Característica | Equipo | |||
| Roche Modular/Cobas | Siemens Dimension RXL | Beckman LX Synchron | Olympus AU | |
| Denominación | Índices séricos | HIL | Índices séricos | LIH |
| Fundamento | Dilución en salino isotónico. Lectura a 600/570 y corregida por lipemia | Dilución en H2O. Lectura a 405 y 720 frente a blanco | Dilución en diluyente del sistema (buffer). Lectura a 6 longitudes de onda | Dilución en salino isotónico. Lectura a 6 longitudes de onda |
| Resultado | Semicuantitativo | Cualitativo | Cualitativo | Cualitativo |
| Categoría: equivalencia en concentración de hemoglobina (g/l) | Resultado expresado en mg/dl de Hb. Hasta 10g/l | H = 1: Hb≤0,25 | 0: No detectada | H = 0: Hb≤0,5 |
| H = 2: 0,25 | 1: 0 a 0,5 | H = +: 0,5 | ||
| H = 3: 0,5 | 2: 0,5 a 1 | H = ++: 1 | ||
| H = 4: 2 | 3: 1 a 1,5 | H = +++: 2 | ||
| H = 5: 3 | 4: 1,5 a 2 | H = ++++: 3 | ||
| H = 6: 5 | 5: 2 a 2,5 | H = +++++: 5 | ||
| 6: 2,5 a 3 | ||||
| 7: 3 a 3,5 | ||||
| 8: 3,5 a 4 | ||||
| 9: 4 a 4,5 | ||||
| 10: 4,5 a 5 |
Hb: hemoglobina.
El laboratorio debe definir previamente para cada magnitud la diferencia respecto al valor real que se considera como un error significativo. Una vez definida, se puede localizar en un interferograma el grado de hemólisis que lo produce.
La definición de error significativo puede variar entre laboratorios, y dependerá de las especificaciones de calidad que el propio laboratorio se marque en cuanto a imprecisión, error sistemático o error total, independientemente del origen del error.
Un problema adicional en las muestras hemolizadas es que se observa un aumento importante de la imprecisión en muchas de las determinaciones habituales en muestras con hemólisis importante50. Para calcular el error total en una determinación afectada por la hemólisis no se puede aplicar la imprecisión calculada en muestras no hemolizadas.
Los primeros estudios publicados sobre el efecto de la hemólisis53 consideraban como significación clínica un 10% de variación sobre el resultado de la muestra sin interferente. Este criterio, utilizado por muchos fabricantes en sus estudios de evaluación, es más permisivo en las magnitudes con pequeña variabilidad biológica y puede ser menos permisivo en aquéllas con elevada variabilidad intraindividual o interindividual. La mayoría de los estudios publicados recientemente sobre significación de la hemólisis utilizan criterios de error sistemático o imprecisión deseable, basados en estudios de variabilidad biológica54.
La comisión de interferencias de la SEQC (documento D55 y E56) propone definir de forma separada la interferencia analíticamente significativa según establece la International Union of Pure and Applied Chemistry (IUPAC) (>3 desviaciones estándar de la imprecisión intraserial) y sólo considerarla clínicamente significativa si además supera la mitad del coeficiente de variación biológico intraindividual (imprecisión deseable). Se recomienda estudiar las concentraciones críticas para cada magnitud biológica. Hay algún estudio57 que utiliza este criterio. Otros estudios58,59 aplican la imprecisión deseable, pero la definen como analíticamente significativa y reservan el término clínicamente significativa para criterios basados en la opinión de expertos.
La OMS, en base a recomendaciones de la Sociedad Alemana de Química Clínica4, define interferencia clínicamente relevante cuando supera el error sistemático deseable. Varios estudios50,60 utilizan este mismo criterio.
El CLSI EP-07A, respecto a significación clínica, propone varias aproximaciones, sin decantarse claramente por ninguna; criterios basados en variabilidad biológica, consenso de expertos o variabilidad analítica.
Respecto a las magnitudes afectadas por la hemólisis, de modo general se puede hablar de determinaciones que se sobreestiman incluso en muestras ligeramente hemolizadas (menos de 1g/l de hemoglobina), difíciles de detectar de forma visual. Son magnitudes con elevada concentración intraeritrocitaria como LDH, AST y K. Otras, con concentración eritrocitaria diferente a la plasmática se afectan solamente con hemólisis de mayor grado. Es el caso del magnesio, la alanina-aminotransferasa (ALT), las proteínas totales y el fósforo que se sobreestiman o el Na que se infraestima. En algunas, frecuentemente mencionadas como afectadas, es posible que predomine un efecto interferente real debido a componentes eritrocitarios, como la CPK, el hierro, la bilirrubina, fosfatasa alcalina, Gamma Glutamil transpeptidasa (GGT) o la urea. En estos casos, la existencia de interferencia dependerá mucho del método analítico utilizado. En cualquier caso, es recomendable que cada laboratorio verifique la información que los proveedores suministran respecto a las interferencias por hemólisis en las condiciones reales de trabajo.
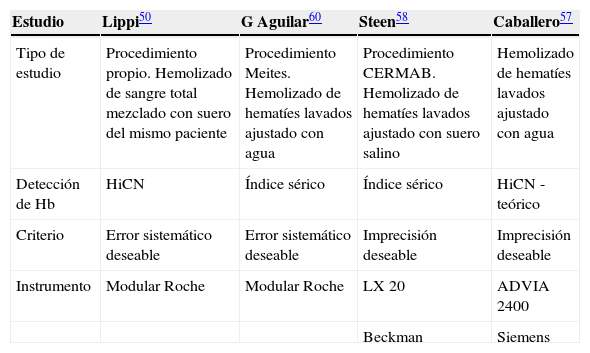
En la tabla 5 se presenta un resumen de algunos estudios recientes indicando las magnitudes afectadas por la hemólisis y el punto de corte (como concentración de hemoglobina libre en suero) a partir del cual se define la existencia de hemólisis significativa. Se indica el tipo de estudio de interferencia, la forma de detección de hemólisis y el criterio de significación utilizado.
Comparación del efecto de la hemólisis sobre determinaciones habituales en química clínica descrito en 4 estudios recientes
| Estudio | Lippi50 | G Aguilar60 | Steen58 | Caballero57 |
| Tipo de estudio | Procedimiento propio. Hemolizado de sangre total mezclado con suero del mismo paciente | Procedimiento Meites. Hemolizado de hematíes lavados ajustado con agua | Procedimiento CERMAB. Hemolizado de hematíes lavados ajustado con suero salino | Hemolizado de hematíes lavados ajustado con agua |
| Detección de Hb | HiCN | Índice sérico | Índice sérico | HiCN -teórico |
| Criterio | Error sistemático deseable | Error sistemático deseable | Imprecisión deseable | Imprecisión deseable |
| Instrumento | Modular Roche | Modular Roche | LX 20 | ADVIA 2400 |
| Beckman | Siemens | |||
| Determinación | Efecto (punto de corte de hemólisis a partir del cual se observa, expresado como g/l de Hb) | |||
| Na | ↓ (0,2) | ↔ | ||
| K | ↑ (0,2) | ↑ (0,5) | ↑ (0,3) | |
| Cl | ↔ | ↔ | ||
| BUN/urea | ↑ (2) | ↔ | ↔ | ↑ (3,7) |
| Glucosa | ↓ (10) | ↔ | ↔ | ↔ |
| Colesterol | ↔ | ↑ (2) | ↑ (5) | |
| Triglicéridos | ↔ | ↑ (2) | ↔ | |
| Ácido úrico | ↔ | ↑ (1) | ↓ (5) | ↔ |
| Calcio | ↔ | ↔ | ↔ | ↔ |
| Fósforo | ↑ (2,5) | ↔ | ↑ (2) | ↑ (0,7) |
| Magnesio | ↑ (1,3) | ↑ (2) | ↑ (1,5) | |
| Proteínas totales | ↔ | ↑ (1) | ↑ (3,7) | |
| AST | ↑ (0,2) | ↑ (0,5) | ↑ (0,5) | ↑ (0,7) |
| ALT | ↑ (2,5) | ↑ (1) | ↑ (5) | ↑ (3,7) |
| GGT | ↓ (2,5) | ↓ (1) | ↑ (2) | ↔ |
| LDH | ↑ (0,2) | ↑ (0,5) | ↑ (0,3) | |
| FAL | ↓ (2,5) | ↑ (1) | ↓ (0,5) | ↓ (3,7) |
| CK | ↑ (0,2) | ↑ (1) | ↑ (3,7) | |
| Albúmina | ↓ (2,5) | ↔ | ↑ (1) | |
| Hierro | ↑ (0,6) | ↑ (0,5) | ↓ (5) | ↑ (0,5) |
| Creatinina | ↑ (1,3) | ↔ | ↓ (0,5) | ↔ |
| Bilirrubina | ↔ | ↑ (0,5) | ||
| Amilasa | ↑ (1) | ↔ | ||
Entre paréntesis está el punto de corte (en g/l de Hg) que define el error significativo producido por la hemólisis.↓: infraestimación; ↑: sobreestimación; ↔: sin efecto; ALT: alanina-aminotransferasa; AST: aspartato-aminotransfersa; BUN: nitrógeno ureico CPK: creatinfosfocinasa; FAL: fosfatasa alcalina; GGT: gammaglutamil transpeptidasa; Hb: hemoglobina; HiCN: cianometahemoglobina; LDH: lactatodeshidrogenasa.
Aunque no se trata en esta revisión, la hemólisis puede producir interferencia, tanto en las técnicas de inmunoanálisis61 como en las de coagulación62-64.
Actuación ante muestras hemolizadasAnte una muestra hemolizada, es conveniente tener en cuenta su posible origen in vivo o in vitro.
Aunque la hemólisis in vivo es mucho menos frecuente, no se debe olvidar que tiene significado patológico. La elevación de hemoglobina libre u otros componentes intraeritrocitarios en estos casos tiene utilidad diagnóstica. Se puede considerar incluso que su detección de forma inesperada puede servir para generar sospechas diagnósticas útiles para el clínico9. Por otro lado, el grado de hemólisis in vivo es menor que el producido por la hemólisis in vitro, por lo que la detección visual es más complicada. En la hemólisis in vivo, sólo las determinaciones interferidas por la hemoglobina están afectadas. No informar el resto de las pruebas, y dar por hecho que se trata de una hemólisis in vitro, en situaciones clínicas donde pueden ser vitales para la atención del paciente, puede suponer un conflicto para el laboratorio. Se ha publicado la imposibilidad de obtener un resultado de K, debido a la política de rechazo del laboratorio, en un paciente con una hemólisis intravascular importante64 o la veracidad de una hiperpotasemia llamativa en un contexto de hemólisis intravascular65. Por suerte, la hemólisis in vivo es mucho menos frecuente que la hemólisis in vitro y su aparición fuera del ámbito hospitalario es aún más escasa.
Por otro lado, la hemólisis in vitro es una muestra deteriorada que puede afectar a la calidad de los resultados emitidos. La preocupación por parte del laboratorio debe ser detectar su presencia y valorar si supone un motivo de rechazo para alguna de las determinaciones solicitadas.
Varias sociedades científicas han publicado guías de práctica clínica para enfrentarse al problema de la hemólisis. La Sociedad Alemana de Química Clínica promovió unas recomendaciones que se recogieron posteriormente en un documento de la OMS4. Las recomendaciones generales, en resumen, son las siguientes:
- •
Documentación de la interferencia como parte de la documentación del método. Cuando exista efecto significativo por la hemólisis deben indicarse los límites a partir de los cuales el análisis no debe realizarse.
- •
Detección visual y registro del aspecto. En caso de hemólisis debe revisarse la solicitud. En caso de encontrar magnitudes afectadas por la hemólisis deben elegirse métodos alternativos no afectados por la hemólisis o someter la muestra a pretratamiento para eliminar la interferencia. Si esto no es posible, la magnitud afectada no debe realizarse.
- •
Informe. Debe incluir un comentario con el aspecto de la muestra y el proceso al que se ha sometido. Si la interferencia no se ha podido eliminar, el resultado debe sustituirse por un texto indicando que el resultado está invalidado por la hemólisis.
- •
Distinción entre hemólisis in vivo o in vitro. Distinguibles por comparación con otras muestras del paciente obtenidas en la misma extracción. Se propone la determinación de haptoglobina, bilirrubina indirecta y reticulocitos para valorar el origen in vivo.
- •
Métodos para evitar la hemólisis. Se recomienda identificar la causa de la hemólisis y utilizar material de calidad contrastada, así como mejorar la formación del personal extractor.
El grupo italiano de calidad extraanalítica publicó en el año 2007 unas recomendaciones basadas en conferencias de consenso entre distintas disciplinas del laboratorio5. Gradúa las recomendaciones de A (muy recomendable) a E (muy desaconsejado). Sus principales puntos son los siguientes:
- •
Aumentar el nivel de formación de los profesionales implicados en la obtención, procesamiento y transporte de muestras biológicas (A).
- •
Adoptar sistemas objetivos y estandarizados para la detección de las muestras inadecuadas (A).
- •
Registrar en bases de datos la información sobre muestras deterioradas. Utilizar comentarios estandarizados en los informes (A) (B).
- •
Actuación ante muestras deterioradas debido a la presencia de interferentes.
- ○
No informar nunca muestras deterioradas sin comentario específico (A).
- ○
Considerar la interferencia como significativa cuando exceda el valor de referencia del cambio (B) o error sistemático deseable (C).
- ○
Documentar la interferencia y el método utilizado en su detección (A), especificando las magnitudes afectadas (A), el límite de decisión (B) y la solución propuesta (A).
- ○
Comunicar inmediatamente al clínico, en relación con la posibilidad de que se trate de hemólisis in vivo (A).
- ○
Las magnitudes no afectadas pueden realizarse normalmente, pero las afectadas no deben realizarse si no se consigue eliminar la interferencia (B). Los resultados deben sustituirse por un mensaje específico e indicar que no puede realizarse la determinación y solicitar una nueva muestra (B).
- ○
No se recomienda (D) utilizar correcciones matemáticas, con el comentario oportuno. Se desaconseja (E) hacer correcciones sin incluir comentarios.
- ○
Como puede observarse, la postura de ambas sociedades respecto al tratamiento de muestras hemolizadas coincide en la necesidad de definir de forma estandarizada y documentada las determinaciones afectadas, investigar de forma sistemática la presencia de hemólisis y no efectuar las determinaciones que se encuentren teóricamente afectadas, sustituyendo el resultado por un comentario promoviendo la comunicación inmediata al facultativo solicitante para descartar la posibilidad de hemólisis in vivo.
La publicación del grupo italiano recibió la respuesta inmediata de Carraro y una contrarrespuesta del autor66,67. Carraro indica el siguiente comentario en caso de hemólisis ligera: “posible sobreestimación de K, excluir hemólisis in vivo o repetir extracción”. Lippi insiste en que lo importante es la notificación y que, debido a la preponderancia de hemólisis in vitro, los comentarios de Carraro serán en su mayoría erróneos en sí mismos.
A pesar del consenso actual de las Sociedades Científicas en contra de la utilización de cálculos matemáticos para estimar la concentración “real” de ciertos constituyentes en muestras hemolizadas, su uso es controvertido. En la literatura médica hay numerosas publicaciones, tanto en el ámbito clínico como en el de los laboratorios, que proponen fórmulas de corrección69. Desde los primeros estudios de interferencias53 se habla de caracterización y corrección matemática, sobre todo para la comprobación urgente de la concentración de K en muestras hemolizadas68,69.
ConclusionesLas muestras hemolizadas son un problema importante en todos los laboratorios, máxime en los de ámbito hospitalario. Las causas principales son la obtención y transporte de las muestras. En unidades de extracción especializadas, estos procesos están más estandarizados, lo que supone una incidencia menor de muestras hemolizadas. En cambio, la extracción en unidades de hospitalización, especialmente en áreas de alta presión asistencial, genera una proporción mayor de muestras hemolizadas.
Los laboratorios deberían asegurar la detección sistemática de la hemólisis y tener establecidas las acciones que se van a tomar frente a estas muestras. Las muestras muy hemolizadas (más de 3g/l de hemoglobina en plasma) son fácilmente detectables de forma visual en la fase preanalítica. Si no es posible evitar el efecto de la hemólisis mediante tratamiento de la muestra, las determinaciones afectadas no deberían realizarse, sustituyendo el resultado por un comentario y asegurando la obtención de una nueva muestra en el plazo de tiempo adecuado para la atención del paciente.
Según la cantidad de muestras hemolizadas que se detecten al día, la notificación efectiva al solicitante y la obtención de una nueva muestra puede complicarse. Por esto, debe hacerse hincapié en las buenas prácticas de laboratorio en la extracción y procesamiento de muestras de sangre, con medidas de formación y concienciación del personal extractor, independientemente de su pertenencia o no al laboratorio.
La detección de hemólisis de bajo grado (menos de 1g/l de hemoglobina libre) no puede realizarse de forma fiable mediante revisión visual del aspecto de la muestra y algunas magnitudes (K, LDH o AST) se afectan de forma significativa con este grado de hemólisis. Por otro lado, la hemoglobina libre en plasma a estos niveles puede ser un indicador de hemólisis in vivo, útil en pacientes con prótesis endovasculares o sometidos a circulación extracorpórea. Es recomendable la utilización en los laboratorios de sistemas automatizados de cuantificación de hemoglobina sérica. Sería deseable que estos sistemas se introdujeran en los equipos preanalíticos, lo que facilitaría la revisión de todos los especímenes del paciente, útil para diferenciar hemólisis in vitro (si de varias muestras obtenidas en la misma extracción alguna no presenta hemólisis se puede excluir la hemólisis in vivo) y para tomar medidas adecuadas a cada determinación (seleccionar métodos alternativos que no se afecten por la hemólisis o efectuar pretratamiento de la muestra). En cualquier caso, la utilización de los índices séricos, disponibles en la mayoría de los equipos de bioquímica actuales, asegura una detección sistemática y fiable de estas muestras.
La significación del efecto de la hemólisis debe establecerse en cada laboratorio y para cada magnitud de acuerdo con sus propias especificaciones de calidad. La información sobre el efecto de la hemólisis en cada magnitud debe suministrarse por el fabricante de forma que cada laboratorio pueda elegir el punto de corte a partir del cual el efecto es significativo según su criterio. Para esto, deben suministrarse los datos completos de los interferogramas, así como el tipo de estudio realizado y la metodología utilizada para la cuantificación de la hemólisis.