Niveles elevados de vitamina B12 pueden ser relacionados con un alto riesgo de desarrollo de cáncer debido a una alteración de la integridad del ADN, como consecuencia del metabolismo anómalo de la cobalamina. Esto es importante para tener en cuenta la vitamina B12 como marcador tumoral inespecífico en el desarrollo de neoplasias sólidas, una vez descartadas otras patologías serias como enfermedades hematológicas, hepáticas y renales.
Se presenta el caso de un paciente con hipervitaminosis B12 y cáncer de recto.
High extreme values of B12 vitamin could be linked with high risk cáncer development throughout the DNA integrity distress because a cobalamine disfunctional metabolism. It's vital to understand the role of B12 vitamin as inespecific tumoral marker in the development of solid neoplasm when other many serious diseases as blood, liver and kidney diseases are rejected.
We report a patient case about B12 hypervitaminosis and rectum cáncer.
Se presenta el caso de un paciente de 70 años con neoplasia de recto y múltiples metástasis hepáticas, que manifestó, en los meses previos a su detección, niveles de cobalamina >1.500pg/ml (vn:180-970) como única alteración analítica y antes de referir sintomatología de tipo digestivo en forma de rectorragias intermitentes y alteración del hábito intestinal (año 2014).
Se trata de un paciente que realizó repetidas consultas, meses previos, por síndrome miccional con disuria y molestias inespecíficas en hipogastrio que no remitieron con el tratamiento convencional y la antibioterapia empírica.
Entre sus antecedentes personales se recogen: exfumador, dislipidemia, hipertensión arterial, fibrilación auricular crónica, trombosis venosa profunda, bronquítico crónico y ulcus gástrico. En tratamiento habitual con acenocumarol, verapamilo 80, ranitidina 150, atorvastatina 40 y bromuro de aclidinio inhalador.
En la exploración se aprecia un buen estado general, con un abdomen blando sin masas ni megalias. Para descartar sintomatología neurológica derivada de un posible déficit de cobalamina se efectúa una primera aproximación analítica, que arroja, en cambio, cifras elevadas >1.500 pg/ml, con el resto de parámetros en rangos normales (fólico, antígeno sérico prostático, sistemático de orina, hormonas tiroideas, hematimetría y función hepatorrenal).
Con posterioridad, el paciente empieza a referir emisión de sangre roja y con coágulos en las heces, por lo que se efectúa un tacto rectal, apreciándose una formación úlcero-vegetante a unos 4cm de margen anal.
En la analítica ulterior se obtiene un antígeno carbohidrato 19.9 (CA19,9): 479U/ml (vn 0-37), proteína C reactiva: 15mg/l (vn 0-10), con antígeno carcinoembrionario y CA125 normales.
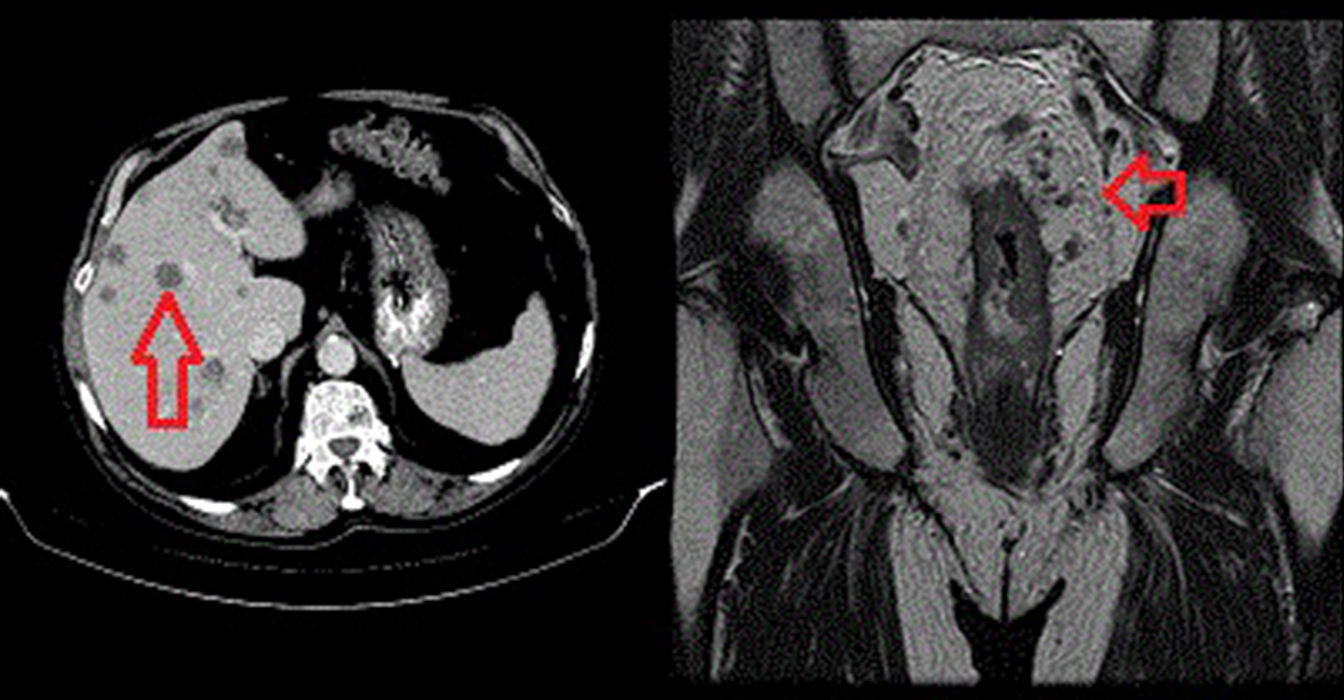
Se deriva al servicio de digestivo, que solicita tomografía (TC) toracoabdominal con contraste apreciándose un engrosamiento de la pared del recto de 7cm, compatible con neoplasia a dicho nivel, múltiples lesiones focales hepáticas (más de 20), hipodensas, localizadas en ambos lóbulos —las mayores de 2cm—, compatibles con metástasis y adenopatías locorregionales en espacio perirrectal (fig. 1).
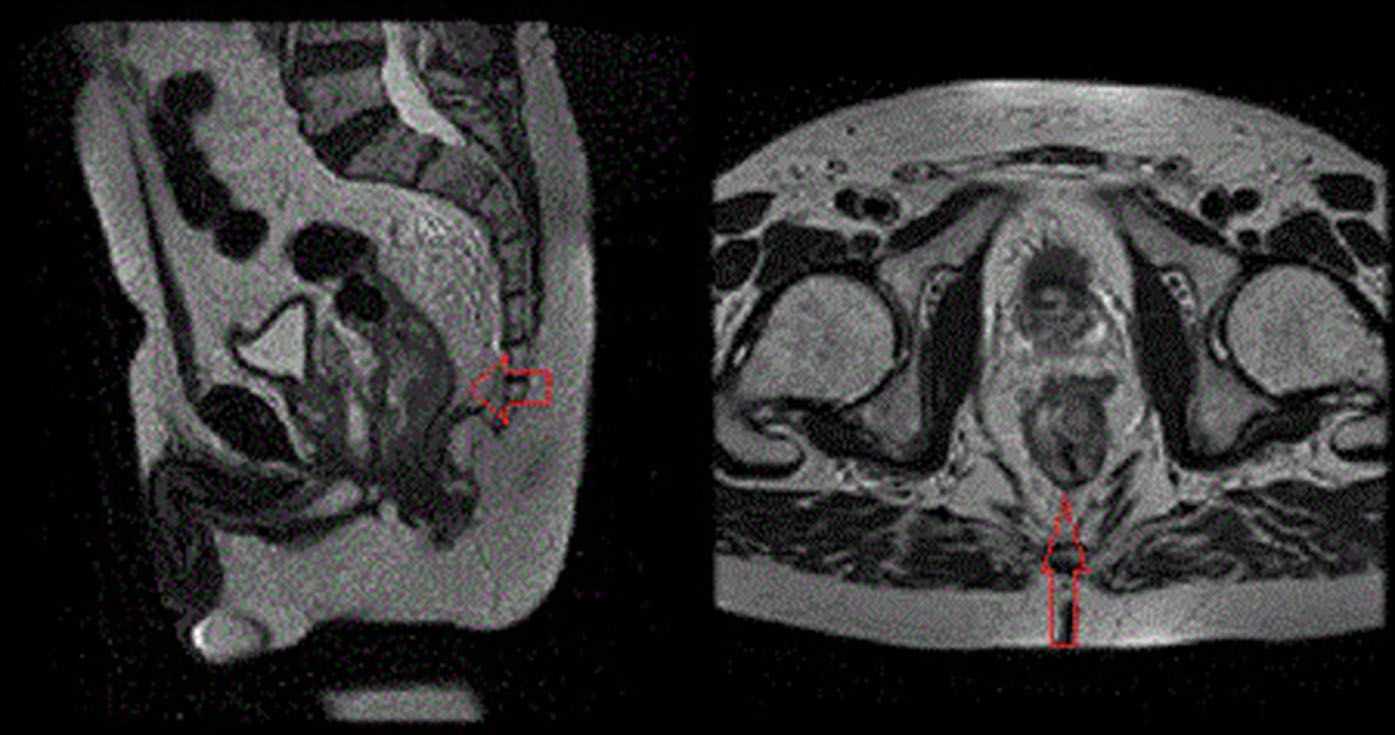
La resonancia magnética (RM) de pelvis con contraste cataloga el adenocarcinoma de recto medio en estadio IV (T4b N2 MX) con múltiples metástasis hepáticas bilobares (figs. 1 y 2).
En el servicio de oncología se hace un abordaje inicial con quimioterapia (QT) neoadyuvante esquema Xelox / 7 ciclos, con controles de progresión para valorar la resecabilidad de la lesión y el intento de cirugía hepática.
A los 6 meses (año 2015), un nuevo TC y RM de control de la respuesta a quimioterapia muestran una significativa reducción del volumen y la infiltración con respecto al examen previo, por lo que se realiza un ingreso programado para intervención, previa aceptación por el comité de cáncer colorrectal.
Ante los hallazgos ecográficos y anatomopatológicos intraoperatorios, que no demuestran enfermedad activa, se decide la amputación abdominoperineal de adenocarcinoma infiltrante moderadamente diferenciado que invade muscular propia (tercio inferior de recto) sin evidencia de metástasis en las adenopatías aisladas, y se practica una colostomía iliaca izquierda terminal.
A los 2 meses de la intervención, la cobalamina sigue >1.500pg/ml. Además, el paciente sufre una anemización transitoria (resuelta con ferroterapia oral): Hb 10,9g/dl (vn: 13,2-16,8), RDW 16,3% (vn: 12-14,6) y ferritina 18ng/ml (vn: 20-300). En la analítica también se refleja FA 152U/l (vn: 30-120) y GGT 128U/l (vn: 0-55), así como hipertiroidismo subclínico transitorio, con TSH <0,01mUI/l (vn: 0,4-5,9), T4 libre 1,92ng/dl (vn: 0,57-1,53) y T3 libre 6,4pmol/l (vn: 1,9-6), resuelto espontáneamente en menos de un mes. Por otra parte, las exploraciones de imagen con TC y RM sugieren un aumento de tamaño de las metástasis hepáticas.
Se plantea, entonces, una nueva intervención quirúrgica, a los 6 meses de la primera, objetivándose en el acto terapéutico signos macroscópicos de carcinomatosis e implantes peritoneales múltiples metastásicos. Ante dichos hallazgos se considera irresecable la enfermedad hepática y se cierra la laparotomía. La anatomía patológica de las biopsias intraoperatorias resuelven hacia infiltración metastásica por adenocarcinoma colorrectal en hígado con inflamación crónica granulomatosa necrosante.
Se programa de nuevo reinicio de QT paliativa con pauta Aflibercept + FOLFIRI quincenal en 6 ciclos (año 2016), tras la buena respuesta de la pauta previa (Xelox), a pesar de la persistencia de neuropatía grado II en las manos y los pies. Y se coloca un implante de reservorio intravenoso en subclavia izquierda (dispositivo Celsite ST201G), que es bien tolerado por el paciente salvo por acusar una evidente disfonía. Ante el desarrollo de una posible paresia recurrencial derecha se evalúa el tórax superior para descartar tumor a ese nivel. También se consulta el TC efectuado tras el tratamiento con QT (a los 3 meses), que no ofrece signos de progresión de enfermedad, no obstante las lesiones metastásicas hepáticas.
Se decide continuar con el tratamiento hasta comentar el caso con el comité de tumores y valorar la opción de radiofrecuencia o cirugía, previa realización de tomografía de emisión de positrones (PET), para descartar metástasis a otros niveles. Y, en caso de no haber opción de tratamiento local, seguir efectuando controles o cambiar a mantenimiento con capecitabina.
En la analítica persisten los valores >1.500pg/ml de B12, fosfato 4,48mg/dl (vn: 2,3-3,7) y uratos 10,3mg/dl (vn: 3,5-7,2), con marcadores tumorales y fólico normales.
Actualmente el paciente se mantiene con buena calidad de vida, con un resultado de PET normal, y en vigilancia a través de un programa de controles seriados.
DiscusiónHabitualmente la cobalamina es medida para controlar su deficiencia. Entre un 7 y un 18% de los casos1-3 encontramos una elevación de sus niveles, lo cual suele relacionarse con patologías serias, así como con un alto riesgo de padecer y/o desarrollar cáncer4,5. Esto es importante a la hora de tener en cuenta la cobalamina como marcador tumoral inespecífico5-7 y precoz para neoplasias sólidas, una vez descartadas enfermedades hematológicas2, hepáticas4 o renales, y tanto como factor diagnóstico como pronóstico8. Algunos estudios correlacionan hipercobalaminemia con disminución de la supervivencia6,8,9.
Solo alrededor del 1% de la cobalamina se encuentra en forma libre. La forma activa (aproximadamente un 20%), con acceso intracelular, circula unida a su transportador específico, la transcobalamina II (TCBII), cuya producción es hepática, fundamentalmente, y endotelial, monocítica o intestinal secundariamente. El complejo circulante cobalamina-TCB forma la holotranscobalamina3,7 (HTC). La cobalamina restante (alrededor de 80%) se une a TCBI y III de origen granulocítico6,7, y pertenecientes a la familia de haptocorrinas (HC), también llamadas cobalofilinas o R-binders.
El aumento de cobalamina tiene distintos orígenes7: a) incremento de proteínas transportadoras en neoplasias hematológicas (HC) y en sólidas (TCBII); b) liberación masiva de los reservorios del hígado en la enfermedad hepática, a la vez que disminuye la síntesis del transportador esencial, TCBII; c) disminución de la filtración y acumulación sérica de TCBII en la enfermedad renal3; d) iatrogenia, fundamentalmente por reposición parenteral (con el posible desarrollo de autoanticuerpos anti-TCMII que disminuyen su aclaramiento); e) disminución de la biodisponibilidad de TCB (de origen genético) o bien limitación en la afinidad de la unión TCB-B12; f) aumento del receptor soluble celular de TCBII (sCD320), y g) idiopático10. También puede ser debido a enfermedades autoinmunes, infecciosas (TCBII actúa como reactante de fase aguda), a la enfermedad de Gaucher, a anomalías hematológicas transitorias y a la sobreproducción bacteriana.
La vitamina B12 participa en 2 reacciones químicas esenciales1,11. En una, catalizada por la metionina sintasa, actúa como cofactor en una doble vía metabólica: una desmetilación para la obtención de tetrahidrofolato, y una metilación de homocisteína para formar metionina; en ambas desempeña un importante papel en la síntesis de las bases del ADN. En la otra, a través de la metil malonil coenzima A mutasa, interviene en la isomerización del metil malonil CoA a succinil-CoA, imprescindible para la formación de los ácidos grasos de las vainas de mielina. Una consecuencia de cambios en sus niveles es una alteración en la replicación celular11, que se manifestará en tejidos de alto recambio como la mucosa gastrointestinal12, entre otros. Las reservas pueden alcanzar hasta 5 años13, por lo que no es esperable una reducción significativa en el tiempo de estudio efectuado del presente caso. Por otra parte, la existencia de metástasis hepáticas constituyen otro motivo de hipervitaminosis (hasta en el 30-40%)1,7,13.
Altos niveles de cobalamina, según estándares biológicos, se definen por valores mayores al límite alto del intervalo de referencia del laboratorio: 180-970pg/ml (rebasados ampliamente de forma repetida por el paciente). El método de medida utilizado, en el analizador DXI-800® de Beckman Coulter, es un inmunoanálisis de quimioluminiscencia con partículas paramagnéticas.
Aunque no es el presente caso, suceden situaciones de déficit funcional y cualitativo por cuadros carenciales a nivel intracelular concomitantes con tasas circulantes elevadas de vitamina B12. Suelen generarse a expensas de HC con disminución de HTC14 (e incremento de homocisteína y ácido metilmalónico). En dichas circunstancias sería más preciso referir hipervitaminemia en vez de hipervitaminosis1.
ConclusionesSe debe evitar subestimar la hipervitaminemia B12, o simple incremento en plasma de cobalamina, antes de su transformación en hipervitaminosis B121. La cobalamina puede comportarse como un indicador de alerta en pacientes aparentemente asintomáticos o que minimicen un determinado tipo de síntoma, para adelantarnos en un rastreo que, es posible, acabe con la detección e identificación de neoplasias8,12, una vez descartadas otras etiologías15. También es factor predictivo8-10 de mal pronóstico, y, en el caso de pacientes con carcinomas ya diagnosticados, de progresión tumoral15.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.