El Mieloma Múltiple (MM) IgD es una entidad compleja que representa menos del 2% de los casos de pacientes con MM. En este estudio describimos las características clínicas y analíticas de una serie de cinco pacientes diagnosticados con MM IgD en nuestro área geográfica destacando la importancia de los hallazgos del laboratorio clínico en el estudio de estos pacientes. La serie de pacientes se caracterizó por una prevalencia del género masculino, con una edad comprendida entre 50 y 83 años y un predominio de la cadena ligera monoclonal lambda. Al diagnóstico, todos los pacientes presentaron fallo renal agudo y lesiones óseas características de la enfermedad.
IgD Multiple Myeloma (MM) is a rare entity that affects less than 2% of patients with MM. The aim of this study is to describe the clinical and analytical findings in five patients diagnosed with IgD MM in our geographic area. Furthermore, the relevance of clinical laboratory findings in the diagnostic protocol for these patients is demonstrated. The majority of patients studied were males, with ages ranging from 50 to 83 years, and a predominance of lambda light chain. At diagnosis, all the patients were shown to have impaired renal function and bone lesions characteristic of the disease.
Desde la descripción del primer caso en el año 1965 por Rowe y Fahey, el mieloma múltiple (MM) IgD se considera una entidad rara dentro de las gammapatías monoclonales y representa menos del 2% del total de casos de MM1. Se caracteriza por un curso agresivo y un peor pronóstico en comparación con los MM de tipo IgA e IgG con una mediana de supervivencia comprendida entre uno y dos años2,3. Reflejo de este curso agresivo es la presencia de complicaciones de la enfermedad al momento del diagnóstico como plasmocitomas extramedulares, riñón de mieloma y amiloidosis. Todos estos hallazgos convierten al MM IgD en una entidad única y compleja. El objetivo de nuestro estudio consiste en describir las características clínicas y analíticas de los pacientes diagnosticados con MM IgD en nuestra área geográfica (sur de España) y destacar el papel fundamental que desempeña el laboratorio clínico en el estudio de estos pacientes.
Materiales y métodosEstudio retrospectivo formado por cinco pacientes diagnosticados con MM IgD durante el periodo de tiempo comprendido entre mayo de 2011 a mayo de 2016. El proteinograma o electroforesis en suero (SPE) se realizó en el analizador Capillarys (Sebia), la inmunofijación en suero (IFE) se obtuvo con el sistema Hydrasys (Sebia) y las cadenas ligeras libres (CLL) en suero se cuantificaron en un analizador SPA PLUS (The Binding Site). El resto de variables bioquímicas del estudio se determinaron en un analizador COBAS 6000 (Roche) mientras que el hemograma se realizó en un analizador Sysmex XE-5000 (Roche). Todas las variables clínicas y analíticas incluidas en el estudio son variables que se realizan de forma rutinaria en el estudio y seguimiento de los pacientes con MM. Por ello, no se solicitó el consentimiento informado a los pacientes al ser un estudio retrospectivo basado en práctica clínica asistencial habitual.
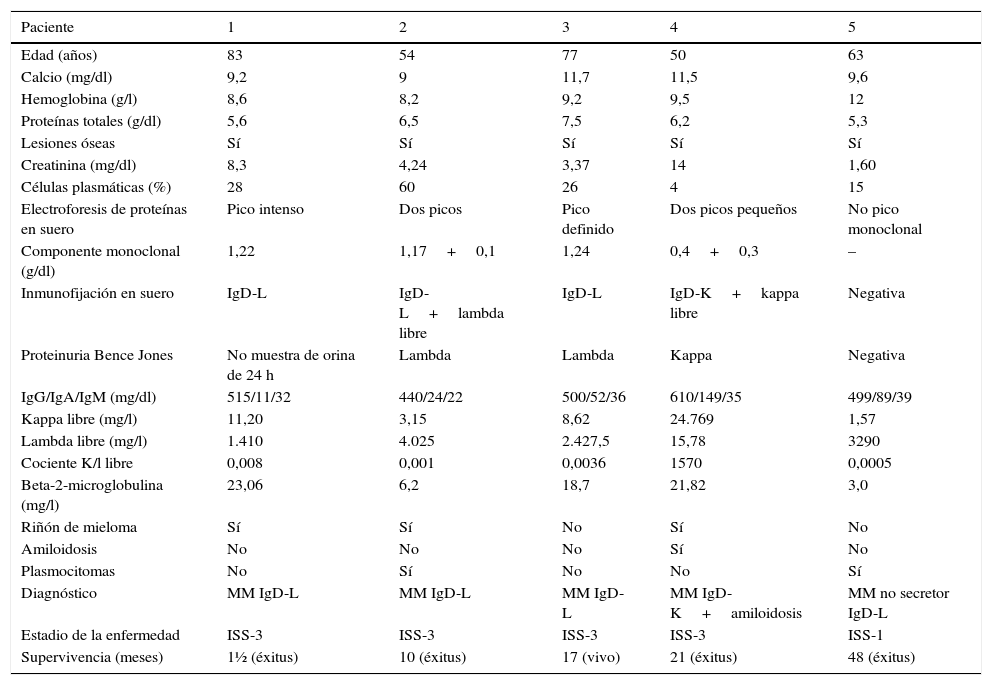
ResultadosNuestra serie estuvo formada por cinco pacientes diagnosticados de MM IgD: cuatro hombres y una mujer, con una edad comprendida entre 50 y 83 años (mediana de edad de 63 años). Las características clínicas y analíticas de los pacientes se exponen en la tabla 1. Al diagnóstico, todos los pacientes presentaron lesiones óseas características de la enfermedad que fueron identificadas por pruebas de imagen (rayos-X, resonancia magnética y/o PET/TAC) y a todos ellos se les detectó un fallo renal agudo (mediana de creatinina de 3,37g/dl). La hipercalcemia estuvo presente en dos pacientes mientras que cuatro pacientes presentaron anemia. El porcentaje de células plasmáticas en el aspirado de médula ósea fue superior al 10% en todos los pacientes excepto en uno de ellos donde fue del 4% (paciente 4 en tabla 1). La mediana del porcentaje de células plasmáticas en médula ósea de la serie de pacientes fue del 26%.
Características clínicas y analíticas de los pacientes con MM IgD
| Paciente | 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|---|
| Edad (años) | 83 | 54 | 77 | 50 | 63 |
| Calcio (mg/dl) | 9,2 | 9 | 11,7 | 11,5 | 9,6 |
| Hemoglobina (g/l) | 8,6 | 8,2 | 9,2 | 9,5 | 12 |
| Proteínas totales (g/dl) | 5,6 | 6,5 | 7,5 | 6,2 | 5,3 |
| Lesiones óseas | Sí | Sí | Sí | Sí | Sí |
| Creatinina (mg/dl) | 8,3 | 4,24 | 3,37 | 14 | 1,60 |
| Células plasmáticas (%) | 28 | 60 | 26 | 4 | 15 |
| Electroforesis de proteínas en suero | Pico intenso | Dos picos | Pico definido | Dos picos pequeños | No pico monoclonal |
| Componente monoclonal (g/dl) | 1,22 | 1,17+0,1 | 1,24 | 0,4+0,3 | – |
| Inmunofijación en suero | IgD-L | IgD-L+lambda libre | IgD-L | IgD-K+kappa libre | Negativa |
| Proteinuria Bence Jones | No muestra de orina de 24 h | Lambda | Lambda | Kappa | Negativa |
| IgG/IgA/IgM (mg/dl) | 515/11/32 | 440/24/22 | 500/52/36 | 610/149/35 | 499/89/39 |
| Kappa libre (mg/l) | 11,20 | 3,15 | 8,62 | 24.769 | 1,57 |
| Lambda libre (mg/l) | 1.410 | 4.025 | 2.427,5 | 15,78 | 3290 |
| Cociente K/l libre | 0,008 | 0,001 | 0,0036 | 1570 | 0,0005 |
| Beta-2-microglobulina (mg/l) | 23,06 | 6,2 | 18,7 | 21,82 | 3,0 |
| Riñón de mieloma | Sí | Sí | No | Sí | No |
| Amiloidosis | No | No | No | Sí | No |
| Plasmocitomas | No | Sí | No | No | Sí |
| Diagnóstico | MM IgD-L | MM IgD-L | MM IgD-L | MM IgD-K+amiloidosis | MM no secretor IgD-L |
| Estadio de la enfermedad | ISS-3 | ISS-3 | ISS-3 | ISS-3 | ISS-1 |
| Supervivencia (meses) | 1½ (éxitus) | 10 (éxitus) | 17 (vivo) | 21 (éxitus) | 48 (éxitus) |
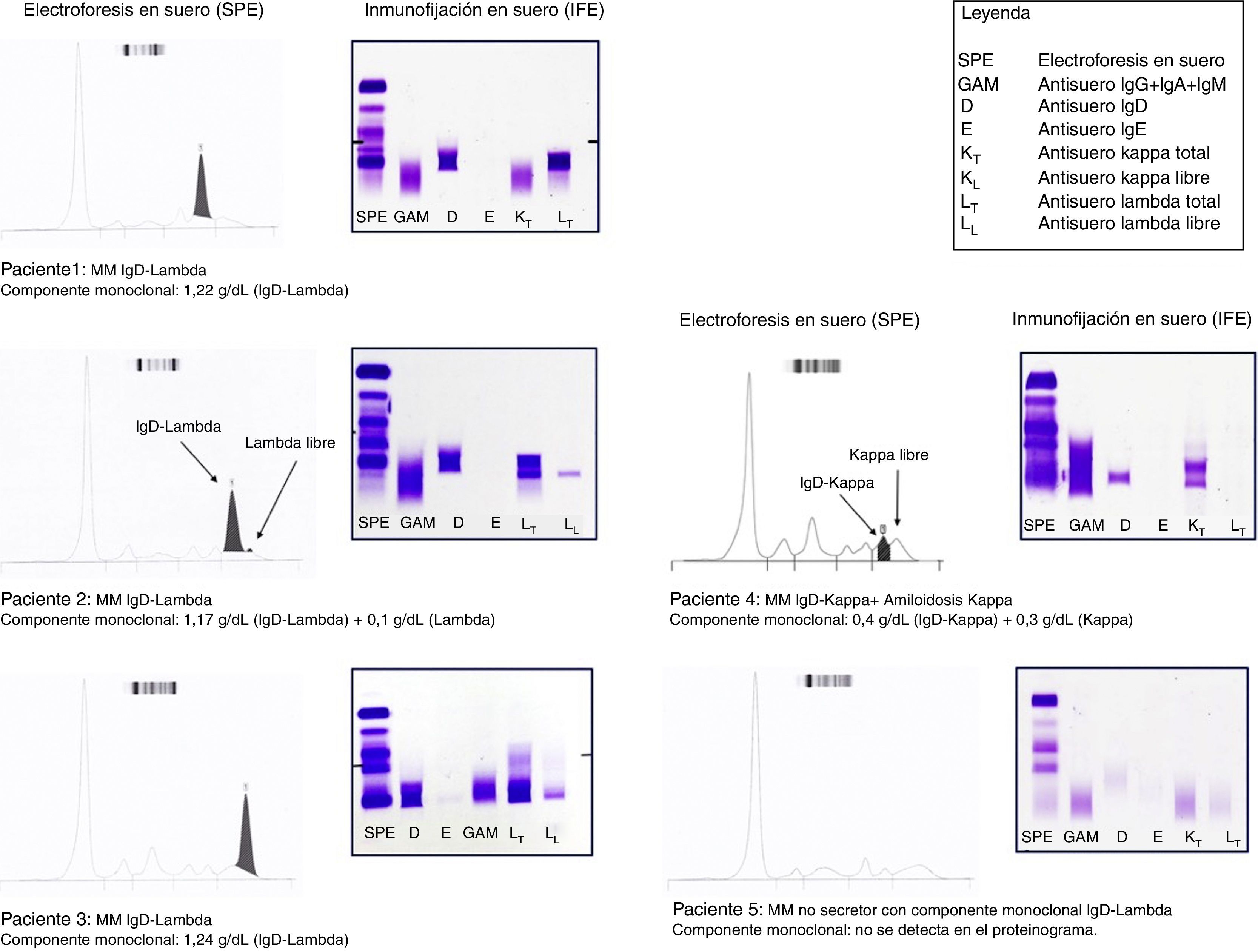
En el estudio del componente monoclonal por el laboratorio; la SPE evidenció la presencia de un pico monoclonal bien definido en tres pacientes (pacientes 1-3 en fig 1). El paciente 4 presentó un componente oligosecretor en forma de dos pequeños picos monoclonales tipificados como IgD-Kappa y kappa libre por IFE (paciente 4 en fig. 1). En el paciente 5 no se observó componente monoclonal en el trazado electroforético, la IFE fue normal pero presentó un cociente K/l libre muy alterado de 0,0005 (paciente 5 en fig. 1). Este paciente fue diagnosticado de MM no secretor tras completar el estudio con la biopsia de médula ósea. En la serie se observó un predominio de la cadena ligera lambda monoclonal (cuatro pacientes) con una mediana de kappa libre de 7,57mg/l y de lambda libre de 2.859mg/l con un cociente K/l libre de 0,002. En el paciente con MM IgD-Kappa, el valor de kappa libre fue de 24.769mg/l con una lambda libre de 15,78mg/l y un cociente K/l libre de 1.570.
Según el «International Staging System (ISS)», sistema empleado para estratificar el riesgo en pacientes con MM, el estadio de la enfermedad fue ISS-3 en cuatro pacientes (pacientes 1-4) mientras que en el paciente con MM no secretor fue ISS-1. Dos pacientes con MM IgD-Lambda presentaron plasmocitomas extramedulares mientras que el paciente con MM IgD-Kappa presentó amiloidosis de cadena ligera kappa. Durante el seguimiento de los pacientes se produjeron cuatro fallecimientos debido a la enfermedad.
DiscusiónEn la actualidad, las series descriptivas de pacientes con MM IgD son escasas debido a la prevalencia tan baja que presenta esta entidad clínica. Estas series de pacientes se encuentran en concordancia y ponen de manifiesto las características clínicas agresivas en la presentación de la enfermedad: fallo renal agudo, lesiones óseas, hipercalcemia y presencia de manifestaciones extramedulares (plasmocitomas, amiloidosis…) que se traducen en una menor supervivencia de los pacientes con MM IgD. Además, el MM IgD se caracteriza por la presentación a una edad más temprana en relación con los mielomas IgG e IgA, con un predominio del género masculino y una predilección por cadenas ligeras monoclonales de tipo lambda junto a altos niveles de beta-2-microglobulina en suero3–6.
Los hallazgos clínicos y analíticos encontrados en nuestra serie de pacientes son similares a los descritos en estos estudios previos. Todos los pacientes presentaron fallo renal agudo y múltiples lesiones óseas al momento del diagnóstico con predominio de la cadena ligera monoclonal lambda. La presencia de complicaciones de la enfermedad es un factor condicionante del pronóstico de los pacientes. Al diagnóstico, dos pacientes presentaron plasmocitomas extramedulares (pacientes 2 y 5 en tabla 1) mientras que en el paciente 4 se identificó la presencia de material amiloide en la biopsia de grasa subcutánea.
Knudsen et al., en un seguimiento de 1.353 pacientes con MM, observaron que la nefropatía por cilindros de cadenas ligeras libres, usualmente denominado «riñón de mieloma», estuvo presente en todos los pacientes con MM IgD7. Este hallazgo refleja la importancia del estudio de la proteinuria de cadenas ligeras en los pacientes con MM8. El «riñón de mieloma» fue una complicación de la enfermedad que estuvo presente en los pacientes 1, 2 y 4 de nuestra serie. En la actualidad, las cadenas ligeras se pueden analizar por dos vías; cuantificando las cadenas ligeras libres monoclonales directamente en el suero o confirmando su presencia en la orina de 24 h del paciente mediante la proteinuria de Bence Jones (PBJ). La cuantificación nefelométrica de las cadenas ligeras libres en suero es un ensayo rápido y fácil en comparación con la PBJ. La PBJ presenta algunos inconvenientes como la incorrecta recogida de la muestra, la falta de representatividad o que la muestra recolectada no corresponda a una orina de 24 h en algunos casos. También es importante reseñar, como describe Gertz et al., la necesidad de descartar la presencia de amiloidosis en el diagnóstico diferencial cuando en un paciente se detecta un componente monoclonal de tipo IgD y, sobre todo, cuando el paciente tiene alguno de los siguientes síndromes asociados a la amiloidosis: miocardiopatía, neuropatía periférica, hepatomegalia y proteinuria en rango nefrótico9.
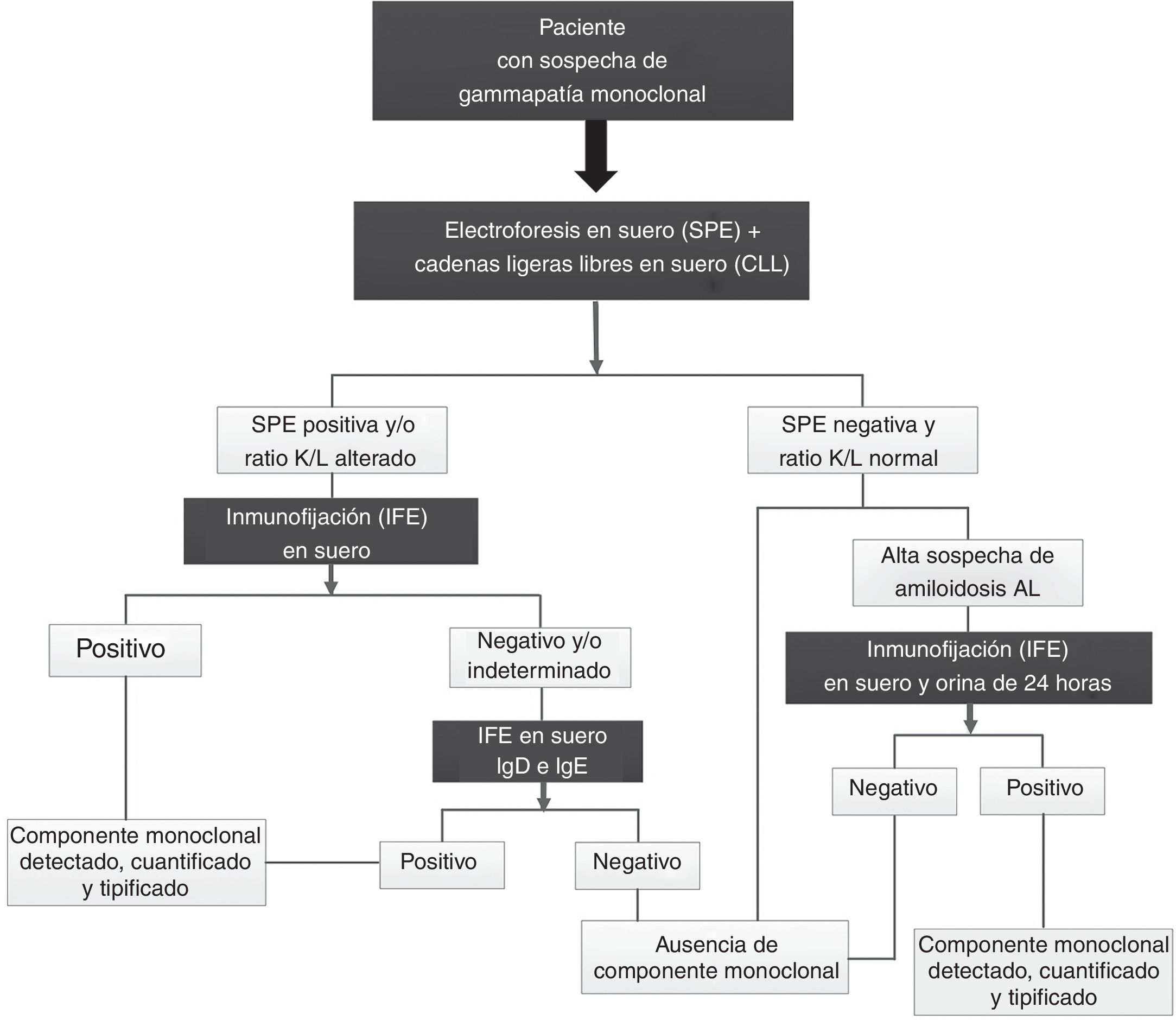
Como consecuencia del curso agresivo que caracteriza al MM IgD, es fundamental el diagnóstico precoz de los pacientes para instaurar rápidamente el tratamiento. En base a la evidencia científica existente, el «International Myeloma Working Group» ha establecido un protocolo de cribado de gammapatías monoclonales que incluye la SPE y la cuantificación de CLL en suero para detectar el componente monoclonal. A continuación, tras detectar el componente monoclonal, se procede a su tipificación mediante la realización de una IFE en suero (fig. 2). El empleo combinado de «SPE+CLL» en el cribado inicial presenta una alta sensibilidad diagnóstica. Es significativo señalar que el estudio de la PBJ en esta primera etapa del cribado se hace innecesaria. Una vez detectada y tipificada la proteína monoclonal entonces es necesaria la determinación de la PBJ en orina de 24 h. No obstante, en pacientes con sospecha de amiloidosis es imprescindible la realización de la PBJ aunque todas las pruebas en suero sean negativas10,11. En este contexto, el laboratorio clínico juega un papel fundamental en el estudio diagnóstico de las gammapatías monoclonales. Los pacientes con MM IgD pueden presentar un componente monoclonal muy pequeño o no identificable en el trazado electroforético siendo difícil su detección empleando solo la SPE. Esta situación se presentó en los pacientes 4 y 5 del estudio (fig. 1). Además, en los pacientes con MM IgD es característica la disminución de los niveles del resto de inmunoglobulinas IgG, IgA e IgM. En este escenario, la cuantificación de las CLL en suero se ha convertido en un biomarcador clave para el estudio de pacientes con gammapatías monoclonales10,12. En los pacientes con niveles altos de CLL con una SPE negativa o un componente monoclonal pequeño, se puede orientar la sospecha diagnóstica hacia un MM de cadenas ligeras siendo necesario descartar la presencia de un posible componente monoclonal IgD y/o IgE mediante una IFE específica para una correcta tipificación del componente monoclonal. Igualmente, otras entidades clínicas a valorar en esta situación son la amiloidosis primaria y la enfermedad por depósito de cadenas ligeras.
Protocolo basado en las recomendaciones del «International Myeloma Working Group» para el estudio diagnóstico de gammapatías monoclonales10,11.
En conclusión, nuestra serie de pacientes con MM IgD presenta características clínicas y analíticas que lo definen como una entidad clínica única. La identificación del componente monoclonal IgD suele ser a veces difícil con el empleo únicamente de la SPE, sobre todo cuando el componente monoclonal se encuentra en concentraciones bajas. Por ello, la cuantificación de las CLL en suero es esencial en el estudio diagnóstico de los pacientes con sospecha de gammapatías monoclonales.