Los laboratorios clínicos son frecuentemente requeridos para la identificación de líquidos corporales de los que se desconoce su origen. La información bibliográfica con respecto a la identificación de líquidos biológicos de procedencia incierta es escasa. El objetivo de este documento es actualizar los conocimientos sobre aquellos constituyentes útiles como marcadores para la identificación y diferenciación de estos líquidos. Se abordan aspectos como la identificación de una punción lumbar traumática o de líquido cefalorraquídeo en fístulas, la identificación de un derrame quiloso o pseudoquiloso, de secreción biliar, pancreática, gastroesofágica o de orina en las cavidades serosas así como del líquido amniótico.
Clinical laboratories are regularly requested to analyze unusual body fluids of unknown origin. There is little in the literature about the identification of body fluids of uncertain origin. The purpose of this document is to perform an updated review on those constituents that may be useful as markers for identifying and diferentiating these unusual fluids. A review is presented on aspects such as the identification of a traumatic lumbar puncture or a cerebrospinal fluid leakage, the identification of a chylous or pseudochylous effusion, leakage of bile, pancreatic fluid, gastroesophageal fluid, or urine, in the serous cavities, as well as the amniotic fluid.
En algunas situaciones clínicas, establecer el origen o la naturaleza de un líquido biológico obtenido de un paciente puede ser importante y el clínico solicitará la colaboración del laboratorio para conocer el tipo de líquido del que se trata y su procedencia. Aunque dicha identificación no siempre sea posible, el Laboratorio Clínico puede asesorar para conocer la naturaleza de un líquido biológico no identificado, basándose en sus características bioquímicas.
Objeto y campo de aplicaciónEl objetivo de este documento es realizar, desde el punto de vista del Laboratorio Clínico, una revisión actualizada que resulte práctica acerca de la composición bioquímica de los diversos líquidos biológicos, con especial atención a las características específicas que pueden ayudar a identificarlos a través de determinados analitos. Aunque algunas de las magnitudes que se describen, no se encuentren disponibles habitualmente en el laboratorio de urgencias, creemos interesante su inclusión en el presente documento, ya que es donde los líquidos biológicos de procedencia incierta se reciben y desde aquí se puede asesorar de la necesidad de realizar estudios complementarios, favoreciendo la colaboración entre el clínico y las diferentes áreas del laboratorio.
Líquido cefalorraquídeoEl líquido cefalorraquídeo (LCR) tiene como funciones aportar nutrientes al tejido nervioso, eliminar los desechos metabólicos y producir una barrera mecánica para proteger el cerebro y la médula espinal contra el traumatismo. El LCR está contenido en el espacio subaracnoideo entre la membrana aracnoides y la piamadre, en los ventrículos del cerebro y en las cisternas que lo rodean. Los plexos coroideos son redes capilares que forman el LCR a partir del plasma por mecanismos de filtración selectiva bajo la presión hidrostática y la secreción por transporte activo, por lo que su composición es diferente al plasma. En las vellosidades aracnoideas tienen lugar los procesos de reabsorción.
El agua constituye el 99% de la composición del LCR, el cual tiene una osmolaridad parecida a la del plasma. Sin embargo, debido a la presencia de la barrera hematoencefálica existen importantes diferencias en su composición (tabla 1). Aproximadamente el 80% de las proteínas del LCR proceden del suero y el 20% se producen intratecalmente. Las proteínas son transportadas desde el suero al LCR por pinocitosis o por transportadores específicos y su concentración depende del radio molecular, la carga, la concentración plasmática de la proteína y el estado funcional de la barrera hematoencefálica. Las proteínas específicas del LCR como la proteína básica de la mielina, la proteína ácida fibrilar glial o la beta-2-transferrina constituyen solo el 1-2% de las proteínas totales en el LCR normal1 y la albúmina es la proteína que se encuentra en mayor concentración.
Composición del líquido cefalorraquídeo
| Magnitud | Concentración |
|---|---|
| Albúmina | 177-251 mg/l (17,7-25,1 mg/dl) |
| Glucosa | Adultos: 2,8-4,4 mmol/l (50-80 mg/dl) |
| Recién nacidos prematuros: 1,3-3,5 mmol/l (24-63 mg/dl) | |
| Recién nacidos a término: 1,9-6,6 mmol/l (34-119 mg/dl) | |
| Proteína | Recién nacido: 0,3-1,4 g/l (30-140 mg/dl) |
| Adulto: 0,15-0,45 g/l (15-45 mg/dl) | |
| Beta-2-transferrina | Positiva |
| Beta-traza | 11,5-32,6 mg/l |
Los cambios en la composición bioquímica del LCR son casi siempre el resultado de la actividad metabólica alterada, muerte celular o de la actividad inmune e inflamatoria. En un adulto, el volumen medio de LCR es de unos 150mL y se renueva completamente cada 5-7 h, aproximadamente. Suele obtenerse mediante punción lumbar en los espacios intervertebrales 3.°-4.° o 4.°-5.° y la muestra se debe recoger en tres tubos estériles de forma secuencial2.
Punción lumbar traumáticaSe ha considerado tratar esta situación en este documento, no por el desconocimiento del origen del líquido sino del contenido hemático. El aspecto del LCR normal es incoloro y cristalino. Una coloración rojiza del LCR indica generalmente la presencia de sangre en el líquido. Puede ser indicativo de una hemorragia subaracnoidea, una hemorragia intracraneal, un infarto cerebral o una punción traumática por perforación de los vasos sanguíneos durante el procedimiento de la punción lumbar.
Si el aspecto hemorrágico aparece de forma uniforme en los tres tubos de muestra de líquido cefalorraquídeo, sería indicativo de hemorragia, mientras que en la punción traumática la mayor concentración de sangre se observa en el primer tubo y disminuye de forma gradual en los tubos sucesivos3. Además, tras la centrifugación se observaría un precipitado hemático y un sobrenadante claro y transparente. En el caso de una punción traumática, el número de leucocitos de la sangre periférica presentes en la muestra debido a la punción puede calcularse a partir del recuento de hematíes en el LCR y las cantidades relativas de leucocitos y eritrocitos en la sangre. El recuento de leucocitos que habríamos obtenido en el LCR en el caso de no existir contaminación se obtiene al restar al recuento total de leucocitos en la muestra el número calculado de leucocitos añadidos4.
El líquido procedente de una punción traumática puede formar coágulos debido al vertido de fibrinógeno plasmático en el propio LCR, mientras que el LCR sanguinolento causado por una hemorragia intracraneal no contiene suficiente fibrinógeno para coagular. Las enfermedades en las que el daño de la barrera hematoencefálica permite una mayor filtración de proteínas y de factores de coagulación también causan la formación de coágulos, aunque normalmente no producen un líquido sanguinolento (meningitis, síndrome de Froin, etc.)2,5.
La xantocromía hace referencia a la coloración rosada o anaranjada del sobrenadante del LCR después de su centrifugación. Aparece entre 2 y 4 h después de producirse una hemorragia subaracnoidea. En un primer momento es de color rosado/rojizo, debido a la oxihemoglobina procedente de la lisis de los eritrocitos. Pasadas las 12 h tras la hemorragia, se torna de un color amarillento (producto del catabolismo de la hemoglobina a bilirrubina) con la intensidad máxima entre las 24 y 36 h para desaparecer entre 4 y 8 días, pudiendo estar presente hasta 4 semanas. Se debe tener en cuenta que la xantocromía aparece cuando los eritrocitos se han lisado, es decir, que han estado presentes en el LCR entre 1 y 4 h. En algunos casos pueden observarse «falsas» xantocromías producidas por3:
- •
Una concentración de proteína superior a 1,5g/l (150mg/dl).
- •
La presencia de bilirrubina procedente del plasma en el LCR debido a que la concentración es superior a 5mg/dl (86μmol/l).
- •
La contaminación sérica o la demora en la centrifugación de un LCR hemático por punción traumática.
- •
La presencia de carotenoides por hipercarotenemia.
- •
La presencia de melanina por un melanosarcoma en las meninges.
- •
La contaminación con mertiolato o desinfectantes yodados utilizados para la desinfección de la zona de punción.
Una fístula de LCR corresponde a una salida anormal de LCR desde el espacio subaracnoideo con drenaje en la nariz o el oído, pudiendo tener un origen traumático, secundario a cirugía o espontáneo. El diagnóstico es esencial para prevenir posibles infecciones que puedan afectar al sistema nervioso central. En el Laboratorio Clínico la detección de la pérdida de LCR en las secreciones está basada en la medición de las proteínas beta-2 transferrina y beta-traza6–8. Sin embargo, la determinación de estas proteínas no se encuentra disponible de forma habitual en un laboratorio de urgencias.
La beta-2 transferrina o asialotransferrina es una variante de la transferrina específica del cerebro que carece de ácido neuramínico. Se puede distinguir de la transferrina sérica mediante electroforesis con una cantidad muy pequeña de muestra. La beta-2-transferrina está presente en el humor acuoso y perilinfa y puede ser detectada en el suero, especialmente en alcohólicos crónicos y en pacientes con errores congénitos del metabolismo de las glicoproteínas o variantes genéticas de la transferrina6,9,10.
La proteína beta-traza que ha sido identificada como la prostaglandina D2 sintasa11, es otra proteína específica del cerebro que se produce principalmente en las leptomeninges y el plexo coroideo y se secreta en el LCR. Es la segunda proteína más abundante del LCR después de la albúmina8. Sin embargo, también está presente en otros fluidos corporales, incluyendo el suero, aunque a concentraciones mucho más bajas que en el LCR. Su aumento en el plasma se ha confirmado en tumores, esclerosis múltiple y enfermedades cerebrovasculares12.
La principal ventaja que ofrece la medición de la proteína beta-traza es la rapidez con la que se obtiene el resultado. El rendimiento diagnóstico que ofrecen ambas pruebas es comparable o ligeramente superior para la beta-traza, aunque su medición puede presentar limitaciones en los pacientes con meningitis bacteriana (concentraciones en LCR disminuidas) y en pacientes con disminución del filtrado glomerular (concentración en el suero y en las secreciones nasales elevadas)8,13,14. La presencia de LCR en la secreción puede ser excluida cuando la concentración de beta-traza es<0,7mg/l, mientras que una concentración ≥ 1,3mg/l sería indicativa de la presencia de LCR en la secreción. La concentración de beta-traza entre 0,7 y 1,29mg/l indica la presencia de LCR si la relación beta-traza secreción/suero es ≥ 215.
Recientemente se ha publicado un estudio piloto que concluye que la medida de proteína Tau, cuyo incremento en LCR es un marcador de enfermedad de Alzheimer, podría ser útil como marcador de la fuga de LCR en la rinorrea16.
La medición de glucosa en las secreciones como prueba para la detección de LCR no debe ser utilizado como único método para diagnosticar pérdidas de LCR por su baja sensibilidad y especificidad. Esta prueba puede dar lugar a falsos positivos debido a la presencia de glucosa en la secreción de las vías respiratorias en los pacientes con diabetes mellitus, hiperglucemia o en la inflamación del epitelio nasal durante el resfriado viral. Por otra parte, la ausencia de glucosa no excluye la pérdida de LCR, ya que se pueden producir falsos negativos en casos de contaminación bacteriana17,18.
Líquidos serososLos líquidos serosos son ultrafiltrados del plasma contenidos en los espacios peritoneal, pleural y pericárdico que tienen la finalidad de lubricar las superficies de las membranas para reducir la fricción. Su formación es un proceso dinámico que implica la formación continua de líquido y su reabsorción, en función de la presión hidrostática, la presión osmótica coloidal, la permeabilidad capilar y el drenaje linfático. El líquido extravascular contenido en las cavidades serosas se produce continuamente, pero en poca cantidad (aproximadamente un 1% del volumen plasmático), se filtra por los capilares y es reabsorbido y transportado de vuelta a la circulación por el drenaje linfático. La formación excesiva de líquido es patológica y se produce por diversas razones, siendo sus mecanismos generales el aumento de la producción de líquido o la reducción de la reabsorción19,20.
Generalmente el examen clínico y el diagnóstico por imagen suelen ser suficientes para determinar la presencia de líquido en la cavidad peritoneal, pleural y pericárdica y no se requiere de la colaboración del Laboratorio Clínico para su identificación. En el caso de los derrames serosos no existen magnitudes características o específicas que contribuyan a su reconocimiento.
El estudio y la clasificación diagnóstica diferencial de los líquidos biológicos serosos ha sido objeto de un documento previo publicado por esta Comisión21 y en el documento actual se abordan los líquidos biológicos desde el punto de vista de su identificación o de su posible procedencia.
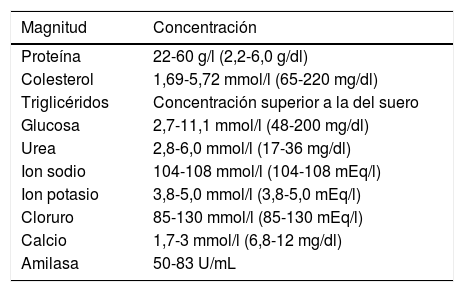
Derrame quiloso y pseudoquilosoEl quilo es la linfa de origen intestinal, producto de la digestión. Pasa a través de las proyecciones digitiformes de la mucosa del intestino delgado a los vasos linfáticos del mismo y desde aquí se drena en el conducto torácico hacia el sistema circulatorio. Durante el ayuno la linfa se aclara y tras una comida rica en grasas se vuelve opaca. Es una sustancia blanco-amarillenta, espesa e inodora, formada principalmente por grasas. Algunas de las características bioquímicas de la linfa se muestran en la tabla 2.
Composición de la linfa
| Magnitud | Concentración |
|---|---|
| Proteína | 22-60 g/l (2,2-6,0 g/dl) |
| Colesterol | 1,69-5,72 mmol/l (65-220 mg/dl) |
| Triglicéridos | Concentración superior a la del suero |
| Glucosa | 2,7-11,1 mmol/l (48-200 mg/dl) |
| Urea | 2,8-6,0 mmol/l (17-36 mg/dl) |
| Ion sodio | 104-108 mmol/l (104-108 mEq/l) |
| Ion potasio | 3,8-5,0 mmol/l (3,8-5,0 mEq/l) |
| Cloruro | 85-130 mmol/l (85-130 mEq/l) |
| Calcio | 1,7-3 mmol/l (6,8-12 mg/dl) |
| Amilasa | 50-83 U/mL |
Fuente: Valentine et al. 53.
Los derrames quilosos se producen por una fístula del conducto torácico, por obstrucción linfática por un linfoma, por un carcinoma o por una interrupción traumática. La identificación de quilo puede ser de interés principalmente en el quilotórax, en la ascitis quilosa y de forma menos frecuente en el quilopericardio.
El quilotórax se define como la presencia de líquido linfático en el espacio pleural y es el resultado de una fuga del conducto torácico o de una de sus principales divisiones. La ascitis quilosa se refiere a la acumulación de líquido linfático en el espacio peritoneal y en algunos casos se asocia a una obstrucción linfática. El quilopericardio es una entidad menos frecuente que puede ser de origen congénito o secundario a un traumatismo quirúrgico o a tumores malignos (linfangiomas, higromas).
Los derrames pseudoquilosos o quiliformes pueden tener apariencia lechosa, verdosa o con brillo metálico. Se forman gradualmente por la rotura de los lípidos celulares en los derrames de larga duración como en la pleuritis reumatoide, la tuberculosis o el mixedema. Se caracterizan por una concentración muy elevada de colesterol. En este caso no están presentes triglicéridos ni quilomicrones y no se encuentra relacionado con el sistema linfático. La presencia de turbidez en el líquido, que se aclara tras centrifugación, suele deberse a elementos celulares o desechos. Si la turbidez persiste tras la centrifugación, es más probable que sea un derrame quiloso22.
No existe un marcador bioquímico específico del quilo. Sin embargo, los quilomicrones generalmente están presentes en la linfa del conducto torácico, por lo que en los líquidos en los que se sospeche un posible derrame de origen quiloso, se debe valorar la presencia de quilomicrones o triglicéridos. La presencia de quilomicrones puede ser reconocible por inspección visual después de la centrifugación de la muestra, observando una fina capa blanco-cremosa en la parte superior del sobrenadante, pero si no es así, la determinación de la concentración de colesterol y triglicéridos es la alternativa disponible al análisis de lipoproteínas.
Los criterios para el diagnóstico bioquímico del quilotórax son una concentración de triglicéridos en líquido pleural>1,24 mmol/l (110mg/dl) con una concentración de colesterol<5,18 mmol/l (200mg/dl). Mientras que una concentración de triglicéridos<0,56 mmol/l (50mg/dl) con una concentración de colesterol>5,18 mmol/l (200mg/dl) correspondería a un pseudoquilotórax. En este último caso también es frecuente la observación de cristales de colesterol. En el quilotórax también se observa una relación líquido/suero de la concentración de colesterol<1 y de triglicéridos>120,23,24. Sin embargo, los resultados deben ser interpretados siempre en el contexto clínico ya que en algunos casos se han observado concentraciones de triglicéridos<110mg/dl en quilotórax en pacientes en ayuno preoperatorio o con desnutrición24. En los casos en los que la concentración de triglicéridos oscile entre 0,56 y 1,24 mmol/l (55-110mg/dl) es necesario el análisis de lipoproteínas para realizar el diagnóstico mediante la identificación de quilomicrones.
La concentración de triglicéridos en la ascitis quilosa es>2,26 mmol/l (> 200mg/dl)25. En algunos pacientes con cirrosis, la aparición de ascitis puede ser opalescente pero no quilosa y en la mayoría de los casos la concentración de triglicéridos es baja26.
Los derrames quilosos sinoviales son extremadamente raros y se asocian a la artritis reumatoide, lupus eritematoso sistémico, filariasis linfática con obstrucción, pancreatitis con necrosis grasa y traumatismos27.
Secreción biliarLa bilis es secretada por el hígado alcanzando un volumen entre 600 y 1.200mL al día. Permite la digestión y absorción de las grasas, gracias a los ácidos biliares que las emulsionan y transforman en partículas pequeñas que pueden ser degradadas por la lipasa y ayudan al transporte y absorción de los productos finales de la digestión además de eliminar productos de desecho como la bilirrubina o el exceso de colesterol. La bilis se forma por la secreción de los hepatocitos (rica en ácidos biliares y colesterol) y la de las células epiteliales que recubren los conductillos y conductos hepáticos (una solución acuosa de iones sodio y bicarbonato).
La bilis es conducida hacia el duodeno o almacenada en la vesícula. Esta última, está 5-10 veces más concentrada que la bilis de los conductos biliares debido a la absorción de agua, sodio y cloro, incrementándose en consecuencia las concentraciones de colesterol, fosfolípidos, ácidos biliares y bilirrubina28.
La bilis puede entrar en la cavidad peritoneal cuando se producen daños en los conductos biliares como por ejemplo tras un traumatismo abdominal o durante los procedimientos quirúrgicos. Una complicación de la colecistectomía puede ser la sutura incompleta de la vía biliar principal, permitiendo de este modo que la bilis fluya directamente a la cavidad peritoneal. El trasplante de hígado con reanastomosis de los vasos y los conductos del órgano donado con las estructuras del receptor, también puede dar lugar a fugas de la bilis como complicación. La obtención continua de líquido por medio de drenajes puede indicar un daño de las estructuras biliares en este tipo de intervención20.
La presencia de bilis es fácilmente reconocible por inspección visual, sin embargo, la observación del color del líquido de drenaje es subjetiva y pueden obtenerse resultados variables, ya que no hay un aspecto típico de este líquido29. Un método muy sencillo, práctico, de bajo coste y ampliamente disponible para determinar si el líquido contiene bilis es medir su contenido de bilirrubina y compararlo con la concentración sérica. La bilirrubina está presente en altas concentraciones en la bilis, pero no en otros fluidos20. Por tanto, la detección de una elevada concentración de bilirrubina en el líquido de drenaje es indicativa de fugas de bilis que podrían ser susceptibles de cirugía.
Una concentración de bilirrubina en el líquido ascítico>102,6μmol/l (6mg/dl) con una relación bilirrubina líquido/suero>1, es indicativo de coleperitoneo30. Los pacientes sometidos a cirugía o que han sufrido un traumatismo abdominal, con una concentración de bilirrubina>83,8μmol/l (4,9mg/dl) en el líquido de drenaje o una relación bilirrubina líquido/suero>5, deberían ser considerados de elevado riesgo de fuga biliar29.
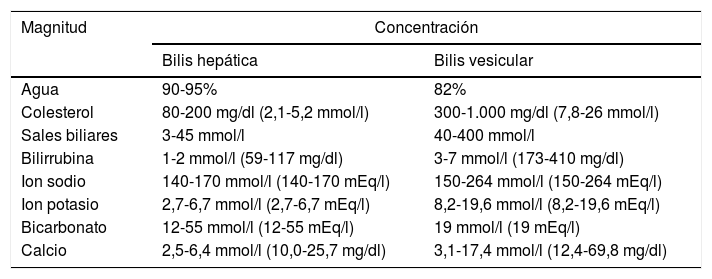
En la tabla 3 se muestran los datos acerca de la composición de la bilis, debiendo distinguirse entre la bilis hepática y la procedente de la vesícula biliar, esta última mucho más concentrada.
Composición de la bilis
| Magnitud | Concentración | |
|---|---|---|
| Bilis hepática | Bilis vesicular | |
| Agua | 90-95% | 82% |
| Colesterol | 80-200 mg/dl (2,1-5,2 mmol/l) | 300-1.000 mg/dl (7,8-26 mmol/l) |
| Sales biliares | 3-45 mmol/l | 40-400 mmol/l |
| Bilirrubina | 1-2 mmol/l (59-117 mg/dl) | 3-7 mmol/l (173-410 mg/dl) |
| Ion sodio | 140-170 mmol/l (140-170 mEq/l) | 150-264 mmol/l (150-264 mEq/l) |
| Ion potasio | 2,7-6,7 mmol/l (2,7-6,7 mEq/l) | 8,2-19,6 mmol/l (8,2-19,6 mEq/l) |
| Bicarbonato | 12-55 mmol/l (12-55 mEq/l) | 19 mmol/l (19 mEq/l) |
| Calcio | 2,5-6,4 mmol/l (10,0-25,7 mg/dl) | 3,1-17,4 mmol/l (12,4-69,8 mg/dl) |
Fuente: Dacygier28.
El páncreas exocrino normalmente secreta múltiples enzimas digestivas (proteasas, lipasas, nucleasas, amilasa) que se liberan en el intestino delgado a través del conducto pancreático. Una lesión pancreática de origen mecánico o secundaria a otras patologías provoca la extravasación de las enzimas de las células exocrinas al espacio peritoneal. Estas enzimas pueden dañar aún más el páncreas y los tejidos circundantes, acentuando la acumulación de líquido20.
La determinación de la amilasa o lipasa en el líquido peritoneal se puede utilizar para confirmar o descartar la lesión pancreática (pancreatitis aguda o crónica, fístulas pancreáticas y pseudoquistes pancreáticos). Además, la pancreatitis puede ir acompañada de un derrame pleural izquierdo, que se puede atribuir a esta lesión si la amilasa y/o la lipasa se encuentran elevadas en este líquido20.
La medición de amilasa y lipasa en un líquido seroso debe ir acompañada de la medición de la concentración sérica para una correcta interpretación de los resultados. La concentración de amilasa en el líquido ascítico en la cirrosis no complicada se encuentra generalmente dentro del intervalo de 42-50 U/l (la mitad del intervalo sérico)31. Tanto la concentración de amilasa como la de lipasa en el líquido peritoneal de origen pancreático son superiores a la del suero, incluso en la pancreatitis aguda32. La medición de la concentración de amilasa del líquido ascítico es útil para la detección de la ascitis de origen pancreático o perforación intestinal hacia la cavidad peritoneal, detectándose en el primer caso concentraciones del orden de 2.000 U/l, más elevadas que en la perforación intestinal33. La fístula pancreática postoperatoria se define como la presencia en el líquido de drenaje de una concentración de amilasa al menos 3 veces por encima de la concentración de la amilasa en suero a partir del tercer día postoperatorio34.
La prevalencia de los derrames pleurales con relación amilasa en líquido/suero>1 es muy baja. Solo se justificaría su medición en el líquido pleural ante la sospecha de rotura esofágica o enfermedad pancreática35. El análisis de las isoformas de la amilasa o de la lipasa podría aportar una mayor información, sin embargo, estas pruebas no suelen estar disponibles de forma urgente. La isoenzima pancreática de la amilasa aparece en los casos relacionados con pancreatitis aguda o crónica, fístulas pancreáticas y pseudoquistes pancreáticos mientras que la isoforma salival de amilasa se observa en la rotura esofágica y en algunos tumores no pancreáticos como el adenocarcinoma de pulmón o de ovario y el mesotelioma36,37.
Secreción gastroesofágicaLa saliva tiene una elevada concentración de iones potasio y bicarbonato y dos tipos de secreción proteica, α-amilasa y mucina, con un pH 6,00-7,00. Por otra parte, el estómago secreta ácido clorhídrico, agua, iones, pepsina, moco, bicarbonato, factor intrínseco, antígenos de grupo sanguíneo y gastrina, constituyendo el jugo gástrico (pH 1,00-3,50)38. En una rotura esofágica, la saliva o el contenido gástrico refluido se extravasan al mediastino pudiendo dar lugar a mediastinitis y/o pioneumotórax dependiendo del grado de la afectación. Los hallazgos en el líquido pleural dependen del grado de perforación y del tiempo entre la perforación y la toracocentesis. Si es temprana sin perforación mediastínica, muestra un exudado seroso estéril con predominio de polimorfonucleares, una concentración de amilasa menor que la del suero y un pH>7,30. Una vez afectada la pleura mediastínica aparece una concentración elevada de amilasa en su isoforma salival en el líquido pleural39. A medida que la secreción gástrica llega al líquido pleural el pH disminuye, ya que la secreción gástrica tiene un pH<3,5040. Por otra parte, la presencia de microorganismos anaerobios procedentes del tracto esofágico, produce una disminución del pH de forma rápida y progresiva hasta aproximarse a 6. Otro hallazgo en el líquido pleural que puede sugerir rotura esofágica es la presencia de células epiteliales escamosas y partículas de alimentos39,41.
OrinaEn la cavidad peritoneal o pleural (urinotórax) se puede producir la acumulación de la orina a causa de las fugas de orina producidas desde el tracto urinario que pueden ser debidas a la obstrucción urinaria por un tumor, fibrosis, cálculos, traumatismos o tras cirugía siendo el tratamiento la reparación quirúrgica del tracto urinario. Un líquido de drenaje continuo claro o con sangre tras una intervención quirúrgica abdominal puede ser indicativo de una fuga constante de orina y no manifestarse hasta algún tiempo después de la intervención, cuando el riñón comienza a producir y excretar orina en cantidad suficiente para que se acumule en el peritoneo20.
El urinotórax por lo general se presenta como un trasudado con un pH<7,30 y una concentración de creatinina mayor que en una muestra de suero obtenida de forma simultánea (relación de creatinina en líquido/creatinina sérica>1)20,22,42, aunque este dato debe interpretarse con cautela junto con el resto de hallazgos clínicos y bioquímicos, ya que se han descrito valores próximos a 1 en derrames pleurales de otros orígenes43. En el caso de que el líquido aspirado sea orina por perforación involuntaria de la vejiga, la relación urea/creatinina debería ser mucho más alta que en el líquido peritoneal, ya que en la cavidad peritoneal la urea se absorbe más fácilmente que la creatinina20.
Líquido amnióticoEl líquido amniótico es un líquido claro y ligeramente amarillento que está contenido en el saco amniótico y rodea al feto dentro del útero durante el embarazo. Las funciones principales del líquido amniótico son proporcionar la amortiguación y protección para el feto, permitir su movimiento y estabilizar la temperatura para protegerlo y permitir el desarrollo pulmonar adecuado. El líquido amniótico constituye un medio dinámico, cuyo volumen y composición están estrechamente controlados y dependen de la edad gestacional. Su volumen aumenta progresivamente a lo largo del embarazo hasta la semana 40, a partir de la cual comienza a disminuir. Se producen intercambios de agua y solutos entre el líquido, el feto y la circulación materna. El feto contribuye a la composición química del líquido amniótico a través de su piel, conducto traqueobronquial y su excreción urinaria44.
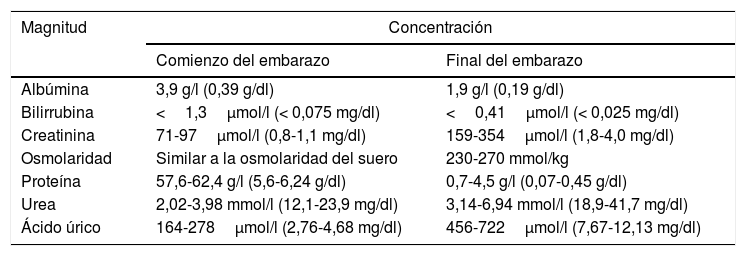
Hasta las 20 semanas de gestación, el líquido amniótico proviene fundamentalmente de la madre, con participación de algunas secreciones fetales, manteniendo una composición similar a la del plasma materno. A partir de las 20 semanas, aumenta la aportación fetal a la formación del líquido amniótico y se va volviendo más hipotónico con el aumento de la orina fetal45. La osmolaridad y la concentración de ion sodio disminuyen a medida que se aproxima el parto, mientras que las concentraciones de creatinina, urea y ácido úrico aumentan46,47 (tabla 4).
Composición del líquido amniótico
| Magnitud | Concentración | |
|---|---|---|
| Comienzo del embarazo | Final del embarazo | |
| Albúmina | 3,9 g/l (0,39 g/dl) | 1,9 g/l (0,19 g/dl) |
| Bilirrubina | <1,3μmol/l (< 0,075 mg/dl) | <0,41μmol/l (< 0,025 mg/dl) |
| Creatinina | 71-97μmol/l (0,8-1,1 mg/dl) | 159-354μmol/l (1,8-4,0 mg/dl) |
| Osmolaridad | Similar a la osmolaridad del suero | 230-270 mmol/kg |
| Proteína | 57,6-62,4 g/l (5,6-6,24 g/dl) | 0,7-4,5 g/l (0,07-0,45 g/dl) |
| Urea | 2,02-3,98 mmol/l (12,1-23,9 mg/dl) | 3,14-6,94 mmol/l (18,9-41,7 mg/dl) |
| Ácido úrico | 164-278μmol/l (2,76-4,68 mg/dl) | 456-722μmol/l (7,67-12,13 mg/dl) |
Fuente: McPherson et al. 22.
En determinadas circunstancias puede ser necesaria la diferenciación entre el líquido amniótico y la orina materna, por la punción accidental de la vejiga materna durante la recolección de la muestra o para diagnosticar una posible rotura prematura de membranas. La medición de creatinina y urea pueden ayudar a esta diferenciación. Las concentraciones de creatinina y urea son mucho más bajas en el líquido amniótico que en la orina. En el líquido amniótico se observa una concentración de creatinina al comienzo del embarazo de 0,8-1,1mg/dl (71-97μmol/l) y de urea 12,1-23,9mg/dl (2,02-3,98 mmol/l), llegando a alcanzarse al final del mismo concentraciones de creatinina y urea de 1,8-4,0mg/dl (159-354μmol/l) y 18,9-41,7mg/dl (3,14-6,94 mmol/l), respectivamente22.
Por otra parte, la identificación del líquido amniótico en el contenido vaginal puede ser útil en el diagnóstico de una rotura prematura de membranas. Clínicamente se identifica por la visualización de salida de líquido amniótico por el canal cervical en la exploración física y en caso de duda, se puede optar por la realización de pruebas como la ecografía fetal o la amniocentesis diagnóstica en casos seleccionados. Además, es útil la determinación de algunas magnitudes bioquímicas, disponibles en ensayos a la cabecera del paciente POCT, que identifican mediante inmunocromatografía proteínas con alto nivel de expresión en el líquido amniótico en comparación con otros fluidos biológicos como la sangre materna, líquido seminal, orina y secreción cervico-vaginal. La alfa microglobulina-1 placentaria (PAMG-1) y la proteína transportadora del factor de crecimiento insulínico (IGFBP-1) cumplen estos criterios y pueden ser fácilmente identificadas en una muestra vaginal con pruebas rápidas con una elevada sensibilidad (PAMG-1: 98-99%; IGFBP-1: 74-97%) y especificidad (PAMG-1: 88-100%; IGFBP-1: 74-98%)48,49. Estas pruebas han demostrado su superioridad diagnóstica frente al test de nitrazina y al test de imagen de arborización visualizada con microscopio óptico48,50,51.
Conclusiones- 1.
El documento presenta una visión general de las características de algunos líquidos biológicos de origen incierto.
- 2.
El Laboratorio Clínico tiene un papel relevante en la medición de algunas magnitudes para el reconocimiento y diferenciación de estos líquidos biológicos.
- 3.
En algunos casos se deben tener en cuenta ciertas consideraciones para interpretar los resultados, siendo necesario disponer de la información del paciente y de los procedimientos llevados a cabo en él, debiendo interpretarse los resultados siempre dentro del contexto clínico.
- 4.
Muchas de las pruebas necesarias para la identificación del origen de estos líquidos están incluidas en el catálogo de cualquier Laboratorio Clínico, pero en cualquier caso este puede asesorar al clínico de la necesidad de realizar estudios complementarios.