La medicina personalizada, medicina de precisión o medicina individualizada ha sido definida como una manera de abordar el tratamiento y la prevención de las enfermedades en base a la variabilidad genética, ambiental y al estilo de vida de cada persona. Clasifica a los individuos en subpoblaciones que difieren en la susceptibilidad a desarrollar una enfermedad determinada o en la respuesta a un tratamiento específico, con el fin de aplicar el seguimiento y tratamiento más adecuado a cada paciente. La implementación de los procesos asociados a la Medicina Personalizada implica que los profesionales de laboratorio se enfrenten a una tecnología muy avanzada y poco conocida y a la dificultad de interpretación de los hallazgos, especialmente la valoración de su significación clínica. En este artículo se revisa la situación actual de la Medicina Personalizada, la función del laboratorio dentro de la misma y los retos que se deben afrontar.
Personalised medicine, precision medicine, or individualised medicine has been defined as the way of preventing and treating diseases based on the genetic, environmental, and lifestyle variability for each individual. It classifies subjects into sub-populations that have different susceptibilities to develop a specific disease or to respond to a particular treatment. Its aim is to follow-up and treat each patient in the more suited to the patient. The establishment of the processes related to personalised medicine requires that specialists in Laboratory Medicine cope with cutting-edge, and little-known, technology with an interpretation that is highly complex from a clinical point of view. This review summarises the current situation of personalised medicine, the role of laboratory medicine in its implementation, and the challenges that need to be faced.
Para conseguir una mejora sustancial en la prevención y el tratamiento de las enfermedades es preciso conocer y entender los factores que contribuyen tanto al mantenimiento de la salud como al desarrollo de la enfermedad. La investigación biomédica reciente ha permitido mejorar la identificación de las enfermedades y los factores que las causan, con el consiguiente incremento de la calidad y la esperanza de vida en las sociedades del mundo civilizado. Sin embargo, la existencia de pacientes en los que aparentemente los tratamientos probados son inefectivos, o incluso perniciosos, ensombrece el resultado global.
El término «medicina personalizada» (MP) hace referencia a una forma de tratar y prevenir la enfermedad que busca mejorar la efectividad con base en la variabilidad genética individual, el ambiente y el estilo de vida. Se ha definido la MP o de precisión como la aplicación de tratamientos dirigidos a las necesidades de cada paciente, teniendo en cuenta las características genéticas, fenotípicas, psicosociales y/o los biomarcadores que distinguen a un paciente de otro1. El objetivo es mejorar los resultados sanitarios a nivel individual, minimizar los efectos secundarios y evitar los costes innecesarios.
El desarrollo de nanotecnologías ha propiciado que el coste de la secuenciación de ADN sea un millón de veces más barato que cuando se realizó la primera secuencia del genoma humano, así como la reducción de los costes para el almacenamiento de datos y la mayor rapidez en el análisis informático.
La medicina del laboratorio constituye una parte esencial en el proceso de toma de decisiones clínicas, interviniendo en el cribado, el diagnóstico, la valoración pronóstica y la monitorización de resultados de la gran mayoría de las enfermedades médicas. Está claro que la MP no es posible ni realizable sin el apoyo de los test de laboratorio. Los estudios son cada vez más diversos, los datos más numerosos y la interpretación más compleja, por lo que el papel de los profesionales del laboratorio en el manejo de la enfermedad es, si cabe, todavía más relevante, siendo preciso que adquieran el conocimiento y las competencias necesarias para poder llevar a cabo correctamente su cometido.
Las sociedades científicas, como la Sociedad Española de Farmacogenética y Farmacogenómica, la Asociación Española de Genética Humana y las sociedades científicas del Laboratorio Clínico (AEBM-ML, AEFA, SEQC), entre otras, están contribuyendo a través de sus programas formativos a que la MP sea conocida en nuestro entorno.
Con este artículo, pretendemos realizar una puesta al día de la situación actual, desarrollando el ámbito de aplicación de la MP, haciendo un breve resumen de los proyectos más relevantes, explicando la función a desarrollar por el laboratorio y, por último, describiendo los retos a los que nos enfrentamos.
Ámbito de aplicación de la medicina personalizadaLa MP es un enfoque multifacético para la atención al paciente, cuya plena aplicación engloba los siguientes aspectos:
- a)
Prevención. La identificación de personas con un alto riesgo de desarrollar una determinada enfermedad permite la instauración de medidas específicas que disminuyan dicha probabilidad. Por ejemplo, está demostrado que la mastectomía bilateral y la ooforectomía disminuyen en más de un 90% la probabilidad de desarrollar cáncer de mama en las mujeres portadoras de mutación en los genes BRCA1/22.
- b)
Detección precoz. Uno de los aspectos básicos de la MP es la identificación de biomarcadores que permitan detectar la enfermedad antes de la aparición de los síntomas. En general, los marcadores moleculares son más sensibles, más precisos y más precoces que los marcadores tradicionales. Por ejemplo, el estudio de ADN tumoral fecal permite la identificación de casi el doble de lesiones premalignas que el test de hemorragia oculta en heces3.
- c)
Diagnóstico. El diagnóstico de precisión es un requisito previo al tratamiento personalizado que caracteriza la MP. Un ejemplo son los cambios sustanciales que han tenido lugar en el tratamiento de las enfermedades oncológicas. Así, la identificación de que la translocación que da lugar al cromosoma Philadelphia crea un oncogén de fusión (BCR-ABL) y que este era el factor causante del crecimiento de las células mieloides dio lugar al desarrollo de fármacos específicos (inhibidores de tirosina cinasas). Existen también test diagnósticos de acompañamiento (companion diagnostic) que identifican a los pacientes con mayor probabilidad de responder favorable o desfavorablemente a un tratamiento y que monitorizan su respuesta al mismo. Además, los paneles de expresión génica basados en PCR cuantitativa y transcripción reversa sirven para la clasificación molecular de tumores, posibilitando una intervención más efectiva en función de las rutas metabólicas afectadas4.
- d)
Tratamiento. La MP tiene como objetivo final diseñar estrategias terapéuticas basadas en la variabilidad personal. La Farmacogenética relaciona la información genética de cada individuo con su forma de responder al tratamiento, contribuyendo a determinar qué fármaco y qué dosis se deben utilizar para el tratamiento de una enfermedad en un paciente concreto. Por otra parte, las terapias dirigidas basadas en diagnósticos de precisión contribuyen a entender las limitaciones terapéuticas generadas por la heterogeneidad molecular, a establecer protocolos de seguimiento más sensibles y específicos, a detectar y reconducir las posibles resistencias generadas durante el tratamiento, y, por tanto, a conseguir una considerable mejora en las tasas de supervivencia y curación de muchos tumores5.
El nivel de implementación de procesos de MP en España es menor del esperado y se encuentra por debajo del alcanzado en países de nuestro entorno. Muchos son los factores que han provocado la falta de unidades de diagnóstico de referencia, en un momento económico complejo y una situación sanitaria desmembrada por las autonomías. Uno de los principales problemas del desarrollo de la MP en los laboratorios clínicos es la ausencia de una especialidad sanitaria que aborde todos los conocimientos moleculares y tecnológicos de la Genética, así como el manejo e interpretación de los resultados de los test genéticos con el adecuado asesoramiento individualizado. Mientras tanto, se produce una explosión tecnológica que avanza a pasos agigantados.
Se enumeran a continuación algunos de los proyectos internacionales y nacionales en MP:
- •
Coalición de Medicina Personalizada. Fue creada en EE. UU. en 2004 y en la actualidad cuenta con la participación de más de 250 instituciones académicas, empresas biotecnológicas, empresas farmacéuticas y asociaciones de pacientes. Tiene como objetivo la difusión de información sobre los beneficios de la MP y servir de marco para la identificación de posibles barreras de implementación y fomentar políticas facilitadoras6.
- •
Iniciativa en Medicina de Precisión. Se inició en 2015 en EE. UU. con el objetivo de ofrecer atención personalizada a los pacientes con base en el conocimiento de la enfermedad adquirido con la aplicación de los avances en investigación y tecnológicos7.
- •
Proyecto 100.000 genomas. Iniciado en diciembre de 2012 en el Reino Unido, tiene como objetivo secuenciar 100.000 genomas de pacientes del Servicio Nacional de Salud, integrando la información generada con los datos clínicos de manera que sirvan de base para desarrollar tratamientos personalizados para las enfermedades raras y el cáncer8.
- •
Estrategia de Medicina Personalizada. Se inició en Inglaterra en 2015, con el fin de conseguir la integración de la MP en la asistencia sanitaria9.
- •
Plan de Acción de Medicina Personalizada. Presentado en Alemania en 2013, fija los siguientes objetivos a 5 años: a) diagnóstico más rápido y preciso mediante la validación de biomarcadores; b) mejora en los tratamientos mediante la integración de la investigación en la práctica clínica; c) aumento de la inversión de los servicios de salud y de la industria en MP; d) divulgación del conocimiento de la MP en la población general10.
- •
Medicina Genómica Francia 2025. Iniciado en 2016, tiene como objetivo realizar unas 235.000 secuencias completas al año, de las cuales 175.000 serán de pacientes con cáncer metastásico o refractarios al tratamiento, y 60.000 de pacientes con enfermedades raras y sus familias.
- •
Alianza Europea para la Medicina Personalizada. Está formada por expertos sanitarios europeos y representantes de pacientes con enfermedades crónicas. Entre sus componentes se encuentran universidades, organizaciones académicas, organizaciones de pacientes, aseguradoras, e industrias del diagnóstico y farmacéuticas.
Estos son algunos de los proyectos que se están desarrollando en nuestro país:
- •
ELIXIR. Es una infraestructura de datos de Ciencias de la Vida, que tiene como objetivo gestionar, explotar y difundir la información generada por la investigación biomédica. España está representada por el Instituto de Salud Carlos III, que coordina al Instituto Nacional de Bioinformática, el Centro Nacional de Investigaciones Oncológicas y el Centro de Regulación Genómica, entre otros11.
- •
REDIEX –Red de Excelencia e Innovación en Exosomas–. Es una iniciativa financiada por el Ministerio de Economía, Industria y Competitividad que agrupa a 10 centros españoles, con el objetivo de avanzar en la MP orientada al desarrollo de estrategias terapéuticas en cáncer y enfermedades parasitarias.
- •
GCAT –Proyecto Genoma para la Vida de Cataluña–. Diseñado para la identificación de factores genéticos y ambientales que conducen a la aparición de enfermedades crónicas a partir de muestras de 50.000 pacientes12.
- •
Proyecto Genoma Médico. Desarrollado por la Consejería de Salud de la Junta de Andalucía en el año 201113.
La medicina del laboratorio ha ido cambiando su foco de atención desde la tecnología analítica tradicional a la participación global en el manejo de enfermedades, de tal manera que en la actualidad cumple un papel central en el cribado, el diagnóstico, la evaluación pronóstica y el seguimiento del tratamiento14–16.
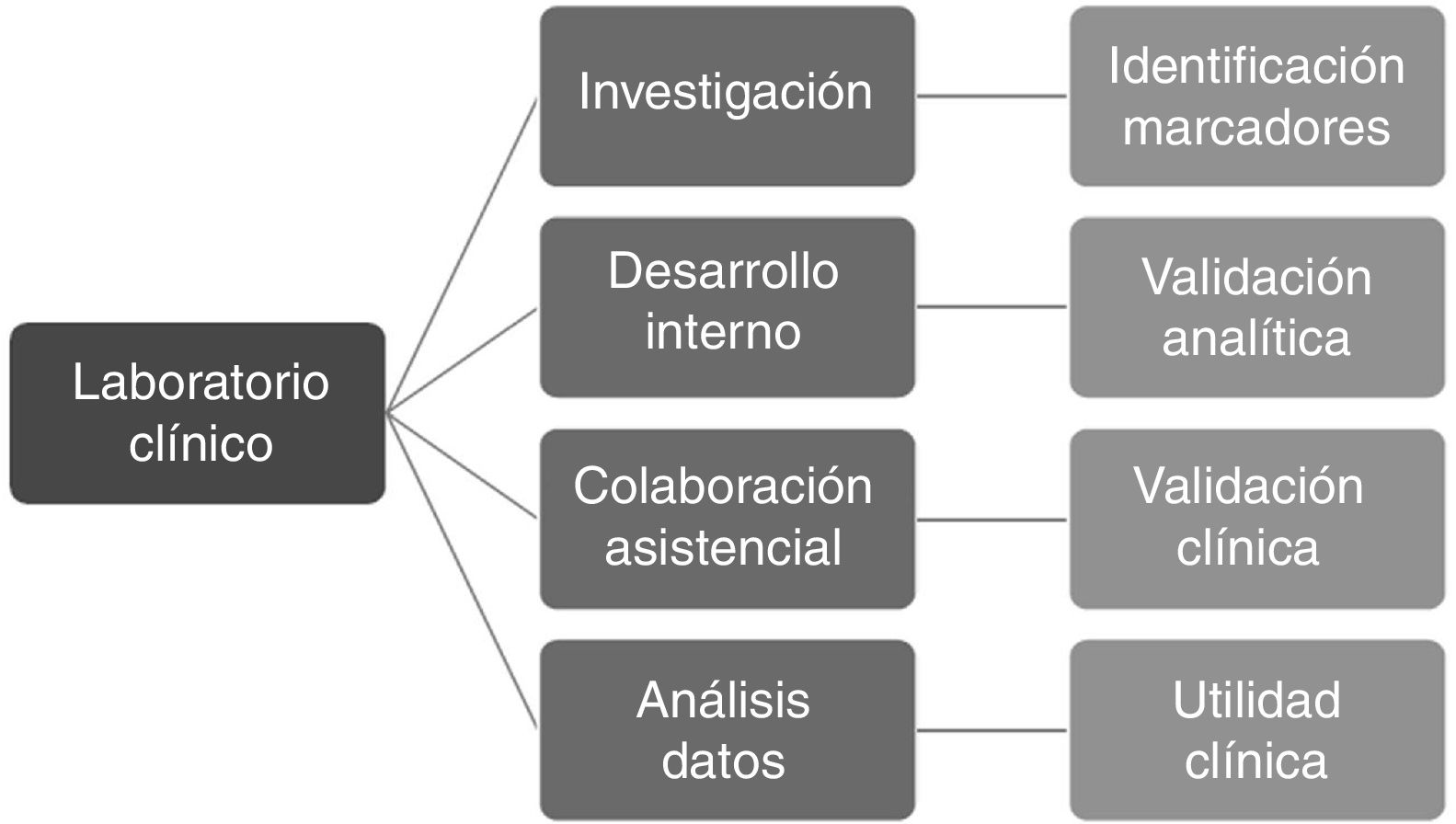
En el caso de la MP, la función del laboratorio en los 4 momentos clave del proceso es (fig. 1):
- 1)
Identificación de nuevos biomarcadores asociados a las distintas enfermedades a través de la aplicación de las tecnologías de alto rendimiento, como proteómica, genómica, metabolómica, etc. Para que esto sea posible, es necesario desarrollar áreas de investigación en los laboratorios clínicos o colaborar con laboratorios de investigación. También es preciso conocer las bases teóricas y el manejo práctico de estas nuevas tecnologías, que deberían formar parte de los programas formativos de los especialistas de laboratorio.
- 2)
Validación técnica de los nuevos marcadores mediante la determinación de las condiciones preanalíticas, la estabilidad del marcador, el análisis de las variaciones intra e interanálisis, los posibles errores y el establecimiento de los controles de calidad adecuados. Esta parte del desarrollo es la que tradicionalmente se ha asignado al laboratorio clínico y se desarrolla íntegramente en su contexto interno.
- 3)
Valoración de la utilidad clínica del test, identificando su papel en el proceso de predicción de riesgo, diagnóstico y valoración pronóstica en comparación con otros posibles test existentes. Para el desarrollo de esta función es imprescindible la colaboración estrecha del profesional del laboratorio con los clínicos con funciones directas de asistencia mediante la generación de grupos de trabajo específicos, y el seguimiento de los pacientes estudiados.
- 4)
Emisión de informes que incluyan no solo el resultado obtenido, sino la interpretación del mismo aplicada al paciente, con base en el conocimiento de las características personales y clínicas del mismo. Teniendo en cuenta la gran cantidad de datos generados por los equipos diagnósticos de alto rendimiento, estos informes deben estar basados en el análisis y la interpretación estadística de los datos (bioinformática). Esta parte del proceso debe llevarse a cabo conjuntamente con informáticos especializados en big data, para el desarrollo de algoritmos que faciliten la interpretación.
La mayoría de las aplicaciones de la MP que se realizan hoy día están basadas en el estudio del genoma. Sin embargo, cada vez son más numerosos los proyectos de investigación encaminados a elucidar los cambios producidos por un estado patológico a otros niveles (epigenoma, ARN, proteínas, metabolitos o microbiota). Estos estudios se han beneficiado de tecnologías next generation sequencing, desarrolladas en la era posgenómica, y de la extensión del empleo de la espectrometría de masas. El futuro de la MP debe tener como objetivo final la integración de todos los datos ómicos junto con el resto de la historia clínica, lo que requerirá indudablemente de un desarrollo paralelo y de igual importancia de la bioinformática17.
- 1.
Secuenciación de ADN. Las técnicas basadas en la secuenciación simultánea de millones de fragmentos de ADN, la detección automática de las reacciones y el análisis bioinformático de las variantes han permitido el desarrollo de la MP, a partir de la secuenciación de paneles de genes, exomas (regiones codificantes) y/o genomas completos, con costes asequibles y tiempos razonables. Esta «secuenciación masiva» permite estudiar el ADN libre circulante y el desarrollo de nuevas estrategias de diagnóstico prenatal y oncológico18.
- 2.
Epigenómica. La epigenética constituye aquellas modificaciones en la expresión génica que son independientes de la secuencia del ADN19. Por ejemplo, la metilación del ADN en las islas CpG de las regiones promotoras de los genes bloquea la expresión génica. Por otro lado, la modificación de histonas mediante diversas actividades enzimáticas (principalmente metilación, acetilación, fosforilación y ubiquitinación) puede conducir a un remodelado de la cromatina que también influye en la expresión génica. Algunas de las aplicaciones y desarrollos que emplean la epigenética como herramienta dentro de la MP han sido compiladas en un libro reciente20.
- 3.
Transcriptómica y microARN. Los primeros estudios transcriptómicos que analizaban la expresión génica mediante el estudio del ARN mensajero tuvieron lugar a principios de los años 90 empleando técnicas basadas en chips (arrays). Hoy día se emplean métodos next generation sequencing (como RNA-Seq), con importantes implicaciones clínicas en MP, como en el caso de las variantes oncogénicas por splicing en ciertos receptores celulares21. Por su lado, los microARN son pequeñas moléculas conservadas de ARN no codificante (20-24 nucleótidos) que participan en la regulación post-transcripcional del ARN mensajero. La caracterización del perfil de microARN podría ser de utilidad para la detección del cáncer, predecir su curso, elegir el tratamiento y adaptarlo a la respuesta del paciente22. Las especiales características de este tipo de ARN (estabilidad, fácil extracción y detección y especificidad de tejido) lo sitúan como uno de los más prometedores marcadores en MP.
- 4.
Proteómica. La utilización de la espectrometría de masas en el análisis del conjunto de proteínas de una muestra específica ha conseguido expandir su aplicabilidad al ámbito clínico y a la MP. Su principal argumento respecto a otros enfoques es que las proteínas constituyen las moléculas funcionales, a diferencia del ADN y el ARN, que solo contienen información, y, por tanto, son en muchos casos la diana final de los tratamientos terapéuticos. La metodología más habitual en proteómica es la basada en la separación cromatográfica acoplada a espectrometría de masas, mientras que los procedimientos basados en microarrays e inmunohistoquímica (que emplean anticuerpos) se utilizan en estudios dirigidos a identificar grupos de proteínas más específicos23. Otra de sus ventajas es la capacidad de identificar cambios postraduccionales, que son muchas veces determinantes en la actividad de las proteínas. El más conocido de ellos es la fosforilación, que juega un papel clave en la activación/inactivación de proteínas (cinasas) implicadas en las cascadas de señalización intracelular que se desencadenan en respuesta a estímulos externos. Estos biomarcadores o dianas terapéuticas son especialmente relevantes en el cáncer, donde estas cascadas se encuentran desreguladas, contribuyendo al desarrollo y la progresión de los tumores24. Otra modificación que puede ser estudiada mediante técnicas proteómicas es la glucosilación, que en receptores o proteínas de membrana podría ayudar a diferenciar las células cancerosas de las células normales.
- 5.
Metabolómica. La metabolómica supone el estudio de todas las moléculas pequeñas (con un peso molecular inferior a 1.500Da) y su concentración en una determinada muestra o matriz biológica. Las alteraciones a nivel metabólico son el resultado de la compleja interacción que existe entre la expresión génica, la actividad enzimática y las reacciones metabólicas. El desarrollo tecnológico de las plataformas que permiten su estudio (basadas mayormente en la espectrometría de masas, al igual que la proteómica), así como de las herramientas para el análisis de datos, que permite la cuantificación de miles de metabolitos en un solo ensayo, ha facilitado su extensión a ciertos ámbitos del laboratorio clínico, especialmente para el descubrimiento de nuevos biomarcadores. Como en el resto de las aproximaciones, el mayor número de estudios sobre su utilidad como herramienta en la MP han sido sobre cáncer. Diversos trabajos han asociado la reprogramación celular que tiene lugar durante el proceso de oncogénesis con cambios a nivel metabólico, de modo que la metabolómica sería una estrategia adecuada para identificar los cambios bioquímicos que, de forma dinámica, son producidos por la proliferación celular incontrolada25.
- 6.
Microbioma (metagenómica). El cuerpo humano está colonizado por un ingente número de microorganismos que son conocidos en conjunto como microflora o microbiota. Se encuentra localizada en la piel, la boca, el tracto respiratorio, el tracto urogenital y, sobre todo, en el tracto digestivo, y ejerce un papel fundamental como simbionte en numerosos procesos fisiológicos. El rol protector del buen estado de salud de los humanos que desempeña la microbiota intestinal puede verse afectado cuando se producen cambios en su composición (proceso conocido como disbiosis). Estas alteraciones de la homeostasis microbiana intestinal se han relacionado con diversas enfermedades, no solo del tracto digestivo26, sino también otros tipos tan dispares como cáncer o enfermedades neurodegenerativas27. Aunque no se conoce con exactitud si estos cambios son causa o consecuencia de la enfermedad, el empleo de técnicas para el estudio del metagenoma (análisis de varios genomas, en este caso bacterianos, simultáneamente) permite identificar de forma personalizada qué tipo de alteraciones se han producido en la microbiota. Esta posibilidad abre la puerta al desarrollo de biomarcadores y tratamientos individualizados específicos (mediante fármacos, antibióticos, pre o probióticos, trasplante de microbiota fecal y/o cambios en la dieta), dirigidos a identificar y corregir el tipo particular de disbiosis presente.
Uno de los ejemplos donde estos enfoques se están aplicando por parte de algunos laboratorios comerciales es el caso de la MP para clasificar el riesgo de los tumores de próstata en ciertos casos concretos28. Así, los siguientes ensayos han sido desarrollados en base a cuatro de las estrategias posgenómicas descritas en este apartado: ConfirmMDx está basado en la epigenómica, Prolaris Score en la expresión génica, ProMark en el análisis de un panel de 8 proteínas y Prostarix en metabolómica sobre muestras de orina.
Retos de la medicina personalizadaLa transición desde la medicina tradicional, basada en un concepto poblacional de la enfermedad, a una MP, que intenta proporcionar una predisposición individualizada para la enfermedad y/o un tratamiento adecuado a un individuo particular en el momento apropiado, parece un viaje que inevitablemente tendrá lugar en un futuro más o menos próximo. Sin embargo, numerosas cuestiones surgen alrededor de cómo se implementará este tipo de medicina en la práctica diaria de los laboratorios, lo cual supone un reto de gran envergadura29. Estos obstáculos que habrá que superar van desde los puramente científicos, como la correcta validación de biomarcadores a través de la translación de la investigación básica a la práctica, hasta aquellos más relacionados con aspectos sociales, como las cuestiones éticas que hay detrás del acceso a los datos genéticos de un individuo o la gestión de dicha información30.
Una de las iniciativas encaminadas a averiguar la postura de los especialistas del laboratorio clínico respecto al reto que supone la MP fue la encuesta auspiciada por la Federación Europea de Química Clínica y Medicina de Laboratorio y la Sociedad Europea de Farmacogenómica y Terapia Personalizada31. En dicha encuesta participaron 48 laboratorios de 18 países europeos, que respondieron a un cuestionario que incluía 5 partes sobre diferentes aspectos relacionados con la MP. Como conclusión, se destacan 4 puntos que requerirían un especial refuerzo dentro de la organización del laboratorio: adquisición de nuevas aplicaciones tecnológicas dentro de las plataformas ómicas, cursos de formación para el personal sobre estas nuevas tecnologías, incorporación de nuevas competencias en interpretación de datos (bioinformática y estadística) y colaboración adicional con profesionales de otras disciplinas.
A pesar de que la gran mayoría de los laboratorios reconoce la importancia que pueden jugar los especialistas de nuestra área y sus sociedades científicas en la implementación de la MP, las exigencias identificadas en esta encuesta traen consigo la idea de que solo aquellos centros con un contacto más cercano entre las actividades de investigación y la práctica clínica estarían en una situación inicial favorable para ejercer un papel relevante.
Otra de las organizaciones del ámbito europeo que ha realizado una contribución a los retos que deben superarse en la implementación de la MP es PerMed, una acción de coordinación y apoyo formada por 27 integrantes y financiada en el 7.o Programa Marco de Investigación de la Unión Europea. En su documento «Agenda Estratégica de Investigación e Innovación»32 recogen los 5 puntos que, en opinión de estos expertos, son prioritarios para promover la MP en todos sus aspectos:
- 1.
Desarrollo del conocimiento en ciudadanos y pacientes. Implica la toma de medidas para facilitar el entendimiento de la MP en la población general, así como un empleo adecuado de sus herramientas y recursos33. Además, los pacientes deberían firmar consentimientos informados que deben estar elaborados en función del tipo de estudio particular que se pretende llevar a cabo34.
- 2.
Integración de datos y recursos tecnológicos informáticos y de comunicación. El desarrollo de bases de datos que puedan integrar de una forma eficiente y sostenible todos los datos de un paciente es uno de los aspectos clave. Estas deben estar orientadas a contener no solo la información generada por las plataformas ómicas, sino también la relativa a los datos clínicos para proporcionar a los pacientes medidas preventivas o terapéuticas personalizadas35.
- 3.
Trasladar los logros de la investigación básica al contexto de la práctica clínica. Debe favorecerse una interacción de los resultados de investigación con sus aplicaciones para identificar nuevas dianas de tratamiento y/o nuevos marcadores de la enfermedad. Para lograr este objetivo, se requiere una financiación sostenida, además de pensada y diseñada con la intención de evitar el malgasto económico36.
- 4.
Llevar la innovación al mercado. Es importante desarrollar una regulación que garantice la seguridad del paciente, la eficacia y la eficiencia de los nuevos descubrimientos y que contenga controles de calidad y supervisión rigurosos.
- 5.
Implementación dentro de un sistema de salud sostenible. Los logros en MP han de ser valorados teniendo en cuenta que su puesta en marcha no debe poner en riesgo la sostenibilidad económica de todo el sistema sanitario37.
En este mismo documento se exponen 35 recomendaciones encaminadas a superar estos 5 retos que trae consigo la MP. Algunas de ellas ya se están llevando a cabo gracias a la colaboración de diversos organismos europeos o a nivel nacional dentro de algunos de los países.
ConclusionesLas partes implicadas en la asistencia sanitaria tienen distintas expectativas ante las promesas de la MP. Los pacientes buscan conocer mejor su enfermedad y que este conocimiento implique tratamientos más efectivos con menos efectos secundarios. Los médicos comparten estas expectativas, pero conocen la dificultad de interpretación de los resultados y el acceso a las pruebas. Las organizaciones sanitarias temen además que estas nuevas tecnologías supongan un incremento en los gastos sanitarios, que haga peligrar el sistema. Las empresas farmacéuticas ven a la vez una oportunidad de desarrollo y el riesgo de que algunos fármacos, que se utilizan en la actualidad y reportan beneficios, pasen a ser obsoletos. Con el fin de que estas innovaciones no desencadenen un efecto desestabilizador, es preciso conocer bien las posibilidades, valorar los costes, medir la eficacia, constatar la seguridad y reconocer las dificultades y fallos que vayan surgiendo. Los profesionales de laboratorio tenemos un papel primordial en el desarrollo de las pruebas, la validación de las mismas, la interpretación de los resultados y la valoración de su utilidad clínica. El futuro es brillante, el camino es largo y los retos que se plantean son estimulantes.
Los autores agradecen a la Asociación Española de Biopatología Médica-Medicina de Laboratorio (AEBM-ML) su interés en la creación del Comité de Medicina Personalizada y su estímulo para el desarrollo de iniciativas dentro de la misma.