La determinación de inmunoglobulinas en suero y, concretamente de IgG y de subclases de IgG, es fundamental para el diagnóstico clínico de numerosas patologías. Los métodos de detección habituales proporcionan resultados diferentes según el analizador utilizado. El objetivo de este estudio fue comparar los resultados obtenidos mediante dos analizadores diferentes para la concentración de IgG y de subclases de IgG.
Materiales y métodosSe analizaron un total de 116 muestras de suero, independientemente del diagnóstico clínico de los pacientes a los que pertenecían dichas muestras. Los análisis se realizaron sobre las plataformas BNII® System (Siemens Healthcare GmbH, Alemania) y Optilite® (The Binding Site Group Ltd., Birmingham).
ResultadosLa correlación entre la concentración de IgG total (mg/dl) y el sumatorio de las concentraciones de subclases de IgG detectadas de manera individual fue mayor usando el analizador Optilite® (0,976 vs. 0,866). El porcentaje de concordancia varió del 43% hasta 71%, siendo el límite inferior para la concordancia de IgG3. Se detectó una ausencia de la proporción fisiológica normal de subclases de IgG (IgG1>IgG2>IgG3>IgG4) al utilizar BNII®. Dichos resultados fueron consecuencia de que la concentración de IgG3 por BNII® fue significativamente inferior a la obtenida por Optilite® (p<0,001), mientras que la concentración de IgG4 no fue significativamente diferente entre analizadores (p=0,117).
ConclusionesLas diferencias existentes entre los resultados obtenidos por ambos métodos analíticos utilizados sugieren que dichos ensayos no deben ser intercambiables, sino que cada laboratorio debe utilizar un único analizador y estandarizar los rangos de referencia según sus resultados.
The quantification of serum immunoglobulins, and particularly of IgG and IgG subclasses, is of interest for the diagnosis of numerous diseases. The usual detection methods provide different results according to the analyser used. The aim of this study was to compare the results obtained with two different analysers in the measurement of the concentration of IgG and IgG subclasses.
Material and methodsA total of 116 serum samples, regardless of the clinical diagnosis of the patients to whom the samples belonged, were analysed. The analyses were performed on a BNII® System (Siemens Healthcare GmbH, Germany) and Optilite® system (The Binding Site Group Ltd., Birmingham).
ResultsThe correlation between total IgG concentration (mg/dl) and the sum of the individual IgG subclasses detected was higher using the Optilite® analyser (0.976 vs. 0.866). The percentage of agreement between assays ranged from 43% to 71%, with the lower limit being for the IgG3 agreement. An absence of the usual IgG subclass physiological proportion (IgG1>IgG2>IgG3>IgG4) was detected using BNII®. These findings were a due to the significantly lower proportion of IgG3 obtained by BNII® compared to Optilite® (P<.001), whereas the IgG4 concentration was not significantly different between analysers (P=.117).
ConclusionsDifferences between the results obtained with the two different methods suggest that they should not be interchangeable, and that each clinical laboratory should only use one type of analyser. The reference ranges should be standardised according to the results obtained.
Las inmunoglobulinas son glicoproteínas que pueden encontrarse de forma soluble en plasma y otros fluidos corporales. Son las moléculas efectoras del sistema inmune humoral y actúan como receptores de membrana de los linfocitos B1. En el ser humano se han descrito cinco tipos de inmunoglobulinas con características y funciones diferentes: IgG, IgA, IgM, IgD e IgE. Todas ellas están constituidas por dos cadenas pesadas y dos cadenas ligeras que forman dímeros unidos por puentes disulfuro2.
La cuantificación de inmunoglobulinas es un método rutinario que se lleva a cabo en los laboratorios clínicos para evaluar el estado del sistema inmune cuando se sospecha de la existencia de un desequilibrio fisiológico, siendo especialmente interesante en el diagnóstico de inmunodeficiencias primarias, gammapatías monoclonales y otras enfermedades3–5. Particularmente, la IgG es la inmunoglobulina más abundante en suero y durante la respuesta inmune secundaria, siendo, además, la única capaz de atravesar la barrera placentaria. Existen cuatro subclases de IgG (IgG1, IgG2, IgG3 e IgG4), cada una de las cuales se diferencian estructuralmente en su región bisagra y en el número de puentes disulfuro que unen las cadenas pesadas6. Debido a sus diferencias estructurales, las cuatro subclases de IgG también desempeñan funciones biológicas diferentes.
La concentración de IgG y de subclases de IgG en el suero de un individuo sano depende de la edad, del estado de maduración del sistema inmune y de factores genéticos y ambientales7. Así, los rangos normales de concentración se han intentado establecer conforme a dichas características y los diferentes métodos de detección existentes8–10. A pesar de que dichos niveles pueden variar entre adultos sanos, la proporción de cada subclase se mantiene en unos rangos relativos: IgG1 60-65%; IgG2 20-25%; IgG3 5-10%; IgG4 3-6%11,12.
En la actualidad los métodos que permiten la cuantificación de inmunoglobulinas en suero más utilizados en los laboratorios clínicos se basan en principios turbidimétricos y nefelométricos. La nefelometría, método de referencia, es un procedimiento analítico dependiente de la capacidad que tienen las partículas de la materia de dispersar la radiación cuando esta las atraviesa13. La turbidimetría, por su parte, cuantifica la disminución de la intensidad de radiación que se produce al atravesar esta una muestra problema. La dispersión y la disminución de la radiación al atravesar una muestra problema están relacionadas con el número de partículas suspendidas en ella, su tamaño, su forma, los índices de refracción de la partícula y el medio y la longitud de onda de la radiación dispersada. Ambos métodos presentan ventajas e inconvenientes, el principal de los cuales es la difícil estandarización de unos rangos de referencia homogéneos14. De hecho, no existen referencias internacionales de estandarización y calibración de los analizadores, y los dos principales proveedores de kits para el análisis de subclases de IgG utilizan estrategias de calibración diferentes15.
Recientemente, el grupo The Binding Site ha diseñado una nueva plataforma en la que mediante principios turbidimétricos es posible detectar y cuantificar las subclases de inmunoglobulinas en suero. Dicha plataforma presenta ciertas ventajas frente a los tradicionales nefelómetros, como los amplios rangos de medición que es capaz de detectar, mejoras metodológicas para minimizar el efecto prozona y la calibración conforme a los estándares internacionales más recientes, que garantiza unos resultados precisos y fiables. Además, la utilización de reactivos líquidos específicos reduce el tiempo de manipulación, mejorando el rendimiento y la eficiencia16.
El objetivo de este estudio fue comparar los resultados obtenidos al analizar la concentración de IgG total y de las subclases de IgG en suero mediante una plataforma cuyos principios analíticos se basan en métodos nefelométricos (BNII® System, Siemens Healthcare GmbH, Alemania) y la nueva plataforma diseñada por The Binding Site (Optilite®, The Binding Site Group Ltd., Birmingham), cuyos principios analíticos se basan en métodos turbidimétricos y comprobar si existen diferencias entre los resultados obtenidos por uno y otro sistema analizador.
Material y métodosSelección y análisis de las muestrasSe analizaron todas aquellas muestras de suero que de rutina se recibieron en el Laboratorio de Inmunología del Hospital Universitario Reina Sofía de Córdoba a lo largo de 6 meses de forma consecutiva (n=116). No se tuvo en cuenta el diagnóstico clínico de los pacientes a los que pertenecían las muestras analizadas. Las muestras de suero se obtuvieron mediante venopunción y se centrifugaron a 3.000rpm durante 5 min a temperatura ambiente para separar el suero del resto de componentes de la sangre. Todas las muestras se conservaron a 4°C y se analizaron en las 2-3 h siguientes a su obtención. El estudio se llevó a cabo siguiendo los principios de la Declaración de Helsinki. Los pacientes no recibieron ninguna intervención adicional a la práctica clínica habitual.
La concentración de IgG y de subclases de IgG (IgG1-4) se determinó mediante nefelometría utilizando la plataforma BNII® System (Siemens Healthcare GmbH, Alemania) y los reactivos correspondientes (IgG ref. OSAS, IGg1 ref. OQXI, IgG2 ref. OQXK, IgG3 ref. OPAV, IgG4 ref. OPAU). Dichas muestras se analizaron paralelamente mediante turbidimetría en la plataforma Optilite® (The Binding Site Group Ltd., Birmingham), utilizando los reactivos correspondientes (IgG ref. NK004.OPT, IGg1 ref. NK006.OPT, IgG2 ref. NK007.OPT, IgG3 ref. LK008.OPT, IgG4 ref. LK009.OPT). El lote de reactivos fue siempre el mismo en todos los casos. Todos los análisis se llevaron a cabo siguiendo las instrucciones del fabricante. La calibración de cada plataforma se realizó diariamente siempre antes de comenzar con el análisis de las muestras. Todos los resultados se expresaron en mg/dl.
Estudio estadísticoPara analizar de forma individual los resultados obtenidos en cada equipo se calcularon la media, los valores máximos y mínimos, la desviación estándar (DE) y el coeficiente de variación (CV) para cada una de las variables de estudio. Además, se determinó el coeficiente de correlación lineal de Pearson entre la concentración de IgG total y la calculada a partir de suma de las concentraciones individuales de las subclases de IgG (IgG suma).
El coeficiente de correlación lineal de Pearson ha sido el test más empleado para la comparación entre dos métodos de medición, sin embargo, como expusieron en 1986 Altman y Bland, no es el más adecuado, ya que dicho estadístico cuantifica la asociación lineal entre dos variables, pero no el grado de acuerdo entre ellas17. Una alternativa adecuada es el coeficiente de correlación intraclase (CCI). Aunque también puede presentar ciertas limitaciones18,19, el CCI puede emplearse como un estadístico complementario al método de Bland-Altman.
Por estos motivos, para establecer la concordancia entre ambos equipos, se emplearon la correlación lineal de Pearson, el CCI y el método de Bland-Altman, confrontando las variables proporcionadas por BNII® y Optilite®. Los resultados se representaron mediante gráficas de dispersión de puntos y gráficas de Bland-Altman. La fuerza de concordancia determinada por el CCI se clasificó en 5 categorías (Fleiss 1981): sin acuerdo (<0%), pobre (<40%), moderado (40-59%), bueno (60-74%) y excelente (>74%).
Por último, se realizó el test t de Student de datos emparejados para comparar la media de las concentraciones de las subclases de IgG1-4 obtenidas por ambos analizadores y se representaron los resultados gráficamente.
Tanto los valores de p inferiores a 0,05, como los intervalos de confianza de 95% que no incluyeron el valor 1, se consideraron estadísticamente significativos.
Para los análisis de correlación lineal de Pearson, CCI y test t de Student se empleó el programa IBM SPSS Statistics (versión 22). Para analizar los resultados mediante el método de Bland-Altman se utilizó el software estadístico EPIDAT (versión 4.2).
ResultadosDescripción de la población de estudioDe los 116 sujetos cuyas muestras fueron analizadas, 65 fueron mujeres (56%) y 51 hombres (44%). La edad media fue 41 años (±25 años), siendo la edad mínima 4 y la máxima 87 años. En cuanto a las patologías registradas (N=112), únicamente 37 (33%) muestras pertenecieron a pacientes diagnosticados de algún tipo de inmunodeficiencia, de las cuales, las tres más frecuentes en orden decreciente fueron: deficiencia selectiva de IgA (24,3%), inmunodeficiencia común variable (16,2%) e hipogammaglobulinemia (1,8%). Por otro lado, el resto de los pacientes (75 muestras, 67%) fueron diagnosticados de patologías no catalogadas como inmunodeficiencias, siendo las 3 más frecuentes: bronquiectasias (16%), bronquitis (12%) y artritis aguda (9,3%).
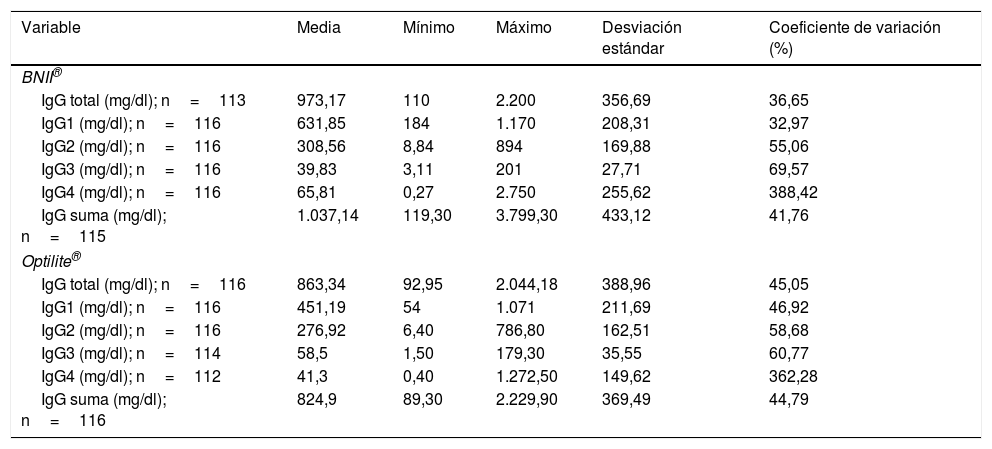
Análisis individual de los resultados obtenidos en cada equipoLos resultados obtenidos mediante los sistemas BNII® y Optilite® para la cuantificación de la concentración de IgG total, de las cuatro subclases de IgG (IgG1-4) y de la IgG suma se muestran en la tabla 1. Para conocer la relación entre el tamaño de la media y la variabilidad de los valores de cada variable de estudio se calcularon los CV. Curiosamente, para ambos equipos los CV de las subclases IgG3 y, especialmente, IgG4 fueron más elevados con respecto al resto, lo que sugiere una mayor heterogeneidad entre los valores que toman dichas variables para la cohorte de estudio.
Resultados obtenidos para la cuantificación de las variables de estudio por los analizadores BNII® y Optilite®
| Variable | Media | Mínimo | Máximo | Desviación estándar | Coeficiente de variación (%) |
|---|---|---|---|---|---|
| BNII® | |||||
| IgG total (mg/dl); n=113 | 973,17 | 110 | 2.200 | 356,69 | 36,65 |
| IgG1 (mg/dl); n=116 | 631,85 | 184 | 1.170 | 208,31 | 32,97 |
| IgG2 (mg/dl); n=116 | 308,56 | 8,84 | 894 | 169,88 | 55,06 |
| IgG3 (mg/dl); n=116 | 39,83 | 3,11 | 201 | 27,71 | 69,57 |
| IgG4 (mg/dl); n=116 | 65,81 | 0,27 | 2.750 | 255,62 | 388,42 |
| IgG suma (mg/dl); n=115 | 1.037,14 | 119,30 | 3.799,30 | 433,12 | 41,76 |
| Optilite® | |||||
| IgG total (mg/dl); n=116 | 863,34 | 92,95 | 2.044,18 | 388,96 | 45,05 |
| IgG1 (mg/dl); n=116 | 451,19 | 54 | 1.071 | 211,69 | 46,92 |
| IgG2 (mg/dl); n=116 | 276,92 | 6,40 | 786,80 | 162,51 | 58,68 |
| IgG3 (mg/dl); n=114 | 58,5 | 1,50 | 179,30 | 35,55 | 60,77 |
| IgG4 (mg/dl); n=112 | 41,3 | 0,40 | 1.272,50 | 149,62 | 362,28 |
| IgG suma (mg/dl); n=116 | 824,9 | 89,30 | 2.229,90 | 369,49 | 44,79 |
Se eliminaron los valores extremos de concentración de IgG4, escogiendo aquellos que presentaban un valor de 3 o más en la puntuación típica (z), de tal forma que para BNII® solo se eliminó un valor, con z=10 (IgG4=2.750mg/dl), mientras que para Optilite® se eliminaron dos, z=8 (IgG4=1.272mg/dl) y z=6 (IgG4=978mg/dl). Entonces, se calculó de nuevo el CV para la concentración de IgG4 y se obtuvo una disminución para ambos analizadores: 109,6% para BNII® (n=115) y 96,8% para Optilite® (n=114). Uno de los datos excluidos fue común para ambos analizadores. Se trataba de un valor de IgG4 para la muestra de un individuo diagnosticado de angioedema (z=10 y z=8, para BNII® y Optilite® respectivamente). El otro dato excluido se obtuvo al analizar la muestra de un paciente diagnosticado de bronquiectasias. La eliminación de estos valores extremos disminuyó el CV, aunque este permaneció siendo elevado.
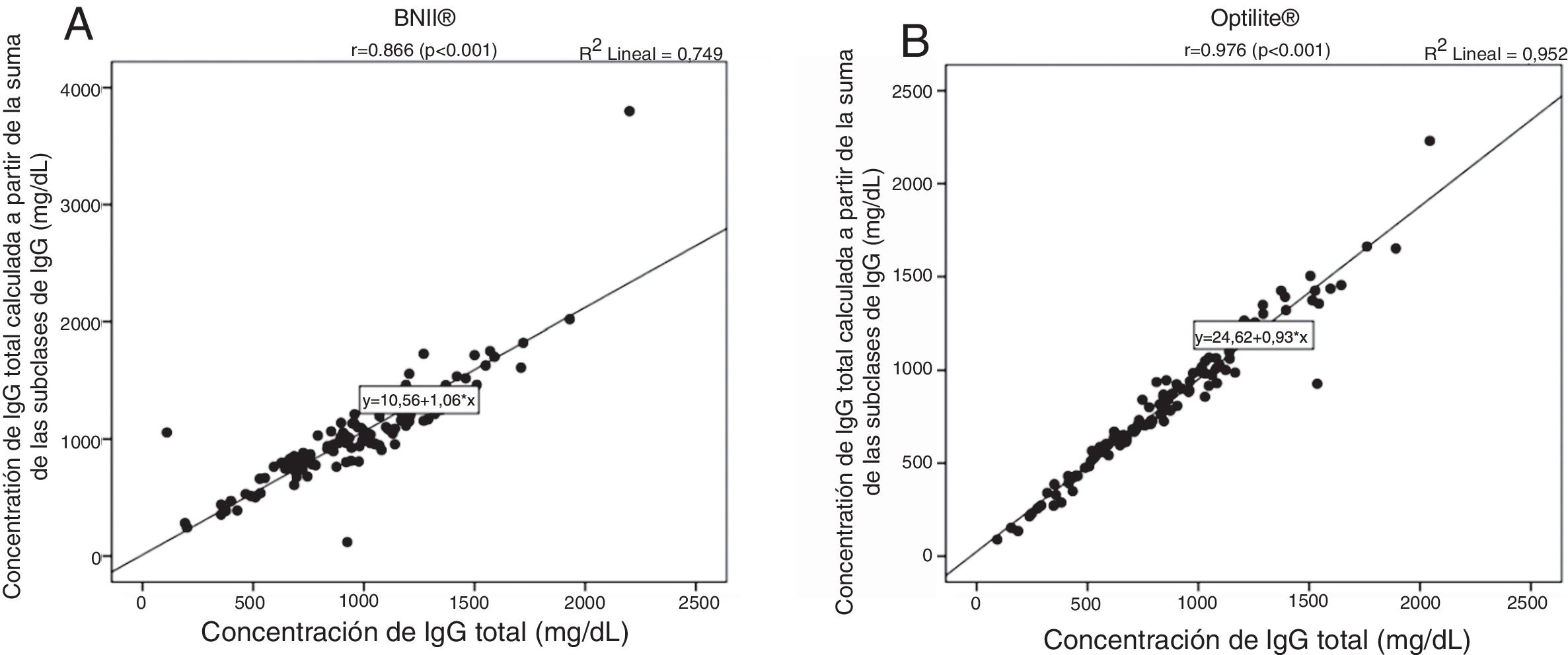
Por otra parte, con el fin de valorar si cada equipo, de forma individual, cuantificaba adecuadamente la concentración de IgG total y las subclases de IgG, se calculó el coeficiente de correlación lineal de Pearson entre la concentración de IgG total y la IgG suma. Tanto para el analizador BNII® como para el analizador Optilite®, las variables estudiadas presentaron una correlación lineal y directa (p<0,05), aunque dicha correlación fue más fuerte para el analizador Optilite® (r=0,976) que para el analizador BNII® (r=0,866; fig. 1).
Correlación entre la cuantificación de IgG total e IgG suma. Gráficos de dispersión de puntos para la correlación entre la concentración de IgG total (mg/dl) y la IgG total resultado de la suma de las concentraciones de las subclases de IgG o IgG suma (mg/dl) en el ensayo BNII® (A) y en el ensayo Optilite® (B). Correlación determinada mediante el coeficiente de correlación de Pearson.
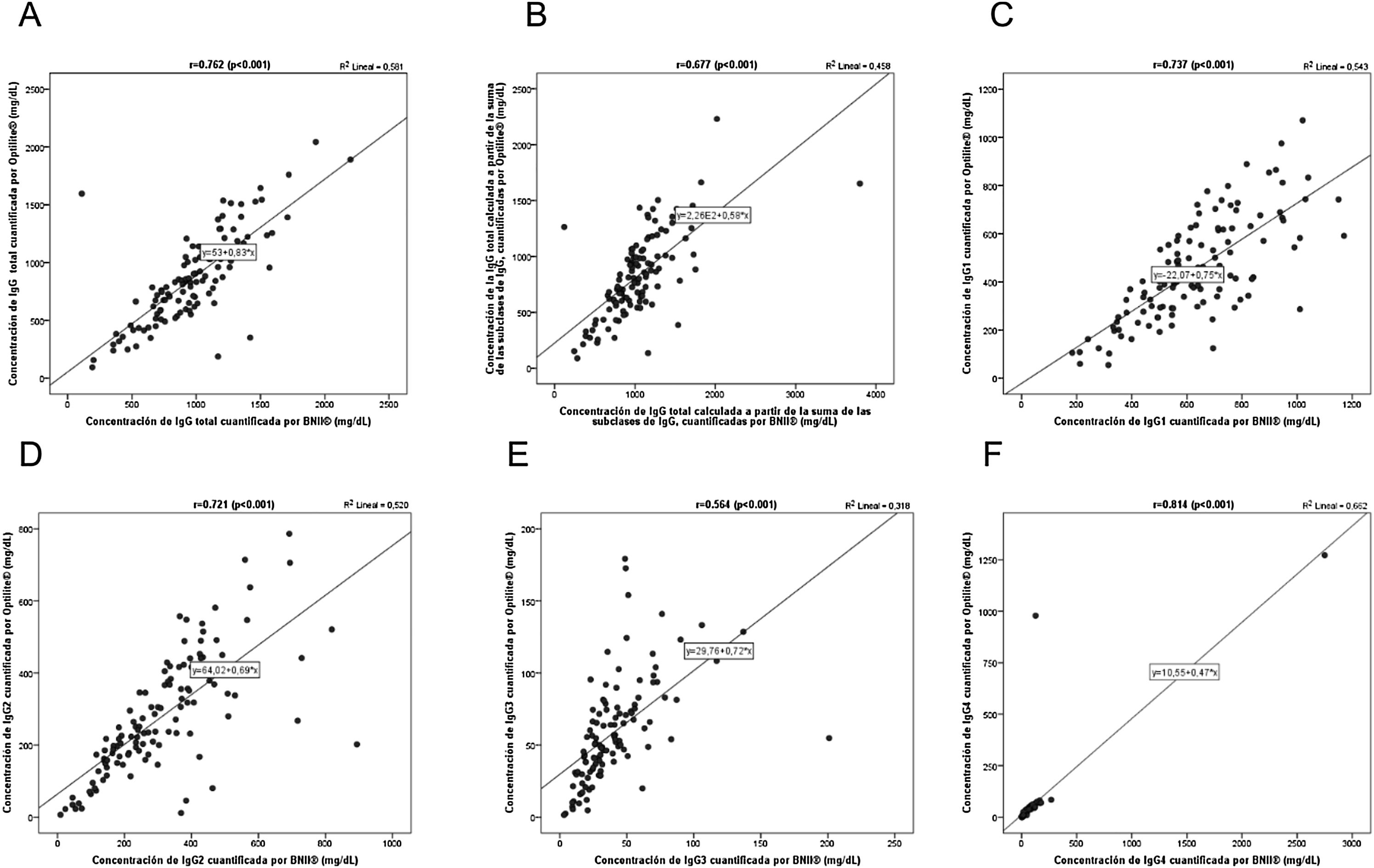
Para analizar la existencia de correlación entre los resultados obtenidos por los analizadores BNII® y Optilite®, en primer lugar, se calculó el coeficiente de correlación lineal de Pearson con las variables concentración total de IgG, IgG suma y concentración de subclases de IgG (fig. 2).
Correlación para las diferentes variables de estudio entre los dos analizadores BNII® y Optilite®. Gráficos de dispersión de puntos para la comparación entre los ensayos BNII® y Optilite® de las concentraciones (mg/dl) de: IgG total (A), IgG total calculada a partir de la suma de las concentraciones de subclases de IgG o IgG suma (B), IgG1 (C), IgG2 (D), IgG3 (E), IgG4 (F). Correlaciones determinadas mediante el coeficiente de correlación de Pearson.
Los análisis revelaron una correlación lineal directa para todas las variables (p<0,05), siendo los coeficientes de correlación para la concentración total de IgG, IgG1, IgG2 e IgG4 de r=0,762; 0,737; 0,721; 0,814; respectivamente. Sin embargo, para la concentración de IgG3 e IgG suma, los valores del coeficiente de correlación fueron más débiles (r=0,564 y r=0,677; respectivamente).
A continuación, para determinar el grado de concordancia entre los resultados obtenidos por los analizadores BNII® y Optilite® se calculó el CCI. Se detectó un grado de concordancia bueno para la concentración de IgG total (72,5%; IC95% 62,4-80,2), IgG2 (70,7%; IC95% 60,3-78,7) e IgG4 (70%; IC95% 59,2-78,3) y moderado para la concentración de IgG suma (56,4%; IC95% 42,6-67,7), IgG1 (46,7%; IC95% 31,2-59,8) e IgG3 (42,9%; IC95% 26,7-56,7), siendo todos los CCI estadísticamente significativos (p<0,05). Estos resultados sugieren que ambos analizadores estaban bien calibrados, debiéndose las diferencias observadas en la concordancia a la variabilidad biológica.
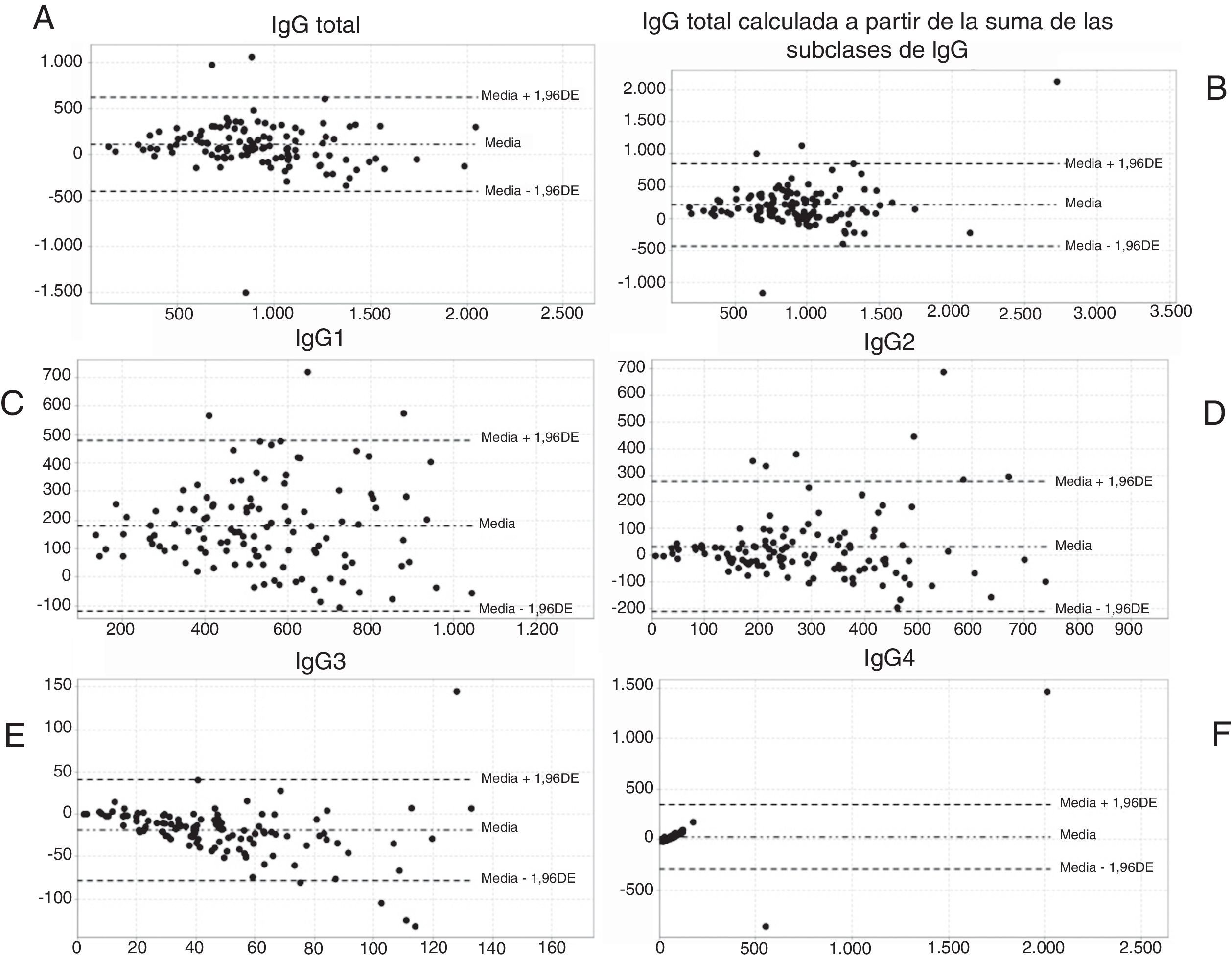
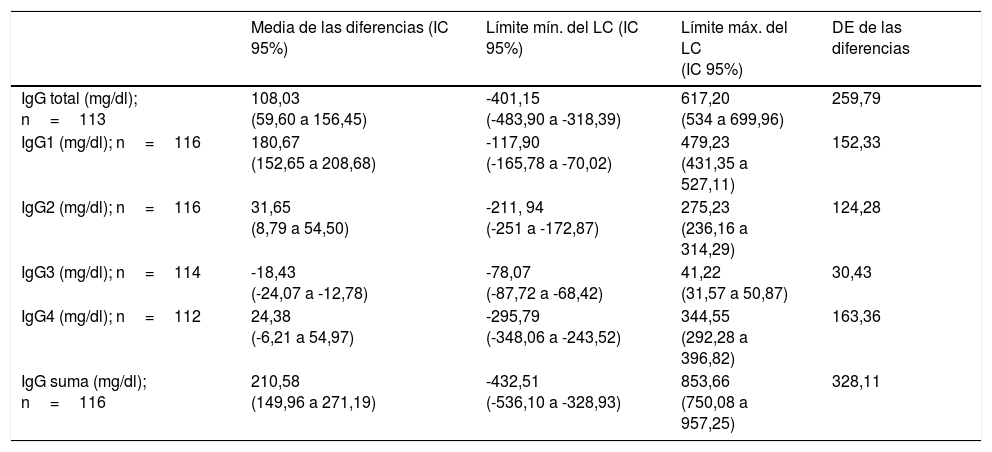
También se usó el método de Bland-Altman para representar la concordancia entre los resultados obtenidos por los analizadores BNII® y Optilite® para las diferentes variables estudiadas (tabla 2 y fig. 3).
Resultados obtenidos de la estimación de la concordancia de los equipos BNII® y Optilite® por el método de Bland-Altman
| Media de las diferencias (IC 95%) | Límite mín. del LC (IC 95%) | Límite máx. del LC (IC 95%) | DE de las diferencias | |
|---|---|---|---|---|
| IgG total (mg/dl); n=113 | 108,03 (59,60 a 156,45) | -401,15 (-483,90 a -318,39) | 617,20 (534 a 699,96) | 259,79 |
| IgG1 (mg/dl); n=116 | 180,67 (152,65 a 208,68) | -117,90 (-165,78 a -70,02) | 479,23 (431,35 a 527,11) | 152,33 |
| IgG2 (mg/dl); n=116 | 31,65 (8,79 a 54,50) | -211, 94 (-251 a -172,87) | 275,23 (236,16 a 314,29) | 124,28 |
| IgG3 (mg/dl); n=114 | -18,43 (-24,07 a -12,78) | -78,07 (-87,72 a -68,42) | 41,22 (31,57 a 50,87) | 30,43 |
| IgG4 (mg/dl); n=112 | 24,38 (-6,21 a 54,97) | -295,79 (-348,06 a -243,52) | 344,55 (292,28 a 396,82) | 163,36 |
| IgG suma (mg/dl); n=116 | 210,58 (149,96 a 271,19) | -432,51 (-536,10 a -328,93) | 853,66 (750,08 a 957,25) | 328,11 |
DE: desviación estándar; IC: intervalo de confianza; LC: intervalo de concordancia.
Concordancia entre ambos equipos mediante el método de Bland-Altman. Gráficas de Bland-Altman para la comparación de los equipos BNII® y Optilite® para las concentraciones (mg/dl) de: IgG total (A), IgG calculada a partir de la suma de las concentraciones de subclases de IgG o IgG suma (B), IgG1 (C), IgG2 (D), IgG3 (E), IgG4 (F). En el eje de abscisas se representa la media de ambas mediciones (por BNII® y Optilite®) de la variable en cuestión, y en el eje de ordenadas la diferencia de ambas mediciones de la misma variable (BNII® – Optilite®). Valor máximo del límite de concordancia (media+1,96 DE); valor mínimo del límite de concordancia (media – 1,96 DE). Media de las diferencias de ambas mediciones (media).
Para generar los cálculos necesarios en el método de Bland-Altman, se crearon 6 variables nuevas que consistían en la diferencia de las variables obtenidas por BNII® menos las obtenidas por Optilite®. Los resultados obtenidos por este método indicaron que, para todas las variables excepto para la concentración de IgG3, BNII® proporcionaba valores más altos que Optilite® (tabla 2). En el caso de la IgG3, Optilite® proporcionaba valores más altos, con una diferencia de 18,43mg/dl, y los límites de concordancia indicaron que los valores de Optilite® estaban 78,07 unidades por encima y 41,22 unidades por debajo. Todos los resultados mostraron que dichas diferencias fueron estadísticamente significativas, es decir, que no eran debidas al azar, ya que los IC 95% no incluyeron el valor 1, exceptuando los resultados para la concentración de IgG4, que para la media de las diferencias el IC 95% fue de -6,21 a 54,97.
La distribución de los puntos en las gráficas de Bland-Altaman, a excepción de la gráfica referente a IgG4, es aleatoria a ambos lados de la línea de la media de las diferencias, por tanto, no podemos identificar que los analizadores (BNII® y Optilite®) cometan errores sistemáticos, proporcionales o constantes al cuantificar las concentraciones de las subclases de IgG.
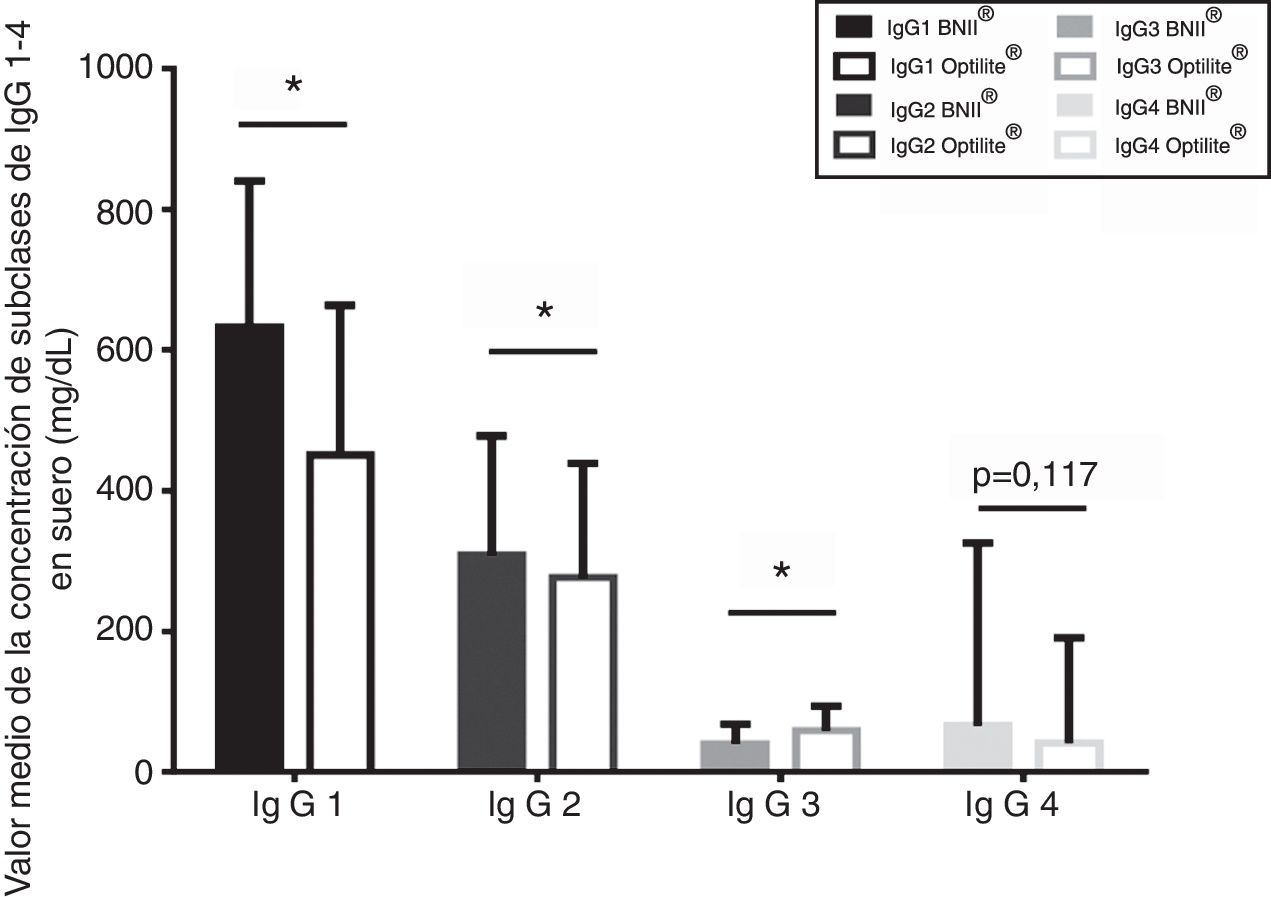
Diferencia entre ensayos en la cuantificación de la concentración de subclases de IgGEn condiciones fisiológicas normales, la subclase IgG1 es la más abundante, seguida de IgG2, IgG3 e IgG420. En nuestra experiencia en el laboratorio con el nefelómetro BNII® se había detectado una inversión entre las concentraciones de IgG3 e IgG4. Para comprobar estos resultados y compararlos con los obtenidos en el analizador Optilite® se calculó la media de las concentraciones de las subclases de IgG, obtenidas por los dos métodos analíticos (tabla 1). Los resultados muestran que, efectivamente, para el analizador BNII®, la media de la concentración de IgG3 en suero era inferior a la media de la concentración de IgG4 (39,83mg/dl, frente a 65,80mg/dl). Por el contrario, mediante el analizador Optilite® la concentración de IgG3 permanecía siendo mayor que la de IgG4 (fig. 4).
Comparación pareada de la media de concentración de subclases de IgG. Gráfico de barras donde se representa la media de las concentraciones de las subclases de IgG (mg/dl) cuantificadas por BNII® y Optilite®. Las desviaciones estándar se indican mediante líneas. La significación estadística (p<0,05) se representa mediante un asterisco. Las comparaciones se realizaron mediante un test t de Student para muestras emparejadas.
Además, se comparó la media de concentración de las subclases de IgG obtenidas por ambos equipos mediante el test t de Student para datos emparejados (fig. 4). La diferencia entre las concentraciones medias de IgG1 e IgG2 obtenidas en ambos analizadores fue significativa (p<0,05). La cuantificación tanto de IgG1 (180,67mg/dl±152,33; IC95%152,65-208,68) como de IgG2 (31,65mg/dl±124,28; IC95% 8,79-54,50) obtenidas por el analizador BNII® fueron superiores a las obtenidas por el analizador Optilite®. En relación a la concentración de IgG3, los resultados igualmente revelaron una diferencia significativa (p<0,001) entre ambos analizadores, de manera que la concentración media de IgG3 obtenida por BNII® fue significativamente menor que la obtenida por Optilite® (-18,57mg/dl±30,38; IC95% -24,21 a -12,93). Finalmente, no se hallaron diferencias estadísticamente significativas para la concentración de IgG4 obtenida por uno y otro equipo (p=0,117).
DiscusiónEn este estudio, se evaluó la precisión de la cuantificación de la concentración de IgG y subclases de IgG (IgG1-4) en muestras de suero de pacientes diagnosticados de diversas patologías mediante dos plataformas comerciales diferentes, una de ellas basada en principios nefelométricos (BNII® System, Siemens Healthcare GmbH, Alemania), y la otra, basada en principios turbidimétricos (Optilite®, The Binding Site Group Ltd., Birmingham).
Los resultados obtenidos muestran CV elevados para las variables de estudio IgG3 e IgG4. Sarnago et al.21, comparando los analizadores SPA Plus® (The Binding Site), basado en principios turbidimétricos, y BNII® (Siemens), obtuvieron mejores coeficientes de variación que nosotros, siendo igualmente los de las subclases IgG3 e IgG4 los menos precisos. A pesar de que, particularmente, se pudo corregir el coeficiente de variación de IgG4 al eliminar los valores extremos, este permaneció siendo elevado. Estos resultados reflejan la heterogeneidad de la cohorte de estudio, compuesta por individuos de muy diferentes edades y diagnosticados de patologías muy diversas.
Por otra parte, al igual que Lepage et al.10, en nuestro estudio, la correlación lineal intraensayo del sistema BNII® para la cuantificación de IgG total e IgG suma fue muy próxima a uno. No obstante, dicha correlación fue superior para el analizador Optilite® (r=0,976). Ludwig-Kraus et al.14 también encuentran una mejor correlación entre la IgG total y la IgG suma para el ensayo de The Binding Site que para el de Siemens, a pesar de que realizan sus ensayos en plataformas analíticas diferentes a las utilizadas en este estudio. Estos resultados sugieren que la cuantificación de la concentración de subclases de IgG de forma individual mediante el analizador Optilite® es más precisa que la obtenida mediante el analizador BNII®.
Cuando se analizó la correlación lineal para las diferentes variables de estudio entre analizadores, se observó que la correlación para la IgG total fue inferior que la correlación para la IgG suma (rIgG=0,677 vs. rIgGsuma=0,762). En cuanto a la correlación lineal entre equipos para las concentraciones de las subclases de IgG, todas fueron altas o muy altas, con excepción de la de IgG3 (r=0,564). Al calcular el CCI, la concentración de IgG3 volvió a mostrar una correlación moderada (42,7%), al igual que la concentración de IgG1 (56,4%). Finalmente, al comparar los valores medios de las concentraciones de las subclases de IgG, mediante el test de t de Student para datos emparejados, se observó que las concentraciones de IgG3 e IgG4 no mantenían la proporción fisiológica cuando estas eran cuantificadas por el ensayo BNII®, mientras que esta proporción sí era respetada al analizar los sueros por el equipo Optilite®. Además, las concentraciones medias de IgG1, IgG2 e IgG3 resultaron ser significativamente diferentes (p<0,05) al ser cuantificadas por cada analizador, de tal forma que la concentración de IgG1 e IgG2 obtenidas mediante BNII® fueron superiores, siendo la concentración media de IgG3 inferior. Para la concentración de IgG4 no se encontraron diferencias significativas entre ambos equipos (p=0,117). Estas mismas diferencias se evidenciaron en los resultados aportados por las gráficas de Bland-Altman. Las diferencias observadas entre analizadores para las concentraciones de IgG3 e IgG4 se debían fundamentalmente a que el valor de IgG3 obtenido por BNII® era significativamente inferior al obtenido por Optilite®, mientras que las concentraciones de IgG4 no eran significativamente diferentes.
Estas discrepancias entre las concentraciones de las subclases de IgG ya habían sido publicadas por otros autores14,15. Sarnago et al.21 evaluando 53 muestras de suero pertenecientes a pacientes con infecciones recurrentes de forma paralela mediante el analizador SPA Plus® (The Binding Site) y BNII®, encontraron valores de concentración mayores para IgG2 e IgG3 con el analizador SPA Plus® y menores para IgG1 e IgG4, con respecto a BNII®. Por su parte, Ludwig-Kraus et al.14, analizando un total de 50 muestras de pacientes sin especificar diagnóstico clínico, utilizando dos kits comerciales diferentes para la cuantificación de subclases de IgG (The Binding Site sobre la plataforma Roche cobas c502 y Siemens sobre la plataforma BN ProSpec) encontraron resultados mayores para las concentraciones de IgG2 e IgG3 con el kit de The Binding Site y menores para IgG1 e IgG4, con respecto al kit de Siemens.
La inmunodeficiencia de subclases de IgG se define como una disminución en la concentración de una o más subclases de IgG, independientemente de la concentración total de IgG en suero22. Aunque en todos los análisis estadísticos ambos equipos han mostrado ser correlativos, que BNII® proporcione una cuantificación de IgG3 significativamente inferior no es despreciable, ya que la cuantificación fidedigna de la IgG es esencial para el diagnóstico de hipo- e hipergammaglobulinemias, sobre todo en presencia de niveles normales de IgG total23. En las deficiencias aisladas de subclases de IgG, la deficiencia de IgG1 es generalmente predecible si el total de IgG es bajo, por el contrario, las deficiencias de IgG2, IgG3 e IgG4 pueden ser enmascaradas por un valor normal de IgG1.
Por su parte, Ghillani et al.16 demostraron que ciertos parámetros eran susceptibles del denominado fenómeno de zona, entre ellos la concentración de IgG4. La enfermedad relacionada con IgG4 es una enfermedad multisistémica de difícil diagnóstico, en la que pueden aparecer niveles aparentemente normales de IgG4 debido al exceso de antígeno24,25. Las muestras con exceso de antígeno muestran una elevada cinética de reacción al inicio, la cual rápidamente se ralentiza por agotamiento del anticuerpo. Para corregir el efecto prozona, el sistema Optilite® utiliza el método de adición, que se basa en la adición de una cierta cantidad de muestra o control al final de la reacción26. No obstante, ellos también puntualizan que estos sistemas no son infalibles y el especialista debe siempre interpretar los resultados teniendo en cuenta la historia clínica del paciente.
La identificación de alteraciones en las subclases de IgG de forma precisa y temprana, tanto en patologías que cursan con hipogammaglobulinemias, como las que cursan con hipergammagoblulinemias27, permitiría establecer un diagnóstico clínico adecuado para la toma de decisiones terapéuticas, como por ejemplo, la utilización de IgG como reemplazo en inmunodeficiencias28.
Las diferencias observadas entre analizadores podrían ser consecuencia de las diferencias metodológicas entre los ensayos nefelométricos y turbidimétricos, diferencias en la especificidad de los anticuerpos que componen los reactivos o la utilización de diferentes controles y calibradores21,29.
Este estudio presenta dos limitaciones importantes. La primera, es la heterogeneidad en cuanto a edad y diagnóstico clínico de los individuos que componen la cohorte de estudio. No se incluyeron individuos sanos ni se clasificaron en grupos de edad, de manera que no se pudieron establecer rangos de referencia específicos para cada analizador. No obstante, no era el objetivo de este estudio establecer rangos de referencia, sino evaluar diferencias entre los resultados proporcionados por dos métodos analíticos. Por otra parte, no pudimos analizar la reproducibilidad de los análisis de las muestras, debido a que cada muestra únicamente se analizó una vez en cada uno de los analizadores.
En resumen, los resultados de este estudio demuestran que ambos analizadores, BNII® y Optilite®, son aceptables para la rutina clínica, pero las concentraciones proporcionadas por ambos no son intercambiables. Existen diferencias entre la cuantificación de las subclases de IgG según el tipo de analizador utilizado. Es de trascendental importancia a la hora de elaborar un juicio clínico de precisión y tomar decisiones terapéuticas, obtener herramientas fiables para la detección y cuantificación de parámetros fisiológicos. Por ello, cada laboratorio debe conocer el funcionamiento y las limitaciones de los analizadores de que dispone y establecer unos rangos de referencia de acuerdo a dichas características.
FinanciaciónLos reactivos necesarios para realizar los parámetros analíticos en la plataforma Optilite®, fueron proporcionados por The Binding Site Group Ltd., Birmingham.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.