La fisiología tiroidea sufre cambios adaptativos durante la gestación, haciendo necesario conocer los límites de normalidad de las hormonas tiroideas según la edad gestacional para una correcta interpretación, principalmente en la enfermedad tiroidea subclínica. Los sistemas de información de laboratorio (SIL) encuentran dificultades para informar rangos de referencia ante diferentes situaciones fisiopatológicas. La labor del facultativo del laboratorio es importante para desarrollar y diseñar herramientas que permitan identificar estas situaciones e interpretar los resultados de forma adecuada.
ObjetivoAnalizar si el cambio del SIL en nuestro servicio y la emisión del informe del laboratorio con la interpretación de los resultados, habían tenido repercusión sobre la identificación y el seguimiento de la disfunción tiroidea en las gestantes de nuestra área.
Material y métodosSe ha realizado un estudio retrospectivo transversal analizando los resultados de las analíticas de todas las gestantes de primer trimestre y a las que se les habían solicitado pruebas tiroideas en los siguientes 6 meses. Se realizaron 2 grupos, antes y después del cambio de SIL.
ResultadosLos porcentajes de seguimiento fueron similares en los 2 grupos, excepto cuando la TSH era patológica para gestantes y normal para población general, es decir, cuando no salía asterisco.
ConclusionesLos rangos de referencia establecidos para población normal no identifican la enfermedad tiroidea subclínica en gestantes. Es imprescindible la intervención activa del facultativo del laboratorio en la valoración de estos resultados. En nuestro estudio un 50% más de las gestantes con hipotiroidismo subclínico se benefició de la estrategia que habíamos introducido.
Thyroid physiology undergoes adaptive changes during pregnancy, making it necessary to know the reference ranges of thyroid hormones according to gestational age for a correct interpretation, especially in subclinical thyroid disease. Laboratory information systems (LIS) have difficulty in reporting reference ranges (RR) in different pathophysiological situations. The work of the laboratory physician is important in developing and designing tools to identify these situations, and to make an appropriate interpretation of the results.
ObjectiveTo determine whether the change in the LIS in our department and the issue of the laboratory report with the interpretation of the results, had an impact on the identification and monitoring of thyroid dysfunction in pregnant women in our area.
Material and methodsA retrospective cross-sectional study was carried out by analysing the results of all first-trimester pregnant women and those on whom thyroid tests had been requested in the following six months. The pregnant women were divided into two groups, before and after the change of the LIS.
ResultsFollow-up percentages were similar in the two groups, except when TSH was abnormal for pregnant women and normal for the general population, that is, when there was no asterisk.
ConclusionsThe RRs established for the normal population do not identify sub-clinical thyroid disease in pregnant women. The active intervention of the laboratory physician is essential in the evaluation of these results. In our study, more than 50% of the pregnant women with sub-clinical hypothyroidism benefited from the strategy introduced.
En los últimos años se han producido importantes avances respecto del conocimiento de las implicaciones clínicas de los trastornos tiroideos en el embarazo, y de la detección de esos trastornos mediante pruebas de laboratorio1:
- -
Aumento de la sensibilidad de las pruebas que valoran la función y la autoinmunidad tiroideas.
- -
Establecimiento de rangos de referencia (RR) para las gestantes según el trimestre de embarazo.
- -
Conocimiento de efectos adversos de distintos grados de hipofunción tiroidea materna y el momento de su detección durante la gestación, sobre los resultados del embarazo y el desarrollo neuropsicológico de los hijos2.
- -
La influencia de la autoinmunidad tiroidea positiva, aun sin disfunción tiroidea (DT), sobre la fertilidad y la evolución del embarazo3.
Estos avances en el conocimiento de la glándula, de la DT y de la autoinmunidad tiroidea han constituido la base científica argumental de la que ha surgido la necesidad de plantearse la conveniencia o no de llevar a cabo un estudio generalizado de la función y del estado de la autoinmunidad tiroidea de todas las mujeres en edad fértil, bien cuando deseen concebir o en una etapa precoz del embarazo.
La fisiología tiroidea materna sufre importantes cambios adaptativos, con variación de las concentraciones periféricas de hormonas tiroideas y tirotropina (TSH) durante la gestación, haciendo necesario conocer sus límites de normalidad específicos según la edad gestacional, para una correcta interpretación, sobre todo de la enfermedad tiroidea subclínica. La mayoría de los trastornos comunes, autoinmunidad y disfunción, que afectan al tiroides y embarazo, generalmente no ocasionan síntomas ni signos. Su diagnóstico es bioquímico.
El estudio de la función tiroidea en el primer trimestre de gestación requiere una única determinación en sangre, que se podría hacer de manera conjunta con el resto de la analítica del primer trimestre. Sin embargo, para clasificar correctamente la DT es muy importante que el obstetra conozca y aplique los RR de la gestación propios de cada laboratorio para la población a la que atiende.
En España existen 5 trabajos publicados que indican los RR de sus respectivas poblaciones: Aragón4, Cartagena5, Cataluña6, Jaén7 y El Bierzo (León)8. Diversas guías internacionales asumen que ante la ausencia de RR locales, en el caso de la TSH, se consideren los puntos de corte de 2,5μUI/ml en el primer trimestre y de 3,0μUI/ml en el segundo y tercer trimestres9,10. El punto de 2,5μUI/ml no solo se elige por aproximarse al percentil 97,5, sino por haberse evidenciado una mayor morbilidad por encima de este11.
En 2009 el grupo de trabajo de DT subclínica de la Sociedad Española de Endocrinología y Nutrición (SEEN) publicaba una guía en la que apoyaba manifiestamente el cribado universal de la función tiroidea en la pregestación o en el primer trimestre12. En nuestro laboratorio llevamos más de 5 años realizando el cribado universal de las gestantes con la medición de TSH, según aconsejaba la SEEN, pero con variabilidad respecto a los rangos de referencia utilizados que afectaba a la clasificación de la DT, y por lo tanto al tratamiento de la gestante. Los sistemas de información de laboratorio (SIL) encuentran complicaciones a la hora de informar RR cuando estos varían ante diferentes situaciones fisiopatológicas. En estos casos la labor del facultativo de laboratorio es importante para identificar a estos grupos poblacionales, interpretar los resultados y emitir un informe acorde a los diferentes RR.
El cambio de sistema informático de nuestro laboratorio ha propiciado que seamos capaces de identificar a las gestantes y podamos aportar mayor información respecto de los RR y de la interpretación de los datos. Nuestro objetivo es averiguar si las medidas que se toman desde el laboratorio favorecen el diagnóstico y seguimiento de la DT en las gestantes, comparando la manera de informar los resultados antes y después del cambio de sistema informático.
Material y métodosSe ha realizado un estudio retrospectivo transversal con los resultados de las analíticas solicitadas a las gestantes de primer trimestre del área de Fuenlabrada (Madrid), que da cobertura a una población de 200.000 habitantes, para analizar la repercusión que los informes del laboratorio han tenido sobre el posible seguimiento de su DT.
Se ha estudiado un período de 4 años, desde junio de 2011 a mayo de 2015, divididos en 2 partes iguales:
- -
Grupo 1: junio de 2011-mayo de 2013; 4.462 peticiones de gestantes de primer trimestre informadas con el SIL antiguo (Servolab®, Siemens). La media de edad y el rango fueron 30,6 y 15-54 años respectivamente. Solo una gestante tenía 54 años, el resto por debajo de 46 años.
- -
Grupo 2: junio de 2013-mayo de 2015; 4.396 peticiones de gestantes de primer trimestre informadas con el nuevo SIL (Modulab™, Werfen). La media de edad y el rango fueron 31,3 y 14-47 años, respectivamente.
El cambio de SIL nos permitió introducir mejoras como:
- -
Informar los RR para gestantes y por trimestre.
- -
Detectar aquellos valores fuera del rango para gestantes.
- -
Generar pruebas reflejas para que cuando la TSH estuviera fuera del rango se ampliara la tiroxina libre (T4L) y los anticuerpos antitiroperoxidasa (TPO).
- -
Realizar un informe de laboratorio facilitando la interpretación de los datos obtenidos conforme a los RR específicos para cada trimestre.
En nuestro laboratorio no teníamos establecidos rangos de referencia para nuestra población de gestantes y por trimestres, por lo que utilizamos los que aconseja la American Thyroid Association, 0,1-2,5μUI/ml para el primer trimestre, 0,2-3,0μUI/ml para el segundo y 0,3-3,0μUI/ml para el tercer trimestre9. A todas las gestantes de primer trimestre se les hace el mismo perfil y para el cribado de DT se utiliza solamente TSH siguiendo criterios de adecuación de la demanda, y según su valor se va añadiendo pruebas.
El grupo 1, debido a que no teníamos medios para identificar que eran gestantes, fue tratado como población general y se utilizaron los RR que aconsejaba la National Academy of Clinical Biochemistry de 0,4-4,0μUI/ml13. Cuando el valor estaba por encima del límite superior se generaba como prueba refleja solamente la T4L. Es decir, las gestantes con valor de TSH entre 2,5 y 4,0μUI/ml eran tratadas como normales, no se ampliaba ninguna prueba y eran informadas «sin asterisco» y sin ningún comentario interpretativo. Solamente en el grupo 2, cuando la TSH estaba por encima de 2,5μUI/ml, límite superior considerado para el primer trimestre, se generaban de manera automática T4L y TPO. Esto traía como consecuencia que en el grupo 1 se quedaban sin diagnóstico inicial las gestantes con TSH entre 2,5-4,0μUI/ml y que en general se desconocía si eran autoinmunes.
Para la T4L los rangos de referencia utilizados son los que proporcionaba el fabricante, que para población adulta son 0,54-1,24ng/dl, y para el primer trimestre de gestación un poco más bajos, 0,47-1,18 ng/dl.
Para los TPO se categorizó como positivo un valor superior a 9UI/ml.
Todas las técnicas fueron realizadas en un Dxi 800 (Beckman Coulter) mediante quimioluminiscencia.
Se realizó una exportación de datos de todas las analíticas de gestantes para el análisis de las hormonas tiroideas del primer trimestre, y para comprobar a cuántas se les había pedido hormonas tiroideas con posterioridad al primer trimestre. Esto nos serviría para identificar a aquellas que se les estaba haciendo un seguimiento por una posible DT.
Los datos se incorporaron a una base de datos para su estratificación y realización de cálculos básicos. Se utilizó el programa SPSS v.23 para la realización de pruebas estadísticas. Como las variables medidas no seguían una distribución normal se utilizó la prueba no paramétrica U de Mann Whitney para la comparación de los grupos y la prueba Chi-cuadrado y la prueba exacta de Fisher (cuando el recuento de alguna de las casillas fue menor de 5) en la comparación de proporciones. Nivel de significación<0,05.
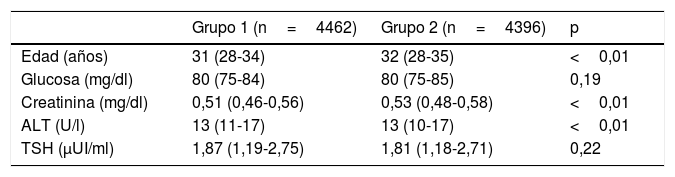
ResultadosNuestro laboratorio tiene petición electrónica, y en el caso de las gestantes tenemos fijados determinados perfiles por trimestres de acuerdo con los obstetras. El perfil de primer trimestre lleva incluido glucosa, creatinina, ALT, TSH, hemograma y serología, a parte del screening prenatal. Aunque no era el objetivo del estudio se utilizaron las otras pruebas de bioquímica que van incluidas en el perfil para verificar que no había diferencias sustanciales entre los 2 grupos. En la tabla 1 se pueden ver las medianas de la edad y de cada una de las pruebas de bioquímica, observándose que los valores son muy similares.
Medianas de las variables de comparación (rango intercuartílico) y significación estadística (p) de la comparación entre los 2 grupos
| Grupo 1 (n=4462) | Grupo 2 (n=4396) | p | |
|---|---|---|---|
| Edad (años) | 31 (28-34) | 32 (28-35) | <0,01 |
| Glucosa (mg/dl) | 80 (75-84) | 80 (75-85) | 0,19 |
| Creatinina (mg/dl) | 0,51 (0,46-0,56) | 0,53 (0,48-0,58) | <0,01 |
| ALT (U/l) | 13 (11-17) | 13 (10-17) | <0,01 |
| TSH (μUI/ml) | 1,87 (1,19-2,75) | 1,81 (1,18-2,71) | 0,22 |
ALT: alanina aminotransferasa; TSH: tirotropina.
p<0,05: estadísticamente significativo.
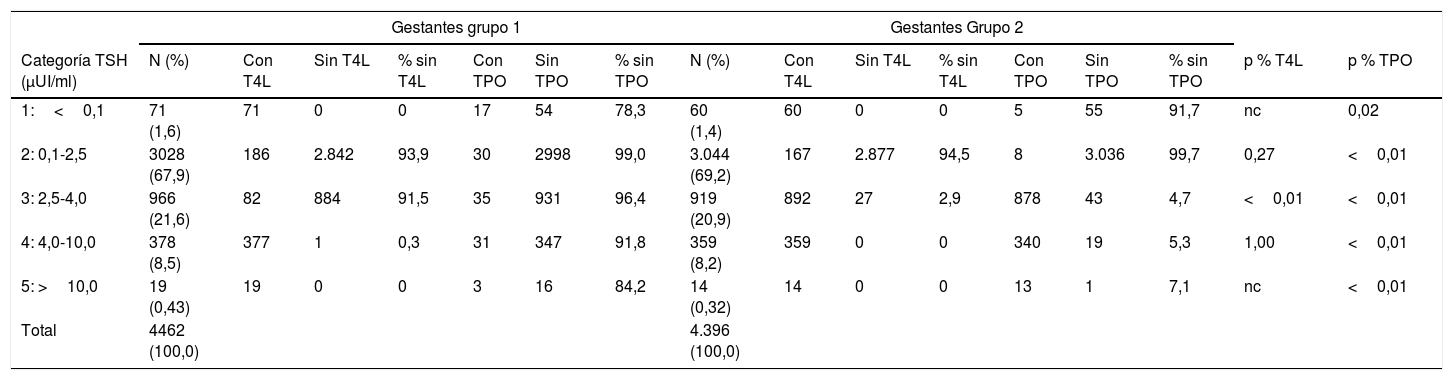
Dentro de cada grupo se hicieron categorías según el valor de la TSH para clasificar la DT (tabla 2). Como el SIL antiguo no nos permitía detectar a las embarazadas y crear pruebas reflejas, no se hicieron T4L y TPO en todas las gestantes del grupo 1 con TSH entre 2,5-4,0μUI/ml, ya que el sistema lo mostraba como normal y pasaba desapercibido. Por esta razón no podemos diferenciar si el tipo de disfunción era clínica o subclínica. Solo podemos identificar que, en los 2 grupos, un porcentaje próximo al 1,5% tenía una TSH suprimida, y que un 30,5% en el grupo 1 y un 29,4% en el grupo 2 eran hipotiroideas. Los porcentajes se pueden considerar similares entre los 2 grupos.
Diferencias en las peticiones de T4L y TPO entre grupos y significación estadística de la comparación de proporciones
| Gestantes grupo 1 | Gestantes Grupo 2 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Categoría TSH (μUI/ml) | N (%) | Con T4L | Sin T4L | % sin T4L | Con TPO | Sin TPO | % sin TPO | N (%) | Con T4L | Sin T4L | % sin T4L | Con TPO | Sin TPO | % sin TPO | p % T4L | p % TPO |
| 1:<0,1 | 71 (1,6) | 71 | 0 | 0 | 17 | 54 | 78,3 | 60 (1,4) | 60 | 0 | 0 | 5 | 55 | 91,7 | nc | 0,02 |
| 2: 0,1-2,5 | 3028 (67,9) | 186 | 2.842 | 93,9 | 30 | 2998 | 99,0 | 3.044 (69,2) | 167 | 2.877 | 94,5 | 8 | 3.036 | 99,7 | 0,27 | <0,01 |
| 3: 2,5-4,0 | 966 (21,6) | 82 | 884 | 91,5 | 35 | 931 | 96,4 | 919 (20,9) | 892 | 27 | 2,9 | 878 | 43 | 4,7 | <0,01 | <0,01 |
| 4: 4,0-10,0 | 378 (8,5) | 377 | 1 | 0,3 | 31 | 347 | 91,8 | 359 (8,2) | 359 | 0 | 0 | 340 | 19 | 5,3 | 1,00 | <0,01 |
| 5: >10,0 | 19 (0,43) | 19 | 0 | 0 | 3 | 16 | 84,2 | 14 (0,32) | 14 | 0 | 0 | 13 | 1 | 7,1 | nc | <0,01 |
| Total | 4462 (100,0) | 4.396 (100,0) | ||||||||||||||
Categorías de TSH: 1 hipertiroideas; 2 normotiroideas en gestantes; 3 normotiroideas en población general e hipotiroideas en gestantes; 4 hipotiroideas tanto en gestantes como en población general; 5 hipotoroidismo franco.
nc: no calculable porque las 2 variables son 0; p<0,05: estadísticamente significativo; p % T4L: significación estadística de las proporciones de T4L; p % TPO: significación estadística de las proporciones de TPO; TPO: anticuerpos antitiroperoxidasa; TSH: tirotropina; T4L: tiroxina libre.
Se analizaron las diferencias entre el número de resultados de T4L y TPO entre los 2 grupos (tabla 2). En el caso de la T4L la mayor diferencia se observa en la categoría 3, donde las situaciones son invertidas. En el grupo 1 prácticamente no hay resultados de T4L, en el 91,5% no están disponibles y el grupo 2 tiene resultados en el 97,1% de los casos. Con los TPO la situación es todavía más llamativa, ya que en el grupo 1 prácticamente no se utilizaban en ninguna categoría y en el grupo 2 la utilización es mayoritaria en las categorías 3, 4 y 5, y llama la atención los pocos resultados que hay de TPO en la categoría 1.
Respecto al análisis del seguimiento de la función tiroidea, de las 4.462 gestantes del grupo 1, a 939 (21,0%) se les realizaron pruebas de función tiroidea en el 2.° y el 3.° trimestre, y de las 4.396 del grupo 2 a 1.346 (30,6%). Esto significa que a un 9,6% más de las embarazadas del grupo 2 se les hizo un seguimiento, lo que en números absolutos significa más de 400. En la tabla 3 figuran los valores por categoría de TSH y los porcentajes de seguimiento de la DT según al grupo al que pertenezcan. Donde más diferencia se observa es en el seguimiento de las gestantes de la categoría 3 de TSH (2,5-4,0μUI/ml), donde hay una diferencia del 51,7% entre los 2 grupos.
Número de gestantes con analítica en el primer trimestre y seguimiento en el segundo y tercer trimestre. Diferencias entre los 2 grupos y significación estadística de las proporciones
| Gestantes grupo 1 | Gestantes grupo 2 | ||||||
|---|---|---|---|---|---|---|---|
| Categoría TSH (μUI/ml) | 1.° trimestre | 2.° y 3.° trimestre | % | 1.° trimestre | 2.° y 3.° trimestre | % | p |
| 1: <0,1 | 71 | 56 | 78,9 | 60 | 43 | 71,7 | 0,03 |
| 2: 0,1-2,5 | 3.028 | 268 | 8,8 | 3.044 | 232 | 7,6 | 0,02 |
| 3: 2,5-4,0 | 966 | 278 | 28,8 | 919 | 740 | 80,5 | <0,01 |
| 4: 4,0-10,0 | 378 | 320 | 84,7 | 359 | 319 | 88,9 | 0,31 |
| 5: >10,0 | 19 | 17 | 89,5 | 14 | 12 | 85,5 | 0,05 |
| Total | 4462 | 939 | 21,0 | 4396 | 1346 | 30,6 | <0,01 |
TSH: tirotropina; p<0,05: estadísticamente significativo.
A juzgar por el número de gestantes en cada grupo parece que la población se mantiene estable, y que las características de la población son muy similares, ya que los valores de glucosa, creatinina y ALT son prácticamente iguales (tabla 1). Las medianas, en general, están en la zona baja del rango de referencia, lo que se corresponde con el grupo poblacional de gestantes. Las pruebas estadísticas en estos analitos indica en algún caso (edad, ALT, creatinina) una diferencia estadísticamente significativa, si bien tanto los valores de las medianas como los rangos intercuartílicos son prácticamente idénticos, por lo que podemos considerar que la relevancia clínica es mínima. Esta situación puede ser debida al amplio número de casos que hace que ante una pequeña diferencia la estadística la haga significativa.
La distribución de la TSH por categorías no tiene grandes variaciones (tabla 2). Según estos datos el 1,6% en el grupo 1 y del 1,4% en el grupo 2 tenían una TSH suprimida. Esto, clínicamente, no se podría considerar hipertiroidismo. Sería necesario confirmarlo con una elevada T4L y anticuerpos antirreceptor de la TSH. En el grupo 1 de las 71 gestantes con TSH suprimida, 21 tenían una T4L por encima del rango superior de normalidad (RSN) (1,18ng/dl), es decir, hipertiroideas, lo que suponía el 0,47% del total. Del grupo 2 tuvimos 20 casos en esas condiciones (0,45%) de las 60 gestantes con TSH suprimida.
Cuando se realizaron las analíticas del grupo 1 los valores de TSH entre 0,1-0,4μUI/ml aparecían como patológicos en una población de gestantes donde no lo eran, ya que el rango de referencia en población general era 0,4-4,0μUI/ml. Esos valores falsamente patológicos generaban pruebas reflejas de T4L que no eran necesarias. Esos casos se contabilizaron en 175, lo que representa un 3,9% del total. En la categoría 2 (0,1-2,5μUI/ml) hubo 186 gestantes con resultado de T4L y prácticamente todas pertenecían al rango bajo (0,1-0,4μUI/ml) anteriormente citado. Y de estas, 12 tenían una T4L por encima del RSN, la mayoría con TSH menor a 0,2μUI/ml, lo que hace pensar en que el rango inferior de normalidad de la TSH (0,1μUI/ml) no debería ser tan bajo y sería necesario obtener nuestros propios RR. Sumadas estas 12 gestantes a las 21 anteriores harían un 0,74% de hipertiroideas.
En el grupo 2 hubo 167 gestantes con TSH entre 0,1-2,5μUI/ml, con resultado de T4L y que no correspondería haberla hecho. Estas gestantes son en gran parte de las primeras fechas, en las que la regla que teníamos configurada para identificar a este grupo de población no estaba funcionando correctamente. Fue modificada posteriormente y no se realizó T4L a no ser que se solicitara expresamente.
La categoría 3 de TSH (2,5-4,0μUI/ml) es la que marca la diferencia, ya que corresponde a un rango de referencia normal para la población en general, pero patológico para las gestantes, que no podía ser identificado por el SIL antiguo, y por lo tanto el resultado se informaba como «normal» (sin asterisco). Por esta razón el 91,5% de estas peticiones de TSH del grupo 1 no tenían T4L hecha. Sin embargo, con el nuevo SIL pudieron ser identificadas y se amplió la T4L en el 97,1% de las ocasiones. Los resultados en este caso iban acompañados de los RR de gestantes por trimestre y de un informe interpretado, haciendo constar que esos resultados eran compatibles con un hipotiroidismo subclínico que podía ser autoinmune, o no dependiendo del resultado de los TPO. En esta categoría con los TPO ocurrió de forma similar a la T4L. No se informaron el 96,4% de los TPO en el grupo 1, pero sí se hizo en el 95,3% del grupo 2.
En el grupo 2 todas las categorías patológicas de TSH (3, 4 y 5) tenían realizada la T4L y los TPO en un porcentaje cercano al 100%. Esto nos permitió identificar prácticamente todos los hipotiroidismos y catalogarlos de clínicos o subclínicos en función de que la T4L fuera baja o normal, respectivamente, y de autoinmunes si los TPO eran positivos. Esta situación no ocurrió en la categoría 3 de TSH del grupo 1, ya que no se procesaron ni la T4L ni los TPO por considerar la TSH normal. Tampoco fueron determinados los TPO en las categorías 4 y 5, ya que la regla estaba activada solo para ampliar la T4L, pero no los TPO. En la tabla 2 llama la atención la categoría 2, que pese a que los porcentajes son muy parecidos (99,0% y 99,7%) la estadística nos dice que hay diferencias. Esto puede ser debido al alto número de casos de la categoría y al bajo número de gestantes a las que se les hizo los TPO, 30 en el grupo 1 y 8 en el grupo 2. Para que no hubiera habido diferencias estadísticamente significativas la diferencia de porcentajes debería haber sido 0,5% en vez de 0,7%. Por esta razón podemos considerar que en la categoría 2 no hubo diferencias entre los 2 grupos y que en la mayoría de los casos no se realizaron los TPO a estas gestantes.
Con el nuevo SIL éramos capaces de identificar a las gestantes, aplicar los rangos de referencia por trimestre, ampliar las pruebas necesarias, valorar correctamente los resultados y proporcionar un informe interpretado. Los informes se realizaban de manera individualizada en función de los resultados, teniendo en cuenta los RR de gestante y por cada trimestre. Como ejemplo, los comentarios que se aportaban eran: «datos de hormonas tiroideas compatibles con hipotiroidismo subclínico en gestante», «datos de hormonas tiroideas compatibles con hipotiroidismo clínico autoinmune en gestante», etc. Además, en el caso de que la TSH fuera>10,0μUI/ml, aparte de elaborar el informe interpretado se comunicaba directamente con el médico peticionario siguiendo el protocolo de resultados críticos.
Sobre la base de que esta estrategia permitía dar resultados de calidad quisimos saber si esto tenía repercusión en la identificación de la DT en la gestante por parte del tocoginecólogo, y le proporcionaba a la gestante un seguimiento adecuado. Trabajamos sobre la hipótesis de que aquellas gestantes con DT iban a ser tratadas con levotiroxina y se iba a realizar controles de tiroideas a lo largo de la gestación. Se hizo una extracción de datos de las gestantes de primer trimestre a las que se les habían solicitado pruebas tiroideas en los siguientes 6 meses. Esto nos indicaría que se les estaba haciendo seguimiento de su DT. Parece que la suposición era correcta, ya que los porcentajes de seguimiento eran muy similares en los 2 grupos, muy cercanos o superiores al 80% en las categorías patológicas de TSH y mínimamente (<10%) en la categoría 2, que era donde la TSH era normal (tabla 3). Excepto en la categoría 3, patológica en gestantes y normal en población general, en la que el seguimiento no llegó al 30% en el grupo 1 y superó el 80% en el grupo 2. Un 50% de las gestantes de este grupo se benefició de la estrategia que habíamos introducido. La ayuda del SIL y la información e interpretación de los resultados que proporcionábamos sirvió para que casi 500 gestantes se beneficiaran de un tratamiento que actualmente se considera necesario.
Según la National Academy of Medicine esta situación se podría considerar un error de diagnóstico, ya que este concepto es definido como un fallo para establecer el diagnóstico de manera adecuada y ajustada a tiempo. Estos errores de diagnóstico se considera que afectan al 5% de los pacientes ambulatorios14.
Sumando las gestantes de las categorías 3, 4 y 5 (tabla 2) podríamos obtener la prevalencia de hipotiroidismo, que sería muy similar en los 2 grupos y alrededor de un 30%. Esto contrasta con los datos publicados, donde la prevalencia es de 5,7-11,8%1. La razón podría ser que el valor de TSH de 2,5μUI/ml utilizado como punto de corte no sea del todo correcto. Esto está avalado por la reciente publicación de la nueva guía 2017 de la American Thyroid Association15, en la que reconoce que ese punto de corte ya no debería utilizarse. En su lugar recomienda establecer RR para cada población, y en su defecto utilizar el valor de 4,0μUI/ml. Si utilizamos ese valor en nuestro estudio la prevalencia de hipotiroidismo sería inferior al 9%, valor más cercano a los publicados.
Una de las recomendaciones del documento de consenso de 2012 de la SEEN y de la Sociedad Española de Ginecología y Obstetricia1 sobre el cribado de la DT era desarrollar programas formativos a médicos de atención primaria, obstetras, internistas y también endocrinólogos no familiarizados con la DT en la gestación para aplicar los rangos correctos y poder identificar y tratar los casos patológicos, y así mejorar el abordaje de la enfermedad tiroidea en la población gestante. Con nuestra intervención hemos colaborado en este objetivo y hemos facilitado esta identificación de los casos.
Además, la generación de pruebas reflejas ante resultados alterados tiene importantes ventajas:
- -
El consumo de recursos se ajustará a lo necesario.
- -
La gestante será diagnosticada en el primer análisis.
- -
El inicio de un tratamiento será inmediato si así lo requiere.
- -
Se evitará una nueva analítica y una nueva consulta para identificar la DT proporcionada por la TSH patológica.
Limitaciones del estudio. Las razones por las que el seguimiento no es del 100% en algunas de las categorías de la TSH no se han estudiado en su totalidad, pero entre ellas se encuentran:
- -
Cambio de hospital para el seguimiento del embarazo.
- -
Aborto.
- -
No se vuelven a tener noticias de la embarazada.
Como el período de tiempo es amplio, el número de gestantes también y los 2 grupos son comparables, se asume que las razones de la falta de datos por estas causas en el 2.° y el 3.° trimestre son similares también, y que no supondrán un sesgo para los cálculos.
ConclusionesSon necesarios los RR de la TSH por trimestre de gestación para poder identificar correctamente la DT en las gestantes.
La utilización de pruebas reflejas desde el primer análisis adelanta el diagnóstico y el tratamiento, si procede.
Es muy importante disponer de un SIL que facilite la identificación de la DT en la gestante.
Los RR de TSH por trimestre, la valoración de los resultados y la elaboración de un informe interpretativo por parte del laboratorio facilita la labor del tocoginecólogo, y de esto se pueden beneficiar un mayor número de gestantes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.