La procalcitonina (PCT) es un biomarcador útil para el manejo de pacientes con infección bacteriana severa y sepsis. Actualmente, diversas metodologías están disponibles para su medición. El objetivo de este estudio fue evaluar el rendimiento analítico del nuevo inmunoanálisis Lumipulse® BRAHMS PCT, adaptado al analizador Lumipulse G 600II de Fujirebio.
Material y métodosLa evaluación analítica incluyó el cálculo del límite de blanco, límite de detección, sensibilidad funcional, imprecisión intraserial y en el laboratorio, la verificación de la linealidad y la comparación con el ensayo ELECSYS® BRAHMS PCT.
ResultadosEl límite de blanco, el límite de detección y la sensibilidad funcional fueron 0,0011 ng/mL, 0,0025 ng/mL y 0,008 ng/mL, respectivamente. La imprecisión intraserial y la imprecisión en el laboratorio variaron entre 0,78 y 2,16 y entre 1,31 y 2,06, respectivamente, utilizando los materiales de control comerciales. La linealidad fue excelente (r=0,999) en el rango de concentraciones establecido por el fabricante. En el análisis de comparación entre métodos, los resultados fueron transferibles entre ambos (Lumipulse® BRAHMS PCT = −0,016 + 1,006 * ELECSYS® BRAHMS PCT). La diferencia media entre ambos métodos fue 0,2 ng/mL (IC95%: −0,906 a 0,430). Cuando las concentraciones de PCT fueron estratificadas según los rangos de concentraciones habitualmente utilizados para su interpretación clínica, el grado de concordancia fue muy alto (índice kappa: 0,9874 (IC95%: 0,9696 a 1,0000).
ConclusiónEl nuevo ensayo Lumipulse® BRAHMS PCT, con tecnología de quimioluminiscencia enzimática (CLEIA), es aceptable para su uso clínico.
Procalcitonin (PCT) is a useful biomarker for the management of patients with severe bacterial infection and sepsis. Different types of assays are currently available for its measurement. This study presents an evaluation of the analytical performance of the novel Lumipulse G BRAHMS PCT™ immunoassay on the Lumipulse 600II analyser.
Material and methodsThis analytical evaluation included the calculation of the limit of blank, limit of detection, functional sensitivity, intra-assay and total imprecision, confirmation of linearity and the comparison with the ELECSYS BRAHMS PCT™ assay.
ResultsLimit of blank, limit of detection and functional sensitivity were 0.0011 ng/mL, 0.0025 ng/mL, and 0.008 ng/mL, respectively. Intra-assay and total imprecision ranged from 0.78 to 2.16 and from 1.31 to 2.06, respectively, when control levels were used. The linearity was excellent (r=0.999) in the range of concentrations established by manufacturer. A highly significant agreement was found in the comparison between both assays (Lumipulse BRAHMS PCT = −0.016 + 1.006 * ELECSYS BRAHMS PCT). The mean bias was 0.2 ng/mL (95% CI: −0.906 to 0.430). When PCT levels were stratified according to the ranges normally used for their clinical interpretation, the agreement was very high (kappa index: 0.9874 (95% CI: 0.9696 to 1.0000).
ConclusionThe novel assay Lumipulse BRAHMS PCT, with CLEIA technology, appears to be acceptable for clinical use.
Las enfermedades infecciosas constituyen un problema mayor de salud pública a nivel mundial, dado que en sus formas más graves, caracterizadas por la presencia de disfunción orgánica (sepsis), están asociadas con una elevada morbimortalidad en todas las áreas o contextos, incluyendo tanto los servicios de urgencias hospitalarios1, con un incremento en la última década en nuestro país de la prevalencia de las infecciones atendidas, como las Unidades de Cuidados Intensivos, en las que la sepsis es la causa principal de muerte en las unidades no coronarias2,3.
El diagnóstico de infección y sepsis se basa en diferentes datos, especialmente la identificación de los signos y/o síntomas característicos de infección y la demostración mediante pruebas microbiológicas de la presencia del agente patógeno4. Sin embargo el diagnóstico de infección no es sencillo y se ve limitado por diferentes factores, como son la toma previa de antibióticos, la ausencia de los hallazgos clínicos habitualmente asociados a la infección, como ocurre en ciertas poblaciones, como pacientes inmunodeprimidos o ancianos, segmento de la población cada vez más frecuentemente atendido en los servicios de urgencias hospitalarios, y el tiempo requerido para la obtención de resultados en los cultivos y otras pruebas microbiológicas. Por ello, la disponibilidad de otra herramienta como los marcadores biológicos, puede ser útil como criterio de rule-in o rule-out de infección y la toma de decisiones respecto a la necesidad de iniciar la terapia antimicrobiana o el nivel hospitalario de ingreso requerido4. En este sentido, y a pesar del elevado número de biomarcadores de infección evaluados con finalidad diagnóstica y pronóstica, son dos los introducidos en la práctica asistencial en el manejo de la infección y la sepsis, la proteína C reactiva y la procalcitonina (PCT)5,6.
La disponibilidad de ensayos para la medida de PCT ha aumentado significativamente durante los últimos años, reemplazando las técnicas de inmunoensayo cuantitativas a las primeras técnicas semicuantitativas, basadas en el principio de inmunocromatografía. El ensayo original fue el BRAMHS PCT Kryptor®, utilizando la tecnología Time-resolved Amplified Cryptate Emission (TRACE). En años recientes, la industria del diagnóstico in vitro ha adaptado en otros analizadores la determinación de PCT utilizando los reactivos proporcionados por BRAHMS, siendo la electroquimiolumiscencia (ECLIA), la quimioluminiscencia enzimática (CLEIA) y el enzimoinmunoensayo con detección final por fluorescencia (ELFA) las metodologías incorporadas o ha desarrollado nuevas metodologías como la inmunoturbidimetría7,8. Recientemente, Fujirebio ha lanzado un nuevo inmunoensayo, basado en la tecnología de CLEIA, adaptado a los analizadores Lumipulse G600II y G1200 (Fujirebio Diagnostics Inc. Tokio, Japón), para la medida de PCT. El objetivo de este estudio es evaluar el rendimiento analítico de este nuevo ensayo.
Material y métodosDescripción del ensayo evaluadoEl método Lumipulse® G BRAHMS PCT immunoassay (Fujirebio Diagnostics Inc. Tokio, Japón) es un inmunoanálisis tipo sándwich en dos pasos adaptado para la determinación cuantitativa de PCT en suero y plasma en los analizadores G600II y Lumipulse G1200. Este ensayo se basa en la tecnología de inmunoensayo enzimático quimioluminiscente (CLEIA).
De acuerdo a los datos proporcionados por el fabricante, el ensayo muestra un límite de detección (LD) de 0,0048 ng/mL, una sensibilidad funcional de 0,0079 ng/mL y un intervalo de linealidad de 0,02-85,10 ng/mL. El volumen de muestra requerido para el ensayo es de 60μL, siendo 100μL el volumen muerto mínimo requerido.
Evaluación de las características analíticasLa evaluación de las características analíticas incluyó el cálculo del límite de blanco (LB), LD y sensibilidad funcional.
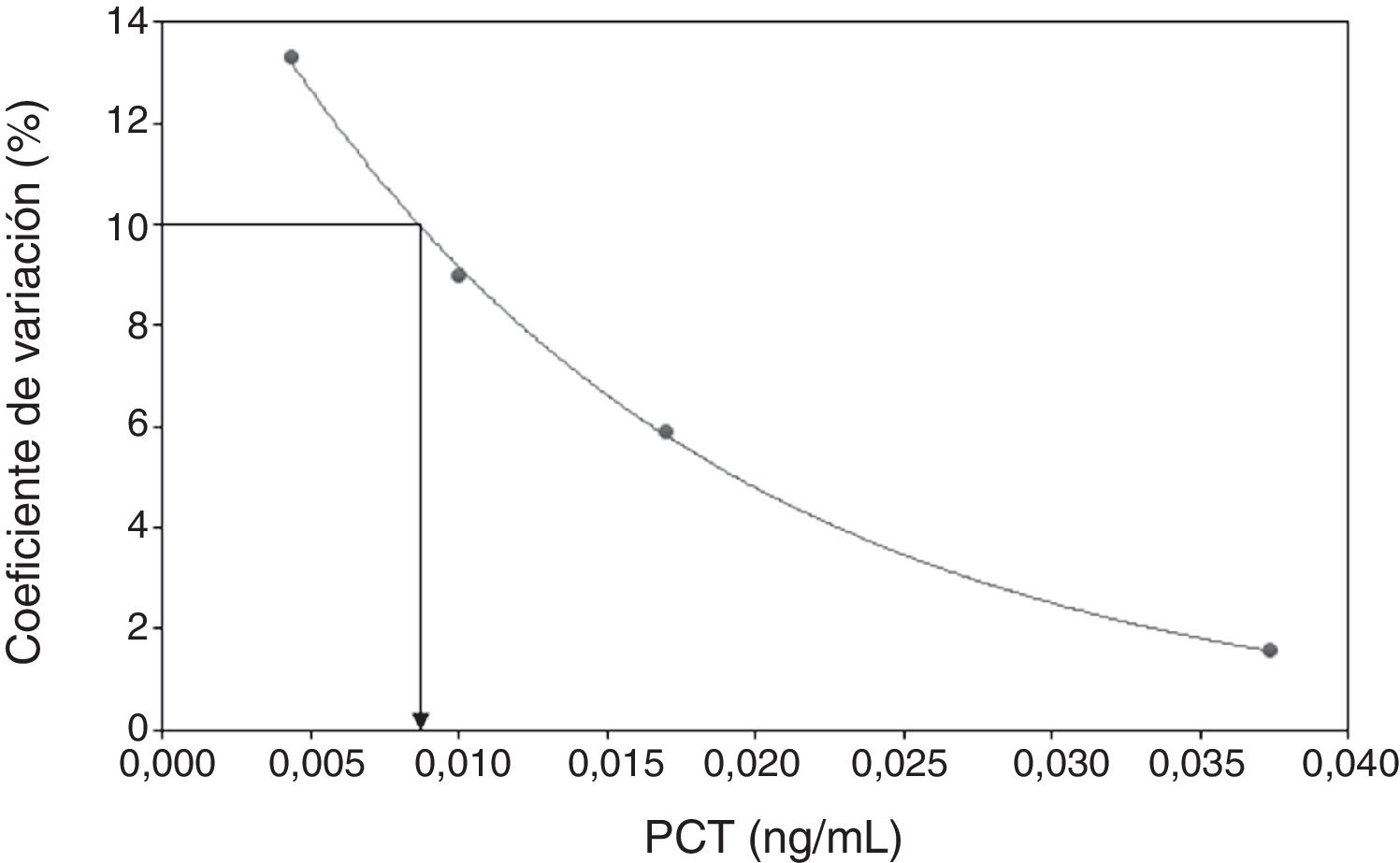
El LB fue calculado como el valor correspondiente a la suma de la media y 1,645 * desviación estándar (DE) de 20 replicados consecutivos de solución salina y el LD fue calculado como el valor correspondiente a la suma del límite de blanco y 1,645*DE de 20 replicados de un pool de sueros con la concentración de PCT más baja medible, de acuerdo a los criterios de Armbruster et al.9. Por último, la sensibilidad funcional fue definida como la concentración de PCT que pudo ser medida con un coeficiente de variación (CV) ≤ 10%, como sugieren Ruzzenente et al.10. Para el cálculo de dicha concentración se prepararon diluciones seriadas (1:2, 1:4 y 1:8) de una muestra de suero con una concentración aproximada de 0,04 ng/mL. Después de medir la concentración en 10 replicados de cada una de las diluciones, el CV fue calculado para cada una de ellas y mediante un modelo de ajuste de los datos (model fit) se identificó el valor de PCT para el cual el CV fue del 10%.
Estudio de imprecisiónPara el estudio de imprecisión se utilizaron los dos niveles de material de control suministrados en el kit de Lumipulse, cuyos valores promedio se muestran en la tabla 1, y se alicuotaron y congelaron a −80°C muestras de un pool de sueros de pacientes. Dicho estudio se realizó de acuerdo al procedimiento recomendado por la Sociedad Española de Medicina de Laboratorio11. Para el cálculo de la imprecisión intraserial (CVr) y de la imprecisión en el laboratorio (CVT) se usó la hoja de Excel «Estimación de la imprecisión en la verificación de las especificaciones del fabricante», de la Comisión de Metrología y Sistemas Analíticos de la Sociedad Española de Medicina de Laboratorio (disponible en: www.seqc.es).
Estudio de imprecisión del ensayo Lumipulse® G BRAHMS PCT en el analizador Lumipulse G 600 II
| Valor promedio (ng/mL) | CVr (%) | CVT (%) | |
|---|---|---|---|
| Pool de sueros bajo | 0,45 | 1,31 | 7,06 |
| Pool de sueros alto | 5,81 | 1,50 | 6,93 |
| Control nivel bajo | 0,85 | 2,16 | 2,06 |
| Control nivel alto | 18,21 | 0,78 | 1,31 |
CVr: coeficiente de variación intraserial; CVT: coeficiente de variación en el laboratorio.
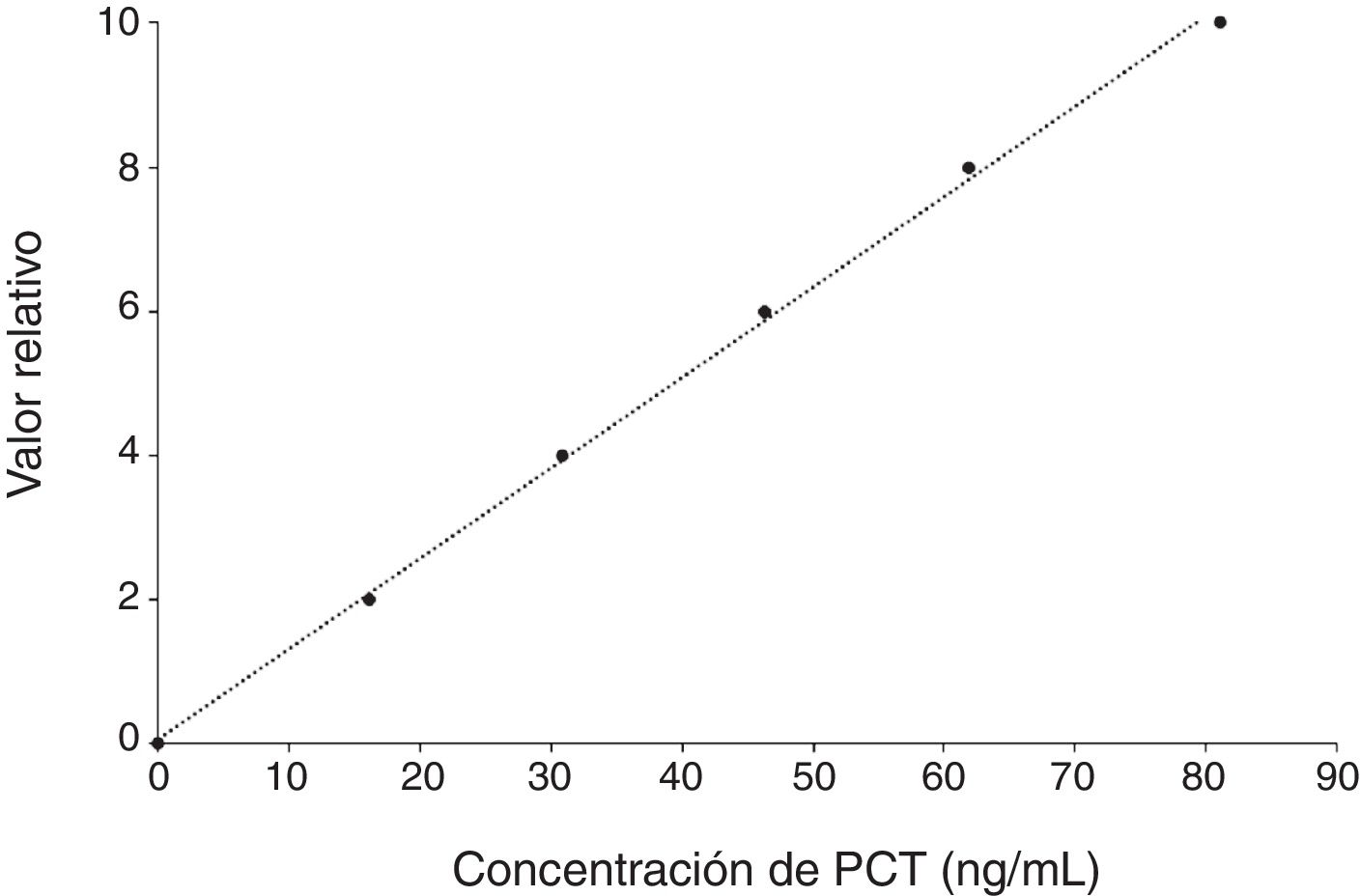
La validación de la linealidad fue realizada de acuerdo al procedimiento recomendado por la Sociedad Española de Medicina de Laboratorio12, utilizando una muestra de suero con una concentración de PCT próxima al límite superior del intervalo de linealidad descrito por el fabricante (85,10 ng/mL).
Estudio de comparación de métodosEl estudio de comparación de métodos fue realizado de acuerdo a las recomendaciones de la Asociación Española de Biopatología Médica para la comparación de equipos de laboratorio13. Para dicho estudio se emplearon 76 muestras de suero de pacientes ingresados en diferentes servicios del hospital y remitidas al Servicio de Análisis Clínicos para la medida de PCT, que cubrían el intervalo de linealidad del ensayo Lumipulse® G BRAHMS PCT (0,02-85,10 ng/mL), cada una de las cuales fue dividida en dos alícuotas y analizadas de forma simultánea con los ensayos Lumipulse® G BRAHMS PCT, en el analizador Lumipulse G600II, y ELECSYS® BRAHMS PCT, en el analizador cobas e601 (Roche, Mannheim, Alemania), en el que la determinación de PCT se basa en el principio de electroquimioluminiscencia (ECLIA).
Análisis de concordanciaPara la evaluación de la concordancia entre las determinaciones de PCT en ambos ensayos dichas concentraciones fueron clasificadas en los 4 rangos de concentración tradicionalmente utilizados para su interpretación clínica: < 0,5 ng/mL, 0,5-2 ng/mL, 2-10 ng/mL y > 10 ng/mL. La concordancia fue evaluada mediante el índice kappa.
Análisis estadísticoPara el análisis estadístico de los datos se utilizaron los programas MedCalc para Windows, versión 15.0, XLSTAT 2017 y EPIDAT 3.1.
Para este estudio se utilizaron muestras de suero de pacientes ingresados en nuestro hospital y remitidas al Servicio de Análisis Clínicos para la medida de PCT como parte de la práctica asistencial. Por ello, la solicitud del consentimiento informado no fue necesaria.
ResultadosCaracterísticas analíticasEl LB, el LD y la sensibilidad funcional (CV ≤ 10%) (fig. 1) fueron 0,0011 ng/mL, 0,0025 ng/mL y 0,008 ng/mL, respectivamente.
Estudio de imprecisiónLos datos de imprecisión intraserial y en el laboratorio se recogen en la tabla 1.
Estudio de linealidadLa inspección visual de la figura 2, demuestra que el ensayo Lumipulse® G BRAHMS PCT presenta una excelente linealidad en el intervalo ensayado, como refleja además el análisis de regresión lineal (r = 0,999; p <0,001).
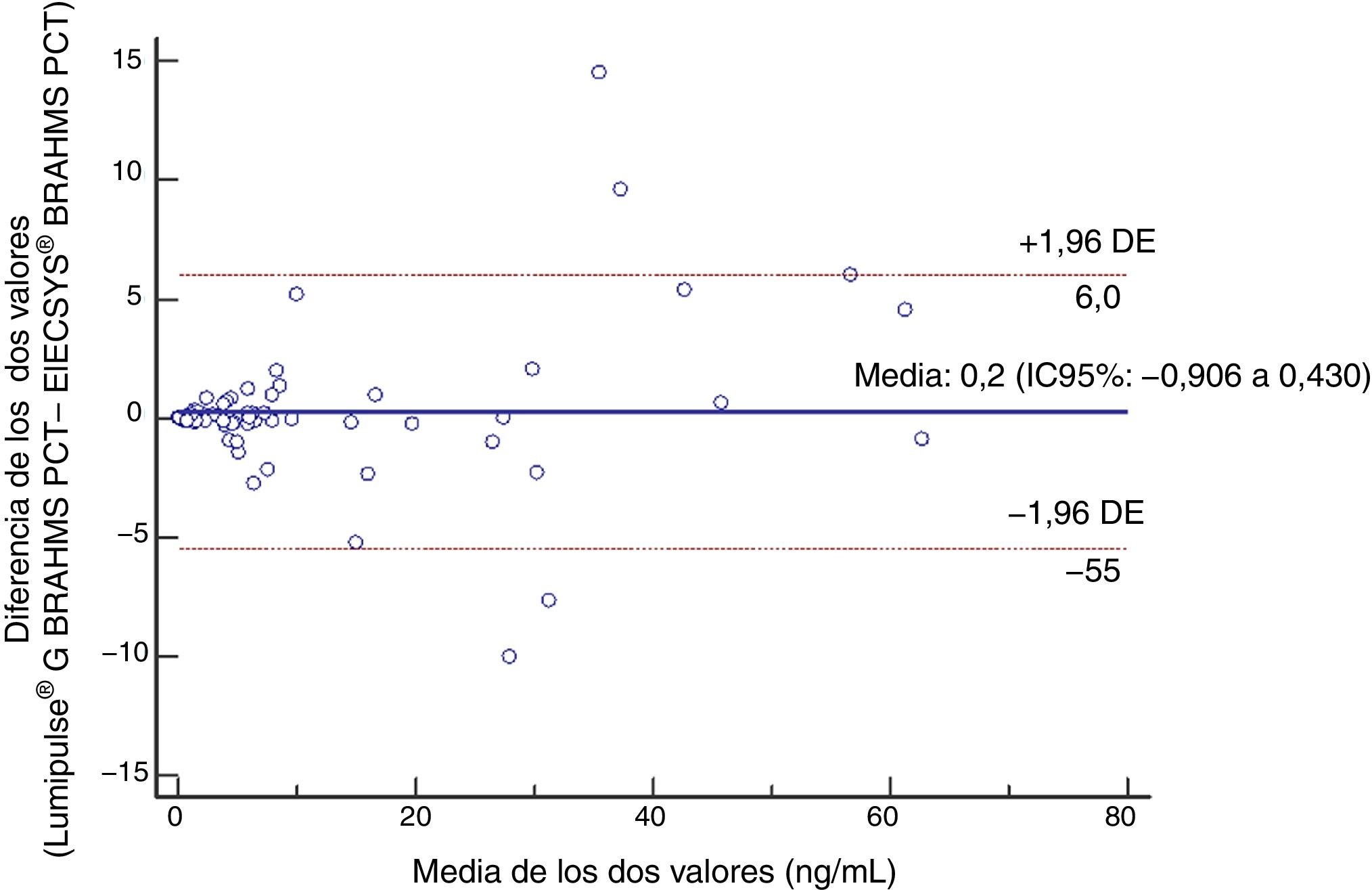
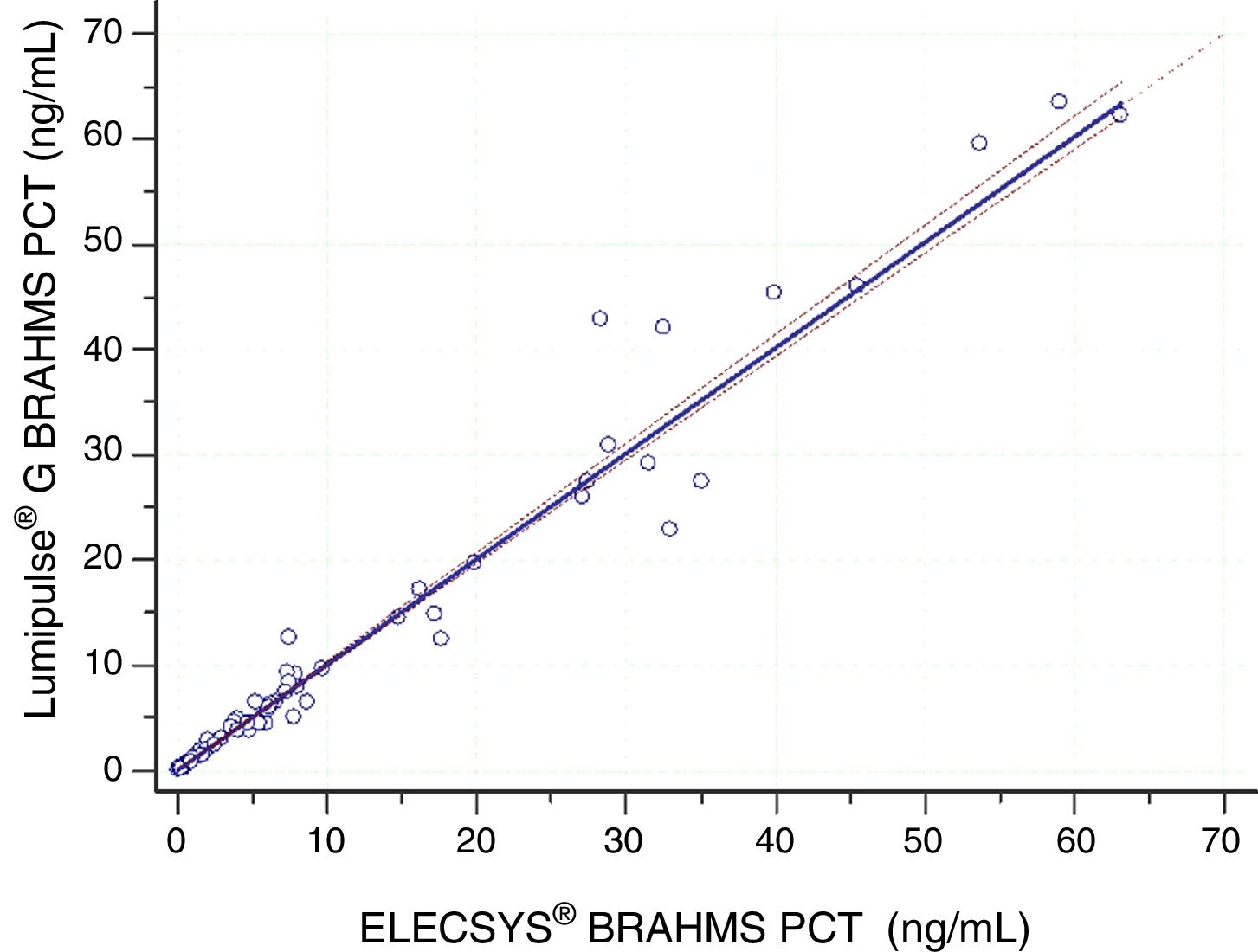
Estudio de comparación de métodosEl análisis de las diferencias (fig. 3) demuestra que no existen diferencias estadísticamente significativas entre los resultados proporcionados por ambos analizadores, con una diferencia media entre las medidas de PCT en ambos ensayos de 0,2 ng/mL (intervalo de confianza [IC] del 95%: −0,906 a 0,430), por lo que los resultados son intercambiables13. Además, y dado que el coeficiente de correlación de Spearman fue superior a 0,7513 (r = 0,991) se efectuó un análisis de regresión lineal mediante la regresión no parámetrica de Passing-Bablok, obteniéndose la ecuación y = −0,016 (IC95%: −0,048 a 0,001) + 1,006 (IC95%: 0,986 a 1,038) * x (fig. 4), que confirma la ausencia de error sistemático y proporcional y por tanto la transferibilidad de resultados13.
El índice kappa calculado para evaluar el grado de concordancia en la medida de PCT entre ambos ensayos fue de 0,9874 (IC95%: 0,9696 a 1,0000), por lo que la fuerza de la concordancia fue muy alta14.
DiscusiónLa PCT presenta algunas limitaciones como biomarcador de infección, debido a su incremento en situaciones fisiológicas, como las primeras h de vida del neonato15, o en condiciones no asociadas a infección (cirugía, grandes quemados, anafilaxia, carcinoma de pulmón, etc.)16–18, así como la posibilidad de obtener resultados negativos en las etapas precoces de la enfermedad5. Sin embargo, actualmente es el biomarcador más útil en el diagnóstico de sepsis, la valoración de la severidad y la toma de decisiones respecto a la instauración del tratamiento antibiótico, la monitorización de la respuesta terapéutica y el desescalaje antibiótico5,19. Su utilidad pronóstica es más controvertida20. Su inclusión en los catálogos de pruebas de los laboratorios de urgencias ha sido recomendado por distintas sociedades nacionales21 e internacionales22 y presenta una fuerte implantación en los laboratorios de nuestro país23.
Son varias las metodologías desarrolladas por la industria del diagnóstico in vitro para la medida de PCT24. Antes de su inclusión en la práctica asistencial, los laboratorios clínicos deben evaluar los procedimientos de medida para confirmar que son adecuados para las aplicaciones clínicas previstas. Esta evaluación es un requisito de las normas que se utilizan para certificar sistemas de gestión de la calidad o para acreditar la competencia de los laboratorios clínicos25. En este trabajo hemos evaluado las principales características analíticas del ensayo Lumipulse® G BRAHMS PCT en el analizador Lumipulse G600II y comprobado la transferibilidad de resultados respecto al ensayo ELECSYS® BRAHMS PCT.
Hasta la fecha, dos estudios han evaluado el ensayo Lumipulse® G BRAHMS PCT para la medida de PCT en los analizadores Lumipulse G 600II26 y Lumipulse G120010, realizando la comparación con los métodos Vidas® BRAHMS PCT (tecnología ELFA) y el original BRAMHS PCT Kryptor®, respectivamente. Por primera vez, el ensayo Lumipulse® G BRAHMS PCT ha sido comparado con otro ensayo (ELECSYS® BRAHMS PCT), que utiliza una tecnología diferente, la ECLIA, y en el que Prieto García et al. demostraron la falta de transferibilidad de resultados respecto al ensayo original27.
Los resultados de esta evaluación confirman que el método Lumipulse® G BRAHMS PCT muestra un excelente rendimiento analítico, con un LD (0,0025 ng/mL) inferior al del ensayo ELECSYS® BRAHMS PCT (0,02 ng/mL) y al declarado por la propia industria fabricante (0,0048 ng/mL) y similar al previamente descrito por Ruzzenente et al.10 (0,0016 ng/mL) y Dupuy et al. (0,0029 ng/mL). De igual modo, en nuestro estudio el ensayo Lumipulse® G BRAHMS presentó una sensibilidad funcional idéntica a la reportada por Ruzzenente et al.10 (0,008 ng/mL) y la propia industria fabricante (0,0079 ng/mL). Sin embargo, la utilidad de medir concentraciones tan bajas de este biomarcador con una imprecisión aceptable permanece incierta. Esta posibilidad podría plantear un cierto interés en la precocidad para detectar un posible proceso infeccioso, pero más estudios son necesarios para poder valorar la trascendencia clínica real de estas variaciones menores de la concentración de PCT. Además, la detección de valores tan bajos podría ser también una fuente de posibles falsos positivos.
En nuestro estudio hemos verificado la linealidad en un rango de concentraciones de PCT clínicamente relevantes, que incluyó una concentración próxima al límite superior del rango de linealidad propuesto por la industria fabricante (85,10 ng/mL).
Finalmente, hemos demostrado la transferibilidad de resultados respecto al ensayo ELECSYS® BRAHMS PCT. En el estudio de Ruzzenente et al.10, en el análisis de Bland-Altman los resultados de la medida de PCT mediante el ensayo Lumipulse® G BRAHMS PCT respecto al ensayo Vidas BRAHMS PCT mostraron un sesgo medio de −3,03 ng/mL, con un IC95% entre −4,32 a −1,74, lo que indica la falta de transferibilidad de resultados; dicho sesgo disminuía a −0,49 ng/mL a concentraciones inferiores a 10 ng/mL, pero el IC95% seguía sin incluir el cero (−0,77 a −0,24 ng/mL), lo que indica la falta de transferibilidad de resultados también en ese rango de concentraciones. Además en el mismo estudio no se informan los IC95% de la ordenada en el origen y la pendiente, lo que impide sacar conclusiones respecto a la transferibilidad de resultados entre ambas metodologías cuando se aplica este tipo de regresión. Los autores atribuyen estas diferencias a la falta de un material de calibración de referencia universalmente aceptado y concluyen que la falta de estandarización del ensayo obliga al uso siempre del mismo ensayo con fines de monitorización del paciente. Por el contrario, en el estudio de Dupuy et al.26 la determinación de PCT mediante el ensayo Lumipulse® G BRAHMS PCT sobreestimaba ligeramente la concentración del biomarcador en comparación con el ensayo BRAMHS PCT Kryptor®, mejorando la correlación cuando el análisis se restringía a un rango entre 0,12 y 1,0 ng/mL.
En conclusión, el ensayo Lumipulse® G BRAHMS PCT para la medida de PCT en el analizador Lumipulse G 600II muestra un excelente rendimiento analítico en lo referente a la sensibilidad analítica y funcional y los resultados son transferibles a los del ensayo ELECSYS® BRAHMS PCT. Sí que creemos necesario mencionar la necesidad de disponer de materiales de control de calidad interno con concentraciones de PCT próximas a los puntos de corte habitualmente utilizados para el inicio de terapia antibiótica en la infección respiratoria de vías bajas (0,25 ng/mL), el diagnóstico de sepsis y la posibilidad de plantear la retirada de tratamiento antibiótico (0,5 ng/mL)5.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los reactivos, materiales de control de calidad y de calibración, así como el resto de materiales necesarios para el estudio fueron cedidos de forma gratuita por Fujirebio Europe que no participó en el diseño del estudio y la interpretación de los resultados.