La electroforesis capilar de proteínas séricas es la técnica más utilizada actualmente por los laboratorios clínicos para la detección de componentes monoclonales en suero por su elevada sensibilidad, rapidez y alto nivel de automatización, mejorando notablemente los resultados frente a los métodos basados en la utilización de geles. Sin embargo, se han descrito interferencias por sustancias exógenas no proteicas que absorben a la misma longitud de onda y provocan la aparición de falsos positivos.
Se describen dos pacientes a los que se les realiza una extracción de sangre para una analítica programada que incluye la determinación del proteinograma. En ambos casos, justo antes de la extracción, se realizó una tomografía axial computarizada (TAC) de tórax con contraste yodado. En el proteinograma se observa un pico monoclonal en la fracción beta. La inmunofijación e inmunosustracción de ambos sueros no confirma la presencia del pico, por lo que se sospecha la existencia de una interferencia por el contraste yodado. Posteriormente, se solicita una nueva extracción a ambos pacientes para repetir el proteinograma y en ambos casos se observa la desaparición del pico obteniéndose un perfil electroforético totalmente normal.
Capillary electrophoresis of serum proteins is the method most currently used by clinical laboratories for the detection of monoclonal components in serum due to it being highly automated and rapid, with a high sensitivity, significantly improving the results compared to methods based on the use of gel techniques. However, there have been reports of interference by exogenous, non-protein substances that absorb at the same wavelength and cause false positives.
Blood samples for laboratory analysis, including protein electrophoresis, were taken from two patients just after they had been subjected to a computed tomography (CT) scan with iodinated contrast. A monoclonal peak was observed in the beta fraction of the electrophoresis pattern, which was unable to be confirmed by immunofixation or immunosubtraction, leading to the suspicion of interference by iodinated contrast. A second sample was requested in both cases to repeat the analysis, which showed the disappearance of the peak, with a totally normal electrophoretic profile being obtained.
El análisis de proteínas en suero por electroforesis capilar de zona (CZE) se ha convertido en el método de rutina para su separación rápida y eficaz, así como para la detección de disproteinemias y componentes monoclonales asociados a la proliferación de un clon específico de células B. La electroforesis de proteínas está indicada siempre que se sospeche una de estas alteraciones conocidas como gammapatías monoclonales (GM)1,2, las cuales presentan una secreción de proteínas de características homogéneas conocidas como inmunoglobulinas (excepto en el denominado mieloma no secretor).
El mieloma múltiple (MM) y la macroglobulinemia de Waldenström (MW) son los dos trastornos típicos asociados a la proliferación de células plasmáticas o a procesos linfoproliferativos.
La presencia de un clon de linfocitos o células plasmáticas con capacidad de producir una inmunoglobulina o un fragmento de la misma se relaciona también con la existencia de una gammapatía monoclonal de significado incierto (GMSI) cuyo origen, en la mayoría de los casos, es desconocido.
En el caso de que aparezca una banda estrecha o un pico monoclonal o se sospeche la presencia de un mieloma múltiple, macroglobulinemia, amiloidosis primaria o enfermedades relacionadas, debe realizarse la inmunofijación, puesto que es crítica para la diferenciación entre un aumento monoclonal o policlonal de las inmunoglobulinas.
Indicaciones adicionales de la inmunofijación son la detección de una pequeña cantidad de proteína M en presencia de inmunoglobulinas normales o aumentadas, pacientes con mieloma múltiple o macroglobulinemia en los que el tratamiento haya producido la desaparición de la proteína M en la electroforesis de rutina y el reconocimiento y distinción de gammapatías biclonales o triclonales. Además, se debe estudiar la posibilidad de una IgD o IgE monoclonal en todos los pacientes con presencia de una cadena ligera monoclonal en el suero pero sin reactividad frente a antisueros anti-G, anti-A o anti-M.
La CZE presenta la ventaja de que cuantifica todas las proteínas directamente a través de los enlaces peptídicos mediante detección ultravioleta; proporciona una elevada precisión y un tiempo de respuesta rápido3,4.
Como inconveniente, la CZE puede producir interferencias por sustancias exógenas no proteicas que también absorben a 200 o 214nm. El principal grupo de sustancias que pueden producir este tipo de interferencia son los agentes yodados radioopacos. Estos pueden producir un pico anormal en la región de la prealbúmina, en la fracción α-2-globulina o en la fracción β-globulina.
El conocimiento de estas sustancias interferentes es imprescindible para evitar la interpretación errónea de los resultados obtenidos por CZE.
Descripción de casosEl presente estudio se basa en la aparición, en la sección de proteínas del Servicio de Análisis Clínicos del Hospital General Mancha-Centro, de dos casos independientes con presencia aparente de un pico monoclonal cuando se analizaron los sueros mediante electroforesis capilar (EC) y que posteriormente se demostró que no existían realmente cuando se realizó la inmunofijación (IF), confirmándose como interferencias.
En la revisión rutinaria que se realiza de todos los proteinogramas diariamente, se observó, en primer lugar, la presencia de un posible pico monoclonal en la región β de uno de los sueros sometidos a EC. Siguiendo el protocolo diagnóstico establecido en el laboratorio se realizó una IF de la muestra siendo negativa la existencia de algún componente monoclonal. Revisada la historia clínica del paciente se pudo comprobar que se trataba de un paciente de 58 años valorado en consultas previas de Neumología que es enviado a Urgencias e ingresado posteriormente. Refiere aumento progresivo de su disnea habitual por enfermedad pulmonar obstructiva crónica (EPOC) desde hace dos semanas junto con tos de predominio nocturno y expectoración mucosa. El tratamiento administrado de forma ambulatoria no produce mejoría. Tras realizarle una exploración física sin hallazgos patológicos de importancia se le solicita una radiografía y una tomografía axial computarizada (TAC) de tórax con contraste. El mismo día que se realiza la TAC se solicita una analítica de rutina al laboratorio para la realización de una electroforesis de proteínas en suero. Concretamente el contraste yodado utilizado para la realización de la TAC es el Optiray 320 Ultraject® compuesto por Ioversol.
Un segundo caso se encontró posteriormente en otra muestra que igualmente mostró un aparente pico monoclonal mediante EC en la misma región que el anterior. La posterior comprobación por IF fue negativa. La paciente de 53 años se valoró en la consulta de Otorrinolaringología (ORL) por sensación de cuerpo extraño faríngeo. Presentaba un cuadro con tos permanente y hemoptisis ocasional. Había sido intervenida de nódulos en las cuerdas vocales en 2 ocasiones y estaba en tratamiento con Sintrom® por un accidente cerebrovascular (ACV) anterior. Se remitió a consulta de Neumología solicitándose una radiografía y TAC torácicos ante la sospecha de una bronquiectasia perihiliar derecha. El mismo día que se realizó el estudio con contraste intravenoso se hizo la extracción de sangre periférica para analítica de rutina con determinación de proteinograma. Se pudo comprobar que el contraste yodado utilizado era el mismo descrito anteriormente.
Material y métodosLas técnicas utilizadas para el análisis de las muestras fueron CZE mediante el sistema Capillarys de Sebia, IF e inmunosustración con el equipo Hydrasys de Sebia para identificar la presencia de un pico en el proteinograma como consecuencia de alguna interferencia.
La EC se utiliza en la separación de proteínas y péptidos como método alternativo a la electroforesis convencional. El mecanismo de separación está basado en las relaciones carga/masa de los analitos. Entre las ventajas que ofrece destaca la utilización de volúmenes de muestra extraordinariamente pequeños (< 10 nanoL) y una elevada resolución y rapidez.
El potencial aplicado hace que los diferentes componentes iónicos de la mezcla migren cada uno según su propia movilidad y se separen en zonas que puedan estar completamente resueltas o parcialmente solapadas.
Si se detecta un pico monoclonal en el proteinograma sérico, el estudio se debe completar mediante la realización de una IF o inmunosustracción para definir el tipo de proteína monoclonal.
La IF es un método inmunológico para identificar proteínas anormales. Con las ventajas de su rapidez y facilidad de interpretación, está sustituyendo gradualmente a la inmunoelectroforesis.
En una placa de gel se efectúa un recorrido electroforético para separar las proteínas que se tratan con los antisueros específicos de inmunoglobulinas anti-IgG, anti-IgA, anti-IgM, anti-kappa y anti-lambda.
De esta forma se permite que la inmunoglobulina que reacciona con su correspondiente antisuero se fije en la agarosa. Las otras proteínas que no reaccionan se eliminan. La tinción del gel con un colorante permite identificar la proteína anormal.
La inmunosustracción consiste en la incubación de la muestra con antisueros monoespecíficos correspondientes a las distintas clases de inmunoglobulinas, antes de su análisis electroforético. Como resultado, se obtienen las gráficas de los proteinogramas en los que se identifican las diferentes inmunoglobulinas por la reducción o ausencia de los picos originales correspondientes, cuando son comparados con el proteinograma de referencia de la muestra no tratada.
Procesamiento de las muestrasEn este estudio se analizaron de manera rutinaria, inicialmente, las muestras de dos pacientes. Las extracciones se realizaron por punción venosa de vía periférica en tubo de extracción de sangre al vacío de 10ml con gel y activador de coagulación de Biogen. Las muestras se centrifugaron posteriormente a 3500 r.p.m. durante 7 minutos para obtener los sueros a estudio, los cuales fueron sometidos a EC el mismo día de su extracción y conservados en nevera a 4°C en tubos tapados e identificados con sus correspondientes etiquetas de códigos de barras.
Tras detectar visualmente en los proteinogramas la presencia de un pico que pudiera estar causado por algún tipo de interferencia, se trataron los sueros con phosphate buffered saline (PBS) al 10% overnight y centrifugación posterior para evitar la posible presencia de fibrinógeno que produce la aparición de un pico en la zona β-γ del proteinograma.
Posteriormente se comprobó que a ambos se les había suministrado por vía intravenosa, el mismo día de la extracción, un contraste yodado para la realización de una TAC torácica. El contraste yodado utilizado era Optiray 320 Ultraject® en solución inyectable administrada por vía intraarterial o intravenosa, cuyo principio activo es Ioversol. Cada mililitro de Optiray 320 Ultraject® contiene 678mg de Ioversol equivalente a 320mg de yodo.
ResultadosLos resultados obtenidos de las muestras extraídas de los dos pacientes son los siguientes:
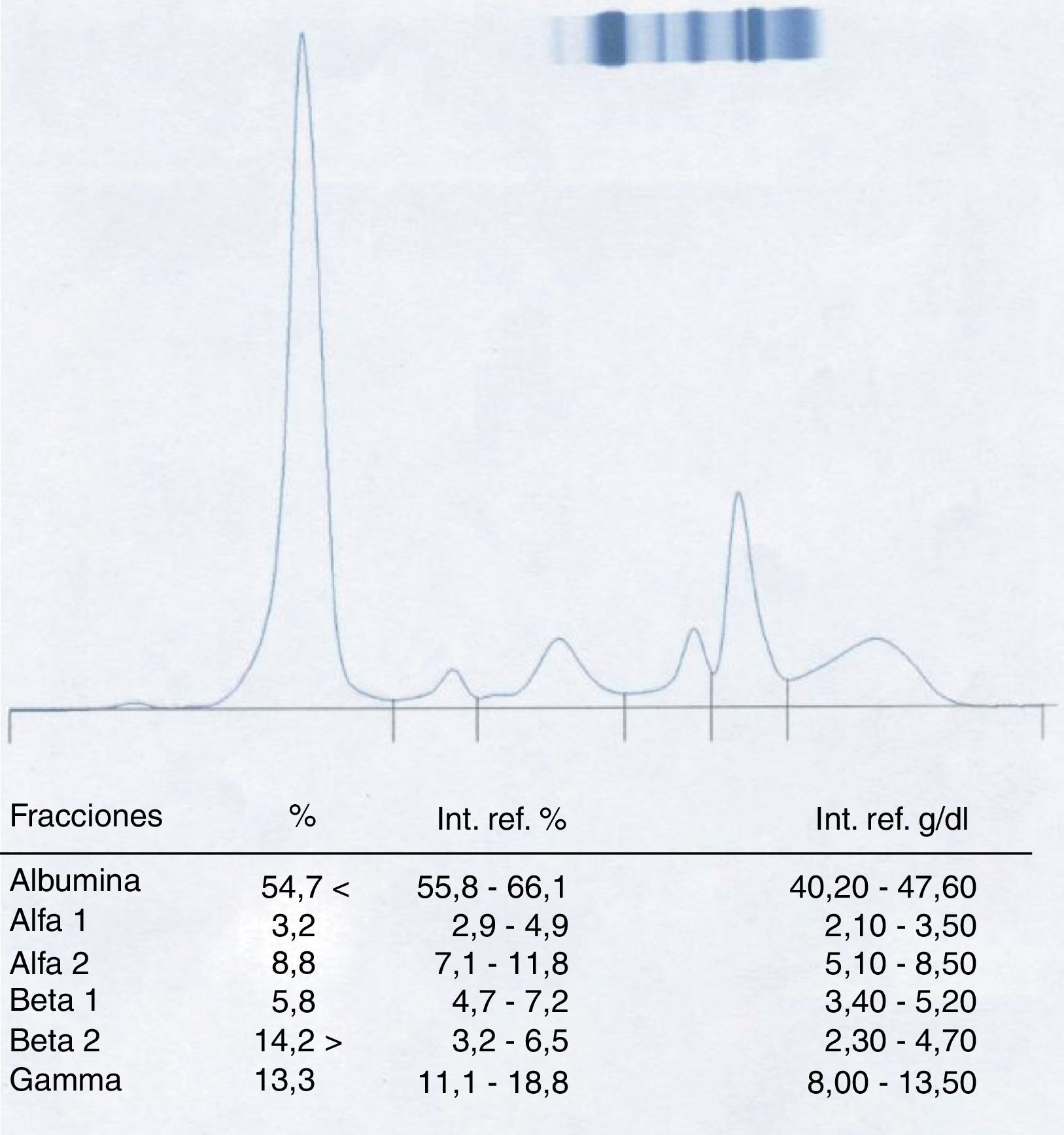
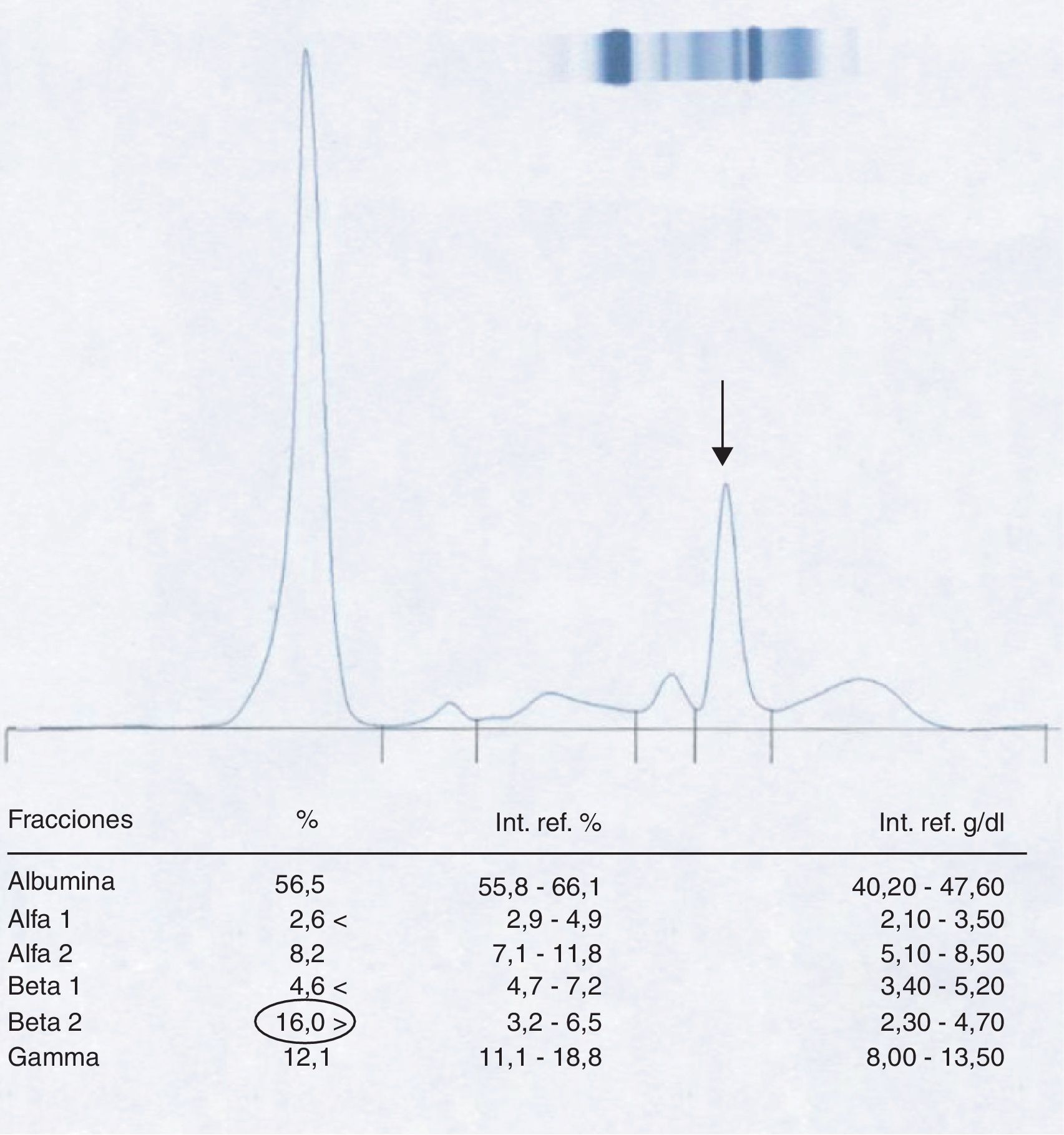
Paciente 1El varón de 58 años presenta una sospecha de componente monoclonal en la fracción β-2 al realizar la CZE del suero (fig. 1).
Posteriormente, siguiendo el protocolo establecido, se realiza una inmunofijación del suero del paciente (fig. 2) que revela la no existencia de una banda correspondiente a proteína monoclonal en la zona donde aparecía el pico.
El suero es tratado con PBS al 10% overnight para evitar la posible interferencia por la presencia de fibrinógeno pero la electroforesis posterior da el mismo resultado.
Consultado el caso con los clínicos se demuestra que la muestra de sangre analizada ha sido extraída el mismo día y con posterioridad a la realización de una TAC de tórax con contraste al paciente, lo cual hace sospechar que la aparición del pico puede ser el resultado de una interferencia por el agente yodado utilizado.
Para confirmar que la interferencia hallada en la CZE es el resultado del Ioversol se solicita una nueva extracción al paciente, realizándose esta 13 días después de la inicial.
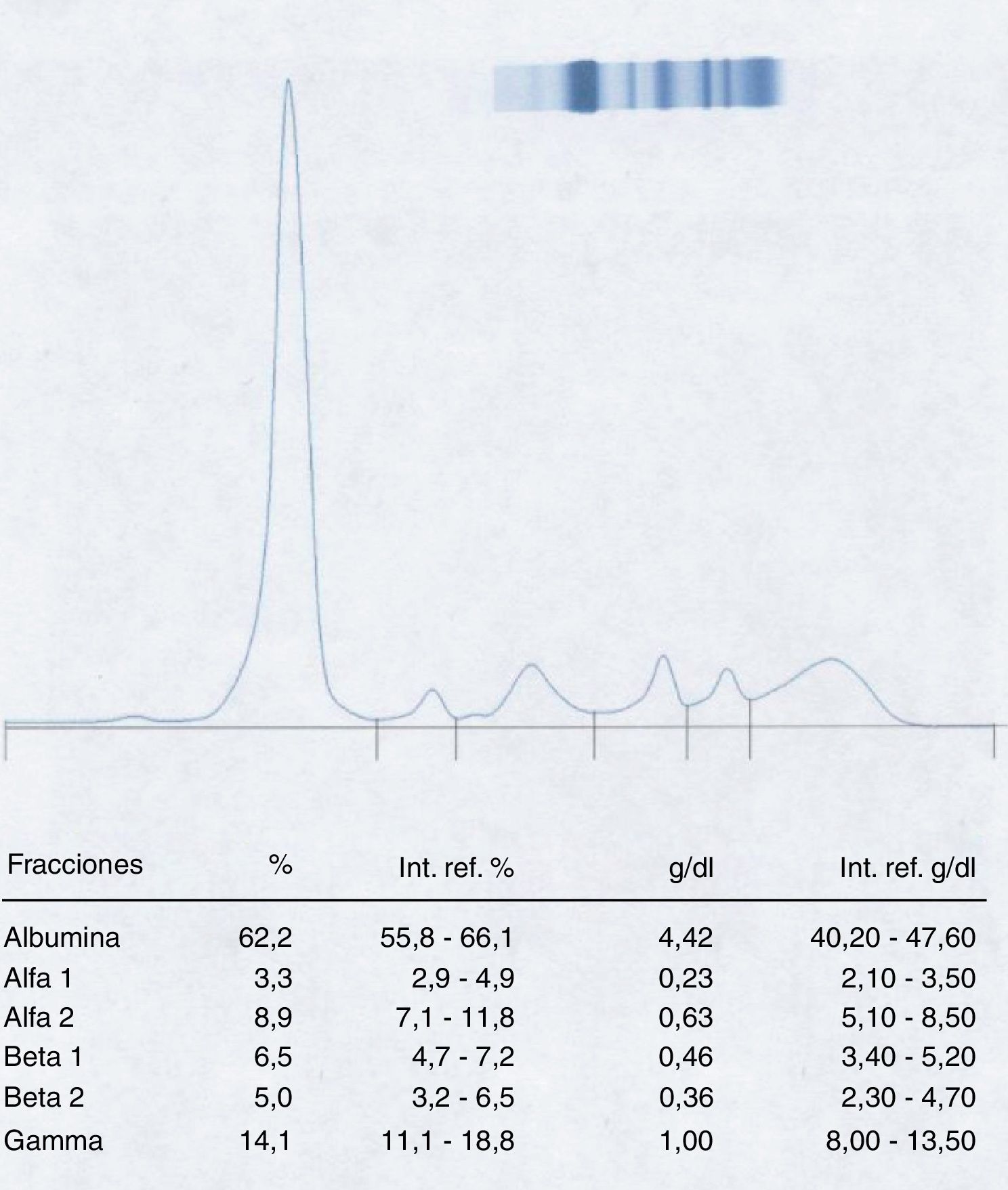
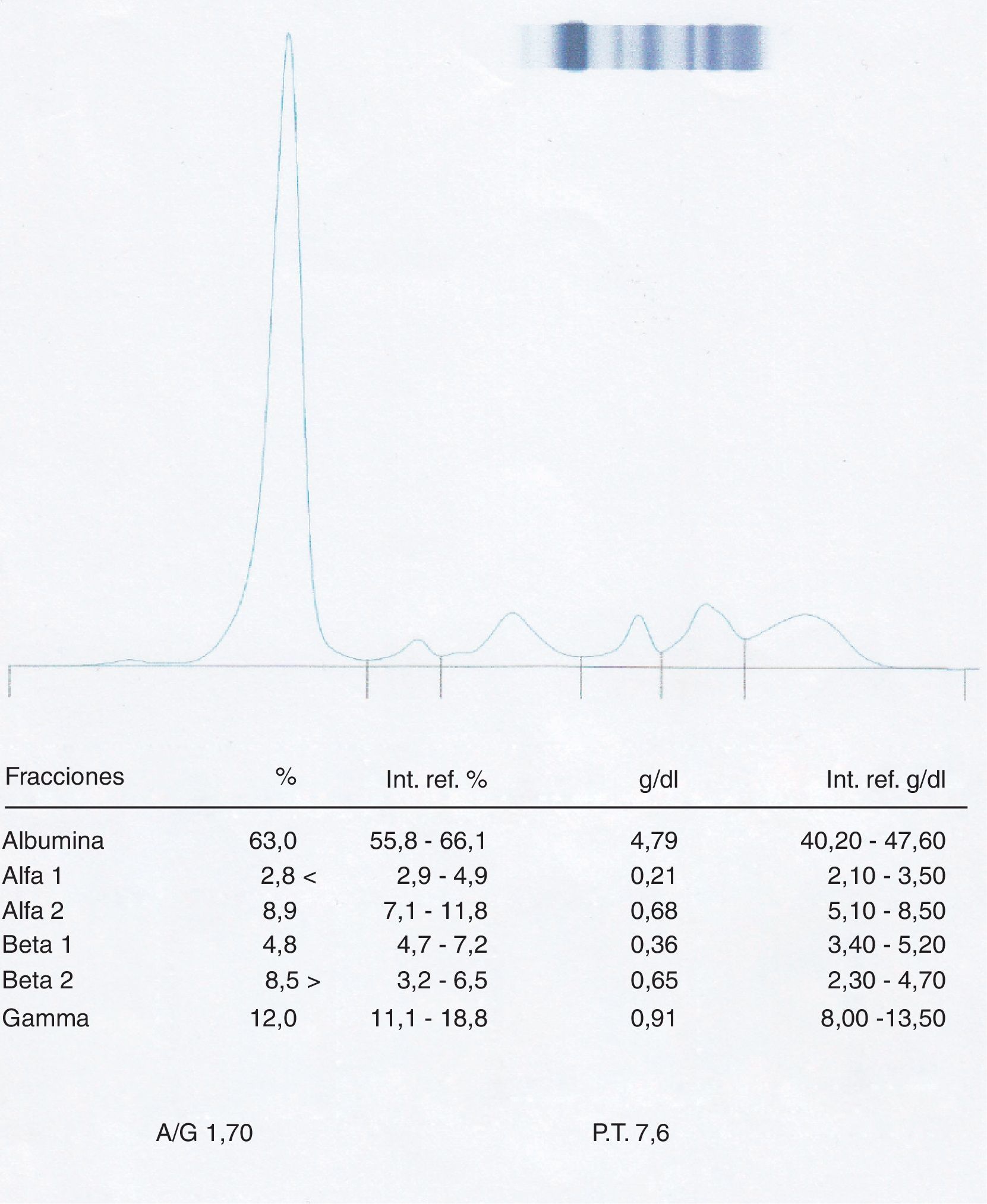
Efectivamente, al realizar el proteinograma a esta segunda muestra (fig. 3) se puede observar la desaparición del pico en la fracción β-2, obteniéndose un proteinograma totalmente normal.
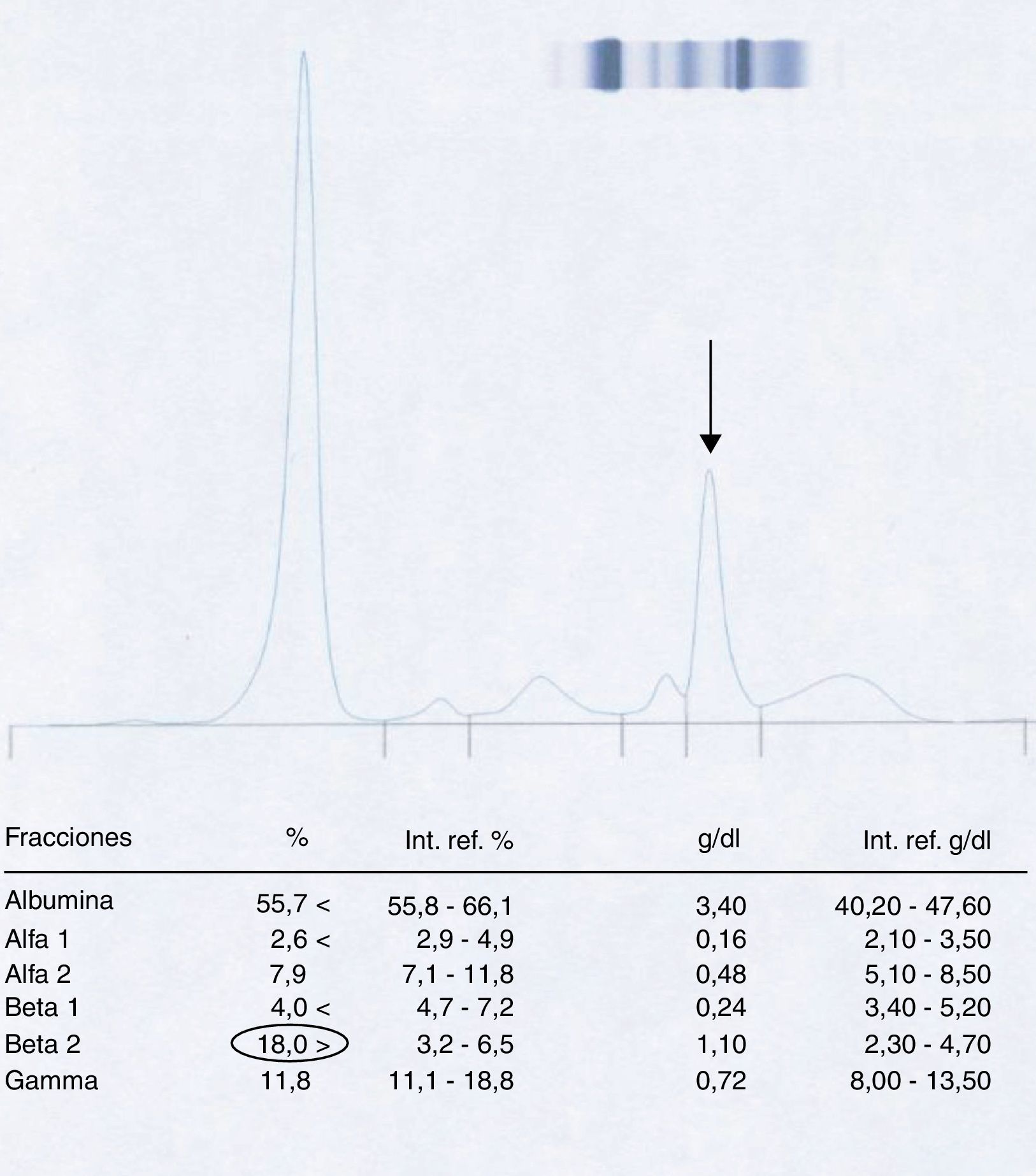
Paciente 2La mujer de 53 años igualmente presentó en la muestra inicial un pico en la región β-2 al realizar la electroforesis (fig. 4).
También se trató el suero con PBS (fig. 5) no apreciándose ningún cambio respecto al proteinograma inicial.
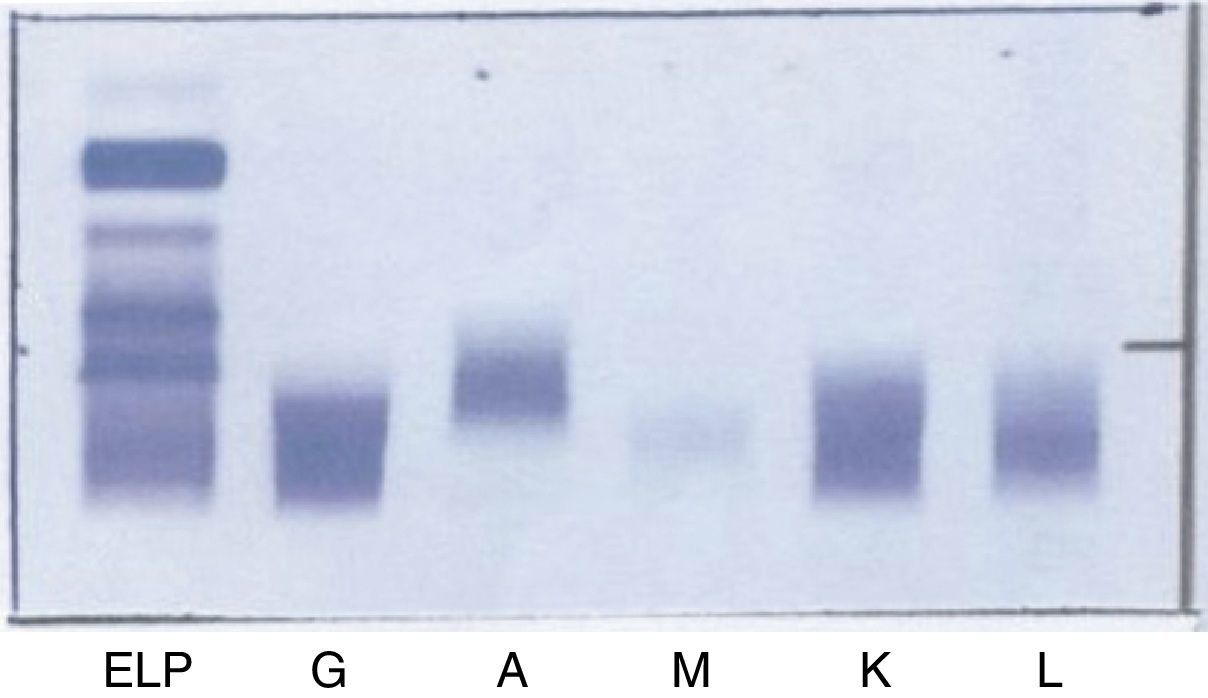
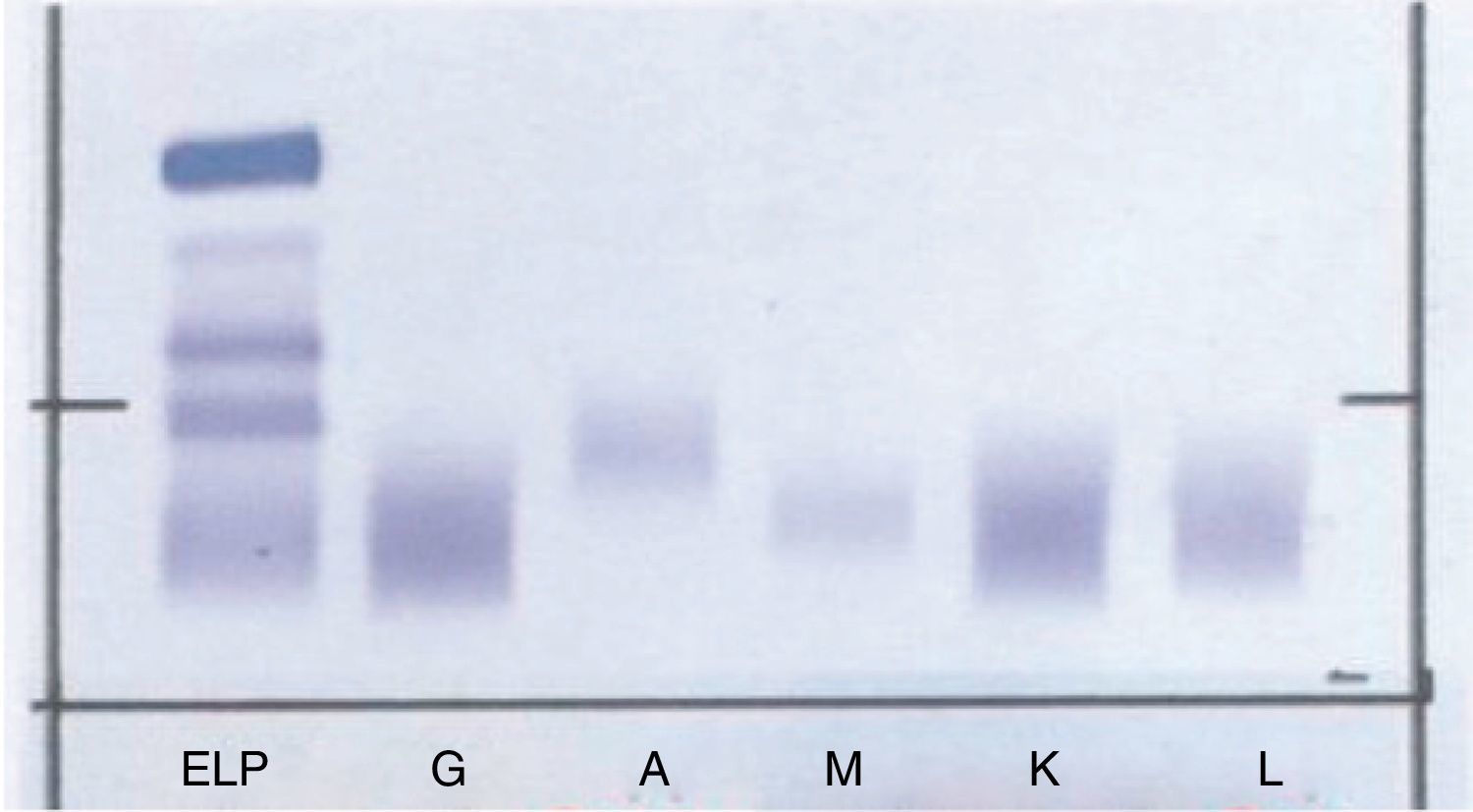
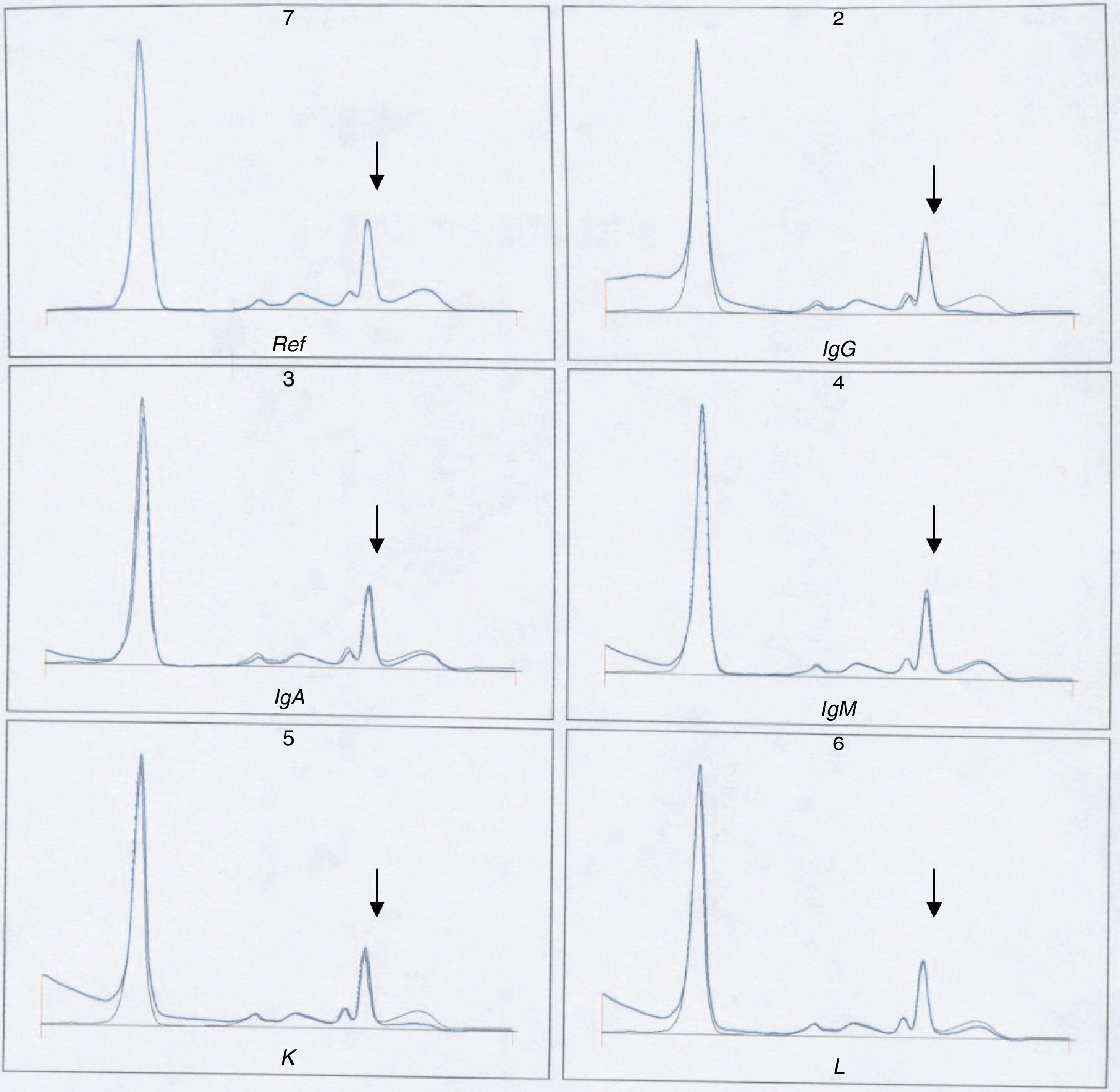
A continuación se realizó una IF (fig. 6) en la cual no aparece banda monoclonal asociada al pico encontrado en la CZE.
Para corroborar esta ausencia de banda se sometió a inmunosustracción la muestra de la paciente (fig. 7) y se comprobó que no se suprimía el pico al tratarla con los antisueros. La muestra del primer paciente no pudo someterse a esta técnica por no disponer de ella en ese momento.
A esta paciente también se le había suministrado Ioversol para la realización de una TAC torácica minutos antes de la extracción de la muestra para la CZE.
Finalmente se solicitó una segunda extracción para comprobar la desaparición del pico en esta muestra, realizándose la misma casi al mes de la primera, debido a que la paciente no se presentó a las citas previas por problemas laborales. Una vez obtenida la muestra, se sometió a una electroforesis rutinaria (fig. 8) obteniéndose como resultado un proteinograma sin ningún pico sospechoso de proteína monoclonal.
DiscusiónExisten diversos estudios que demuestran la aparición de interferencias tras la administración de contrastes yodados en muestras sometidas a electroforesis.
Hasta ahora, la mayoría de los artículos han descrito casos en los que la interferencia se localizaba en la fracción α-2. In vitro, Arranz-Peña et al.5 han comparado las interferencias por 13 agentes de contraste yodado diferentes y encontraron que la mayoría de ellos producía un pico en la fracción α-2 aunque alguno lo hacía en la β. En cuanto al tiempo necesario que se debería dejar entre la administración del contraste y la extracción de la muestra para CZE, estos mismos autores concluyen que debería ser entre 2 y 6 días.
En otro estudio realizado por Bossuyt et al.6 se comprobó la interferencia causada por tres contrastes yodados en la fracción α-2 del proteinograma. Coincide también en el tiempo necesario para la eliminación del contraste, entre 2 y 6 días, ya que transcurrido ese periodo no se observa ningún pico al extraer de nuevo las muestras para CZE.
Sin embargo, existen algunos estudios in vivo que demuestran la progresiva disminución del pico interferente del proteinograma hasta su casi total desaparición a las 8 horas tras la administración del agente yodado7,8. Concretamente se ha descrito que tras estar 8 horas la concentración del mismo disminuye hasta aproximadamente un 5% de la cantidad administrada.
Como conclusión del presente estudio, se puede confirmar que la administración del contraste yodado Optiray 320 Ultraject® cuyo principio activo es el Ioversol, produce una interferencia en la fracción β del proteinograma realizado por CZE, en las muestras de los pacientes a los que se les ha administrado el contraste inmediatamente antes de la extracción.
Para tratar de evitar este tipo de interferencias, se debería especificar en las instrucciones de uso de este tipo de agentes que no se debe realizar extracción de sangre para electroforesis de proteínas por CZE inmediatamente después de su administración.
La aparición de pseudoparaproteinemia también se puede aplicar a otras exploraciones con contraste distintas de la TAC como la angiocardiografía. En un trabajo publicado por Vermeersch et al.9 se demostró la aparición, en la fracción β, de un posible pico monoclonal tras la administración del contraste iomeprol previo a una angiocardiografía. Posteriormente la inmunofijación confirmó la interferencia producida por el contraste al no encontrarse dicho pico.
Asimismo, se han encontrado antibióticos que pueden interferir en los resultados de la CZE. El Sulfametoxazol migra en la zona más anódica y puede producir un pico en la zona de la prealbúmina10, por lo que no daría lugar a error ya que en esta zona no se observan proteínas monoclonales. Sin embargo otros, como la Ampicilina-Sulbactam11, producen un pico en α-2 semejante a los que aparecen con contrastes yodados.
Un aspecto a tener en cuenta sería el retraso que la velocidad de eliminación de los contrastes experimentaría en el caso de pacientes con una función renal alterada. En estos casos la interferencia persistiría durante un período de tiempo más prolongado en función del grado de deterioro renal, ya que el contraste permanecería más tiempo en circulación antes de su eliminación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.