La terapia con anticuerpos monoclonales desarrollada en los últimos años se utiliza actualmente en numerosas patologías. Al ser similares estructuralmente a las inmunoglobulinas endógenas podrían detectarse como bandas monoclonales mediante técnicas de electroforesis e inmunofijación en el análisis de proteínas séricas resultando un falso positivo e informarse erróneamente como componente monoclonal.
ObjetivoReproducir in vitro la concentración sérica de rituximab, infliximab y tocilizumab y evaluar la interferencia producida por estos fármacos en la electroforesis e inmunofijación de proteínas en gel de agarosa.
Material y métodosSe parte de un pool de sueros de pacientes sanos a los que se añade la cantidad de fármaco necesaria para obtener concentraciones decrecientes de anticuerpos monoclonales. Se realiza la electroforesis y la inmunofijación a estas muestras con diluciones de fármacos en el equipo IINTERLAB G26 de Biometa.
Resultados y conclusionesEn los tres fármacos el proteinograma resulta positivo para las concentraciones de fármaco más elevadas y la señal va disminuyendo hasta desaparecer según disminuye la concentración de fármaco. Así mismo la inmunofijación también resulta positiva observando una banda que corresponde a inmunoglobulina G kappa con la diferencia que rituximab y tocilizumab migran en una zona más próxima al cátodo que infliximab.
Rituximab, infliximab y tocilizumab se detectan como bandas monoclonales en la electroforesis de proteínas e inmunofijaciones correspondientes siendo falsos positivos en la detección de componentes monoclonales. Es necesario que se conozcan los patrones del proteinograma y de la inmunofijación de los anticuerpos monoclonales utilizados en cada hospital con la finalidad de evitar informar falsos positivos.
Monoclonal antibody therapy is being used nowadays to treat many diseases. Due to the structural similarity to endogenous immunoglobulins, they might be detected while testing for serum proteins using immunifixation and electrophoresis techniques, giving as a result false positives and being reported as monoclonal components mistakenly.
ObjectivesTo reproduce rituximab, infliximab and tocilizumab serum concentrations in vitro and to evaluate the interference of these drugs when performing protein electrophoresis and immunofixation with agarose gel electrophoresis.
Methods and materialsThe amounts of drug needed in order to achieve decreasing concentrations of monoclonal antibody were added to sera samples taken from healthy individuals. Both serum protein electrophoresis and inmunofixation were performed into those drug dilutions using IINTERLAB G26 as equipment.
Results and conclusionsThe electrophoresis was positive for high drug concentrations in the three monoclonal antibody groups, being the signals weaker with decreasing concentrations. Same result was obtained with immunofixation, noting a band corresponding to a kappa G immunoglobulin which migrates closer to the cathode for the cases of rituximab and tocilizumab than for infliximab. It has been proved that rituximab, infliximab and tocilizumab are detected by agarose gel electrophoresis and their corresponding immunofixations and may cause false positives while detecting monoclonal components. Professionals should know the electrophoresis and immunofixation patterns of the monoclonal antibody drug used in their workplaces in order to avoid reporting false positives.
Los métodos de identificación de proteínas se basan en la combinación de una separación de las proteínas por electroforesis e inmunoelectroforesis (en gel de agarosa, poliacrilamida) y una reacción inmunoquímica con antisueros específicos como son la inmunofijación, inmunosustracción e inmunotipado1,2.
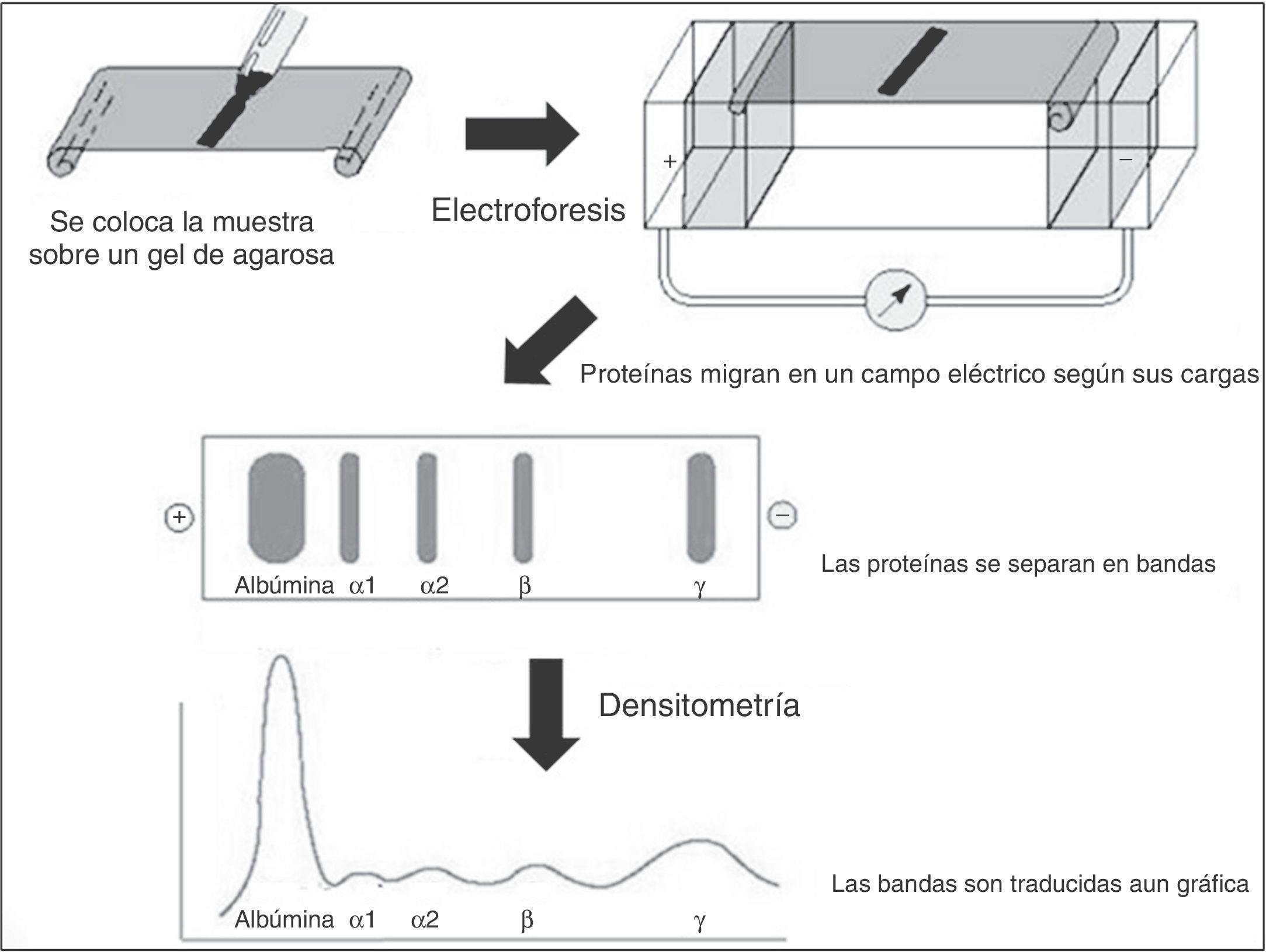
La electroforesis es un método ideado hace más de 50 años que se basa en separar las proteínas por medio de un campo eléctrico. Si ponemos una solución de proteínas (suero sanguíneo) sobre un soporte (gel de agarosa o poliacrilamida), inmerso en un tampón de pH básico, todas las proteínas estarán cargadas. Y si ahora sometemos el suero a una corriente eléctrica, se separarán grupos o fracciones de proteínas en función de su carga y su peso molecular. Se obtienen grupos de proteínas en forma de bandas, que una vez teñidas dan lugar a una imagen de las diferentes fracciones proteicas, que es lo que se denomina proteinograma (fig. 1).
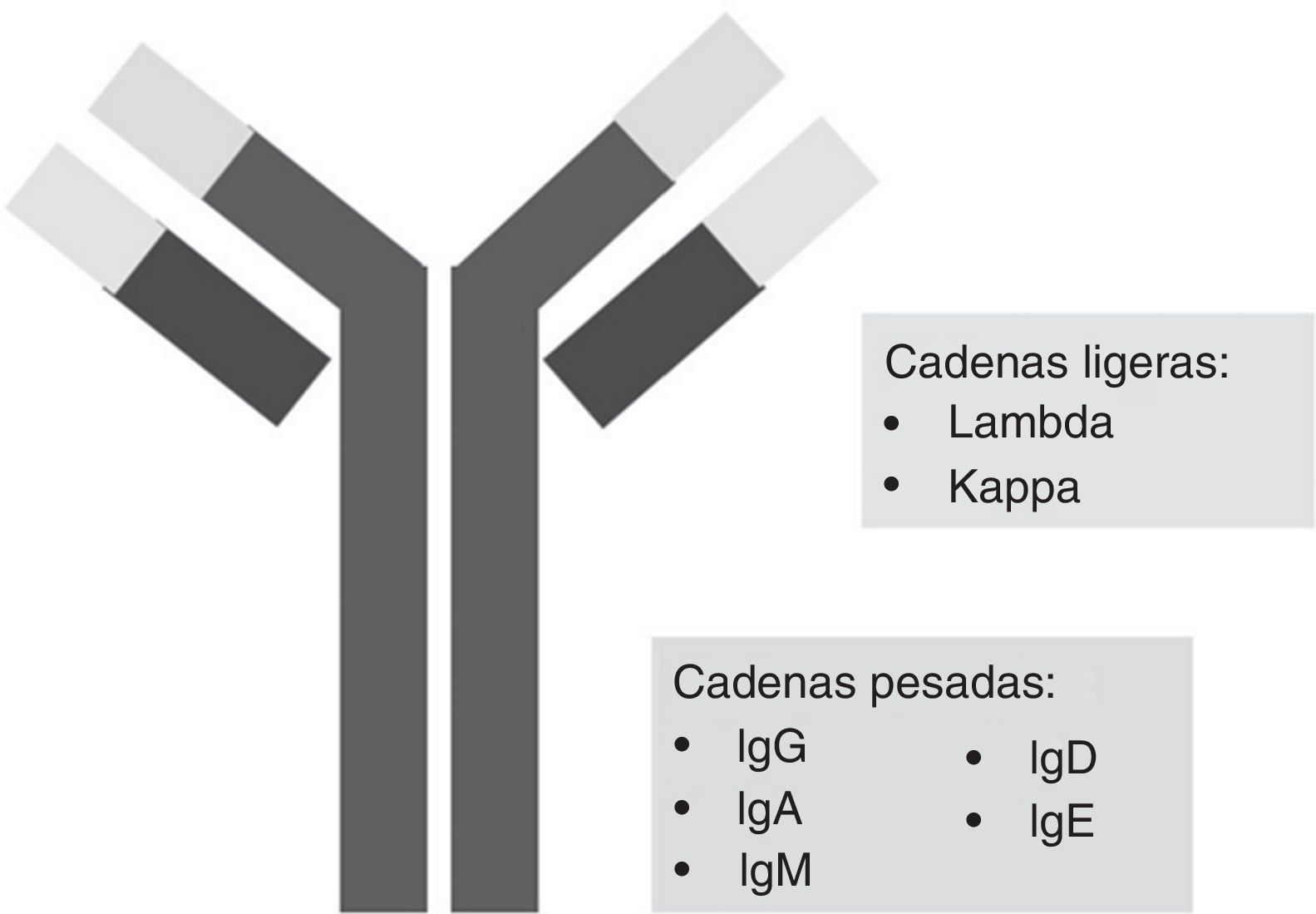
La intensidad y anchura de cada banda se visualiza con un densitómetro, que transforma las bandas en curvas. La reacción inmunoquímica enfrenta anticuerpos para identificar los tipos de proteínas o anticuerpos separados por electroforesis de proteínas. Estos anticuerpos abarcan IgG, IgM, IgA, formas de cadena ligera lambda y formas de cadena ligera kappa (figs. 2 y 3).
En algunas situaciones especiales además se debe estudiar IgD IgE y cadenas ligeras libres kappa y lambda.
Hoy en día en los laboratorios de análisis proteicos está muy extendido el uso de la electroforesis capilar que se realiza en sistemas totalmente automatizados y es otra técnica de separación de proteínas cuyo soporte es un capilar de sílice fundida de diámetro muy pequeño. Un pequeño volumen de muestra es inyectado por aspiración en el extremo anódico del capilar relleno con el tampón. La separación de proteínas se realiza a un voltaje elevado siendo la detección directa y la cuantificación de las diferentes fracciones de proteínas se realiza a una longitud de onda específica en el extremo catódico del capilar. La diferencia principal radica en que no hay tinción ninguna1-3.
La electroforesis de proteínas y posterior reacción inmunoquímica con antisueros, son técnicas utilizadas hoy día para la detección e identificación de componentes monoclonales e indicado realizarlas ante la sospecha, pronóstico y seguimiento de todas las gammapatías monoclonales.
Las gammapatías monoclonales constituyen un conjunto de trastornos diversos asociados a una proliferación de células B maduras. Las dos entidades clínicas sintomáticas más importantes asociadas a trastornos de células B maduras son el mieloma múltiple y la macroglobulinemia de Waldenström. Se caracterizan (con alguna excepción como es el caso del mieloma no secretor) por la secreción de moléculas de inmunoglobulinas (intactas o fragmentos) homogéneas desde el punto de vista inmunoquímico y electroforético, a las que habitualmente se conoce como componente monoclonal. Existe además una serie de GM que cursan de manera asintomática denominadas gammapatías monoclonales de significado incierto y que se consideran una etapa premaligna de mieloma múltiple ya que un 1% anual puede evolucionar a este1,4 (fig. 1).
Ante la sospecha de una GM, es imprescindible que el clínico disponga desde el momento del diagnóstico, de una electroforesis de proteínas en suero con el gráfico del trazado electroforético y una vez detectado el CM, es necesario identificar convenientemente el isotipo de inmunoglobulina que lo integra (cadena pesada y cadena ligera) por inmunofijación, inmunosustracción o inmunotipado y en el caso de las gammapatías monoclonales de significado incierto, permite efectuar el seguimiento de su evolución1,4.
En los métodos de identificación de proteínas actuales se producen interferencias que son conocidas ampliamente por los laboratorios, como es la concentración elevada de lipoproteínas, la hemoglobina libre y la que forma complejos con haptoglobina, el fibrinógeno y la proteína C reactiva, contrastes yodados e incluso algunos antibióticos. Pero cada vez son más empleados en terapia los fármacos con estructura de anticuerpo monoclonal que pueden también interferir en estas técnicas y no son tan conocidos2,3.
Los anticuerpos monoclonales (AcM) son moléculas de anticuerpos IgG Kappa, idénticos y específicos para un determinante antigénico. Fueron descritos por primera vez en 1975 por Köhler y Milstein y obtuvieron por ello el Premio Nobel en Fisiología o Medicina en 19845. El primer AcM empleado con fines terapéuticos fue en 1982 para el tratamiento de un linfoma6. Los AcM son herramientas esenciales en el ámbito clínico y biotecnológico, y han probado ser útiles en el diagnóstico y tratamiento de enfermedades infecciosas, inmunológicas y neoplásicas, así como en el marcaje, detección y cuantificación de diversas moléculas. Actualmente, la incorporación de las técnicas de biología molecular e ingeniería genética y proteica han permitido ampliar el horizonte de la generación de AcM y sus usos, y se han encontrado técnicas como la hibridación, la quimerización, humanización y la producción de anticuerpos monoclonales totalmente humanos7.
La terapia con AcM desarrollada en los últimos años es muy utilizada actualmente para tratar numerosas patologías principalmente en los Servicios de Hematología y Reumatología. En nuestro hospital son de uso habitual rituximab, infliximab, tocilizumab como fármacos intravenosos y golimumab, adalimumab, certolizumab, belimumab y ustekinumab, en formas farmacéuticas subcutáneas.
Al ser similares estructuralmente a las inmunoglobulinas endógenas podrían detectarse como bandas monoclonales mediante técnicas de identificación de proteínas séricas resultando un falso positivo e informarse erróneamente como componente monoclonal.
Rituximab, infliximab y tocilizumab son AcM tipo IgG1 subclase kappa. Rituximab se une específicamente al antígeno CD20, una fosfoproteína que se expresa en los linfocitos pre-B y B maduros. Se utiliza en el tratamiento del linfoma no Hodgkin, leucemia linfática crónica, granulomatosis con poliangeitis y artritis reumatoide8–11. Infliximab es un AcM anti-TNFalfa y sus aplicaciones fundamentales son la artritis reumatoide, las espondiloartropatías, la enfermedad de Crohn, colitis ulcerosa y psoriasis12–14. Tocilizumab se une al receptor celular de la interleucina-6 y se usa principalmente para el tratamiento de la artritis reumatoide15,16.
Conocer el patrón de bandas monoclonales en la electroforesis e inmunofijación de estos fármacos es importante para interpretar correctamente los resultados evitando falsos positivos.
ObjetivoEl objetivo de nuestro trabajo es reproducir in vitro la concentración sérica de rituximab, infliximab y tocilizumab y evaluar la interferencia producida por estos fármacos cuando realizamos el proteinograma e inmunofijación por electroforesis en gel de agarosa.
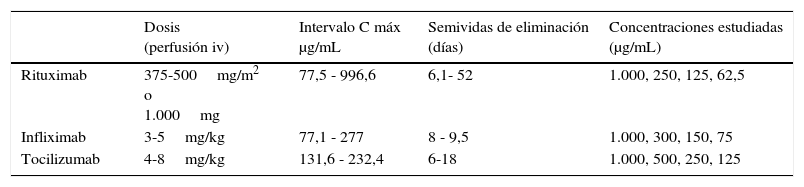
Material y métodosSe parte de un pool de sueros de pacientes sanos a los que se añade la cantidad de fármaco necesaria para obtener concentraciones decrecientes de AcM. Dichas concentraciones las realizamos basándonos en los intervalos de concentraciones máximas medias obtenidas en los ensayos clínicos pivotales que se describen en las características farmacocinéticas de la ficha técnica de cada fármaco y son resultado de medir la concentración de fármaco en sangre tras la administración de las dosis más habituales utilizadas en la terapia con esos fármacos (tabla 1).
Dosis terapéuticas según patología, intervalos de concentraciones máximas y de semividas de eliminación obtenidas según ensayos clínicos descritos en ficha técnica (11,14,16) y concentraciones ensayadas en el estudio
| Dosis (perfusión iv) | Intervalo C máx μg/mL | Semividas de eliminación (días) | Concentraciones estudiadas (μg/mL) | |
|---|---|---|---|---|
| Rituximab | 375-500mg/m2 o 1.000mg | 77,5 - 996,6 | 6,1- 52 | 1.000, 250, 125, 62,5 |
| Infliximab | 3-5mg/kg | 77,1 - 277 | 8 - 9,5 | 1.000, 300, 150, 75 |
| Tocilizumab | 4-8mg/kg | 131,6 - 232,4 | 6-18 | 1.000, 500, 250, 125 |
Para rituximab preparamos cuatro alícuotas de 1.000, 250, 125 y 62,5μg/ml basándonos en el intervalo 77,5 - 996.6μg/mL indicado en la ficha técnica del fármaco11.
Para infliximab otras cuatro alícuotas de 1.000, 300, 150 y 75μg/ml para el intervalo 77,1-277μg/mL14 y de tocilimumab 1.000, 500, 250 y 125μg/ml para el 131,6-232,416.
El método de identificación de proteínas que se utiliza en este estudio es la electroforesis e inmunofijación en gel de agarosa. Se realiza en el equipo INTERLAB G26 de Biometa siguiendo protocolo habitual de trabajo.
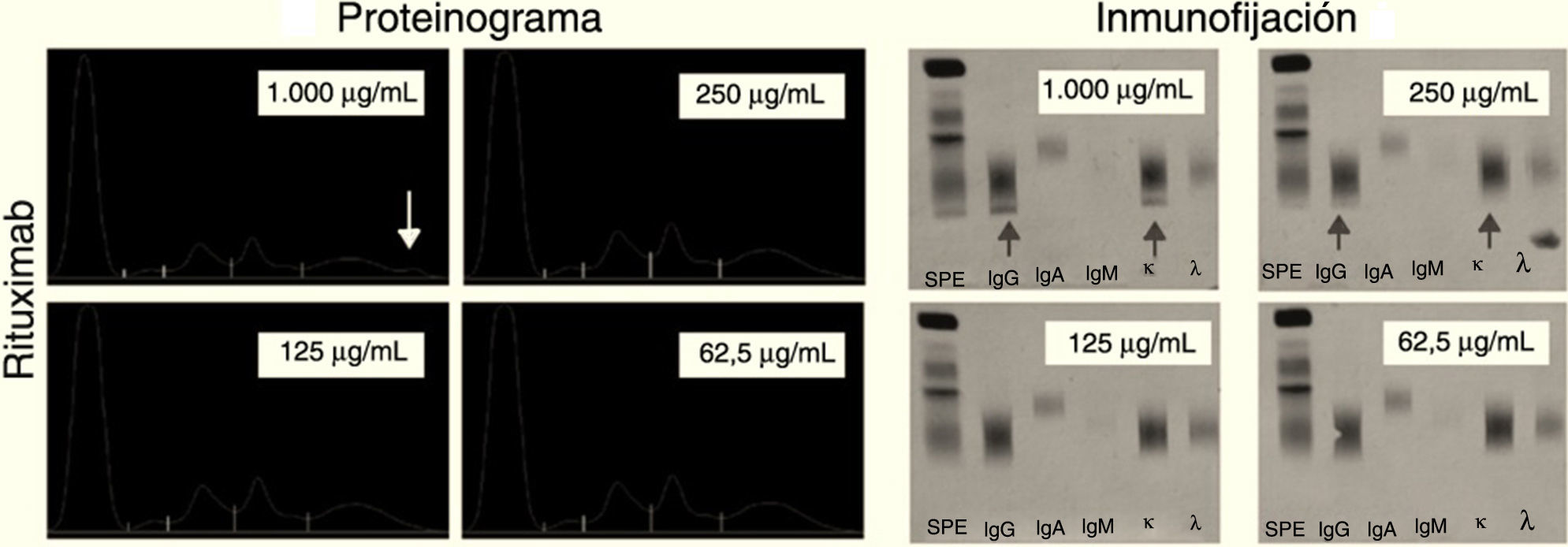
ResultadosRituximab: tras la electroforesis a las cuatro concentraciones decrecientes (1.000, 250, 125 y 62,5μg/ml) se observa la aparición de un pico en la zona gamma del proteinograma solo a la concentración de 1.000μg/ml.
En la inmunofijación, ya que es una técnica más sensible, resulta negativa a una concentración menor de 125μg/mL (fig. 4).
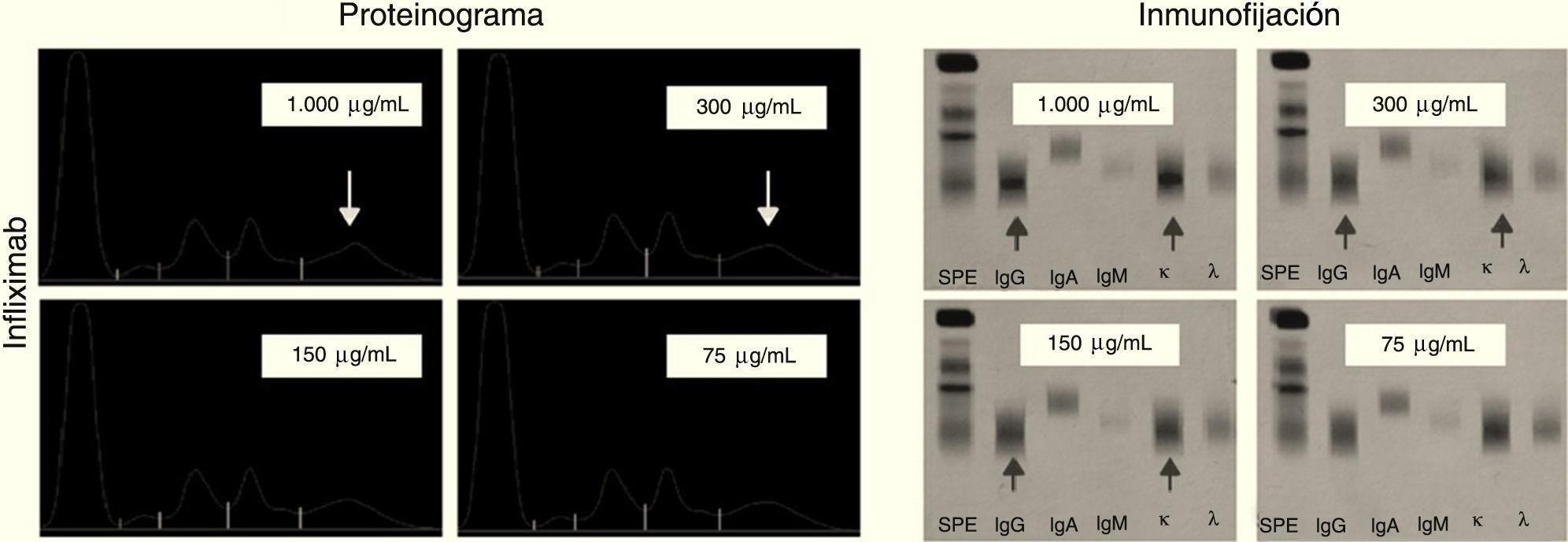
Infliximab: a las concentraciones ensayadas (1.000, 300, 150 y 75μg/ml) se observa la aparición de un pico en la zona gamma del proteinograma a las concentraciones de 1.000 y 300μg/ml y es negativa a 150μg/mL. Las inmunofijaciones correspondiente muestran bandas correspondientes a IgG kappa visible a la concentración de 150μg/mL y resulta negativa a 75μg/mL (fig. 5).
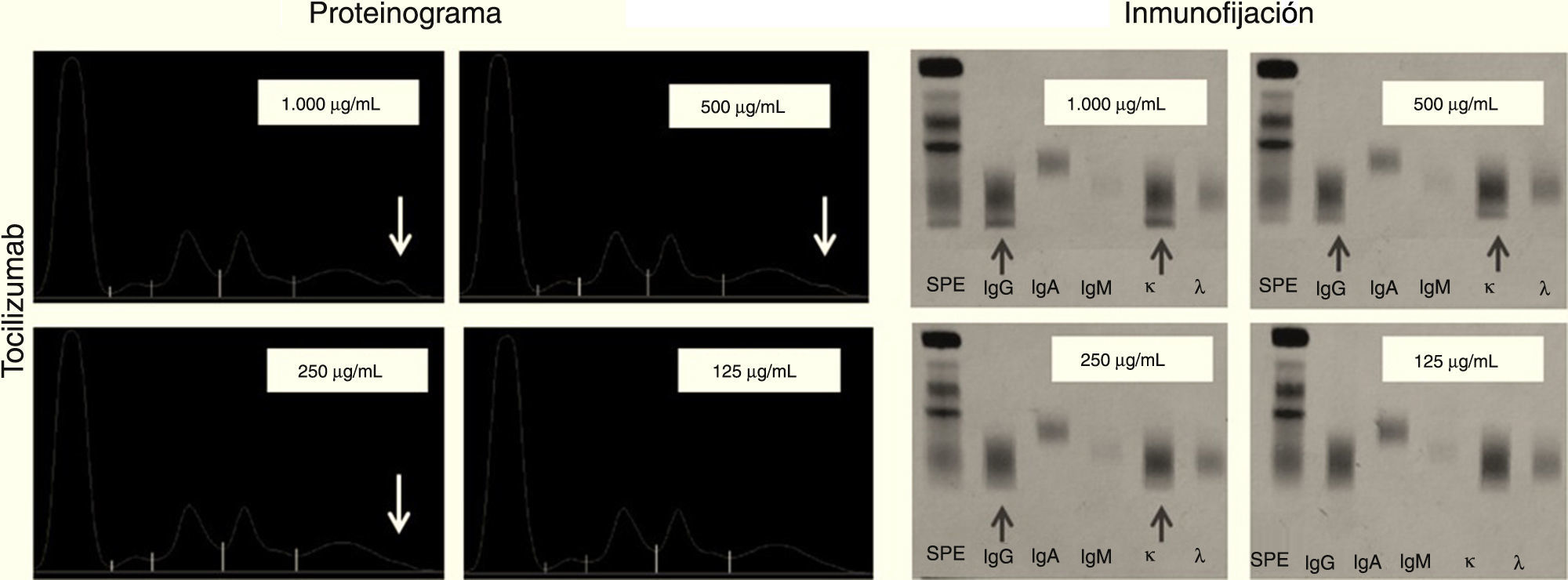
Tocilizumab: tras la electroforesis a las cuatro concentraciones decrecientes (1.000, 500, 250 y 125μg/ml), se observa la aparición de un pico en la zona gamma del proteinograma a las concentraciones 1.000, 500 y 250μg/mL. No se observa pico a 125μg/mL.
Las inmunofijaciones correspondientes muestran que se trata de IgG kappa siendo visible a las mismas concentraciones en las que apareció el pico en la electroforesis (fig. 6).
Podemos observar en el infliximab que el pico aparece en el centro de la fracción gamma del proteinograma al igual que la banda de la inmunofijación. En cambio rituximab y tocilizumab son muy catódicas apareciendo el pico y la banda en la zona más cercana al cátodo.
DiscusiónLos AcM cada vez se utilizan más debido a su eficacia demostrada en una amplia gama de trastornos clínicos, tanto en oncología como en enfermedades autoinmunes. Algunos se administran en dosis muy altas, especialmente en el tratamiento de tumores, por lo general por un período corto de tiempo adjuntos a la quimioterapia o radioterapia como el rituximab. Otros, se utilizan a largo plazo, para el tratamiento de enfermedades crónicas y se administran en dosis más bajas como el infliximab y tocilizumab. Por tanto, es de vital interés conocer el patrón de migración de dichos fármacos para evitar hacer diagnósticos erróneos de falsos positivos de gammapatías monoclonales.
A la vista de los resultados podemos observar que a las concentraciones más altas en sangre según los ensayos clínicos indicados en ficha técnica, todos los fármacos resultan positivos o bien en la electroforesis o bien en la inmunofijación (técnica más sensible) pero no se detectan a concentraciones más bajas. Por lo que dichas interferencias en la clínica diaria serían solo posibles cuando la administración del fármaco ha sido reciente o aunque en ficha técnica manifiestan que no se ha estudiado, en caso de pacientes con insuficiencia renal o hepática que pudieran alcanzar concentraciones mayores en sangre.
En estudios similares al nuestro como el de Willrich et al. a diferentes muestras de sueros normales añadieron diferentes concentraciones de infliximab (100μg/mL), adalimumab (100μg/mL), eculizumab (200μg/mL), vedolizumab (300μg/mL) y rituximab (400μg/mL) observando que a las concentraciones de 300 y 400mg/ml de vedolizumab y rituximab el proteinograma (Helena Laboratories) e inmunofijación (Sebia) son positivas, mientras que el resto de AcM a concentraciones menores (100 y 200μg/mL) resultan negativos. En dicho estudio además para demostrar la presencia del fármaco en todas las muestras realizan espectrometría de masas de tiempo de vuelo (AbSciex Triple TOF 5600) pudiéndose observar en el cromatograma la presencia de los picos a todas las concentraciones ensayadas de los cinco fármacos17.
En un ensayo clínico que investiga oofatumumab para el tratamiento de la macroglobulinemia de Waldenstrom, se observan siete pacientes que (junto con su anteriormente descrita IgM monoclonal) aparecía adicionalmente un componente monoclonal IgG kappa cerca del cátodo en la electroforesis e inmunofijación durante la terapia con ofatumumab18. En otros estudios similares como el de McCudden et al. (2010) se observaron componentes monoclonales IgG kappa en proteinograma e inmunofijación en sueros de pacientes en terapia con siltuximab, rituximab,trastuzumab, bevacizumab, infliximab, cetuximab y adalimumab19.
En cuanto a las limitaciones de nuestro estudio diremos que al no ser un estudio in vivo no hemos podido calcular el tiempo en que cada fármaco se metaboliza y poder mostrar las correspondientes electroforesis e inmunofijación a diferentes tiempos. Por otro lado no hemos demostrado que a concentraciones más bajas en que electroforesis e inmunofijación son negativas, realmente esté el fármaco en sangre como en el estudio de Willrich et al., que pudieron demostrarlo con espectrometría de masas de tiempo de vuelo.
Finalmente como conclusiones podemos decir que en este estudio se demuestra que rituximab, infliximab y tocilizumab se detectan en la electroforesis en gel de agarosa e inmunofijación correspondiente por lo que se comprueba que pueden dar falsos positivos e interpretarse como gammapatías monoclonales de forma incorrecta en caso de pacientes que han recibido el tratamiento con AcM recientemente o pacientes con insuficiencia renal o hepática. Sería de gran utilidad hacer estudios similares con el resto de fármacos AcM utilizados habitualmente para conocer su patrón de migración electroforética. Cada vez hay más AcM comercializados debido a su demostrada efectividad terapéutica por lo que el conocimiento de dichos patrones de migración asegura la interpretación correcta de resultados en aquellos pacientes sometidos a terapias con AcM.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.