La 25-hidroxivitamina D [25(OH)D] se considera un marcador del estado general de salud y su deficiencia es un problema a nivel mundial. En la actualidad no existe un consenso para definir sus niveles óptimos, siendo necesario establecerlos para cada población de acuerdo con sus características étnicas y factores ambientales a los que está expuesta.
ObjetivoDeterminar los intervalos de referencia para 25(OH)D en población autóctona y aparentemente sana de Yucatán.
MétodosSe estudiaron 71 voluntarios aparentemente sanos, de uno u otro sexo, de uno a 65 años, originarios y residentes en Yucatán. Se determinaron los niveles séricos de 25(OH)D, así como los de calcio, fósforo y paratohormona por su relación con el metabolismo de la vitamina D. Los intervalos de referencia se calcularon con los métodos paramétrico y consistente. Se registró el fototipo de piel y se aplicó el test de Garabédian para determinar el consumo diario de calcio y vitamina D.
ResultadosEl valor medio de 25(OH)D fue de 23,49±5,60ng/mL. Los límites de referencia para 25(OH)D total y por sexos fueron más estrechos y significativamente diferentes a los propuestos por el fabricante. Se encontró correlación directa entre los niveles de 25(OH)D y el calcio sérico (r=0,36; p=0,003) e inversa con la paratohormona intacta (r=−0,44; p<0,001). Una dieta rica en calcio y vitamina D no es suficiente para mantener los requerimientos normales de 25(OH)D en esta población.
ConclusionesLos intervalos de referencia propuestos están adecuados a las peculiaridades de la población de Yucatán, y pudieran mejorar la exactitud de la medición del estado de salud con base en los niveles séricos de vitamina D.
25-hydroxyvitamin D [25(OH)D] is considered a marker of general health and its deficiency is a problem worldwide. There is still no consensus to define their optimal levels, with it being necessary to establish them for each population according to their ethnic characteristics and environmental factors to which they are exposed.
ObjectiveTo determine the reference intervals for 25(OH)D in the native and apparently healthy population of Yucatan.
MethodsThe study included 71 apparently healthy volunteers, female and male, between one and 65 years old, and originally from Yucatan. Serum levels of 25(OH)D were measured along with the determination of calcium, phosphorus, and parathormone levels due to their relationship with vitamin D metabolism. Reference intervals were calculated using parametric and robust methods. The skin phototype was recorded and the Garabedian test was applied to determine the daily intake of calcium and vitamin D.
ResultsThe mean value of 25(OH)D was 23.49±5.60ng/mL. The reference limits for total and gender-related 25(OH)D, and by gender were narrower and significantly different from those proposed by the manufacturer. A direct correlation was found between 25(OH)D levels and serum calcium (r=0.36; P=.003) and an inverse one with intact parathormone (r=−0.44; P<.001). A diet rich in calcium and vitamin D is not sufficient to maintain the normal requirements of 25(OH)D in this population.
ConclusionsThe proposed reference intervals are adequate to the peculiarities of the population of Yucatan and could improve the accuracy of health status measurement based on serum levels of vitamin D.
La 25-hidroxivitamina D [25(OH)D] se considera un marcador del estado general de salud, y su deficiencia es un problema reconocido a nivel mundial que afecta a grupos poblacionales de diferentes edades, aun cuando estos proceden de latitudes geográficas que reciben una elevada radiación solar1-3. En Latinoamérica, son escasos los estudios que han evaluado el estatus de la vitamina D, pero se estima que entre el 40,2 y el 96,8% de la población tiene niveles de insuficiencia4-6.
Los factores que se asocian con bajos niveles de vitamina D son muy diversos, desde la edad, el índice de masa corporal (IMC), el grado de exposición solar, la estación del año, la latitud, el fototipo de piel, las enfermedades hepáticas, autoinmunes, renales o asociadas con una mala absorción de grasas, algunos tipos de neoplasias y diabetes, hasta polimorfismos genéticos que podrían aumentar la predisposición a esta carencia7-9.
La vitamina D es una prohormona cuya principal función es garantizar la integridad mineral ósea a través del mantenimiento regulado de los niveles de calcio extracelular. La eficiencia en la absorción renal de calcio y fósforo intestinal aumenta en presencia de vitamina D. Sin ella, solo se absorbe el 10-15% del calcio de la dieta y el 60% del fósforo10. La vitamina D es también un potente modulador de la función paratiroidea y su deficiencia provoca una hiperplasia de la glándula, con un incremento de la síntesis y secreción de paratohormona (PTH)11. Por tanto, conocer los niveles séricos de calcio, fósforo y PTH también es importante a la hora de evaluar el estado de la vitamina D, por estar estrechamente relacionados con las desregulaciones que ocurren en su metabolismo.
Habitualmente, los intervalos de referencia que informan los laboratorios no se ajustan a los individuos que se evalúan, sino que son los recomendados por los fabricantes o la literatura. Probablemente, estos valores que se calculan en la población y los proporcionados por el fabricante difieran, al ser obtenidos en grupos étnicamente distintos. Por ello, los intervalos de referencia deben determinarse para cada población considerando sus características étnicas y los factores ambientales a los que está expuesta. Este aspecto resulta relevante en el caso de la vitamina D, cuyas variaciones son de naturaleza multifactorial. De hecho, la Federación Internacional de Química Clínica y Ciencias del Laboratorio Clínico y el Clinical and Laboratory Standards Institute (CLSI, «Instituto de Estándares Clínicos y de Laboratorio») indican que cada laboratorio debe ser capaz de establecer y verificar la aplicabilidad de los intervalos de referencia a su propia población12. Incluso el CLSI, en su guía EP28-A3C, establece los criterios para la obtención de intervalos de referencia en las distintas poblaciones12. Sin embargo, aunque no existe un consenso sobre los valores óptimos de 25(OH)D, muchos autores coinciden en definir deficiencia cuando las cifras son inferiores a 20ng/ml, siendo este el límite a partir del cual la PTH comienza a elevarse, pudiendo originar un hiperparatiroidismo secundario que afectará la salud ósea13,14.
El objetivo de este estudio fue determinar los intervalos de referencia para 25(OH)D en población autóctona y aparentemente sana de Yucatán. Adicionalmente, se exploró la correlación entre la 25(OH)D y el fototipo de piel, los niveles séricos de calcio, fósforo y PTH intacta, así como el consumo diario de calcio y vitamina D en la población estudiada.
Material y métodoEstudio observacional descriptivo llevado a cabo en 71 voluntarios aparentemente sanos de uno u otro sexo, de entre uno y 65 años, seleccionados en los meses de verano de 2016 (junio-agosto). Se establecieron como criterios de inclusión ser originario y vivir en el estado de Yucatán, tener hábitos de nutrición normales (sin dieta), peso normal (IMC entre 18,9 y 24,9), no haber tomado baños de sol, no recibir tratamiento con esteroides, antiinflamatorios, estatinas o fármacos que interfieren con la homeostasia del calcio (bifosfonatos, diuréticos, litio) ni ingerir suplementos alimentarios, no padecer cáncer, enfermedad ósea, paratiroidea, intestinal, reumática ni dolencias crónicas (particularmente diabetes, enfermedad arterial coronaria e insuficiencia renal), y no haber sido intervenido quirúrgicamente o estar inmovilizado. Se excluyeron las mujeres embarazadas, en periodo de lactancia y en terapia de reemplazo hormonal, así como los individuos que mostraron resultados fuera de los intervalos de referencia esperados para calcio (8,8-10,8mg/dL), fósforo (2,7-4,5mg/dL) y PTH intacta (15,0-68,0pg/mL).
Con base en el ritmo circadiano, a cada sujeto, en ayuno de 8h, se le tomó una muestra de sangre periférica entre las 8 y las 9 de la mañana, depositándose en un tubo con gel separador para suero. De cada muestra se separaron 2 alícuotas: una para la detección de 25(OH)D y otra para calcio, fósforo y PTH intacta. Todas las muestras se almacenaron a −20°C durante un máximo de 5 días hasta su procesamiento. Los tubos para la determinación de 25(OH)D se protegieron de la luz. La obtención y el análisis de todas las muestras se realizó en los Laboratorios Biomédicos de Mérida.
Se aplicó un cuestionario para registrar la edad y el fototipo cutáneo de acuerdo con la clasificación de Fitzpatrick15 que establece una escala desde el fototipo 1 (piel muy clara, color blanco-lechoso, con riesgo de quemaduras al exponerse al sol sin protección) hasta el fototipo 6 (pieles oscuras/negras que no se queman con la exposición al sol). Se aplicó la encuesta de Garabédian16 para evaluar el consumo diario de calcio y vitamina D. Todos los sujetos se consideraron mestizos y declararon ser descendientes de padres y abuelos yucatecos, así como residir en Yucatán por más de 5 años.
Se contó con el consentimiento informado de cada participante y/o tutor en el caso de los menores de edad. El protocolo fue aprobado por el Comité de Ética en Investigación de la Unidad de Atención Médica e Investigación en Salud de Yucatán.
DeterminacionesLa plataforma ARCHITECT c8100 (Abbott Laboratories) se utilizó para determinar los niveles de 25(OH)D mediante quimioluminiscencia de micropartículas, y por fotometría el calcio y el fósforo. La PTH se cuantificó utilizando un ensayo inmunométrico quimioluminiscente en fase sólida con el sistema IMMULITE® 1000 (Siemens).
El ensayo ARCHITECT 25-OH Vitamin D posee una imprecisión intraensayo con un CV≤10% y una sensibilidad de 8,0ng/mL. Su intervalo analítico es de 8-160ng/mL; las muestras por encima de esta concentración deben ser diluidas utilizando una muestra de baja concentración de 25(OH)D (≤10,7ng/mL).
Análisis estadísticoSe confeccionó una base de datos en Excel para el registro de los datos. Las variables cualitativas se presentan como valor absoluto y porcentaje, y las cuantitativas, como media y desviación estándar.
Primeramente se determinó la distribución y la normalidad de los datos a través de histogramas y de las pruebas de bondad de ajuste para los test de Kolmogorov-Smirnov y Shapiro-Wilk, considerando un nivel de significación estadística de p<0,05. A continuación se realizó la identificación de los posibles valores extremos para la población general y por sexos, según el algoritmo de Tukey, considerando los cuartiles inferiores (percentil 25%) y superiores (percentil 75%) para cada conjunto de datos, debiendo ser eliminado cualquier valor ubicado fuera de los límites establecidos. Con base en la distribución normal que siguieron los datos, se seleccionó el método paramétrico (idóneo cuando n≤120) para establecer los intervalos de referencia considerando la media±2 desviaciones estándar, rango que incluye el 95% de los valores. Paralelamente se utilizó el método consistente recomendado por el CLSI en su guía EP28-A3C para pequeños tamaños de muestra (40≤n≤120)12. Para determinar la existencia de una diferencia significativa entre los intervalos de referencia obtenidos y los descritos por el fabricante (Abbott), se realizó la prueba t de Student. Se determinó la relación entre los niveles de 25(OH)D y las variables cuantitativas (niveles séricos de calcio, fósforo, PTH intacta, fototipo cutáneo, consumo diario de calcio y vitamina D) mediante el coeficiente de correlación de Pearson (r) o Rho de Spearman de acuerdo con la distribución de cada variable. Se aplicó el análisis de regresión lineal para determinar el peso de las variables influyentes en los niveles séricos de 25(OH)D (variable dependiente). Se consideró un nivel de significación estadística de p<0,05. Todos los análisis se realizaron con el programa estadístico MedCalc v. 17.0 (MedCalc Software).
ResultadosDe los 71 sujetos seleccionados, 65 (34 femeninos, media de edad 26,9±21,4 años, y 31 masculinos, media 26,5±20,8 años) mostraron niveles séricos de calcio, fósforo y PTH intacta dentro de los intervalos de referencia considerados normales, sin diferencias significativas entre sexos (p>0,05). Fueron excluidos 6 individuos que tuvieron cifras de PTH intacta>65ng/mL. El promedio global del IMC fue 22,26±5,28. La distribución del fototipo de piel (escala de Fitzpatrick) fue 0% tipo i; 7,69% tipo ii; 12,3% tipo iii; 80,0% tipo iv; 0% tipos v y vi, sin diferencias significativas entre sexos (p>0,05).
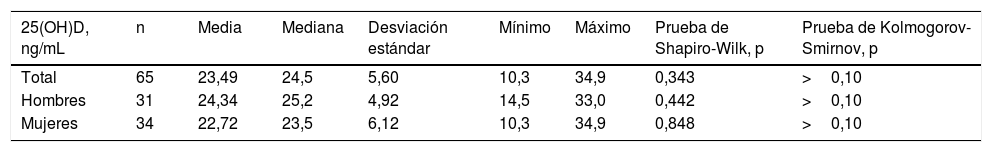
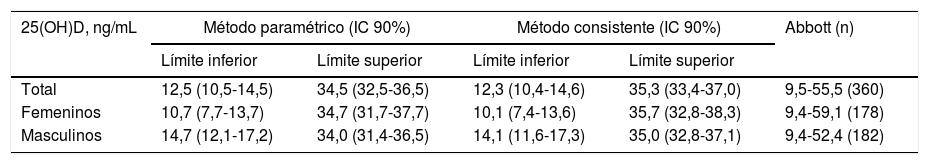
La tabla 1 muestra las medias, las medianas, las desviaciones estándar, los mínimos y los máximos de los valores correspondientes a 25(OH)D total y por sexos. Los valores de p para las pruebas de Kolmogorov-Smirnov y Shapiro-Wilk evidenciaron la distribución normal de los datos. La coincidencia observada en los valores de media y mediana también es un reflejo de la simetría de la distribución. Este comportamiento pudiera deberse a la proporción de muestras por sexo y grupos de edad que se tomaron para el estudio, la cual se corresponde con la densidad poblacional de Yucatán (49,2% masculino y 50,8% femenino) y la edad (26% entre 0 y 14 años, 48% entre 15 y 44 años y 26% mayores de 45 años)17, y que sigue una distribución normal. No se identificaron valores extremos. En la tabla 2 se muestran las comparaciones de los intervalos de referencia del 95% con sus correspondientes IC del 90% para la población general y por sexos de acuerdo con los métodos paramétrico y consistente, respectivamente, así como el rango de referencia brindado por el fabricante (Abbott). Los intervalos de referencia calculados para la población general y por sexos son más estrechos para ambos límites que los definidos en el inserto. Para el sexo femenino los límites inferiores son ligeramente menores con respecto al sexo masculino y a la población general. Los rangos estimados por cada método estadístico no mostraron diferencias estadísticamente significativas entre sí (p>0,05). La comparación de los intervalos de referencia de la población en estudio y los propuestos por el fabricante fueron significativamente diferentes (p<0,01).
Resumen de estadística descriptiva para 25(OH)D total y por sexos y valores de p para los estadísticos de comprobación de normalidad
| 25(OH)D, ng/mL | n | Media | Mediana | Desviación estándar | Mínimo | Máximo | Prueba de Shapiro-Wilk, p | Prueba de Kolmogorov-Smirnov, p |
|---|---|---|---|---|---|---|---|---|
| Total | 65 | 23,49 | 24,5 | 5,60 | 10,3 | 34,9 | 0,343 | >0,10 |
| Hombres | 31 | 24,34 | 25,2 | 4,92 | 14,5 | 33,0 | 0,442 | >0,10 |
| Mujeres | 34 | 22,72 | 23,5 | 6,12 | 10,3 | 34,9 | 0,848 | >0,10 |
Cuando p<0,05 se rechaza la normalidad.
Intervalos de referencia (95%) e intervalos de confianza para 25(OH)D en suero, según los métodos paramétrico y consistente, recomendado por la CLSI, y el descrito por el fabricante (Abbott)
| 25(OH)D, ng/mL | Método paramétrico (IC 90%) | Método consistente (IC 90%) | Abbott (n) | ||
|---|---|---|---|---|---|
| Límite inferior | Límite superior | Límite inferior | Límite superior | ||
| Total | 12,5 (10,5-14,5) | 34,5 (32,5-36,5) | 12,3 (10,4-14,6) | 35,3 (33,4-37,0) | 9,5-55,5 (360) |
| Femeninos | 10,7 (7,7-13,7) | 34,7 (31,7-37,7) | 10,1 (7,4-13,6) | 35,7 (32,8-38,3) | 9,4-59,1 (178) |
| Masculinos | 14,7 (12,1-17,2) | 34,0 (31,4-36,5) | 14,1 (11,6-17,3) | 35,0 (32,8-37,1) | 9,4-52,4 (182) |
De acuerdo con los resultados del test de Garabédian, el 75 y el 67,7% de la población estudiada mostró un consumo moderado de alimentos con contenido de vitamina D (80-200UI/día) y calcio (400-1.200mg/día), respectivamente, sin diferencia significativas entre sexos (p>0,05). El resto de los sujetos se ubicaron en la categoría de bajo consumo, con una ingesta de vitamina D menor de 80UI/día y de calcio menor de 400mg/día, con similar comportamiento en ambos sexos (p>0,05).
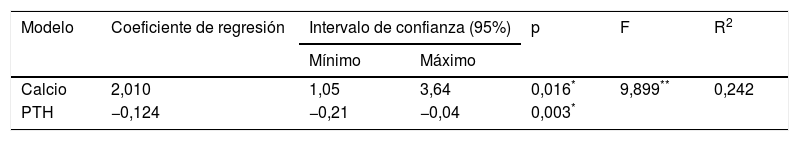
No se encontró correlación entre la 25(OH)D y la ingesta diaria de calcio (r=0,012; p=0,92), el aporte diario de vitamina D (r=−0,10; p=0,45), el fósforo sérico (r=0,24; p=0,06) y el fototipo de piel (r=−0,08; p=0,53). Por el contrario, se observó una asociación directa entre los niveles de 25(OH)D y el calcio (r=0,36; p=0,003), e inversa con la PTH intacta (r=−0,44; p<0,001). De acuerdo con el modelo de regresión lineal múltiple, ambas variables están asociadas (R2=0,242; p<0,001) con la vitamina D, pudiendo explicar el 24,2% de su variabilidad: la vitamina D aumenta en promedio 2,0ng/mL por cada mg/dL de calcio sérico, y disminuye en promedio 0,12ng/mL por cada pg/mL de PTH (tabla 3).
Modelo de regresión lineal, coeficiente de determinación (R2), estadístico F y significación estadística
| Modelo | Coeficiente de regresión | Intervalo de confianza (95%) | p | F | R2 | |
|---|---|---|---|---|---|---|
| Mínimo | Máximo | |||||
| Calcio | 2,010 | 1,05 | 3,64 | 0,016* | 9,899** | 0,242 |
| PTH | −0,124 | −0,21 | −0,04 | 0,003* | ||
Variable dependiente: 25(OH)D; variables independientes: calcio y PTH intacta.
El principal objetivo de este estudio fue determinar los intervalos de referencia para 25(OH)D en sujetos originarios de Yucatán, a los que se les controlaron varios factores preanalíticos que influyen en los niveles del metabolito: ritmo circadiano, IMC, historia personal de enfermedades crónicas y medicamentos. Por su parte, las variables analíticas fueron depuradas según los estándares de calidad de la institución, y de acuerdo con un sistema planificado de control de calidad interno y de evaluación externa a través de un programa de comparación interlaboratorios.
Los intervalos de referencia para 25(OH)D total y por sexos establecidos en este estudio se determinaron según los métodos paramétrico y consistente, y no mostraron diferencias significativas entre sí (p>0,05), por lo que pueden utilizarse indistintamente. No obstante, considerando que estos intervalos fueron obtenidos con un pequeño tamaño de muestra (n=65) y siguiendo las recomendaciones de la guía EP28-A3C del CLSI12,18, preferimos adoptar los estimados con el método consistente. Los intervalos obtenidos en nuestra población para la 25(OH)D total y por sexos se encuentran dentro de los rangos propuestos por el fabricante, pero los límites superiores presentan un corrimiento notable hacia valores más bajos (tabla 2). Con base en las diferencias significativas del análisis de comparación de medias, consideramos que los intervalos recomendados por Abbott no se ajustan totalmente a la población de Yucatán, debido principalmente a diferencias geográficas y étnicas. En varias publicaciones se definen concentraciones de 25(OH)D según las estaciones del año19-21. Abbott también reporta intervalos de referencia para verano (15,7-60,3ng/mL) e invierno (8,8-46,3ng/mL), y aunque sus criterios de inclusión y exclusión fueron similares a los nuestros, sus valores proceden de individuos de los Países Bajos (latitud norte 52°30, ángulo de incidencia de la radiación solar 60,5°) que están expuestos, aun en verano, a un potencial de luz solar mucho menor que el de Yucatán (latitud norte 20°57, ángulo de incidencia solar 89,9°), en donde se registra un promedio elevado de radiación solar anual (220-260W/m2), con poca variación estacional. De acuerdo con un estudio realizado por Levis et al.22 en los residentes del sur de La Florida, Estados Unidos (latitud norte 25,8°), las concentraciones de 25(OH)D tienen una variación estacional del 14%, porcentaje mucho menor que el reportado en latitudes septentrionales (de hasta un 38%)21. Este comportamiento también se observó en un estudio realizado entre enero y julio del 2015 en colombianos con función renal normal entre 20 y 60 años residentes en Medellín, en donde se registra un clima uniforme durante todo el año23. Los valores normales de vitamina D planteados en este estudio (15-35ng/ml) son similares a los recomendados por nosotros para población sana yucateca (12,3-35,3ng/mL).
La relación entre radiación ultravioleta y pigmentación cutánea también ha sido destacada por varios autores24,25. Se ha demostrado que el contenido de melanina en la piel, al menos en ciertos ambientes como los trópicos, está bajo un fuerte control por selección natural. Según esta relación, los europeos poseen la pigmentación constitutiva más baja, seguida por los asiáticos orientales y los hispanos25. La pigmentación cutánea también está relacionada con la alteración del metabolismo de la vitamina D, de manera que los individuos con pieles oscuras tienen una menor eficiencia de la síntesis cutánea de esta vitamina cuando se exponen a la radiación ultravioleta26,27. En este estudio, el 80% de los sujetos se clasificaron en el fototipo iv, que corresponde a pieles morenas, pero no se encontró correlación con los niveles de 25(OH)D. Se ha planteado que la causa de los bajos niveles de vitamina D en las poblaciones están relacionados, más que con el fototipo cutáneo en sí mismo, con los hábitos de exposición solar que estos conllevan28.
También existe controversia acerca de los niveles óptimos circulantes de 25(OH)D y los puntos de corte que deben utilizarse para categorizarlos. Los niveles de deficiencia se han establecido con base en estudios realizados en poblaciones mayoritariamente caucásicas, siendo estos límites muy poco informativos cuando se aplican a grupos poblacionales mestizos29-31. Aunque el valor recomendado por los principales paneles de expertos para hablar de deficiencia de vitamina D es de 20ng/mL, hay estudios que utilizan 15ng/mL e incluso 10ng/mL32-34. Las concentraciones bajas de vitamina 25(OH)D provocan una menor absorción intestinal de calcio y fósforo, reduciendo así sus niveles séricos, lo que trae como consecuencia el aumento de la síntesis y liberación de PTH35,36. Existen evidencias de que la pérdida ósea mediada por la PTH contribuye al aumento de fracturas37. Por lo tanto, sería lógico establecer como límite inferior de lo normal aquella concentración de 25(OH)D que mantenga en el rango de normalidad la PTH, como señal de una respuesta fisiológica adecuada de vitamina D. En nuestro caso, recomendamos considerar, de forma preliminar hasta no aumentar el tamaño de la muestra, niveles de deficiencia utilizando el punto de 12,5ng/mL, ya que por debajo de este valor se observó un aumento de la PTH (en los 6 sujetos excluidos para el cálculo de los intervalos de referencia). Una de las posibles razones del bajo límite inferior obtenido podría ser el proceso conocido como déficit de sustrato, en donde los niveles séricos de 25(OH)D están disminuidos como resultado de una menor síntesis cutánea de provitamina D debido a un mayor contenido de melanina en la piel, independientemente de la exposición solar. En un estudio en 331 colombianos de los cuales 235 eran mestizos, el valor promedio de 25(OH)D fue significativamente más bajo con respecto al detectado en población blanca (22,8 vs. 25,0ng/mL; p<0,01)38. En los Estados Unidos, los datos de los Institutos Nacionales de Salud indican que alrededor del 73% de los afroamericanos tienen concentraciones de 25(OH)D menores de 20ng/mL, mientras que el 42% de los mexicanos tienen concentraciones por debajo de este nivel39. De igual forma, el estudio realizado por Levis et al. en 157 blancos hispanos de entre 6 y 53 años residentes en La Florida reportó un promedio de 23,6±7,8ng/mL, muy similar al reportado por nosotros (23,49±5,60ng/mL). Estos autores también definieron como hipovitaminosis D niveles inferiores a 12ng/mL21. En México, no se conocen con exactitud los valores óptimos de 25(OH)D por regiones debido a la falta de datos en población aparentemente sana y por la controversia sobre cuáles son los niveles séricos que deben considerarse adecuados40. La mayoría de estos estudios evalúan la asociación entre el déficit de vitamina D y enfermedades en poblaciones seleccionadas de niños, adolescentes, adultos y embarazadas, reportando un rango amplio de prevalencia en los diferentes grupos de edad41-43.
En este trabajo también se evaluó la ingesta diaria de calcio y vitamina D utilizando la encuesta de Garabédian, en la que se clasifican los alimentos en diferentes grupos de acuerdo con su contenido de calcio y aporte de vitamina D, no encontrando correlación con las concentraciones séricas de 25(OH)D. De acuerdo con estos resultados, pudiéramos suponer que una dieta con contenido de calcio y vitamina D no es suficiente para predecir el estatus de vitamina D en esta población. Se conoce que la dieta aporta solo un 10% de los requerimientos diarios de vitamina D, mientras que la exposición a la radiación ultravioleta aporta el 90%.
La principal limitación de este estudio fue no haber evaluado la exposición solar debido a la falta de una encuesta validada que se ajustara a las características de nuestra población. De igual forma, no se incluyó un mayor número de individuos por dificultades en seleccionar sujetos que cumplieran con los criterios de inclusión establecidos para el estudio.
ConclusionesEste estudio representa el primer intento en definir intervalos de referencia de 25(OH)D en población sana y mestiza del suroeste de México, lo cual permitirá estimar la verdadera prevalencia de deficiencia de vitamina D en esta población. Nuestros resultados también apuntan a que la determinación de los niveles séricos de calcio y PTH intacta deberían considerarse a la hora de evaluar el estado de salud con base en la vitamina D.
FinanciaciónEste trabajo fue financiado por Laboratorios Biomédicos de Mérida, Yucatán, y por los Laboratorios Abbott, México.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.