El desgaste proteico-energético y la inflamación crónica en el enfermo renal se relacionan con un aumento de la mortalidad, así como con la aparición de anemia refractaria y alteraciones en el metabolismo óseo-mineral. Entre las causas está el aumento del estrés oxidativo, en el que el selenio desempeña un papel a través de la actividad de varias selenoproteínas. Se investiga la relación entre el selenio plasmático y sérico y la desnutrición e inflamación en pacientes adultos en tratamiento sustitutivo renal.
Material y métodosEstudio observacional transversal que incluyó 85 plasmas o sueros de pacientes en diálisis y 118 de sujetos control. Se midieron selenio y marcadores bioquímicos de nutrición, inflamación y otras comorbilidades. Las comparaciones se realizaron mediante U de Mann-Whitney, ANOVA y chi-cuadrado. Las correlaciones se estimaron mediante Rho de Spearman.
ResultadosLa mediana de selenio fue 58,2μg/L en el grupo de pacientes y 89,3μg/L en el grupo control (p<0,001). El selenio se correlacionó con la albúmina (Rho=0,440), el colesterol (Rho=0,278) y la creatinina (Rho=0,367) en los pacientes. La clasificación en función de la hiposelenemia llevó a 2 grupos con diferencia significativa en el tiempo en diálisis (p=0,018), la albúmina (p=0,003), la creatinina (p=0,004), el colesterol (p=0,038) y el fosfato (p=0,025).
ConclusionesEl selenio se correlaciona con los marcadores nutricionales en el grupo de pacientes. La clasificación de los pacientes según hiposelenemia lleva a 2 poblaciones diferenciadas en el estado nutricional y en el tiempo en diálisis. El selenio podría ser un marcador útil en el diagnóstico de desgaste proteico-energético.
Protein-energy wasting and chronic inflammation in renal patients are related to an increase in mortality, as well as the occurrence of unresponsive anaemia and mineral and bone disease. The increase in oxidative stress, in which selenium plays a role, is among the causes of malnutrition and inflammation. The relationship between plasma or serum selenium and malnutrition and inflammation in adult patients undergoing renal replacement therapy is investigated.
Material and methodsCross-sectional observational study that included 85 plasma specimens from patients on dialysis, and 118 from control subjects. Selenium and biochemical markers of nutrition, inflammation, and co-morbidities were measured. The comparisons were using Mann-Whitney, ANOVA and chi-squared tests. Correlations were estimated using Spearman's Rho.
ResultsThe median selenium was 58.2μg/L in the patient group, and 89.3μg/L in the control group (p<.001). Selenium correlated with albumin (Rho=0.440), cholesterol (Rho=0.278) and creatinine (Rho=0.367) in the patient group. Patients classification based on selenium level led to significant differences between the 2 groups in time on dialysis (p<.018), albumin (p<.003), creatinine (p<.004), cholesterol (p<.038) and phosphate (p<.025).
ConclusionsSelenium positively correlates with nutritional markers in the group of patient group. According to selenium level, there are 2 populations differentiated by nutritional status and time on dialysis. Plasma selenium is a potentially useful marker for protein-energy wasting diagnosis.
Numerosos estudios encuentran niveles inferiores de selenio sérico o plasmático en pacientes con enfermedad renal crónica (ERC) y con ERC avanzada, tanto en tratamiento con hemodiálisis como con diálisis peritoneal, comparados con sujetos sanos1–9. Un metaanálisis de 20092 de 46 cohortes que englobaron a 1.496 pacientes en hemodiálisis y 1.443 sujetos control, encontró una diferencia media significativa de selenio en componentes sanguíneos entre los grupos, con selenio inferior en el grupo de pacientes. Entre los mecanismos propuestos para explicar la alteración del selenio en los pacientes con ERC está una ingesta disminuida, pérdidas urinarias o dialíticas, absorción intestinal impedida, unión anormal a proteínas o terapias farmacológicas10.
En varias publicaciones se ha encontrado relación entre el selenio bajo en estos pacientes y una mayor mortalidad por cualquier causa, por causa cardiovascular o por enfermedad infecciosa, mientras otras no encuentran relación significativa, a favor de otros marcadores bioquímicos relacionados con la actividad redox9,11,12. El selenio tiene actividad antioxidante y antiinflamatoria formando parte del sitio activo de las selenoproteínas en forma de aminoácido selenocisteína. Se conocen 25 selenoproteínas en humanos. Las 3 familias mejor caracterizadas son las tiorredoxina reductasas, las glutatión peroxidasas (GPx) y las yodotironina desyodasas. Las selenoproteínas previenen la modificación oxidativa de los lípidos, inhiben la agregación plaquetaria y reducen la inflamación, lo que apoya su relación con la salud cardiovascular13. Varias selenoproteínas están involucradas en la activación, proliferación y diferenciación de las células del sistema inmunológico y en la inmunorregulación, crucial para la prevención de la respuesta excesiva que lleva a la autoinmunidad o a la inflamación crónica14.
Desnutrición e inflamaciónLos estudios epidemiológicos demuestran repetidamente una fuerte asociación entre las medidas de desnutrición y de inflamación en pacientes en diálisis y la alta mortalidad, tanto cardiovascular como infecciosa. Entre el 30 y el 60% de los pacientes en América del Norte y Europa tiene marcadores de inflamación elevados15. Las citocinas proinflamatorias parecen aumentar sinérgicamente los efectos nocivos que llevan al desgaste proteico energético (DPE)16. Otras consecuencias de la inflamación crónica son la anemia refractaria y las alteraciones en el metabolismo óseo-mineral. El DPE, muy frecuente en el enfermo renal, es el estado patológico en el que hay un descenso continuado tanto de los depósitos proteicos como de las reservas energéticas, incluyendo pérdida de grasa y músculo17,18. Las posibles causas se clasifican en 2 grupos: aquellas que provocan un descenso en la ingesta y aumento de la pérdida de nutrientes, como la anorexia, las dietas restrictivas y la pérdida dialítica de nutrientes; y las que aumentan el catabolismo, como la acidosis metabólica, alteraciones endocrinas, aumento del estrés oxidativo y acumulación de toxinas urémicas.
Marcadores bioquímicosLos criterios diagnósticos de DPE se clasifican en 4 categorías: criterios bioquímicos, masa corporal, masa muscular e ingesta, y se requiere cumplir al menos un criterio de 3 de ellas para el diagnóstico de DPE. Los criterios bioquímicos son albuminemia<3,8mg/dL (verde de bromocresol), prealbuminemia<30mg/dL (solo en pacientes en diálisis) y colesterol sérico<100mg/dL18.
La creatinina no es un criterio bioquímico en DPE, pero se emplea en la valoración del estado nutricional de los pacientes con ERC avanzada19. En pacientes estables anúricos, una baja creatinina sérica prediálisis sugiere baja masa muscular o ingesta proteica insuficiente y se recomienda que se valore su estatus nutricional. No hay consenso sobre el punto de corte a emplear, pero estaría alrededor de 10mg/dL. La PCR es un marcador de inflamación que predice con precisión mortalidad en ERC avanzada20. La hemoglobina es el marcador de anemia que se emplea en la toma de decisiones de tratamiento con hierro, con agentes estimulantes de la eritropoyesis o de transfusión sanguínea. Para el manejo de las alteraciones del metabolismo óseo-mineral se emplean los marcadores calcio, fosfato y PTH, pero no los valores aislados sino las tendencias evolutivas21.
ObjetivosEl objetivo principal del presente estudio es investigar la relación entre el selenio sérico o plasmático y la desnutrición e inflamación en pacientes adultos en tratamiento sustitutivo renal. Para ello, se seleccionan los marcadores bioquímicos empleados habitualmente en su diagnóstico y manejo, así como en algunas de sus consecuencias como la anemia y las alteraciones minerales y óseas. Además, se comparan los niveles de selenio de estos pacientes con los de sujetos sanos de la misma área geográfica.
Material y métodosPacientes y muestrasSe incluyeron en el estudio 85 muestras de plasma o suero de diferentes pacientes adultos con ERC terminal en tratamiento sustitutivo con cualquier modalidad de diálisis, tanto incidentes como prevalentes del Área Sanitaria 9 de la Comunidad de Madrid.
Se analizaron 118 muestras de sujetos control, ajustados por edad y sexo, a los que se les realizó analítica solicitada desde atención primaria, aparentemente sanos y que cumplían los criterios de inclusión:>18 años, sin historia de enfermedad renal y con estimación del filtrado glomerular por MDRD>60ml/min/1,73m2, sin historia de patología tiroidea, de enfermedad cardiovascular, de diabetes mellitus, de patología prostática o de neoplasia.
Las muestras se recogieron en tubo con heparina de litio y gel separador (plasma) y en tubo con K3-EDTA (sangre total). Ni el gel separador ni la heparina de litio interfieren en la medida de selenio total22. Las muestras de suero y plasma se centrifugaron a 3.000r.p.m. durante 10min. Se congeló una alícuota de plasma o suero a −20oC hasta la posterior medición de selenio.
Se recogieron las variables epidemiológicas: edad, sexo, modalidad de diálisis y meses en diálisis. Se midieron selenio, creatinina, albúmina, colesterol, PCR, calcio, fosfato y PTH en suero o plasma y hemoglobina en sangre total.
Métodos analíticosEl selenio sérico o plasmático se midió en un espectrofotómetro de absorción atómica Perkin-Elmer modelo 4100ZL, con cámara de grafito con calentamiento transversal, corrección de fondo por efecto Zeeman longitudinal y automuestreador AS 71. Las muestras se diluyeron 1:7 con modificador de nitrato de paladio y Triton X-100 y se empleó cloruro de hidroxilamina como reductor del paladio23. La precisión intermedia es del 4,40%.
Albúmina, creatinina, colesterol total, PCR, calcio y fosfato se determinaron en un analizador Modular Analytics SWA de Roche Diagnostics. Se midió molécula intacta de PTH (1-84) en un analizador Cobas e411 de Roche Diagnostics. La hemoglobina se determinó en un contador hematológico Advia 2120 de Siemens Healthcare Diagnostics.
Análisis estadísticoSe realizó un análisis descriptivo de las variables recogidas para conocer las características generales de la población de estudio. Los datos se presentan utilizando estadísticos de tendencia central y de dispersión: media y desviación estándar (DE) para variables cuantitativas que se ajustan a una distribución normal y mediana y rango intercuartílico (RIC) para las que no se ajustan.
Se empleó el test de Kolmogorov-Smirnov y la prueba de Lilliefors para la verificación de la normalidad de las distribuciones.
Se compararon los resultados de selenio plasmático entre el grupo de pacientes y el grupo control mediante el test no paramétrico de Mann-Whitney.
Se estimaron correlaciones bivariadas mediante el estadístico no paramétrico Rho de Spearman.
Se compararon las proporciones o porcentajes de variables cualitativas mediante el test χ2, las variables continuas con distribución normal mediante ANOVA y las variables continuas con distribución no normal mediante el test U de Mann-Whitney. Se empleó el test z con corrección de p por el método de Bonferroni para la comparación de proporciones de columna.
EL análisis estadístico se llevó a cabo mediante el paquete estadístico IBM SPSS Statistics 22. Todas las pruebas se realizaron en contraste bilateral y se consideraron significativos los valores de p<0,05.
ResultadosCaracterísticas de los sujetos de estudioEl grupo control consistió en 72 hombres y 46 mujeres, entre 26 y 93 años, con edad (media±DE) 59,9±14,3.
El grupo de 85 pacientes consistió en 53 hombres y 32 mujeres, con edades comprendidas entre los 23 y los 84 años. La edad media fue 60,4±14. Cuarenta y ocho pacientes estaban en tratamiento con hemodiálisis convencional (56,5%), 26 con hemodiafiltración «on line» (30,6%) y 11 con diálisis peritoneal (12,9%). Llevaban una mediana de 22 meses en diálisis, con RIC=9-49 meses, mínimo<1 y máximo 269.
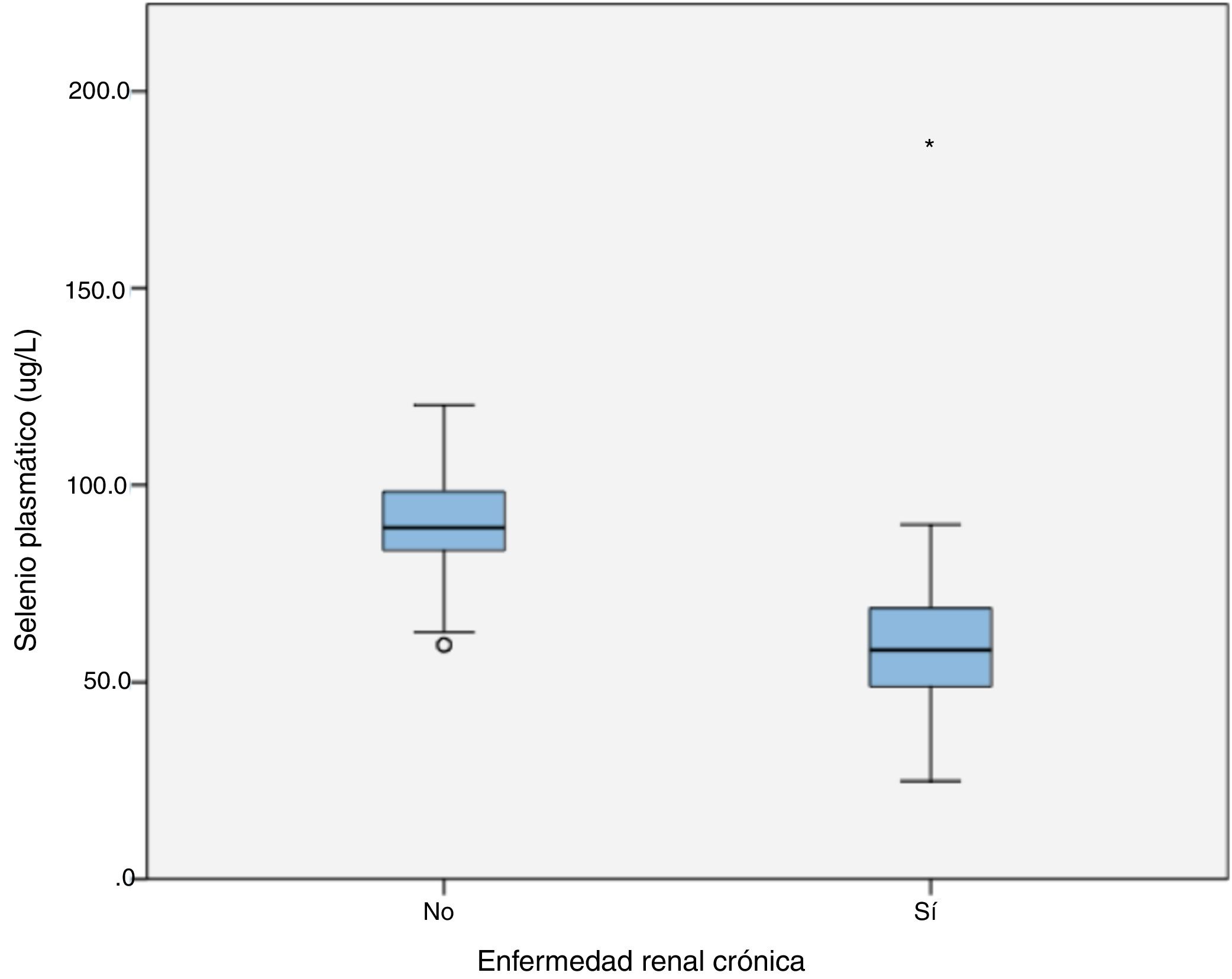
La distribución de selenio plasmático en el grupo control se ajustó a la normalidad (p=0,200). La concentración media fue 89,93±12,60μg/L, la mediana 89,3μg/L y el RIC 83,5-98,3. En el grupo de pacientes, el selenio plasmático no se ajustó a una distribución normal (p=0,006). La mediana de selenio fue 58,2μg/L, RIC 48,7-69,1, mínimo 24,9 y máximo 186,6 (fig. 1).
Comparación del selenio plasmático con grupo controlEn la comparación entre el selenio plasmático de pacientes y controles, U de Mann-Whitney fue igual a 559,5; p<0,001. La diferencia entre el selenio plasmático de ambos grupos fue estadísticamente significativa.
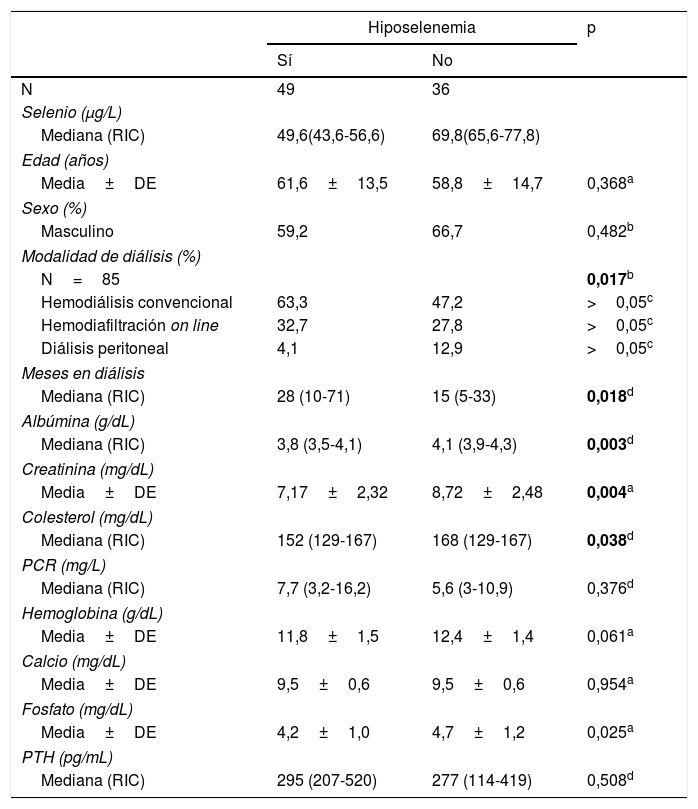
Clasificación según el intervalo de referenciaSe clasificó a los pacientes según el intervalo de referencia de selenio plasmático del laboratorio (63-118μg/L). Cuarenta y nueve pacientes tenían hiposelenemia (57,6%), 35 normoselenemia (41,1%) y uno hiperselenemia (1,2%). Las características de los pacientes según tuvieran hiposelenemia o no se recogen en la tabla 1.
Características de los pacientes agrupados según la existencia de hiposelenemia
| Hiposelenemia | p | ||
|---|---|---|---|
| Sí | No | ||
| N | 49 | 36 | |
| Selenio (μg/L) | |||
| Mediana (RIC) | 49,6(43,6-56,6) | 69,8(65,6-77,8) | |
| Edad (años) | |||
| Media±DE | 61,6±13,5 | 58,8±14,7 | 0,368a |
| Sexo (%) | |||
| Masculino | 59,2 | 66,7 | 0,482b |
| Modalidad de diálisis (%) | |||
| N=85 | 0,017b | ||
| Hemodiálisis convencional | 63,3 | 47,2 | >0,05c |
| Hemodiafiltración on line | 32,7 | 27,8 | >0,05c |
| Diálisis peritoneal | 4,1 | 12,9 | >0,05c |
| Meses en diálisis | |||
| Mediana (RIC) | 28 (10-71) | 15 (5-33) | 0,018d |
| Albúmina (g/dL) | |||
| Mediana (RIC) | 3,8 (3,5-4,1) | 4,1 (3,9-4,3) | 0,003d |
| Creatinina (mg/dL) | |||
| Media±DE | 7,17±2,32 | 8,72±2,48 | 0,004a |
| Colesterol (mg/dL) | |||
| Mediana (RIC) | 152 (129-167) | 168 (129-167) | 0,038d |
| PCR (mg/L) | |||
| Mediana (RIC) | 7,7 (3,2-16,2) | 5,6 (3-10,9) | 0,376d |
| Hemoglobina (g/dL) | |||
| Media±DE | 11,8±1,5 | 12,4±1,4 | 0,061a |
| Calcio (mg/dL) | |||
| Media±DE | 9,5±0,6 | 9,5±0,6 | 0,954a |
| Fosfato (mg/dL) | |||
| Media±DE | 4,2±1,0 | 4,7±1,2 | 0,025a |
| PTH (pg/mL) | |||
| Mediana (RIC) | 295 (207-520) | 277 (114-419) | 0,508d |
Contrastes realizados mediante
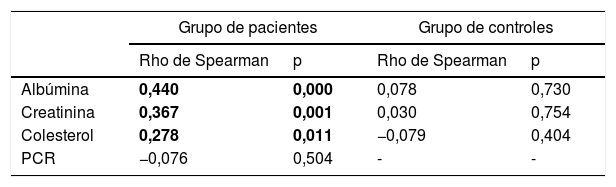
Se estimaron las correlaciones bivariadas entre el selenio y los marcadores bioquímicos de desnutrición e inflamación mediante el estadístico no paramétrico Rho de Spearman en el grupo de pacientes y en el de sujetos control. Los resultados se recogen en la tabla 2.
Análisis de correlaciones bivariadas con el selenio plasmático
| Grupo de pacientes | Grupo de controles | |||
|---|---|---|---|---|
| Rho de Spearman | p | Rho de Spearman | p | |
| Albúmina | 0,440 | 0,000 | 0,078 | 0,730 |
| Creatinina | 0,367 | 0,001 | 0,030 | 0,754 |
| Colesterol | 0,278 | 0,011 | −0,079 | 0,404 |
| PCR | −0,076 | 0,504 | - | - |
p: nivel de significación.
En negrita, p < 0,05.
El selenio se correlacionó positiva y significativamente con la albúmina, la creatinina y el colesterol, pero solo en el grupo de pacientes con ERC.
Además, el selenio plasmático se correlacionó significativamente con los meses en diálisis, con Rho de Spearman=−0,357; p=0,001. El resto de marcadores bioquímicos investigados no se correlacionó con el tiempo en diálisis.
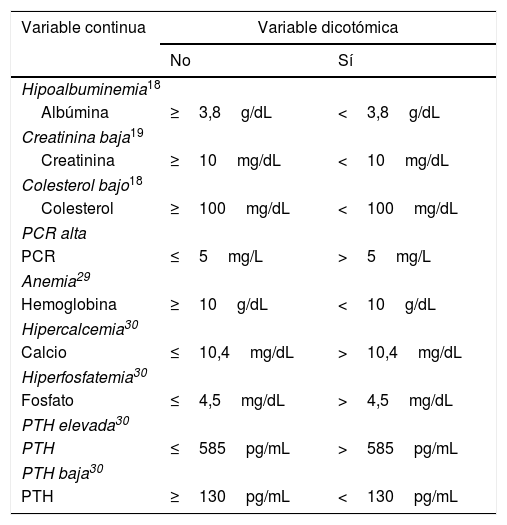
Hiposelenemia y alteraciones analíticasSe categorizaron las variables analíticas en distintos grupos de acuerdo a puntos de corte utilizados en la toma de decisiones en el seguimiento de estos pacientes (albúmina, creatinina, hemoglobina, colesterol, fosfato y PTH) o al intervalo de referencia del laboratorio (PCR). Los agrupamientos se describen en la tabla 3.
Categorización de variables
| Variable continua | Variable dicotómica | |
|---|---|---|
| No | Sí | |
| Hipoalbuminemia18 | ||
| Albúmina | ≥3,8g/dL | <3,8g/dL |
| Creatinina baja19 | ||
| Creatinina | ≥10mg/dL | <10mg/dL |
| Colesterol bajo18 | ||
| Colesterol | ≥100mg/dL | <100mg/dL |
| PCR alta | ||
| PCR | ≤5mg/L | >5mg/L |
| Anemia29 | ||
| Hemoglobina | ≥10g/dL | <10g/dL |
| Hipercalcemia30 | ||
| Calcio | ≤10,4mg/dL | >10,4mg/dL |
| Hiperfosfatemia30 | ||
| Fosfato | ≤4,5mg/dL | >4,5mg/dL |
| PTH elevada30 | ||
| PTH | ≤585pg/mL | >585pg/mL |
| PTH baja30 | ||
| PTH | ≥130pg/mL | <130pg/mL |
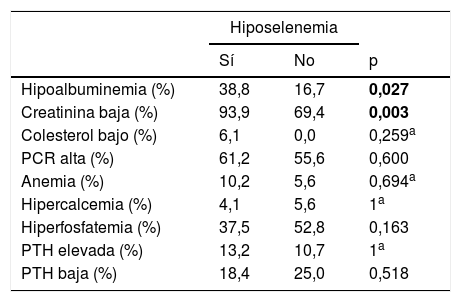
Las frecuencias de las alteraciones analíticas agrupadas con y sin hiposelenemia se compararon mediante χ2 (tabla 4). Hubo diferencia estadísticamente significativa en los porcentajes de pacientes con hipoalbuminemia y con creatinina por encima o por debajo de 10mg/dL.
Frecuencias de alteraciones analíticas con y sin hiposelenemia
| Hiposelenemia | |||
|---|---|---|---|
| Sí | No | p | |
| Hipoalbuminemia (%) | 38,8 | 16,7 | 0,027 |
| Creatinina baja (%) | 93,9 | 69,4 | 0,003 |
| Colesterol bajo (%) | 6,1 | 0,0 | 0,259a |
| PCR alta (%) | 61,2 | 55,6 | 0,600 |
| Anemia (%) | 10,2 | 5,6 | 0,694a |
| Hipercalcemia (%) | 4,1 | 5,6 | 1a |
| Hiperfosfatemia (%) | 37,5 | 52,8 | 0,163 |
| PTH elevada (%) | 13,2 | 10,7 | 1a |
| PTH baja (%) | 18,4 | 25,0 | 0,518 |
Contraste realizado mediante test χ2 o
Encontramos en esta cohorte de pacientes en tratamiento sustitutivo renal un selenio sérico o plasmático inferior al de población sana de la misma área, sumándose a la evidencia existente de esta alteración bioquímica. El 57% de los pacientes tiene selenio por debajo del límite inferior del intervalo de referencia. El selenio en el plasma se corresponde, en condiciones normales, en un 50-60% con la selenoproteína P, proteína con función transportadora de selenio y antioxidante, en un 10-30% con la glutatión peroxidasa plasmática (GPx3), de síntesis renal, y en un 10-13% se encuentra unido a albúmina como selenometionina24–26. Los resultados de las comparaciones de la actividad GPx3 encuentran una actividad disminuida en ERC y muy disminuida en ERC avanzada27, pero no hay homogeneidad en los resultados de asociación entre la actividad GPx y el selenio sérico o plasmático, con solo algunos estudios encontrando correlación significativa. La disminución del selenio plasmático en ERC avanzada, por tanto, no refleja exclusivamente una disminución en la GPx3. Son necesarios estudios de especiación del selenio plasmático en estos pacientes.
En nuestra serie, el selenio mostró correlación positiva débil con los 3 marcadores de desnutrición valorados y no se asoció con el marcador de inflamación. En el grupo control, formado por sujetos normonutridos, con los marcadores bioquímicos dentro del rango normal, es de esperar que el selenio no se asocie con la albúmina, suponiendo el selenio unido a esta proteína una décima parte del selenio total plasmático. La asociación, aunque débil, que sí se observa en los sujetos con ERC avanzada indica que las causas de disminución de la albúmina podrían coincidir en mayor o menor grado con las del selenio. Además, la proporción de selenio unido a albúmina en estos pacientes podría ser superior a la de los sujetos sanos. Los resultados de las correlaciones bivariadas apuntan a una posible utilidad del selenio como marcador de nutrición en ERC avanzada.
La clasificación de los pacientes según tuvieran hiposelenemia o no llevó a 2 poblaciones de pacientes diferenciadas en el estado nutricional y en el tiempo en tratamiento sustitutivo. Los pacientes con selenio bajo llevaban más tiempo en diálisis y tenían valores inferiores de los marcadores bioquímicos de desnutrición. Las proporciones de pacientes que cumplían criterios de albúmina y creatinina alteradas fueron significativamente distintas entre los 2 grupos. Los pacientes con hiposelenemia presentaron, además, menores niveles de hemoglobina, aunque sin alcanzar la significación estadística (p=0,061). El grupo de normoselenemia tuvo valores superiores de fosfato, lo que indica una relación entre las fuentes dietéticas de ambos marcadores o algún efecto sobre el selenio de los tratamientos quelantes del fosfato.
En base a estos resultados, creemos que son necesarios estudios que valoren la utilidad del selenio en el diagnóstico y seguimiento del DPE en los pacientes en tratamiento renal sustitutivo, así como nuevos estudios longitudinales que analicen la relación de este oligoelemento o su suplementación con la mortalidad cardiovascular e infecciosa. En la actualidad, no hay evidencia suficiente para recomendar la suplementación de oligoelementos en los pacientes con ERC avanzada, por lo que no suelen monitorizarse sus niveles en muestras biológicas. La guía de práctica clínica de K/DOQI para la nutrición no contempla en la desnutrición a estos elementos esenciales19, y la guía europea de European Renal Best Practice reconoce que no puede hacer recomendaciones y que lo que expone entra en la categoría de opinión de expertos28. Con respecto al selenio, recoge que no debería suplementarse a menos que haya clínica compatible con déficit, en cuyo caso debe monitorizarse estrechamente. Los ensayos clínicos de suplementación de selenio en pacientes en tratamiento sustitutivo son pocos y de corta duración. En general, se obtienen elevaciones del selenio sérico o plasmático y de actividad GPx eritrocitaria de manera similar a los ensayos en otras poblaciones, pero los resultados sobre la actividad GPx plasmática (GPx3) u otras medidas de la capacidad antioxidante son menos concluyentes27. No hay datos acerca del efecto de la suplementación sobre la mortalidad en estos pacientes.
ConclusionesEl selenio plasmático de los pacientes en tratamiento sustitutivo renal es significativamente inferior al de los sujetos control. El 57,6% de los pacientes tiene selenio plasmático por debajo del intervalo de referencia.
El selenio plasmático tiene correlación positiva con los 3 marcadores nutricionales estudiados en el grupo de pacientes. Se correlaciona negativamente con el tiempo en diálisis.
La clasificación de los pacientes según el límite inferior de la normalidad del selenio plasmático lleva a 2 poblaciones diferenciadas en el estado nutricional.
El selenio podría ser un marcador útil en el diagnóstico de desgaste proteico-energético. Son necesarios más estudios, incluyendo estudios de especiación del selenio en ERC avanzada.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.