Justificar la importancia clínica de la determinación del isoenzima de fosfatasa alcalina (PLAP-like) como marcador en tumores de células germinales (TCG).
Pacientes y métodosSe documentan dos casos clínicos observando el comportamiento de este isoenzima: 1) Niño con germinoma intracraneal en región pineal, 75% de actividad de PLAP-like al inicio (valor normal: 0%), resto de marcadores tumorales negativos, y 2) Niña con teratoma inmaduro de ovario estadio I, elevación de la alfafetoproteína (AFP), 197ng/mL; PLAP-like 5,1% al inicio y 0,7% en recidiva tumoral tras dos años. Se determina PLAP-like valorando la actividad remanente tras termodesnaturalización sérica.
Discusión y conclusionesPLAP-like se comporta como único marcador específico en el primer caso de tumor germinal pineal que justifica su utilidad junto a pruebas de imagen en el diagnóstico de tumores de localización craneal. En el seguimiento, también es crítico el análisis dado que constata la buena respuesta al tratamiento en el primer caso, y en el segundo caso clínico, es el único marcador que complemente la valoración de la recidiva. Concluimos en la relevancia del análisis de este isoenzima como marcador complementario en TCG.
To determine the clinical relevance of placental-like alkaline phosphatase isoenzyme (PLAP-like) as a marker for germ cell tumours (GCT).
Patients and methodsWe report the behaviour of this isoenzyme in two patients; 1) A Child with an intracranial germinoma in the pineal region who showed 75% of PLAP-like activity at onset (normal value: 0%), with the rest of the tumour markers being negative, and 2) A girl with a stage I ovarian immature teratoma who had an elevated alpha-fetoprotein (AFP), 197ng/mL, PLAP-like 5.1%, at onset and 0.7% at tumour recurrence two years later. PLAP-like was determined by assessing the remaining activity after heat denaturation of the serum.
Discussion and conclusionsPLAP-like constituted the only specific marker in the case of the pineal cell germ tumour, which justifies its use in association with neuroimaging studies in the diagnosis of cranial tumours. At follow-up analysis, PLAP-like was also critical since it confirmed the good response to treatment in the first case, while in the second one, it was the only marker to complement the assessment of tumour recurrence. We believe that this isoenzyme analysis is of relevance as a complementary marker in GCT.
La fosfatasa alcalina (ALP) es una enzima dimérica unida a la membrana celular por grupos glicosilfosfatidilinositol; la acción de fosfolipasas específicas tiene la capacidad de liberar ALP libre al suero1,2. ALP consiste en una familia de 4 isoenzimas: 1) isoenzima no específica de tejido (TNSAP): hígado/hueso/riñón, siendo la mayoritaria en proporción al resto; 2) Intestinal; 3) Placentaria (PLAP, o hPLAP en el caso de la placenta humana), y 4) De células germinales (PLAP-like) conocida como isoenzima de Reagan, Nagao o Kasahara, forma oncofetal o carcinoembrionaria; ambas estables a 65°C y presentan homología del 98% entre sí, mientras que las isoenzimas TNSAP e intestinal presentan un 88 y 56% respectivamente de homología con PLAP3,4.
La isoenzima PLAP-like es sintetizada principalmente en los testículos, cuello uterino y timo y en menor cantidad en otros tejidos como la placenta y el pulmón5. En adultos sanos no fumadores, las actividades enzimáticas de PLAP y PLAP-like representarían prácticamente un 0% de toda la ALP6. En el embarazo, hábitos como fumar tabaco, pueden provocar elevaciones de la isoenzima PLAP-like, pudiendo disminuir su valor como marcador tumoral, si bien retorna a la normalidad después de 1-2 meses de abandonar el hábito de fumar7.
La utilidad clínica de las isoenzimas de ALP recae en el diagnóstico diferencial de órgano-especificidad en el caso de un resultado elevado8. La expresión ectópica de la isoenzima PLAP-like puede estar asociada al cáncer de pulmón, ovario, útero y tumores de origen germinal como cáncer testicular: neoplasia intratubular de células germinales sin clasificar (IGCNU), seminoma, carcinoma embrionario y coriocarcinoma9. Se han encontrado concentraciones séricas elevadas de PLAP y PLAP-like en el 25-65% de los pacientes con cáncer de ovario10, y en un 22-89% de los pacientes con neoplasias testiculares7,11,12. También es conocida su importancia en otros tipos de tumores como pulmón o cáncer colorrectal avanzado13.
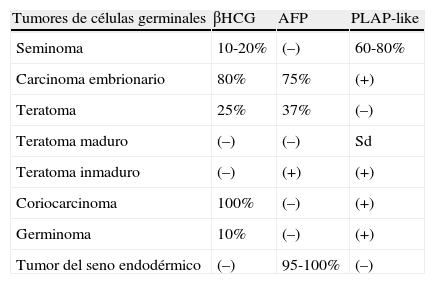
La información que nos ofrecen las pruebas de imagen como tomografía computarizada (TC) o resonancia magnética nuclear (RMN) y una buena interpretación de los marcadores tumorales asociados, es de gran importancia al inicio del tratamiento de pacientes aquejados de tumores de células germinales (TCG), debido a la condición de éstos, de ser radio y quimiosensibles y presentar una buena respuesta9,14,15. Este tipo de tumores producen un aumento de marcadores como alfafetoproteína (AFP) en tumores del seno endodérmico, carcinoma embrionario y ocasionalmente en teratomas. La subunidad β-libre de gonadotropina coriónica humana (βhCG) se eleva en el 100% de los coriocarcinomas y en un 10% de germinomas (tabla 1)10–12.
Positividad de los marcadores en TCG
| Tumores de células germinales | βHCG | AFP | PLAP-like |
| Seminoma | 10-20% | (–) | 60-80% |
| Carcinoma embrionario | 80% | 75% | (+) |
| Teratoma | 25% | 37% | (–) |
| Teratoma maduro | (–) | (–) | Sd |
| Teratoma inmaduro | (–) | (+) | (+) |
| Coriocarcinoma | 100% | (–) | (+) |
| Germinoma | 10% | (–) | (+) |
| Tumor del seno endodérmico | (–) | 95-100% | (–) |
Los marcadores deben de ser valorados con precaución y el diagnóstico diferencial no basarse en su presencia o ausencia, puesto que algunos tumores pueden no producirlos o, por el contrario, tener un componente celular mixto7,16 e incluso en recidivas tumorales expresar otro tipo de marcador que evidencie un cambio histológico de la recidiva frente al tumor primario17. Dado que la PLAP-like es un parámetro poco solicitado y poco determinado en los centros hospitalarios, el objetivo de este estudio es resaltar mediante dos casos clínicos la importancia de la medición de PLAP-like como marcador tumoral complementario, especialmente en TCG.
Material y métodosCaso 1Niño de 6 años, que debido a cefalea, alteración del sueño, vómitos, visión doble, así como estrabismo, acude al oftalmólogo que detecta un edema de papila y deriva a Neuropediatría en julio de 2001.
Antecedentes familiares: presenta numerosos casos de familiares directos diagnosticados de diferentes tipos de cáncer en edades avanzadas.
Examen físico: buen estado general. SNC: consciente y orientado. Midriasis arreactiva izquierda. Fondo de ojo: edema de papila bilateral.
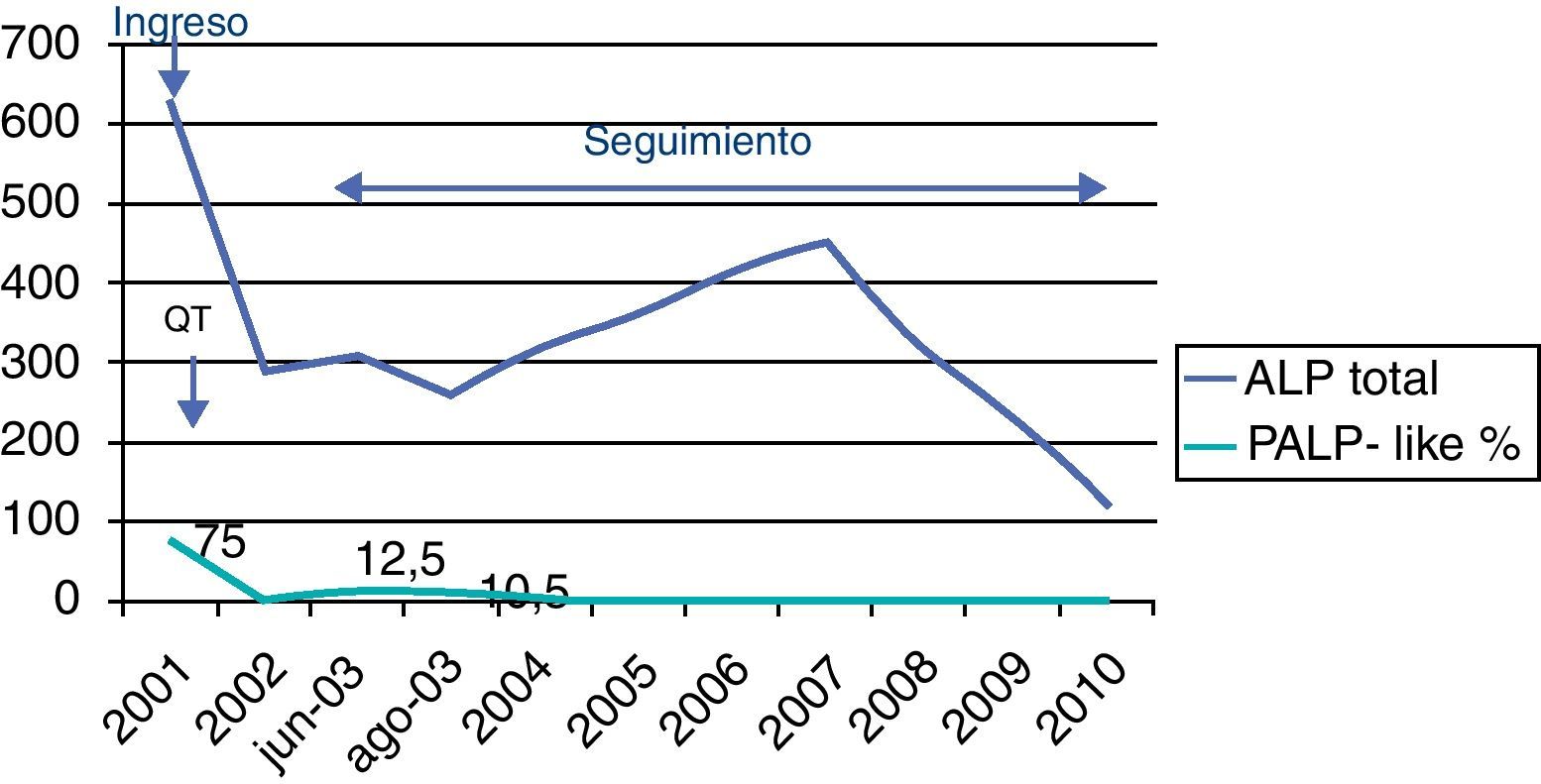
Informe de laboratorio: el estudio de marcadores tumorales al inicio aportó los siguientes resultados: βHCG 0 U/L; alfafetoproteína (AFP): 0,9ng/mL (valores de referencia [VR]<11); CEA: 1,4ng/mL (VR: 0-5); ALP: 628 U/L (VR: 40-129). Isoenzimas de ALP: ALP ósea: 17%; ALP hepática 8%; PLAP-like: 75% (normal: 0%).
Exámenes complementarios: TC craneal: se le detecta masa hiperdensa con calcificaciones en región pineal que provoca hidrocefalia secundaria a obstrucción del acueducto de Silvio. En la RMN presenta un proceso expansivo en región pineal de 3×2cm. La lesión comprime el tectum mesencefálico provocando importante hidrocefalia obstructiva. Se repite RMN ampliada a columna presentando una morfología e intensidad de señal de médula espinal normales en todo su recorrido. Se diagnostica de «germinoma intracraneal en región pineal» que provoca a su vez hidrocefalia triventricular obstructiva.
Evolución: el paciente es sometido a intervención neuroquirúrgica con ventriculostomía del tercer ventrículo y comunicación del mismo a cisterna basilar para disminuir la hidrocefalia al poco tiempo del diagnóstico, presentando un postoperatorio sin complicaciones. Comienza quimioterapia (QT) con protocolo «SIOP CNS GCT 96»: carboplatino, etopósido e ifosfamida. Como complicaciones presentó paresia del tercer par craneal izquierdo. Tras 4 meses de QT el tumor remitió completamente.
Caso 2Niña de 6 años que ingresa en 2004 por masa abdominal a estudio y es citada para intervención quirúrgica. Al examen físico presenta buen estado general. Se observa masa en línea media en hipogastrio y mesogastrio llegando a fosa ilíaca izquierda, de unos 12×12cm. No megalias. Genitales femeninos normales.
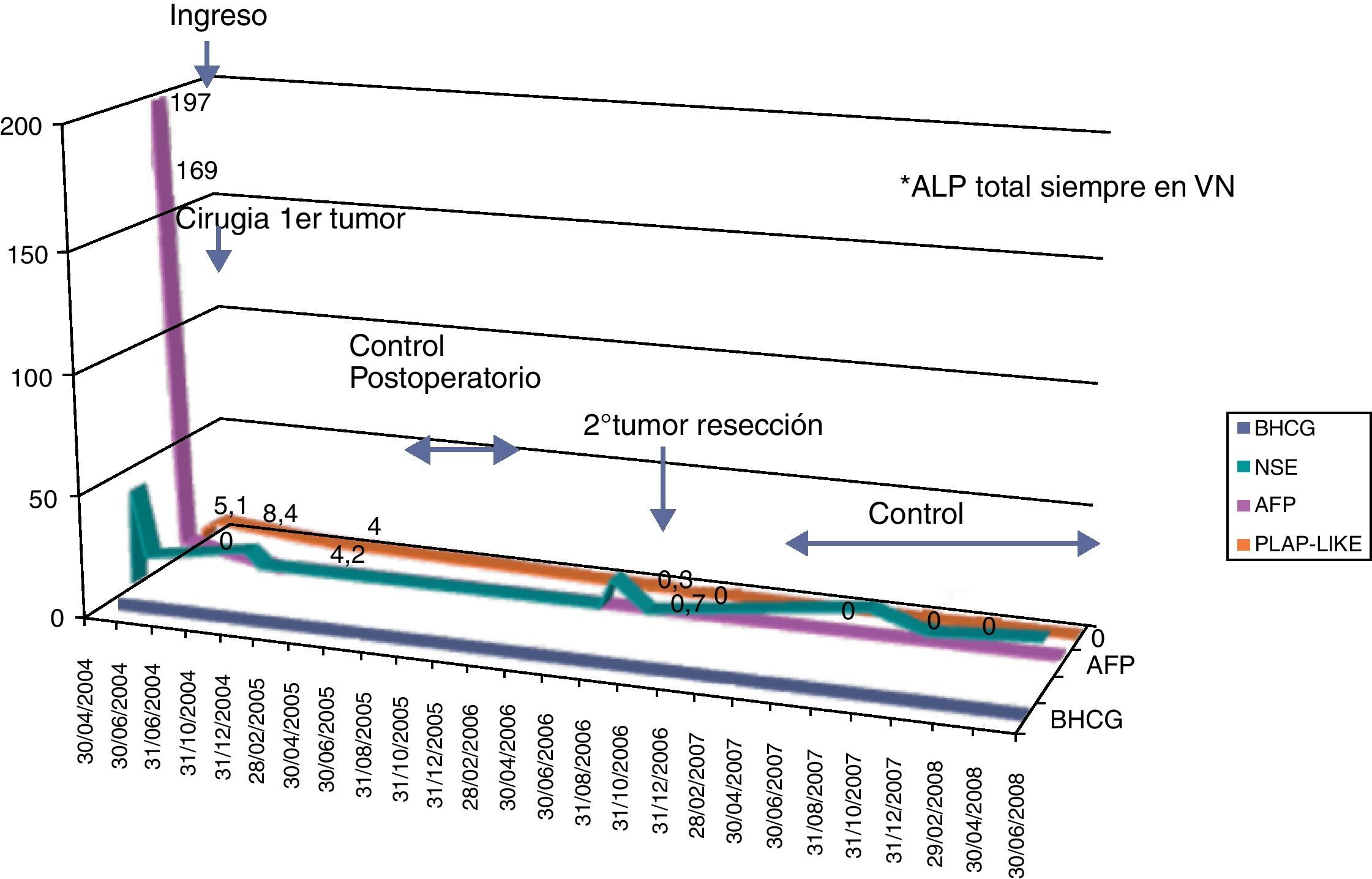
Informe de laboratorio: marcadores tumorales al inicio: βHCG 0 UI/L (VR<5); AFP: 197ng/mL (VR<11); enolasa (NSE) 40ng/mL (VR<15); LDH 614 U/L (VR: 230-460); ALP 246 U/L (VR: 40-129); PLAP-like 5,1% (VR 0%). Catecolaminas en orina normales.
Exámenes complementarios: TC pulmonar normal. Gammagrafía con Tc99 negativo.
Actitud y evolución: se realiza laparotomía media infraumbilical. Se aprecia gran tumoración dependiente de ovario izquierdo, con una zona de protusión en la que se encuentra adherido el epiplón. La trompa, ovario derecho y útero presentan aspecto normal. Se diagnostica de «teratoma ovárico inmaduro grado III, estadio I» («FIGO») tras realización de resección ovárica izquierda completa. No requiere QT. La paciente presenta disminución progresiva de los marcadores tumorales hasta normalizarse y pruebas de imagen negativas tras la resección. Tras dos años (en julio de 2006) acude a urgencias por dolor abdominal, se somete a ecografía en la que se observa masa sólido-quística con contenido líquido mucinoso próximo a la cola del páncreas sin vascularización.
En el estudio de marcadores tumorales presenta βHCG 0 UI/L, AFP 2ng/mL y PLAP-like 0,7%, siendo éste el único marcador positivo en la recidiva. Se realiza laparotomía media supraumbilical y exéresis de la masa tumoral intraabdominal aparentemente bien encapsulada sin depender de órganos vecinos, la cual hay que descartar como primera posibilidad de ser recidiva del teratoma previo. No precisa QT.
MétodosDeterminación de isoenzimas de fosfatasa alcalinaSe determinó la actividad sérica de ALP total en un analizador Cobas® 6000 (Roche Diagnostics, Mannheim, Alemania).
Los isoenzimas que contribuyen a la actividad total de ALP, se identifican por electroforesis en gel de agarosa (SAS-I Alkaline Phosphase-12, Helena®, BioSciences Europe, Sunderland); este procedimiento en combinación con métodos químicos (neuraminidasa) permite identificar las fracciones intestinal, ósea y hepática. Los resultados, cuantificados por densitometría, se expresan como porcentaje de la fracción de isoenzima respecto a la actividad de fosfatasa alcalina total. Los valores de referencia por esta combinación de métodos son: isoenzima ósea (25-51,5%), isoenzima hepática (30,1-85,7%), isoenzima intestinal (0-5%), isoenzima placental-like (0%)18.
Dado que PLAP y PLAP-like presentan movilidad electroforética similar a la isoenzima ósea y ambas son la únicas que resisten la termodesnaturalización a 65°C, durante 30 minutos se somete una alícuota de suero a este método para calcular la actividad remanente de ALP correspondiente al porcentaje de ALP tumoral, forma oncofetal o carcinoembrinaria18,19.
DiscusiónObservamos mediante estos casos clínicos varios aspectos de la interpretación de PLAP-like como marcador tumoral en TCG. En el primer caso y debido a la localización intracraneal profunda y vascularización intrínseca tumoral, la biopsia de este tipo de tumores puede ser de mayor riesgo que las biopsias estereotáxicas de otros tipos de tumores en otras regiones. Por tanto, el valor de la prueba de imagen (TC o RMN) e interpretación de marcadores tumorales asociados, es definitivo para comenzar el tratamiento de estos pacientes, al ser tumores radio y quimiosensibles9,14,15. En tumores de origen pineal, podemos encontrar ciertos marcadores, βHCG, CEA y AFP normales, como ocurre en este caso, mientras que ALP total y su isoenzima tumoral están elevadas (PALP-like 75% de actividad). Puede ser por tanto, el único marcador específico en este tipo de tumores germinales de localización pineal y complementa la clasificación de tumores de localización craneal20,21. En el seguimiento, la disminución de los marcadores indica la buena respuesta al tratamiento ya sea radio o quimioterapia como es en nuestro caso, presentando remisión del tumor (fig. 1); esta gráfica permite observar el seguimiento de ALP total y PALP-like. El paciente presentó picos de la isoenzima PLAP-like que no tuvieron repercusión clínica, mientras que la ALP total presentó valores alternados y más bajos de lo normal en el seguimiento hasta la actualidad, por la edad del paciente y atribuibles probablemente a la afección de los tratamientos quimioterápicos en el desarrollo óseo del niño o a un tallaje bajo del niño.
En cuanto al segundo caso, la valoración de los distintos marcadores al debut y en la recidiva fueron diferentes. En el teratoma inmaduro de ovario diagnosticado al ingreso, fue la AFP el principal marcador junto al PLAP-like, mientras que en la recidiva fue la isoenzima PLAP-like el único positivo que permitió junto al resto de pruebas complementar el diagnóstico. Vemos la ventaja de su medición en el seguimiento, ya que esta recidiva tuvo un comportamiento histológico diferente al considerarse un tumor germinal extragonadal, y la valoración de marcadores es diferente (fig. 2)17. Además, observamos un comportamiento dudoso de enolasa (NSE), que podría considerarse elevada aunque los picos podrían atribuirse a posibles falsos positivos por hemólisis. La cuestión importante de clasificar los teratomas ováricos como maduros o inmaduros es discutida. Los teratomas son tumores compuestos por elementos que representan las tres capas germinales y se dividen en subtipos maduros o inmaduros en función de los elementos constitutivos16.
En este punto, también la valoración de marcadores es complementaria. Así, en la tabla 1 se encuentra el porcentaje de positividad de los marcadores en cada uno de los TCG, que además de ayudar al diagnóstico, determinan el riesgo de recaída, ya que si la AFP o βHCG, o ambas, permanecen elevadas después del tratamiento, hay un riesgo de progresión del 70%, contrario a si se normalizan disminuyendo este riesgo al 7%22. Si bien más del 90% de los tumores no seminoma presentan elevada la AFP o la BHCG, la alteración no es igual para cada uno de los tumores7.
Los TCG derivan de las células germinales primordiales, que en la vida embrionaria migran desde el sistema nervioso central primitivo hasta localizarse en las gónadas. Se cree que un bloqueo en la maduración de las células germinales, iniciado desde la vida fetal, e inducido posiblemente por alteraciones en el microambiente celular pueda originarlos, con una presentación masculina en el 90% de los casos, pudiendo causar también neoplasias ováricas23. Su incidencia se ha duplicado en los últimos 40 años con un incremento anual del 3 al 6%, posiblemente por edad materna avanzada y por la teoría que postula un posible efecto carcinogénico de sustancias similares a estrógenos y antiandrógenos tanto en la vida fetal como durante la primera infancia24,25 y que se conocen como disruptores endocrinos. Generalmente predominan los germinomas y teratomas, mientras que del 2% que corresponden a neoplasias intracraneales, predominan los tumores de la región pineal (51%) y supraselar (30%), habiendo localizaciones menos frecuentes como sacro, tiroides, senos paranasales y tejidos blandos de cabeza y cuello23–25. De todos modos, se necesitan más estudios concluyentes que corroboren dichas teorías.
Nuestro estudio no muestra una casuística ámplia, en cambio, muestra dos ejemplos de comportamiento diferente del isoenzima PLAP-like como marcador tumoral, en el diagnóstico y seguimiento de recidivas. Con estos dos casos podemos observar comportamientos y valores diferentes de PLAP-like, como por ejemplo las elevaciones sin repercusión clínica en el primer caso de alrededor del 10%, mientras que en el segundo caso en el que la interpretación clínica de marcadores es más confusa, un valor mucho menor y único marcador elevado, apoyaría al resto de pruebas a concluir en un diagnóstico. Por todo ello, podemos concluir la relevancia que proporciona la determinación analítica de PLAP-like como un marcador complementario valorable en el diagnóstico y seguimiento de TCG, siendo muy recomendable y estando clínicamente justificada la solicitud de éste parámetro en este tipo de tumores.