Evaluar la fiabilidad y la practicabilidad del analizador Delfia Xpress en las técnicas del cribado prenatal del primer y segundo trimestre.
Material y métodosEl Delfia Xpress (Perkin-Elmer, Wallac) es un analizador de enzimoinmunoensayo que utiliza el europio como marcador fluorescente específico y que permite la determinación de los parámetros que integran el perfil del cribado prenatal del primer y segundo trimestre; la fracción libre de la β-gonadotrofina coriónica humana libre (fβhCG), la proteína A plasmática asociada al embarazo (PAPP-A), la alfafetoproteína (AFP) y el estriol libre (uE3). Además, el analizador incorpora el software Lifecycle v3.0® para el cálculo del riesgo prenatal de las trisomías 21 y 18, con conexión bidireccional con el sistema informático del laboratorio. Se procesaron 3.020 muestras de cribados del primer trimestre y 678 del segundo.
ResultadosEn cuanto a fiabilidad, el Delfia Xpress mostró una imprecisión intra-interdía en las determinaciones de fβhCG y PAPP-A inferiores al 6%, comprobándose la linealidad y la correlación de sus determinaciones. El análisis de los resultados de 3.020 gestantes del cribado prenatal combinado del primer trimestre muestra una sensibilidad en la detección del síndrome de Down de 78,57% y un valor predictivo positivo (VPP) de 11,58%, con un 2,79% de falsos positivos. Se diagnosticaron 11 portadoras de síndrome de Down y 2 de síndrome de Edwards. Respecto a la practicabilidad, su sencillo manejo y puesta en marcha, y la estabilidad de las calibraciones, junto con el coste equitativo por cribado, hacen que el analizador presente una buena relación calidad/coste.
ConclusionesEl completo estudio realizado muestra que el Delfia Xpress es un analizador de elevada fiabilidad técnica y clínica, y los resultados hallados lo validan para procesar la rutina del cribado prenatal en nuestro hospital de referencia.
To evaluate the Delfia Xpress analyzer reliability and practicability in all the techniques of first and second trimester prenatal screening.
Materials and methodsThe Delfia Xpress (Perkin-Elmer, Wallac) is a biochemical immunoassay analyzer,that uses the Europium as specific fluorescent labelled marker and allows the determination of the first and second trimester parameters of the prenatal screening profile's: free β-human chorionic gonadotrophin (fβhCG) and pregnancy associated plasma protein-A (PAPP-A), alpha-fetoprotein (AFP), free-estriol (uE3), incorporating the Lifecycle v3.0® software for risk-prenatal calculation on-line with the laboratory compute system. First trimester combined screening test was performed on 3020 pregnant women and 678 on second trimester screening tests.
ResultsConcerning its reliability, Delfia Xpress analyzer has shown a within and between day imprecision for the fβhCG and PAPP-A determinations below to 6%, proving the linearity and the correlation of its determinations. The analysis of the results of 3020 first trimester combined prenatal screening tests, shows a sensitivity in detecting Down‘s syndrome of 78.57% with a PPV (positive predictive value) of 11.58% with a 2.79% false positive. Eleven patients were diagnosed as carriers of Down‘s syndrome and two with Edwards syndrome. As for the practicability, the start up and operation of the analyzer are simple, and the stability of the calibration along with equitable cost for screening, makes the Delfia Xpress as an analyzer with a good relationships quality/cost.
ConclusionsThe complete study has shown that Delfia Xpress is an analyzer with a high technical and clinical reliability, validating the instrument for processing the prenatal screening routine of our reference hospital.
Se estima que el riesgo de una pareja de tener un hijo con una crosomopatía es de 10 de cada 10.000 nacimientos1. El cribado prenatal y el cálculo de riesgo de ser portadora de una aneuploidía identifican a las pacientes que presentan mayor riesgo, siendo el único diagnóstico el análisis genético posterior.
En los años noventa, el primer cribado prenatal que se realizó fue el llamado triple screening, entre las semanas 14 y 18 de gestación, pero actualmente el cribado del primer trimestre, realizado entre las semanas 10 y 14, es el que se practica con carácter mayoritario.
El cribado del primer trimestre se realiza incorporando a las determinaciones bioquímicas de la fβhCG y la PAPP-A el parámetro ecográfico de la translucencia nucal (TN) al cálculo del riesgo, lo cual ha permitido en estos últimos años el diagnóstico prenatal de un número creciente de aneuploidías, con una sensibilidad entre el 85-93% en el síndrome de Down1 con un 5% de falsos positivos. El cribado del segundo trimestre actualmente minoritario, realizado entre las semanas 14 y 19 con solo las determinaciones bioquímicas de AFP, uE3 y fβhCG, permite a las gestantes que no han podido realizar el cribado del primer trimestre una alternativa diagnóstica, pero con una menor sensibilidad, entre el 65 y el 70%1. Las combinaciones de parámetros bioquímicos del primer y el segundo trimestre con las variables ecográficas, biopsia o amniocentesis, constituyen estrategias alternativas, que son avaladas por diversos grupos de trabajo1–4, que presentan sensibilidades entre el 85 y el 93% en la detección del síndrome de Down.
En Europa, la Fetal Medicine Foundation5 (FMF), pionera en promover estudios y comités en el ámbito del cribado prenatal6, ha orientado en estos últimos años las diversas estrategias y ha sugerido pautas acerca de los coeficientes de variación máximos permitidos para las técnicas bioquímicas que integran el cribado prenatal. En el campo de la formación, su trabajo ha sido muy valorado por sus cursos presenciales y a distancia dirigidos a ginecólogos y ecografistas para el aprendizaje en la medición de la TN, el hueso nasal y otros parámetros eco-cardiológicos, que hace que la certificación FMF sea muy valorada, ya que supone una mejora importante en la estandarización de las mediciones ecográficas, dado el importante peso específico que supone la TN en el cálculo del riesgo prenatal, que incluso supera los parámetros bioquímicos.
En nuestro país, auspiciadas por la Sociedad Española de Ginecología y Obstetricia7 (SEGO) y el Ministerio de Sanidad, varias comunidades autónomas8,9 han promulgado instrucciones para la introducción del cribado prenatal del primer trimestre en los catálogos de sus prestaciones sanitarias. En el año 2010, la Sociedad Española de Bioquímica Clínica y Patología Molecular (SEQC) creó un grupo de trabajo de diagnóstico prenatal de aneuploidías fetales para estudiar la situación de nuestro país y aportar algunas recomendaciones de los profesionales expertos en el área, de acuerdo con las normativas vigentes y con el fin de unificar criterios entre todas las autonomías de España.
El presente trabajo tiene como objetivo realizar la evaluación de la fiabilidad y la practicabilidad técnica del analizador Delfia Xpress y valorar la eficacia diagnóstica de nuestra estrategia de realización del cribado prenatal en dos pasos. Se presentan los resultados obtenidos al procesar 3.020 cribados del primer trimestre y 678 del segundo realizados en nuestro centro.
Material y métodosPoblación en estudioSe procesaron 3.020 muestras de gestantes del primer trimestre, que incluyeron 2.995 de embarazo único y 22 gemelares bicoriales y 3 monocoriales. El 93,94% de las gestantes eran caucásicas, con una edad media de 30,46 años (DE=5,67) y un rango de 14 a 52 años. El 85,4% de las gestantes provenían de centros de asistencia primaria de nuestra área sanitaria y el 14,6% de las pacientes restantes eran de las consultas externas de nuestro hospital maternal o pacientes remitidas a nuestro centro de referencia de otras áreas sanitarias, al ser consideradas embarazos de alto riesgo (gemelares, diabéticas, HIV, etc.). Se realizaron también 678 cribados del segundo trimestre de embarazo único. El 87,1% de las gestantes eran caucásicas, con una edad media de 28,69 años (DE=5,72) y un rango entre 14 y 45 años; el 94,4% provenían de centros de asistencia primaria y el 5,6% de nuestro hospital. Las embarazadas dieron el correspondiente consentimiento informado tal y como especifica la instrucción dictada por el Departament de Salut de la Generalitat de Cataluña8. Se ha efectuado el seguimiento clínico de la gestante hasta la finalización del embarazo.
MaterialAnalizador Delfia Xpress 6000 immunoAnalyzer (Perkin-Elmer, Wallac) y software de cálculo del riesgo prenatal Lifecycle v3.0 (Wallac).
Control Sero Maternal-Health (Sero lab), lote 0703106 niveles 1, 2 y 3.
Control Lyphocheck Maternal Serum control (Bio-Rad) lote 3908 niveles 1, 2 y 3.
Controles externos internacionales valorados «Screening for Down's syndrome in the first trimestre and second trimester». United Kingdom National External Quality Assessment Service10 (UKNEQAS) (Edimburgo) lotes F355-384 (first trimester) y lotes D640-669 (second trimester), procesados durante los 10 meses que ha durado la evaluación del Delfia Xpress.
Estrategia de cribado prenatal combinado de primer trimestre en dos pasosLa metodología de realización del cribado combinado del primer trimestre fue la denominada en dos pasos o dos tiempos2–4. Se realiza una extracción de sangre a las 10 semanas de gestación y análisis de los parámetros bioquímicos fβhCG y PAPP-A. A la 12.a semana de gestación se efectúa la ecografía y la medición de la TN y de la longitud cráneo caudal (LCC) utilizando un ecógrafo Siemens Antares y por ginecólogos acreditados por la FMF. El facultativo del laboratorio comprueba los resultados, y calcula y valida el riesgo prenatal combinado para su posterior envío on-line de resultados en formato pdf a la historia clínica del paciente.
Las gestantes con riesgo de trisomía 21 o trisomía 18 superior a 1/250 se remitieron a la unidad de diagnóstico prenatal del centro para valorar la realización de prueba invasiva (biopsia corial o amniocentesis).
Métodos de determinación de fβhCG, PAPP-A, AFP y uE3Se efectuaron las determinaciones de fβhCG, PAPP-A, AFP y uE3 en el analizador Delfia Xpress con las curvas de normalidad propias preestablecidas antes del estudio, con el procesamiento de 1.000 gestantes. A partir de estas curvas, se calcularon los valores de múltiplos de la mediana (MoM) de los parámetros bioquímicos y de la TN, corregidos por la edad gestacional, el peso y la raza de la gestante. Se ha realizado el cálculo de los riesgos de la trisomía 21 y 18 con el software de cálculo Lifecycle v3.0 con la incorporación de los parámetros ecográficos, como la TN y la LCC, a los parámetros bioquímicos.
La determinación de fβhCG, PAPP-A y AFP es un ensayo inmunofluorimétrico11–14 de doble marcaje en fase sólida, basado en la técnica directa del sándwich, con un anticuerpo monoclonal marcado con europio fluorescente. Se mide la fluorescencia de cada pocillo, siendo esta proporcional a la concentración del analito. La determinación de uE3 es un enzimoinmunoensayo competitivo entre europio-uE3 y el uE3 de la muestra y un anticuerpo policlonal de conejo con ligandos específicos para el uE315, siendo la fluorescencia en este ensayo inversamente proporcional a la concentración del estriol de la muestra.
Como materiales de calibración se emplearon los suministrados por el fabricante, que tienen trazabilidad con los patrones de la OMS ref. IRP 75/551 (fβhCG), 78/610 (PAPP-A), 72/225 (AFP) de cada analito. Se verificó esta calibración con el procesamiento de los controles valorados y el análisis de su deriva (DE: +/−2) en cada serie de determinaciones.
Nuestro laboratorio está certificado para realizar cribados prenatales y tiene la certificación internacional UKNEQAS10 para efectuar estas determinaciones.
Métodos de evaluación y estadísticosPara realizar la evaluación se ha seguido las recomendaciones de la SEQC16,17 y los NCCLS18. Para el estudio de la imprecisión analítica se siguieron las recomendaciones de Canalias19. El estudio de la linealidad se realizó según la normativa18, y el cálculo del blanco y límite de detección se hizo según Armbruster y Pry20. Para la comparación de métodos y el estudio de la idoneidad de los resultados se ha seguido la normativa16,17, utilizando las gráficas de Bland-Altman21 y la regresión de Passing-Bablock22. Se calculó la sensibilidad, la especificidad y la eficiencia diagnóstica del cribado del primer y del segundo trimestre de los resultados del cálculo del riesgo de 3.698 pacientes, y el posterior estudio genético complementario de las biopsias y las anmiocentesis de las pacientes positivas, con el seguimiento clínico de todas las gestantes hasta el parto. Se evaluó la practicabilidad siguiendo a Biosca y Galimany23. Los cálculos de los parámetros de las rectas de regresión y graficas de Bland-Altman se efectuaron con los programas estadísticos SPSS 19.0 (SPSS, Chicago, IL, EE.UU.) y MedCalc 10.0.2.0 (MedCalc. Software, Mariakerke, Bélgica).
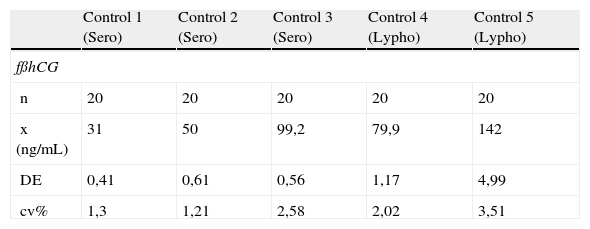
ResultadosImprecisiónImprecisión intradíaSe ha valorado la imprecisión intradía de la determinación de fβhCG y PAPP-A con controles valorados Sero Maternal-Health a tres niveles de concentración. La imprecisión intradía de las determinaciones uE3 y la AFP ha sido valorada con el control Lyphocheck Maternal Serum control (Bio-Rad) a tres niveles.
Los resultados se muestran en la tabla 1. El análisis de estos resultados revela que la determinación de fβhCG presenta una media de coeficiente de variación (CV) de 2,1% con un rango entre 1,3-3,5% dependiendo de la concentración estudiada. La determinación de PAPP-A presenta una media de CV de 1,6% con un rango entre 1,5 y 1,8%. La determinación de la AFP presenta una media de CV de 2,9% con un rango entre 2,2 y 3,9%. La determinación de uE3 presenta una media de CV de 3,0% con un rango entre 2,5 y 3,6%.
Imprecisión intradía con controles Sero Maternal health, Lyphocheck
| Control 1 (Sero) | Control 2 (Sero) | Control 3 (Sero) | Control 4 (Lypho) | Control 5 (Lypho) | |
| fßhCG | |||||
| n | 20 | 20 | 20 | 20 | 20 |
| x (ng/mL) | 31 | 50 | 99,2 | 79,9 | 142 |
| DE | 0,41 | 0,61 | 0,56 | 1,17 | 4,99 |
| cv% | 1,3 | 1,21 | 2,58 | 2,02 | 3,51 |
| Control 1 (Sero) | Control 2 (Sero) | Control 3 (Sero) | |
| PAPP-A | |||
| n | 20 | 20 | 20 |
| x (mU/L) | 4260 | 2264 | 515 |
| DE | 66,72 | 40,87 | 7,88 |
| cv% | 1,57 | 1,81 | 1,53 |
| Control 1 (Lypho) | Control 2 (Lypho) | Control 3 (Lypho) | |
| AFP | |||
| n | 20 | 20 | 20 |
| x (U/mL) | 9,5 | 25,3 | 58,1 |
| DE | 0,25 | 0,98 | 1,27 |
| cv% | 2,65 | 3,88 | 2,18 |
| Control 1 (Lypho) | Control 2 (Lypho) | Control 3 (Lypho) | |
| uE3 | |||
| n | 20 | 20 | 20 |
| x (nmol/L) | 3,4 | 14,5 | 38,7 |
| DE | 0,12 | 0,42 | 0,96 |
| cv% | 3,6 | 2,87 | 2,48 |
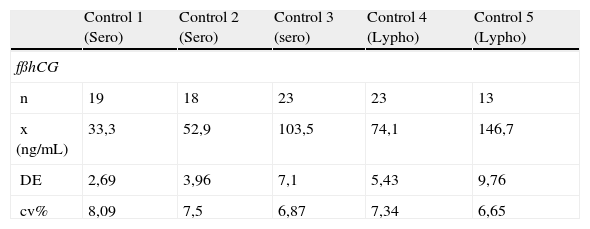
Se ha valorado la imprecisión interdía de la determinación de fβhCG, PAPP-A, AFP y uE3 con los mismos controles de la evaluación interdía procesándolos durante 20 días consecutivos. Los resultados se muestran en la tabla 2. El análisis de estos resultados indican que la fβhCG presenta un CV medio interdía de 7,3% (6,6-8,1%); la PAPP-A ha mostrado una media de CV de 5,2% (3,6-7,4%). La AFP ha mostrado una media de CV de 3,7% (2,9-3,8%), y el uE3ha presentado una media de CV de 6,5% (5,2-8,7%).
Imprecisión interdía con controles Sero Maternal health, Lyphocheck
| Control 1 (Sero) | Control 2 (Sero) | Control 3 (sero) | Control 4 (Lypho) | Control 5 (Lypho) | |
| fßhCG | |||||
| n | 19 | 18 | 23 | 23 | 13 |
| x (ng/mL) | 33,3 | 52,9 | 103,5 | 74,1 | 146,7 |
| DE | 2,69 | 3,96 | 7,1 | 5,43 | 9,76 |
| cv% | 8,09 | 7,5 | 6,87 | 7,34 | 6,65 |
| Control 1 (Sero) | Control 2 (Sero) | Control 3 (Sero) | |
| PAPP-A | |||
| n | 19 | 18 | 23 |
| x (mU/L) | 4333 | 2267 | 493 |
| DE | 154,15 | 106,87 | 36,65 |
| cv% | 3,56 | 4,71 | 7,43 |
| Control 1 (Lypho) | Control 2 (Lypho) | Control 3 (Lypho) | |
| AFP | |||
| n | 17 | 23 | 13 |
| x (U/mL) | 9,8 | 27,1 | 59,7 |
| DE | 0,28 | 1,19 | 2,27 |
| cv% | 2,86 | 4,39 | 3,81 |
| Control 1 (Lypho) | Control 2 (Lypho) | Control 3 (Lypho) | |
| uE3 | |||
| n | 11 | 15 | 11 |
| x (nmol/L) | 2,9 | 13,9 | 37,5 |
| DE | 0,25 | 0,74 | 2,12 |
| cv% | 8,66 | 5,23 | 5,61 |
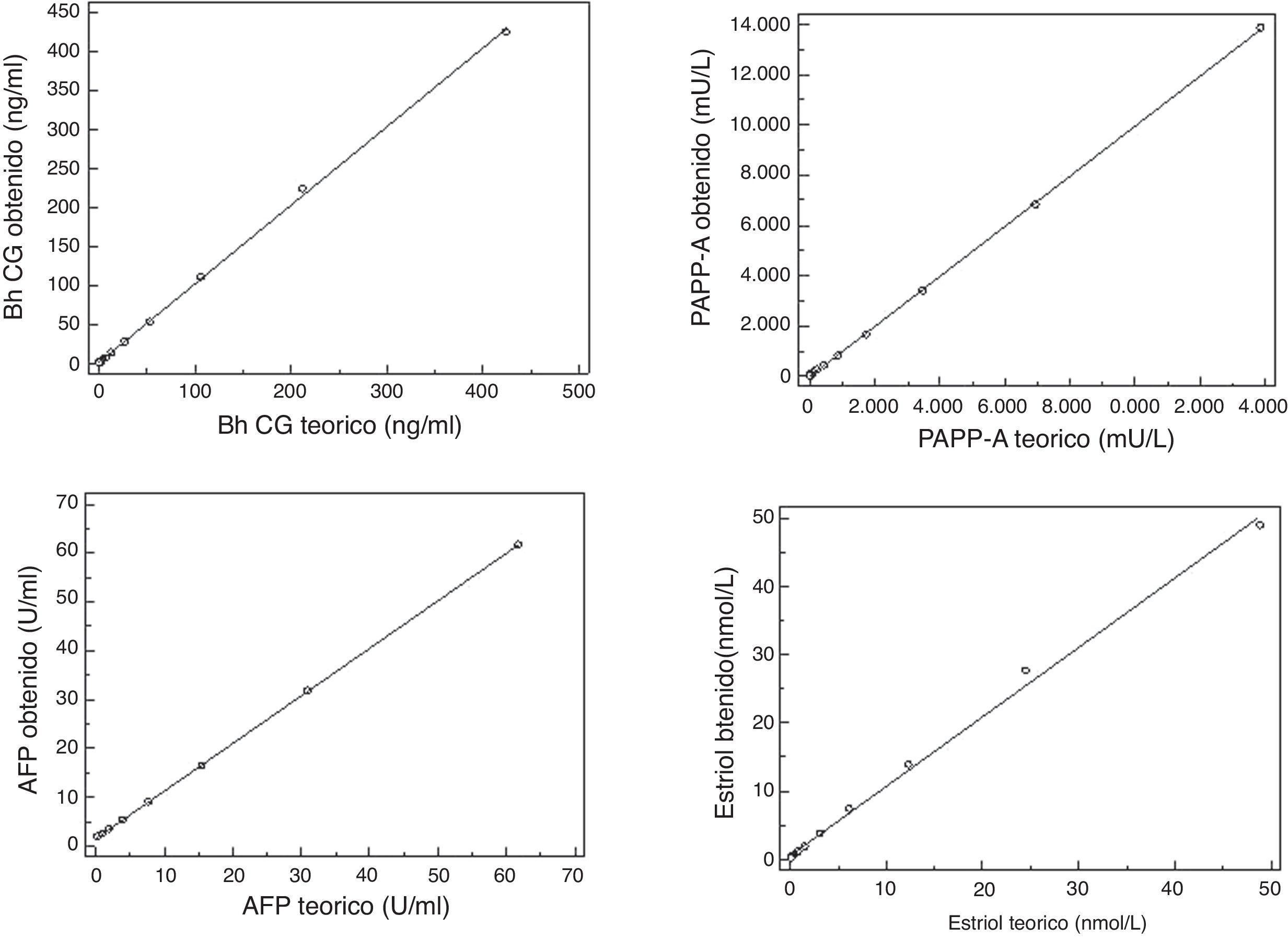
Se ha estudiado la linealidad de la determinación de fβhCG y PAPP-A, AFP y uE3 siguiendo las indicaciones NCCLS18 y de Armbruster y Pry20 para el cálculo del blanco y del límite de detección de la técnica. Para estudiar la linealidad se ha utilizado una mezcla de sueros de pacientes con valores altos para cada técnica, con una concentración cercana al límite superior esperado, efectuando diluciones seriadas, con un suero de varón, previa comprobación de valor cero de la técnica cuya linealidad se determinaba, y efectuando la determinación de cada dilución por duplicado. La representación gráfica de la recta de regresión entre los resultados obtenidos y los teóricos de las determinaciones estudiadas se muestra en la figura 1. Con la prueba de Cusum se comprueba que los puntos obtenidos no se desvían de la linealidad, para una p<0,05. Para fβhCG hemos comprobado la linealidad con nuestros resultados entre 0,9 y 424ng/ml, con un límite de detección de 0,7ng/ml y un blanco de 0,62ng/ml. Respecto a PAPP-A hemos comprobado la linealidad entre 28 y 13.868mU/l, con un límite de detección situado en 7mU/l y un blanco de 0,23mU/l. La AFP ha mostrado una linealidad entre 0,4 y 62U/ml con un límite de detección de 0,26U/ml y un blanco de 0,062U/ml. El uE3 ha mostrado una linealidad entre 2 y 49nmol/l con un límite de detección de 0,15nmol/l y un blanco de 0,060nmol/l; para concentraciones inferiores o superiores a las estudiadas no se ha verificado su linealidad, ya que están fuera los rangos fisiológicos o patológicos de la determinación.
Comparación con otros métodos (UKNEQAS)El control de screening prenatal del primer y segundo trimestre de UKNEQAS es el control externo más prestigiado en el entorno del cribado prenatal10, teniendo estrechas relaciones con la FMF (Londres). El control de cribado prenatal de primer trimestre UKNEQAS evalúa a 300 laboratorios que utilizan varias tecnologías y presentan diferencias significativas en los calibradores que usa cada una, como se ha descrito para el PAPP-A y uE324,25. Por ello, nos ha parecido técnicamente más correcto efectuar la comparación de nuestros resultados, con la media de resultados diana de los 62 laboratorios que integran el grupo con la misma tecnología Delfia Xpress.
Para ello, se han procesado 30 muestras de los lotes F355-384 del primer trimestre y 30 muestras de los lotes D640-669 del segundo trimestre, recibidos los 10 últimos meses.
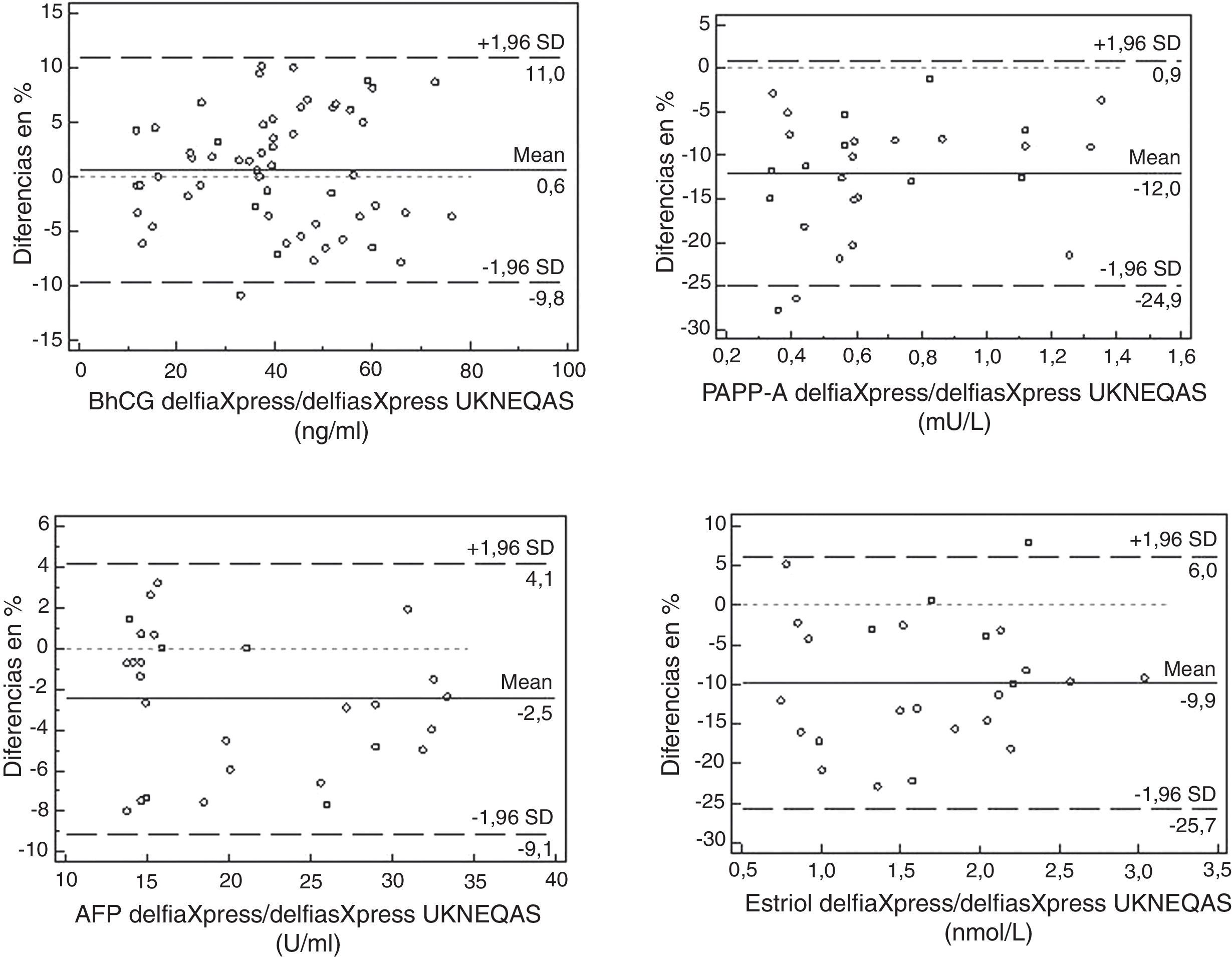
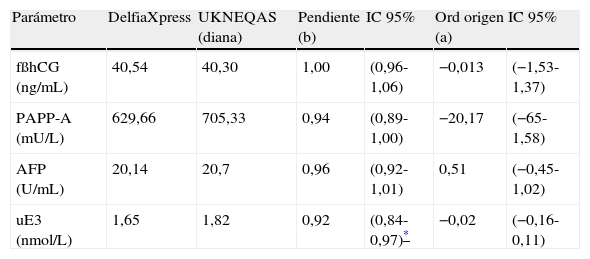
Para el estudio de la comparación, se han calculado las gráficas de Bland-Altman21 de los resultados obtenidos por el Delfia Xpress, con la media (diana) de los restantes 62 laboratorios participantes. En la figura 2 se muestran los resultados obtenidos; en la gráfica se representan, en ordenadas, el porcentaje de diferencias observadas y, en abscisas, los valores de las medias del parámetro estudiado. Estas gráficas indican que el intervalo de confianza del 95% de la media de todas ellas engloba el valor cero; luego, nuestros resultados no difieren significativamente del resto de los laboratorios, aunque los valores de PAPP-A y uE3 son sensiblemente menores, estando al límite de la significación. El cálculo de los parámetros de la recta de regresión Passing-Bablock22, para estudiar la idoneidad de los resultados observados en el estudio, se muestra en la tabla 3.
Parámetros regresión Passing-Bablock DelfiaXpress/grupo DelfiasXpress UKNEQAS
| Parámetro | DelfiaXpress | UKNEQAS (diana) | Pendiente (b) | IC 95% | Ord origen (a) | IC 95% |
| fßhCG (ng/mL) | 40,54 | 40,30 | 1,00 | (0,96-1,06) | −0,013 | (−1,53-1,37) |
| PAPP-A (mU/L) | 629,66 | 705,33 | 0,94 | (0,89-1,00) | −20,17 | (−65-1,58) |
| AFP (U/mL) | 20,14 | 20,7 | 0,96 | (0,92-1,01) | 0,51 | (−0,45-1,02) |
| uE3 (nmol/L) | 1,65 | 1,82 | 0,92 | (0,84-0,97)* | −0,02 | (−0,16-0,11) |
Con el fin de analizar la eficiencia diagnóstica de nuestra estrategia de realización del cribado prenatal en dos pasos y de la metodología analítica utilizada, se han procesado 3.698 muestras de pacientes, 3.020 gestantes del primer trimestre y 678 del segundo, a las que se les ha realizado el cribado prenatal, y se dispone de información clínica completa de la gestación y el parto.
Los resultados del cribado prenatal del primer trimestre del riesgo a término de trisomía 21 de las 3.020 gestantes muestran que 95 pacientes (3,1%) han dado positivo (>1/250). A 81 de estas pacientes se les ha efectuado la biopsia de corión y 14 han renunciado a la prueba. El resultado de las 81 biopsias ha permitido detectar, con las técnicas de QC-PCR y el posterior cultivo, 11 síndromes de Down y 2 síndromes de Edwards. De las 14 pacientes positivas que renunciaron a la prueba invasiva, se confirmó que no había nacido ningún síndrome de Down ni de Edwards. En nuestra serie de pacientes se identificaron también tres falsos negativos de síndrome de Down.
El estudio estadístico de estos datos muestra que se obtiene una sensibilidad de detección del síndrome de Down en exclusiva del 78,57% con un VPP del 11,58%, con un 2,79% de falsos positivos y un 0,1% de falsos negativos de síndrome de Down.
En lo que respecta al diagnóstico del síndrome de Edwards, se han diagnosticado dos pacientes portadores de la trisomía, que habían dado negativo al riesgo de trisomía 18, pero positivo al riesgo de trisomía 21, motivo por el cual, al realizarse el estudio genético, se detectó la trisomía en el cromosoma 18. En nuestra serie se detectó también un falso negativo t18.
El análisis de los falsos negativos detectados de síndrome de Down mostró los siguientes resultados. Paciente afrocaribeña de 30 años, con un PAPP-A de 0,11 MoM y una fβhCG 2,02 MoM, TN de 1,20mm con un riesgo de trisomía 21 1/780, que se diagnosticó al realizarse la ecografía morfológica a las 20 semanas y posterior amniocentesis. La segunda paciente era una mujer caucásica de 41 años, con un PAPP-A de 0,56 MoM y una fβhCG de 1,72 MoM, con una TN de 1,40mm y un riesgo final de trisomía 21 de 1/410, que se diagnosticó después del nacimiento. La tercera paciente era una mujer caucásica de 30 años, con un PAPP-A de 0,47 MoM y una fβhCG de 2,63 MoM, con una TN de 0,90mm con un riesgo de trisomía 21 de 1/2.200, que también se diagnosticó después del nacimiento. El falso negativo de síndrome de Edwards se trataba de una mujer caucásica de 42 años con un PAPP-A de 0,99 MoM, una fβhCG de 0,98, con una TN de 1,2mm y un riesgo t21 de 1/3.900 y t18 de 1/10.000, que se diagnosticó en la ecografía morfológica de la semana 20, por la característica imagen ecográfica del cráneo en fresa, confirmado posteriormente con el estudio genético de la amniocentesis.
Los resultados del cribado prenatal del segundo trimestre a las 678 gestantes muestran que 79 (11,6%) han dado positivo (riesgo superior a 1/250). A 59 pacientes se les realizó una amniocentesis y 20 renunciaron a la prueba invasiva. El resultado del cariotipo de las 59 amniocentesis ha mostrado, con las técnicas de QC-PCR y el posterior cultivo, que no se ha detectado ningún síndrome de Down. En el seguimiento de las 20 gestantes con un riesgo superior a 1/250 que renunciaron a la prueba invasiva se comprobó que no nació ningún síndrome de Down ni de Edwards. En nuestra serie se detectó también un falso negativo de síndrome de Down: mujer caucásica de 30 años con AFP de 0,67 MoM, una fβhCG de 2,05 MoM y 0,69 MoM de uE3 con un riesgo de trisomía 21 de 1/310, que se diagnosticó al realizarse la ecografía morfológica a las 20 semanas y un posterior análisis genético de la amniocentesis.
La sensibilidad de detección del síndrome de Down en el cribado del segundo trimestre fue del 0%, presentando la serie un 11,67% de falsos positivos y un 0,15% de falsos negativos (un paciente).
PracticabilidadSiguiendo los criterios de Biosca y Galimany23 y preconizados por la SEQC, se han evaluado los criterios de practicabilidad en sus diversos apartados.
Organización del trabajoSe han hallado los tiempos de realización práctica de los análisis, con el cálculo de los tiempos medios del procesamiento de la rutina durante 5 días. Desde la puesta en marcha del analizador hasta la obtención del primer resultado de controles se precisa de alrededor de 30min. Se alcanza una velocidad de 40-42 determinaciones por hora, con una carencia de 2min 30s en el cribado prenatal del primer trimestre (2 analitos) y de 4min en el cribado del segundo trimestre (3 analitos). El software identifica los reactivos de cada lote que presentan una larga estabilidad, pero, en la determinación de uE3, hay que señalar que los reactivos, una vez abiertos, tienen una caducidad de solo 48h (buffer-trace), que consideramos que debería ser revisada por su poca practicabilidad y por resultar inadecuada en un analizador de última generación. Los reactivos han de estar refrigerados en una nevera, ya que el analizador no dispone de sistema de refrigeración propio.
CalibraciónSe ha comprobado la correcta estabilidad de la calibración de las determinaciones fβhCG, PAPP-A, AFP y uE3 durante los 6 y 4 meses que han durado los dos lotes utilizados, por la valoración de la desviación de los resultados de la exactitud de los controles valorados en cada serie (DE: ±2) y por los informes de controles de calidad externos UKNEQAS que se procesaban mensualmente, por lo que no ha hecho falta la recalibración del analizador durante el tiempo que ha durado cada lote.
MantenimientoLos tiempos de mantenimiento se han calculado también prácticamente durante 5 días. El mantenimiento diario consta de lavado y vaciado de residuos, y dura 10-12min. El mantenimiento semanal realiza un chequeo electrónico de 6min. El mantenimiento quincenal consta de una desinfección con etanol al 96% de la sonda de toma de muestras con alcohol y dura 33-35min.
EntornoDelfia Xpress realiza el análisis inmunofluorimétrico de los parámetros que integran el cribado del primer y del segundo trimestre, calculando en un módulo informático anexo, el Prenatal Lifecycle software v. 3.0, el valor del riesgo con la integración de los parámetros bioquímicos, ecográficos y demográficos.
Permite también realizar la validación técnica y facultativa, y su conexión con terminales de cálculo en áreas clínicas (ecografías, unidad de diagnóstico prenatal) y con el sistema informático del laboratorio y de los ambulatorios externos, y posibilita el envío on-line de un informe en formato pdf con los resultados del riesgo prenatal a la historia clínica de la paciente.
Formación del personalEl Delfia Xpress es un analizador de fácil manejo y sencillo aprendizaje, con un sistema informático en el entorno de Windows Vista. El aprendizaje de nuestro personal técnico se realizó en un módulo de 3h. Consideramos que la dificultad técnica de puesta en marcha y manejo está a nivel de un técnico superior de laboratorio.
CosteSe ha calculado el coste en nuestro laboratorio de las determinaciones del cribado, considerando solo los costes directos del alquiler y del mantenimiento anual del analizador, de la instalación de las terminales informáticas (Prenatal Lifecycle) de conexión del laboratorio con los servicios clínicos (unidad de diagnóstico prenatal y unidad de ecografías), la conexión con el sistema informático del laboratorio y, finalmente, el importe de los controles y los reactivos para la realización de las determinaciones bioquímicas. El coste del cribado del primer trimestre en nuestro laboratorio es de 17,23 euros, y el del cribado del segundo trimestre, de 19,22 euros. En estos costes no se incluye el coste del personal ni otros apartados de costes indirectos como la extracción, los tubos, etc.
DiscusiónEl estudio de la imprecisión intradía e interdía muestra que fβhCG y PAPP-A tienen unos CV medios de 4,7 y 3,4%, respectivamente. Los parámetros AFP y uE3 muestran unos CV medios de 3,3 y 4,7%, respectivamente, todos ellos inferiores al 6% y que cumplen con los requisitos analíticos requeridos por el UKNEQAS24, que establece el 10% del coeficiente de variación como el porcentaje máximo recomendado para estas determinaciones. Estos coeficientes de variación obtenidos son equivalentes a los obtenidos por otros autores13.
El estudio de la linealidad y del límite de detección ha mostrado una linealidad demostrada por nuestros resultados, para fβhCG entre 0,9 y 424ng/ml y, para PAPP-A entre 20 y 13.868mU/l. Estas linealidades, así como las obtenidas para AFP y uE3, pueden considerarse excelentes puesto que cubren todos los rangos fisiológicos y patológicos, por lo que no es necesario efectuar diluciones de las muestras de las pacientes.
El estudio de la comparación de nuestros resultados al procesar los controles UKNEQAS del primer y del segundo trimestre en el Delfia Xpress, con los valores de referencia del grupo de 62 laboratorios que presentan la misma tecnología Delfia Xpress, muestran que nuestro analizador presenta valores idóneos a los del grupo de referencia para las determinaciones de fβhCG y AFP, más bajos que PAPP-A y uE3, pero que no llegan a presentar diferencias significativas con respecto a los valores diana del grupo de su misma tecnología, que requerirán, sin embargo, la recalibración de nuestro analizador para mejorar sus resultados.
La sensibilidad para la trisomía 21 fue del 78,57% con un VPP del 11,58%, con un 2,79% de falsos positivos; se diagnosticaron 11 síndromes de Down y 2 Edwards. En esta serie se detectaron 3 falsos negativos de síndrome de Down y uno de síndrome de Edwards. Estos resultados son inferiores a los de otras series en nuestro país26 y de Europa1–4, que presentan sensibilidades cercanas al 90%, pero hay que considerar que la media de edad de nuestras gestantes es de 30,46 años, con un 21,52% de las gestantes con una edad superior a 36 años, siendo esta edad media superior a las de otras series estudiadas de nuestro país26 y de Europa. A pesar de los resultados inferiores a la media, los consideramos aceptables, pero también mejorables con la recalibración de la técnica de PAPP-A ya señalada y el recálculo de nuevas curvas de normalidad realizadas para el estudio con las 1.000 primeras gestantes, y que ahora, al disponer de los resultados de casi 3.000 pacientes, podrían mejorar notablemente. La decisión, a partir de este trabajo, de considerar a las pacientes que presenten valores de PAPP-A <0,4 MoM como pacientes de riesgo, siguiendo las orientaciones de otros grupos27, también puede mejorar nuestra sensibilidad.
El cribado del segundo trimestre con un 11,23% de positivas no ha detectado ningún síndrome de Down. Thilagananthan et al28 y Kadir y Economides29, en dos series inglesas, estudian la influencia de la introducción del cribado del primer trimestre en los resultados del cribado del segundo y concluyen que el diagnóstico de las pacientes portadoras de síndrome de Down en el primer trimestre ocasiona la disminución de la prevalencia en el segundo trimestre y la bajada consecuente del VPP. Kadir y Economides29, además, cuantifican que la tasa de detección del síndrome de Down baja del 87,5 al 50%, y el VPP, del 2,7 al 0,45%. En otras series europeas30 se señala el aborto espontáneo que presentan los síndromes de Down antes del segundo trimestre también como una de las causas de la disminución de la tasa de detección de los síndromes de Down en este periodo.
Nuestros resultados del segundo trimestre son similares a otra serie de nuestro país publicada recientemente31, que también refiere sensibilidades de detección del 0% con un 7% de falsos positivos. Así, en nuestro entorno sanitario, la estrategia del cribado del segundo trimestre, por su baja sensibilidad y el alto porcentaje de falsos positivos, ha quedado relegada a las gestantes que, por alguna causa (demora diagnóstica del embarazo, no acudir a realizarse la ecografía a la 12.ª semana, etc.), no se han podido realizar el cribado del primer trimestre.
Con respecto a la practicabilidad, los resultados nos han mostrado que el Delfia Xpress es un analizador con una elevada fiabilidad técnica que permite procesar 40 determinaciones por hora, con un sencillo manejo y mantenimiento, y con un precio de 17,23euros por cribado del primer trimestre, con la posibilidad de conexión del software de cálculo, con los servicios clínicos y laboratorios externos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.