Leímos con interés la publicación de Marina Parra Robert et al.1, ya que nuestro laboratorio tiene implantado un procedimiento similar desde el año 2011.
Como se ha comentado en el citado artículo, actualmente la mayoría de analizadores disponen de sistemas de detección de las sustancias interferentes más prevalentes que ayudan a identificar de forma estandarizada, objetiva y homogénea la calidad preanalítica de la muestra.
Nuestro laboratorio tiene implantado de forma automática la anulación de parámetros y la creación de comentarios informativos en función de los resultados obtenidos en la medición de los índices séricos. De esta forma se evitan errores de interpretación y validación que se producirían si hubiese que introducir estas modificaciones de forma manual, siguiendo las recomendaciones de las sociedades científicas nacionales y organismos internacionales2–4.
La principal limitación de la implantación de este procedimiento radica en la dificultad para diferenciar entre hemólisis in vivo e in vitro5. La información adicional proporcionada por el clínico en la petición analítica como sugieren los autores, es fundamental en muchos casos en los que la búsqueda de un diagnóstico debe estar dirigida. Sin embargo pueden darse situaciones no contempladas a priori, que impidan un diagnóstico acertado al no tenerlas en cuenta. Asimismo la revisión manual de los casos, no obvia el posible «error humano» al pasar por alto alguna de las condiciones clínicas reportadas. Limitar solo a unos cuantos diagnósticos la posibilidad de informar de los resultados, dando por hecho que el resto de hemólisis son producidas in vitro puede llevar a un retraso en el correcto manejo del paciente crítico e incluso llevar a un diagnóstico erróneo.
Presentamos un caso detectado en nuestro centro donde la anulación de parámetros por la elevada hemólisis que presentaba la muestra, supuso un retraso diagnóstico de un síndrome hemolítico urémico.
Se trató de un paciente ingresado a causa de lo que en principio parecía una sepsis de origen urológico con disfunción multiorgánica. En las analíticas presentaba un fracaso renal con rápido incremento de creatinina y urea, un incremento de la bilirrubina de carácter mixto, trombocitopenia progresiva y anemización. Desde el segundo día del ingreso, en todas las analíticas se informaba de la intensa hemólisis de la muestra, por lo que se anulaban los parámetros interferidos (potasio, lactato-deshidrogenasa y creatín-kinasa) lo que dificultó el correcto diagnóstico del paciente. Este caso fue notificado como evento de seguridad y propició un análisis causa-raíz (a través de diagrama de Ishikawa). Los principales problemas detectados fueron: la anulación de parámetros debido a la hemólisis de la muestra (la falta de visibilidad de los resultados impidió una correcta orientación diagnóstica), la presencia de una hiperbilirrubinemia mixta (normalmente la hemólisis in vivo cursa con un incremento de la bilirrubina indirecta5) y que en el primer frotis no se observaron esquistocitos.
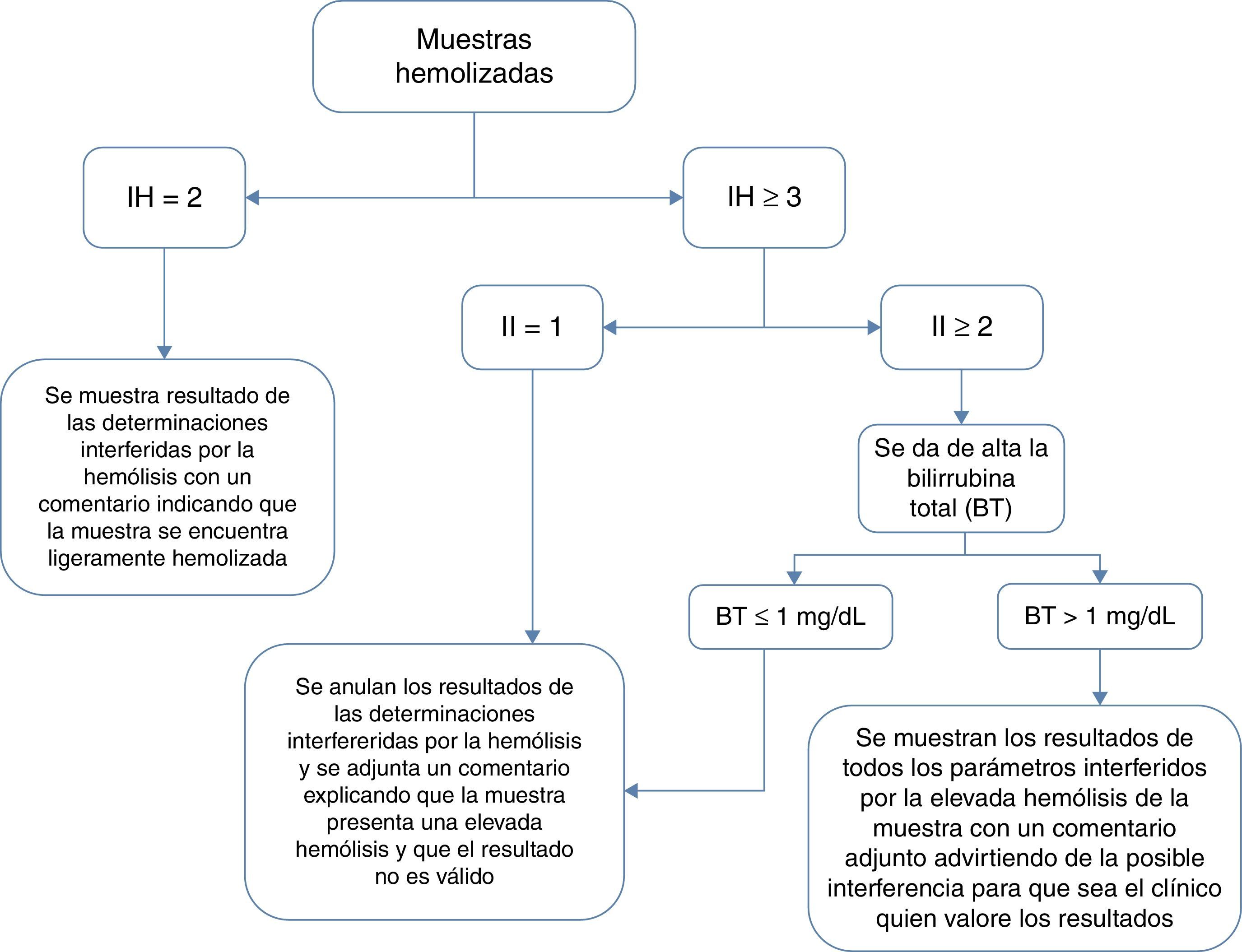
Esto supuso una modificación del procedimiento en la comunicación de los índices séricos y en la anulación de parámetros en las muestras de bioquímica. Se introdujo la generación de una cascada de pruebas secundarias al análisis de los índices séricos (índice hemolítico [IH]; índice ictérico [II] e índice lipémico [I]) para blindar que en los posibles casos de hemólisis in vivo no se perdiera información relevante (fig. 1).
El analizador Dimension Vista® 1500 (Siemens HealthCare) expresa los índices séricos de cada sustancia interferente en una escala ordinal sin unidades (1 al 8). Cada valor se correlaciona con un intervalo de concentraciones de cada interferente analizado (hemólisis, ictericia y lipidemia).
IH (índice hemolítico), II (índice ictérico), BT (bilirrubina total).
En la muestras con hemólisis con valores de hemoglobina (Hb) comprendida entre los 10-25mg/dl (que en nuestro analizador, Dimension Vista® 1500 se corresponde con un IH=2) se informa de que la muestra se encuentra ligeramente hemolizada para que el clínico valore la posible interferencia mostrando el resultado de las determinaciones interferidas.
En el caso de hemólisis con concentraciones de Hb≥25mg/dl (se corresponden con IH≥3) se tendrá en cuenta también el II de la muestra. Cuando el II=1 (que en nuestro analizador correlacionan con concentraciones de bilirrubina total [BT] inferiores a 2mg/dl) y el IH≥3 se anulan todos los parámetros interferidos por la hemólisis con un cometario adjunto a la anulación. En los casos con IH≥3 y II≥2 (que se correlacionan con concentraciones de BT≥2mg/dl) se amplía la determinación de BT. Cuando la BT≤1mg/dl se anulan todos los resultados de los parámetros interferidos. Sin embargo cuando los resultados de BT son superiores a 1mg/dl se mostrarán todos los parámetros interferidos aunque el IH≥3. Ello permitirá que sea el clínico el que pueda valorar si los niveles de BT y lactato deshidrogenasa asociados a hemólisis en la muestra pueden estar relacionados con hemólisis intravascular.
Como conclusión, creemos que automatizar de manera sistemática las acciones correctivas (en este caso la anulación de parámetros) y la introducción de comentarios, también de forma automática, homogeniza y evita arbitrariedades a la hora de interpretar y validar los índices séricos y su potencial influencia sobre las muestras del laboratorio.