La relevancia del selenio en la salud humana está siendo cada vez mejor caracterizada, así como la relación de un estado nutricional insuficiente de este elemento con diversas enfermedades. A pesar de los avances en el conocimiento de las funciones y la localización de las selenoproteínas, el marcador de elección continúa siendo la cuantificación del selenio total en muestras biológicas. Hay varios métodos analíticos que se pueden emplear en el laboratorio clínico para su medición. En el presente documento se revisan los procedimientos de medida disponibles para el laboratorio clínico y los procesos para asegurar la fiabilidad de los resultados.
El selenio es un no metal que se encuentra ampliamente distribuido en el medio ambiente, principalmente en rocas y suelos de la corteza terrestre. Se introduce en la cadena alimentaria a través de las plantas1, que pueden contener selenio de manera natural o a partir de fuentes antropogénicas, como el uso de abonos y fertilizantes2.
El selenio es el único elemento traza especificado en el código genético a través del aminoácido selenocisteína3. Se han identificado 25 selenoproteínas en humanos, aunque se desconoce la función de muchas de ellas. El papel biológico más importante que se le atribuye a este elemento es su poder antioxidante, formando parte del sistema glutatión-peroxidasa (GPx) y siendo necesario para el mantenimiento de la integridad de las membranas celulares frente a la acción dañina de los radicales libres4. Además de su función antioxidante, ejerce funciones antiinflamatorias e interviene como catalizador en la biosíntesis de las hormonas tiroideas5.
La absorción y la biodisponibilidad del selenio pueden modificarse por la interacción con otros nutrientes de la dieta6,7, así como por la interacción con metales pesados6,8. Por ejemplo, algunos investigadores han señalado que la formación de complejos metilmercurio-selenocisteína podría reducir la biodisponibilidad del selenio, interfiriendo de esta manera en la síntesis de selenoenzimas que proporcionan protección antioxidante en el cerebro9. Además, se postula que el cadmio podría desplazar al selenio de las metalotioneínas produciendo alteraciones en el metabolismo del mismo10.
Los efectos producidos por la deficiencia de selenio se identificaron en 1979, cuando en ciertas regiones de China se observó que su deficiencia explicaba numerosas manifestaciones de la enfermedad de Keshan, una miocardiopatía que afecta principalmente a mujeres en edad fértil y niños, y de la enfermedad de Kashin-Beck, una osteoartropatía que afecta a niños11.
Posteriormente, se comenzó a investigar la deficiencia de selenio con relación a un gran número de enfermedades. Existen estudios que atribuyen al selenio un papel protector frente a diversos tipos de cáncer12, aunque ello es objeto de intensos debates13. Es también el caso del papel protector del selenio en las enfermedades cardiovasculares, ya que algunos estudios han señalado que este elemento podría ser un factor independiente de riesgo de infarto de miocardio en poblaciones con déficit de selenio14, mientras que otros investigadores no han hallado esta asociación15. El selenio disminuye como reactante de fase aguda al disminuir la síntesis de selenoproteinas por la acción de citocinas inflamatorias y en la insuficiencia renal por baja producción de GPx35.
Desempeña un papel relevante tanto en la reproducción masculina, como en el sistema inmunitario. Además, el déficit de selenio se encuentra asociado a la virulencia de algunas infecciones virales, a un mayor riesgo de mortalidad y a un mayor deterioro cognitivo4,16. El selenio es tóxico cuando hay una exposición prolongada a dosis altas. No obstante, los niveles de exposición que producen la intoxicación son difíciles de establecer. Los síntomas más relevantes en la intoxicación aguda son hipotensión y taquicardia, mientras que en la selenosis o intoxicación crónica por selenio destacan la fragilidad y la pérdida de pelo y uñas17.
El estado nutricional del selenio se ha valorado en las últimas décadas mediante la determinación del elemento en suero, plasma, sangre total, eritrocitos, orina, uñas y pelo. Las medidas de selenio sanguíneo son las más utilizadas y se consideran buenos indicadores del estatus de selenio y de su ingesta. El selenio sérico o plasmático refleja su ingesta y disponibilidad reciente, mientras que el eritrocitario es un indicador de un periodo más largo, debido a que la incorporación de selenio se produce durante la síntesis de estas células, que tienen una vida media de 120 días. La orina es la principal ruta de excreción del selenio, por lo que se considera un espécimen apropiado para la detección de toxicidad por selenio18.
La valoración del estatus de selenio también puede incluir la medida de la actividad de algunas selenoproteínas, proporcionando información más certera del estatus funcional, aunque la determinación de una sola selenoproteína puede ser insuficiente debido a su expresión jerárquica. El selenio es un regulador clave de su incorporación a las selenoproteínas y se ha demostrado que existe una jerarquía en la expresión de selenoproteínas durante la escasez y la depleción de selenio19. Por ejemplo, la actividad GPx3 plasmática y la GPx1 eritrocitaria son buenos marcadores de ingesta de selenio y de estatus funcional en el rango deficitario, pero cuando la ingesta alcanza y excede el nivel óptimo, estas actividades se estabilizan. La saturación de la GPx3 se produce en el rango de selenio plasmático 70-90μg/l y la de la selenoproteína P en el rango 110-125μg/l. La falta de estandarización de los métodos existentes para la determinación de la actividad de selenoproteínas dificulta la comparación de resultados entre laboratorios20-22.
Los distintos marcadores reflejan, en general, el estatus insuficiente de selenio. Los sujetos con cantidades suficientes alcanzan la máxima expresión de las selenoproteínas y solo la medida del selenio total puede poner de manifiesto cambios en la ingesta.
Está indicada la determinación de selenio en muestras biológicas si hay sospecha de déficit o de intoxicación de este elemento traza. Tras cirugía bariátrica malabsortiva, debería hacerse una medida de selenio si el paciente presenta anemia o fatiga inexplicada, diarrea persistente, miocardiopatía o enfermedad metabólica ósea23.
Objeto y campo de aplicaciónEl objeto de este documento es revisar los métodos analíticos para la medida directa del contenido de selenio en diversos especímenes biológicos y detallar aquellos procedimientos que presentan una mayor fiabilidad entre los que son más accesibles al laboratorio clínico. Además, hacer una revisión de los valores de referencia del selenio en diferentes matrices y áreas geográficas. Es de aplicación en los laboratorios clínicos.
Especímenes biológicos para la medición de selenioConsideraciones generalesEl riesgo de contaminación de las muestras para análisis de selenio es muy bajo, a diferencia de lo que ocurre con otros elementos traza, por lo que pueden utilizarse contenedores convencionales para la extracción y el almacenaje de las muestras18,24. Pese a que el selenio no es un elemento especialmente ubicuo, ni se encuentra en cantidades extremadamente bajas en las muestras biológicas25, la Sociedad Española de Medicina del Laboratorio (SEQCML) publicó en 2014 los requerimientos técnicos y ambientales26 y las medidas de seguridad27 que se deben tener en cuenta en los laboratorios clínicos para la determinación de elementos traza y que deberían ser seguidas cuando se trabaja con este tipo de elementos.
Suero y plasmaSon aptos para la toma de muestras de sangre jeringas o tubos de vacío de polipropileno, cloruro de polivinilo o poliestireno y agujas de acero inoxidable. El uso de los anticoagulantes heparina y ácido etilendiaminotetraacético (EDTA) para la obtención de plasma no produce diferencias significativas con respecto a la medición en suero, pero sí el citrato28. El contacto del plasma o suero con gel separador no produce tampoco diferencias significativas en la concentración de selenio29. Debe evitarse la hemólisis porque puede producir una elevación de la concentración de selenio por liberación desde los eritrocitos. Una vez extraída la sangre, se puede esperar a que se produzca la coagulación para la obtención de suero o centrifugar directamente para la separación de plasma. La centrifugación debe realizarse durante 10 min a 1.000-1.200×g con el tapón puesto en el tubo para evitar contaminaciones procedentes de la centrífuga y evaporaciones25.
La concentración de selenio se mantiene estable durante 3 días cuando las muestras se almacenan a 4°C, disminuyendo significativamente a partir de 7 días y drásticamente después de 20. Las muestras congeladas a –20°C son estables durante meses28.
Sangre y eritrocitosTanto la heparina como el EDTA son apropiados como anticoagulantes para su empleo en muestras de sangre. A fin de obtener una muestra eritrocitaria, se debe centrifugar la sangre lo antes posible a 700×g durante 5min. Se separa el plasma cuidadosamente, se lava con igual volumen de solución salina (9,0g/l de NaCl), se mezcla, se vuelve a centrifugar, se elimina el sobrenadante y se repite este procedimiento 2veces. Se congela a –20°C hasta su determinación. Para ello, se descongela, se agita vigorosamente y se diluye la solución al 1:20 con agua destilada, antes de su análisis, siguiendo el protocolo de suero.
OrinaLa orina debe recogerse durante 24 h, ya que las concentraciones de selenio en muestras de orina aisladas presentan una elevada variabilidad intraindividual. Se recomienda la obtención de orina sin conservante o recogida sobre 10ml de ácido nítrico suprapuro en contenedores convencionales. El crecimiento bacteriano disminuye el nivel de selenio en orina, ya que algunas bacterias son capaces de reducir este elemento a hidruro de selenio, un compuesto muy volátil que se desprende con facilidad. La concentración de selenio permanece estable en las muestras sin acidificar durante 24 h a temperatura ambiente, 7 días a 4°C y 14 días a –20°C24,30.
PeloEl cabello es un espécimen que genera gran controversia dado que el contenido del selenio puede encontrarse alterado por la utilización de cosméticos, productos de higiene y contaminación ambiental entre otros. Esto hace necesario un cuidadoso lavado del cabello previo a la toma de la muestra teniendo especial cuidado de no arrastrar algo del selenio capilar. Por ello, esta matriz, aunque presenta la ventaja de su fácil recolección y conservación, requiere de una adecuada técnica de lavado y preparación de la muestra a fin de evitar contaminaciones externas.
Metodología para la medición de selenioLa técnica más extendida para la determinación de selenio total es la espectrometría de absorción atómica por atomización electrotérmica (ETAAS), por la posibilidad que ofrece de análisis directo de este elemento en muestras biológicas. La espectrometría de masas con plasma de acoplamiento inductivo (ICP-MS) es otra técnica en auge para la determinación de selenio. Otras técnicas empleadas requieren tratamiento previo de la muestra, siendo menos idóneas para su empleo en laboratorios clínicos. Es el caso de la fluorometría y de la espectrometría de absorción atómica con generación de hidruros. En 161 trabajos europeos publicados entre 1972 y 2009 en los que se analizó el selenio sérico o plasmático de sujetos sanos, se empleó ETAAS en el 64% de ellos, fluorometría en el 19% y análisis de activación por neutrones (AAN) en el 12%. Todos los estudios que emplearon AAN se publicaron antes de 1991 y el 87% de los que utilizaron fluorometría se publicaron entre 1981 y 199031. En la revisión similar que se llevó a cabo de estudios europeos publicados a partir de 2010 que incluyeran el análisis de selenio en plasma, suero, orina y pelo en sujetos sanos, se encontraron 22 publicaciones que cumplieron los criterios mencionados. En 15 de ellas, el 68%, se empleó ICP-MS para el análisis.
A continuación, se describen las metodologías analíticas para la medición de selenio empleadas en el laboratorio clínico en orden de mayor a menor límite de detección.
Espectrometría de fluorescenciaLas muestras de suero deben ser digeridas previamente mediante ácidos oxidantes y temperatura elevada. Los métodos descritos que emplean esta técnica se basan en la reacción en medio ácido del Se4+ con el 2,3-diaminonaftaleno o compuesto similar para dar un piazoselenol fluorescente. Tras la digestión, es necesaria la reducción con ácido clorhídrico del Se6+ formado. Se extrae el fluoróforo con un solvente orgánico y se mide la fluorescencia (excitación a 366nm y emisión a 544nm). Son métodos largos pero consistentes, con recuperaciones de más del 90% y un coeficiente de variación en suero del 3-4%. Los límites de detección están en torno a 35,5μg/l30,32,33.
Análisis de activación por neutronesLos distintos métodos emplean el isótopo 77Se, con semivida de 17,5 segundos, o el 75Se, con semivida de 121 días. Demandan una fase previa de extracción, de ultrafiltración o de digestión y coprecipitación para eliminar la interferencia espectral de radionúclidos abundantes, como 24Na, 80Br, 82Br, 38Cl y 42K. Las muestras tratadas se bombardean con un flujo de neutrones para formar los isótopos inestables, que se desintegran radiactivamente. La energía del fotón y la intensidad de la radiación inducida se miden mediante un contador de radiación gamma. Los límites de detección están en torno a 17μg/l34,35.
Espectrometría de absorción atómica con generación de hidrurosLa generación de hidruros es uno de los procedimientos de derivatización más importantes para la determinación de selenio. Se acopla habitualmente a detección por absorción atómica, pero también se utiliza acoplado a fluorometría y voltamperometría. La reacción de obtención del hidruro de selenio tiene un rendimiento elevado, permite la separación del analito de matrices complejas y consigue alcanzar límites de detección muy bajos. Las muestras se digieren con ácidos oxidantes y temperatura elevada para convertir todo el selenio presente en Se4+, que reacciona con borohidruro de sodio para la obtención de hidruro de selenio. Suele ser necesario un paso adicional de reducción del Se6+ con ácido clorhídrico previo a la derivatización. Se ha publicado otro procedimiento de digestión por microondas que descompone todo el selenio en Se4+ y que simplifica la determinación. El límite de detección descrito es de 13,4μg/l36,37.
Fluorescencia de rayos X por reflexión totalLas ventajas de esta técnica son la capacidad de análisis de volúmenes muy pequeños de muestra con un pretratamiento sencillo consistente en una dilución con agua suprapura, adición del estándar interno, habitualmente galio, y secado en un portador de muestras de cuarzo. La muestra se irradia con un haz de rayos X, cuya absorción produce iones excitados electrónicamente que vuelven al estado fundamental mediante transiciones que involucran a los electrones de los niveles de mayor energía, con emisión de rayos X característicos. El análisis dura pocos minutos y es posible analizar simultáneamente otros elementos en un amplio intervalo de concentraciones. Los límites de detección descritos son de 10-12μg/l para sangre y suero, y de 7-8μg/l para orina38-40.
Espectrometría de absorción atómica por atomización electrotérmicaEsta técnica es la más utilizada en los laboratorios clínicos debido a la gran ventaja de no necesitar pretratamiento de la muestra, además de emplear pequeños volúmenes de muestra. Destaca el manejo sencillo de los espectrómetros en comparación con el resto de técnicas descritas. Son necesarios métodos de corrección del fondo: la lámpara de deuterio no es suficiente para la corrección de las interferencias provocadas por el contenido en hierro y fosfatos del suero, mientras que la corrección por efecto Zeeman ofrece una mejor solución al problema. Se emplean modificadores de matriz que permiten la formación de seleniuros refractarios y el empleo, por tanto, de temperaturas de calcinación elevadas que permiten eliminar la mayor parte de la matriz. Los distintos modificadores estabilizan en desigual grado el selenio orgánico y el inorgánico y la elección debe hacerse teniendo esto en cuenta. Se han publicado métodos con níquel, paladio, rodio, iridio, combinaciones de Pd/Mg(NO3)2, Cu/Mg(NO3)2 y Pd/agente reductor, entre otros41-43. El paladio parece proporcionar la mayor sensibilidad y la mejor reproducibilidad, más aún cuando se combina con un agente reductor como el ácido ascórbico. Con reductores, sin embargo, se incrementan los problemas de obstrucción en el muestreador por reducción del paladio en el capilar, que precipita28. El uso de paladio resultó ser el mejor modificador en determinados hornos de grafito, con una sensibilidad similar para selenato y selenito, y del 80% en la medición de selenometionina en varios estudios18. En otro tipo de hornos, la estabilización efectiva de todas las especies presentes en el plasma se produjo con paladio reducido con ácido ascórbico18. Se han descrito límites de detección con esta técnica que llegan a ser, en algún caso, inferiores a 1,0μg/l30.
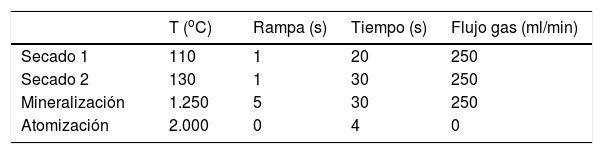
Procedimiento de medida de la concentración de selenio en suero, plasma y sangreCondiciones analíticasSe ha de emplear una lámpara de cátodo hueco o de descarga monoelemental para obtener la mayor intensidad de señal luminosa, la longitud de onda de 196nm y la rendija de 0,7nm. Las cámaras de grafito han de ser pirolíticas con plataforma tipo L’Vov. Existe un gran número de programas para el análisis de selenio. En general, los métodos descritos emplean 2etapas de secado para evaporar la muestra. La elevación gradual de la temperatura, tanto en el secado como en la calcinación, es más eficaz en la prevención de la volatilización del selenio que una elevación rápida de la temperatura seguida de una etapa larga de temperatura constante. Las temperaturas de secado están en el rango 40-300°C, las de calcinación entre 300 y 1.350°C y las de atomización entre 1.900 y 2.800°C28. Un programa rápido y al alcance de cualquier equipo es el representado en la tabla 1. Se recomienda utilizar un volumen de muestra de 20μl. Se emplea lectura en área de pico con un tiempo de integración de 4 s. Se puede añadir un paso adicional de limpieza a 2.600°C.
Preparación de la muestraEn general, el único tratamiento de las muestras previo al análisis por ETAAS suele ser una dilución, habitualmente con el modificador de matriz y con Triton X-100® (Sigma-Aldrich Chemie Gmbh, Múnich, Alemania). Las diluciones más empleadas se encuentran entre 1:3 y 1:20. La concentración máxima de Triton X-100® que se inyecta es del 0,25%28. Se recomienda una dilución 1:9 con el modificador de matriz y posterior homogeneización. El modificador puede consistir en una solución de Pd(NO3)2 0,1g/l y Triton X-100® 0,1% (V/V) en agua suprapura.
Preparación de los patronesSe pueden preparar patrones de concentración 50, 100 y 200μg/l (0,63, 1,27 y 2,53μmol/l), que se diluyen en modificador de matriz (Paladio y Triton X-100®) en proporción 1:9. Se puede partir de un patrón certificado de 1g/l, que se diluye en un matraz aforado hasta concentración de 10mg/l, estable en nevera al menos durante 3meses. El blanco consiste en una mezcla de agua y modificador de matriz en proporción 1:9 (igual tratamiento que las muestras).
Características metrológicasEste procedimiento es lineal hasta los 400μg/l (5,08μmol/l). El límite de detección es de 0,79μg/l (0,01μmol/l) y la masa característica de 39,1 pg/0,0044 unidades de absorbancia.
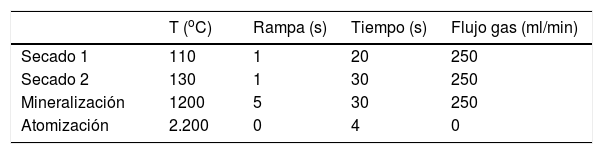
Procedimiento de medida de la concentración de selenio en orinaCondiciones analíticasSe emplea una lámpara de cátodo hueco o de descarga monoelemental, la longitud de onda de 196nm y la rendija de 0,7nm. Las cámaras de grafito han de ser pirolíticas con plataforma tipo L’Vov. Es imprescindible la corrección de fondo por Zeeman dada la alta concentración de fosfatos. Un programa puede ser el representado en la tabla 2. Se recomienda utilizar un volumen de muestra de 20μl. Se emplea lectura en área de pico con tiempo de integración de 4 s. Se puede añadir un paso adicional de limpieza a 2.600°C.
Preparación de la muestraLas muestras de orina suelen requerir solo de centrifugación y dilución como tratamiento previo al análisis, habitualmente con modificador de matriz. Se recomienda una dilución 1:4 con el modificador de matriz y posterior homogeneización. El modificador puede consistir en una solución de Pd(NO3)2 0,1g/l, HNO3 suprapuro 20ml/l y Triton X-100® 0,1% (V/V) en agua suprapura.
Preparación de los patronesSe pueden preparar patrones de concentración 50, 100 y 200μg/l (0,63, 1,27 y 2,53μmol/l), que se diluyen en modificador de matriz en proporción 1:4. El blanco consiste en una mezcla de agua suprapura mezclada en proporción 1:4 con modificador de matriz (igual tratamiento que las muestras).
Espectrometría de masas con plasma de acoplamiento inductivoEs una técnica de reciente incorporación al laboratorio clínico y, debido a su complejidad y coste elevado, no está implementada de forma mayoritaria. Mediante esta técnica es posible determinar de forma cuantitativa la mayoría de los elementos de la tabla periódica a niveles de traza y ultratraza, partiendo de muestras en disolución acuosa. La ICP-MS utiliza como fuente de radiación un plasma de acoplamiento inductivo y como detector un espectrómetro de masas. Los iones generados en el plasma pasan a través de un filtro (cuadrupolar, etc.), que separa dichos iones según su relación masa/carga (m/z). Cada una de las masas separadas llega al detector donde se cuantifica el elemento de la muestra. Para controlar la estabilidad de la señal obtenida y para corregir interferencias no espectrales se emplean los patrones internos. Estos son elementos que no están presentes en la muestra: indio, rodio, itrio, escandio, germanio, bismuto, renio, etc.; se añaden tanto al blanco como a los estándares y las muestras. El bismuto debería evitarse como patrón interno en el caso de que el paciente estuviera tratado con sales de bismuto (subsalicilato de bismuto). Esta técnica combina la eficiente descomposición de la muestra en iones atómicos del plasma con la habilidad de la espectrometría de masas para distinguir iones de masas distintas.
Existen varios tipos de interferencias en ICP-MS:
- –
Espectrométricas: surgen cuando una especie iónica tiene una relación m/z igual a la del analito. Se evitan con una adecuada selección del isótopo a analizar.
- –
No espectrométricas: debidas a la matriz, que suele provocar una disminución de la señal al repelerse iones en el haz procedente del plasma. Pueden corregirse diluyendo la muestra, separando previamente los compuestos interferentes, introduciendo la muestra de forma diferente por vaporización electrotérmica44, uso del nebulizador a 2°C45, por inyección de flujo46, etc., o bien empleando un patrón interno.
La determinación de selenio por ICP-MS no está exenta de complicaciones debido, por un lado, a su alto potencial de ionización que implica que el porcentaje de átomos que se ionizan es pequeño y a que la señal del selenio se reparte entre numerosos isótopos (m/z 74, 76, 77, 78, 80, 82) y, por otro lado, a que los isótopos útiles en el análisis sufren interferencias, principalmente por iones poliatómicos que involucran al argón con las mismas relaciones m/z. Para evitar estas interferencias se emplean condiciones de plasma frío, instrumentos de sector magnético de alta resolución, celdas de colisión o reacción (CRC, DRC) o la introducción en el plasma de moléculas orgánicas simples, como etanol, 2-propanol o 1-butanol. Los gases más empleados en DRC y CRC son H2, He, NH3 y CH4.
No es necesaria la digestión de las muestras. La mayoría de los métodos publicados46-50 emplean solo una dilución previa, habitualmente con Triton X-100® y ácido nítrico, en proporciones entre 1:9 y 1:20. Los isótopos más usados para cuantificación son 82Se en modo estándar de ICP-MS y 78Se y 80Se en DRC-ICP-MS. Esta técnica permite análisis multielemental y, además, se emplea en estudios de especiación18,44-55. El límite de detección más bajo publicado es de 0,2μg/l54,55.
Pese a la limitación del encarecimiento que supone la ICP-MS para un laboratorio clínico, presenta una serie de ventajas que se deben tener en cuenta: mejores límites de detección (< 1μg/l) que la ETAAS, obtención de espectros sencillos y fácilmente interpretables, y permitir realizar un análisis simultáneo multielemental de casi todos los elementos del sistema periódico. Además, es una técnica sensible y precisa, y requiere un mínimo pretratamiento de la muestra56. Es la técnica de elección cuando se requiere un análisis de múltiples elementos y con un número elevado de muestras56,57. Por todo ello, hoy en día la ICP-MS está siendo introducida en un número cada vez mayor de laboratorios clínicos en análisis de rutina. Así, en los últimos años, se está objetivando un incremento en el número de los laboratorios que participan en programas de Garantía Externa de la Calidad y utilizan esta técnica para determinar selenio en suero/sangre.
Procedimiento de medida de la concentración de selenio en distintos tipos de muestraCondiciones analíticasA pesar de que las condiciones analíticas dependen del equipo utilizado, uno de los estándares internos más habitualmente empleados es el germanio, dado que posee una masa atómica (72,64 u) muy similar a la del selenio, elemento a analizar.
Preparación de las muestrasPara las muestras de suero y orina se obtienen resultados satisfactorios utilizando diluciones 1:20 para suero y 1:10 para orina. El diluyente de suero/orina puede ser HNO3 suprapuro 5ml/l, etanol 10ml/l y Triton X-100® 0,2ml/l para las muestras, los patrones y los controles.
Para las muestras de pelo se recomienda cortar un mechón del diámetro de un lápiz, de unos 0,5cm de largo, preferiblemente de la zona occipital, y lavar dicho mechón con 5ml de Triton X-100®, 10ml/l, mezclando durante 2 h. Después se enjuaga con agua desionizada varias veces y se añaden 3ml de EDTA-Na2 0,1mol/l, agitando durante 2 h. Se vuelve a enjuagar con agua desionizada y se seca hasta peso constante a 75°C en un horno. Unos 50mg (mínimo 20mg) de pelo se digieren con 1ml de H2O2 10mol/l a 65-70°C hasta sequedad (unas 8 h). Se repite el proceso otra vez. El residuo se disuelve en 1ml de HNO3 0,5mol/l durante 2 h a temperatura ambiente. Posteriormente, se añaden 4ml de agua desionizada. Existen otros métodos estandarizados de preparación de la muestra de pelo, como el de la Agencia Internacional de Energía Atómica58. Sería adecuada una dilución 1:10 del preparado junto con el diluyente (HNO3 suprapuro 10ml/l).
Preparación de patrones- a.
Suero: a partir de un patrón certificado de 1g/l de selenio (12,66 mmol/l), se prepara una disolución acuosa intermedia y, por diluciones seriadas, los patrones de la curva de calibración. También se pueden preparar a partir de una disolución intermedia procedente de un patrón comercial multielemento. Se recomienda que las concentraciones de la curva de calibración sean de 2.000μg/l (25,33μmol/l), 1.000μg/l (12,66μmol/l), 500μg/l (6,33μmol/l), 100μg/l (1,27μmol/l), 50μg/l (0,63μmol/l) y 25μg/l (0,32μmol/l). Los patrones deben prepararse en cada análisis y para cada serie analítica. Tanto las puntas de pipeta como las cubetas y los contenedores deben estar lavados previamente con ácido y enjuagados con agua desionizada.
- b.
Orina: se puede preparar una disolución acuosa intermedia, bien a partir de un patrón certificado de 1g/l de selenio (12,66 mmol/l) y por diluciones seriadas los patrones de la curva de calibración, o bien a partir de un patrón comercial multielemento. Se recomiendan concentraciones de 1000μg/l (12,66μmol/l), 500μg/l (6,33μmol/l), 100μg/l (1,27μmol/l) y 50μg/l (0,63μmol/l). Al igual que se ha descrito para suero, los patrones deben prepararse en cada análisis. Tanto las puntas de pipeta como las cubetas y los contenedores han de estar lavados previamente con ácido y enjuagados con agua desionizada.
- c.
Pelo: se puede preparar una disolución acuosa intermedia, bien a partir de un patrón certificado de 1g/l de selenio (12,66 mmol/l) y por diluciones seriadas los patrones de la curva de calibración, o bien a partir de una solución patrón multielemental. Serían recomendables concentraciones de 50μg/l (0,63μmol/l), 20μg/l (0,25μmol/l), 10μg/l (0,13μmol/l) y 2μg/l (0,03μmol/l). Los patrones han de prepararse en cada análisis. Tanto las puntas de pipeta como las cubetas y los contenedores han de estar lavados previamente con ácido y enjuagados con agua desionizada.
Los criterios de variabilidad biológica pueden aplicarse adecuadamente en el caso del selenio para establecer recomendaciones de calidad analítica.
Teniendo en cuenta que la variación biológica para el selenio intraindividual e interindividual es del 12 y el 14%, respectivamente59, las especificaciones deseables deben ser: el coeficiente de variación analítico inferior al 6,0%, el error sistemático inferior al 4,6% y el error analítico total inferior al 14,5%60.
Materiales de controlLa incorporación de materiales de referencia al proceso analítico es básica para la evaluación de la calidad. Los laboratorios deben utilizar, en su trabajo diario, controles de calidad internos con matriz similar a la de los especímenes (suero, sangre, orina, pelo) a fin de asegurar la fiabilidad de sus resultados. Por ello, para suero se recomiendan los controles Lyphocheck (Bio-Rad Laboratories, Inc., Irvine, California, Estados Unidos), Seronorm Trace Elements (SERO AS, Billingstad, Noruega), ClinCheck (Recipe, Múnich, Alemania) u otros similares.
En la matriz de orina se sugieren los siguientes: Lyphocheck Quantitative Urine (Bio-Rad), Seronorm Trace Elements Urine (Nycomed), ClinCheck (Recipe) u otros similares.
Programas de evaluación externa de la calidadEs conveniente la participación en programas de Garantía Externa de la Calidad de intercomparación de laboratorios, con el fin de asegurar la exactitud de sus resultados. Se trata, además de un requisito indispensable, exigido por la Entidad Nacional de Acreditación para todos aquellos laboratorios clínicos que pretendan acreditarse por la Norma UNE-EN ISO 15189:2013. En la actualidad, existen numerosos programas externos de evaluación de la calidad específicamente diseñados para elementos traza que incluyen el selenio.
La SEQCML participa en la organización del Programa de Garantía Externa de Calidad de la Occupational and Environmental Laboratory Medicine (OELM) en la que intervienen Australia, Francia, Italia, España, Bélgica y Holanda. Estos países comparten las muestras, la base de datos y el diseño de los informes con un enfoque federativo, aunque se mantienen como organizaciones independientes con sus propias inscripciones al programa, idioma, reuniones de usuarios y otros sistemas de soporte (http://www.trace-elements.eu). Las matrices que presentan son suero, sangre y orina.
Otros programas a destacar son: el UKNEQAS TEQAS de Surrey (Reino Unido), que cuenta con muestras de suero, sangre, orina y muestras sólidas, y el CTQ/INSPQ del Centre de Toxicologie du Québec (Canadá), que dispone de las matrices suero, sangre, orina y pelo.
Intervalos de referenciaLas concentraciones de selenio en matrices biológicas varían sustancialmente en sujetos sanos en función de su localización geográfica, debido fundamentalmente al diferente contenido de selenio en los suelos de las distintas áreas geográficas61 por lo que no es posible establecer valores de referencia universales. La concentración media de selenio en la población española es aproximadamente 74μg/l (0,94μmol/l)31, similar a la encontrada en la mayoría de países europeos pero inferior a la hallada en países como Estados Unidos, Canadá, Venezuela y Japón, probablemente debido a la mayor concentración de selenio en el suelo de estas áreas geográficas.
Diferentes países han mostrado un gran interés en establecer intervalos de referencia para elementos traza en población general, por lo que se han desarrollado estudios como el National Diet and Nutrition Surveys (NDNS) en Reino Unido, el estudio Supplémentation en Vitamines et Minéraux Antioxydants (SU.VI.MAX) en Francia, el National Health and Nutrition Examination Surveys (NHANES) en Estados Unidos o el proyecto European Trace Element Reference Values In Human Tissues (EUROTERVITH) en Europa. En ellos, se ha observado que las concentraciones de selenio en la población general difieren considerablemente entre distintos países62-67.
Asimismo, los niveles de selenio pueden verse influidos por el método empleado para su determinación y por el tipo de matriz biológica seleccionada. Existen estudios en los que se determina este elemento en sangre, plasma, suero, orina, pelo y uñas. Sin embargo, se ha señalado que las concentraciones de selenio en todas estas matrices están altamente correlacionadas68. Estas correlaciones facilitan la interpretación de la gran disparidad de estudios que utilizan matrices biológicas diferentes para determinar el estatus nutricional de selenio.
Algunos estudios encuentran diferencia significativa en los niveles de selenio sérico o plasmático entre sexos. La edad es una variable significativa por debajo de 20 y por encima de 60 años. Los niveles disminuyen durante los primeros meses de vida para después experimentar un aumento lento y constante hasta alcanzar los valores de la edad adulta. A partir de los 60 o 70 años, los niveles son menores69.
Las concentraciones de selenio en sangre total y eritrocitos son alrededor de un 15 y un 37% superiores a las del plasma, respectivamente18. En muestras de orina, la mayoría de las concentraciones descritas son inferiores a 30μg/l (0,38μmol/l), excepto en regiones seleníferas. En general, en orina no se superan los 100μg/l (1,27μmol/l).
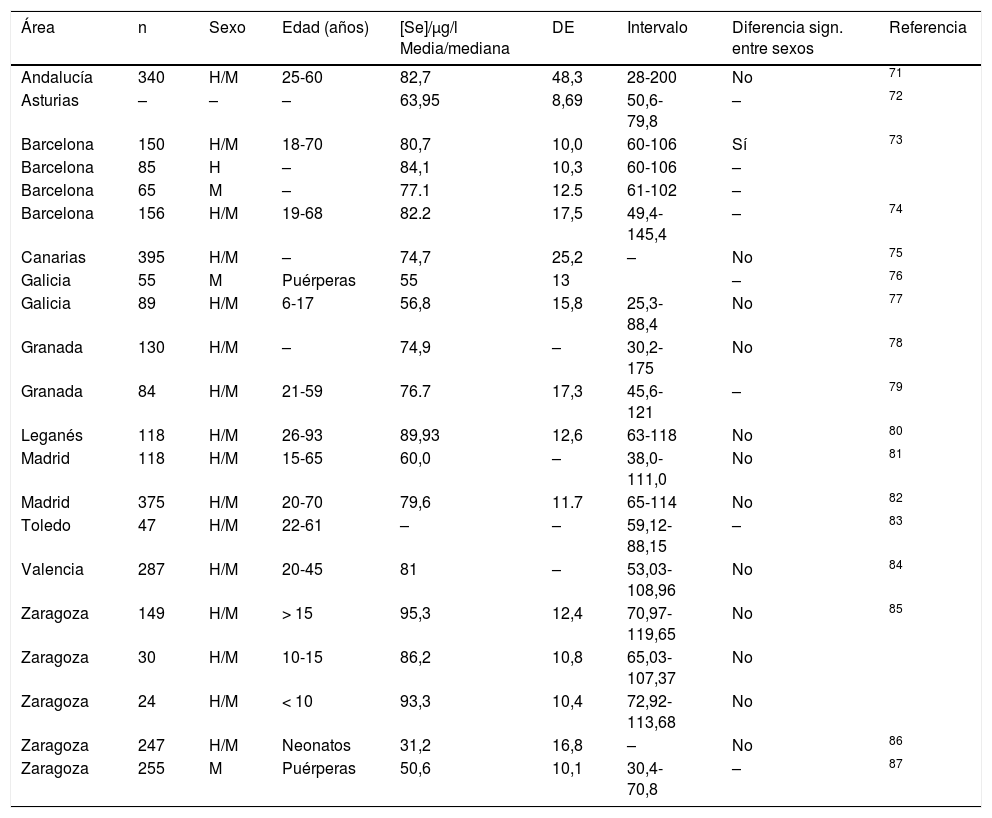
Niveles de selenio en población españolaSe han llevado a cabo numerosos estudios que ponen de manifiesto las diferentes concentraciones de selenio en suero/plasma en las distintas regiones geográficas de España (tabla 3). Los intervalos reflejados en la tabla han sido obtenidos en sujetos sanos. Estos datos deben ser únicamente orientativos, siendo necesario que cada laboratorio establezca sus propios valores de referencia para el selenio.
Valores de referencia de selenio en suero o plasma en distintas regiones españolas
| Área | n | Sexo | Edad (años) | [Se]/μg/l Media/mediana | DE | Intervalo | Diferencia sign. entre sexos | Referencia |
|---|---|---|---|---|---|---|---|---|
| Andalucía | 340 | H/M | 25-60 | 82,7 | 48,3 | 28-200 | No | 71 |
| Asturias | – | – | – | 63,95 | 8,69 | 50,6-79,8 | – | 72 |
| Barcelona | 150 | H/M | 18-70 | 80,7 | 10,0 | 60-106 | Sí | 73 |
| Barcelona | 85 | H | – | 84,1 | 10,3 | 60-106 | – | |
| Barcelona | 65 | M | – | 77.1 | 12.5 | 61-102 | – | |
| Barcelona | 156 | H/M | 19-68 | 82.2 | 17,5 | 49,4-145,4 | – | 74 |
| Canarias | 395 | H/M | – | 74,7 | 25,2 | – | No | 75 |
| Galicia | 55 | M | Puérperas | 55 | 13 | – | 76 | |
| Galicia | 89 | H/M | 6-17 | 56,8 | 15,8 | 25,3-88,4 | No | 77 |
| Granada | 130 | H/M | – | 74,9 | – | 30,2-175 | No | 78 |
| Granada | 84 | H/M | 21-59 | 76.7 | 17,3 | 45,6-121 | – | 79 |
| Leganés | 118 | H/M | 26-93 | 89,93 | 12,6 | 63-118 | No | 80 |
| Madrid | 118 | H/M | 15-65 | 60,0 | – | 38,0-111,0 | No | 81 |
| Madrid | 375 | H/M | 20-70 | 79,6 | 11.7 | 65-114 | No | 82 |
| Toledo | 47 | H/M | 22-61 | – | – | 59,12-88,15 | – | 83 |
| Valencia | 287 | H/M | 20-45 | 81 | – | 53,03-108,96 | No | 84 |
| Zaragoza | 149 | H/M | > 15 | 95,3 | 12,4 | 70,97-119,65 | No | 85 |
| Zaragoza | 30 | H/M | 10-15 | 86,2 | 10,8 | 65,03-107,37 | No | |
| Zaragoza | 24 | H/M | < 10 | 93,3 | 10,4 | 72,92-113,68 | No | |
| Zaragoza | 247 | H/M | Neonatos | 31,2 | 16,8 | – | No | 86 |
| Zaragoza | 255 | M | Puérperas | 50,6 | 10,1 | 30,4-70,8 | – | 87 |
Tabla modificada a partir de la establecida por López-Bellido Garrido y López-Bellido70.
Es destacada la importancia de establecer y revisar periódicamente los valores de referencia con el fin de garantizar y asegurar la calidad de los resultados ofrecidos, desde la Comisión de Elementos Traza se proponen, únicamente con una finalidad orientativa, como valores de referencia los siguientes:
- –
Suero/plasma: 65-120μg/l (0,83-1,52μmol/l).
- –
Sangre: 75-138μg/l (0,95-1,75μmol/l).
- –
Orina: < 35μg/día (< 0,44μmol/día).
Los autores declaran no tener ningún conflicto de intereses.
A. Anadón Ruiz, J.A. Cocho de Juan, P. Bermejo Barrera, M.J. Gaspar Blázquez, M.M. González Estecha, J. González Revaldería, S. Izquierdo Álvarez, M.T. Llorente Ballesteros, J.L. López Colón, I. Palazón Bru, E. Urrechaga Igartua, M. Jose Ariza Astolfi, Sonia Perez San Martín.