Streptococcus suis es un importante patógeno asociado con una amplia gama de enfermedades en cerdos, y constituye uno de los problemas más importantes de la industria porcina en todo el mundo.
Sin embargo, la infección por S.suis en humanos es poco frecuente y se considera una zoonosis inusual, ya que desde 1968 hasta 2004 solo se habían descrito alrededor de 250 casos en todo el mundo.
La aparición de algunos brotes muy extensos de infección por S.suis en Europa y Sudeste Asiático a partir del año 2005, y el aumento de la incidencia de casos en otros países europeos, ha hecho pensar que podemos encontrarnos ante un proceso de emergencia de estas infecciones.
S. suis es un coco grampositivo anaerobio facultativo perteneciente a los grupos R, S y T de Lancefield. Hasta hace poco ha habido importantes dificultades en la identificación y diferenciación de este microorganismo de otras especies de Streptococcus, lo que podría ser la causa de una infravaloración de estas infecciones. Actualmente se cuenta con herramientas de diagnóstico y tipificación molecular que permiten una mejor caracterización de los aislados.
La infección más frecuente por S.suis en humanos es la meningitis, pero se han descrito casos de endocarditis, neumonía, celulitis, rabdomiólisis, artritis, espondilodiscitis, absceso epidural, peritonitis, enteritis, endoftalmitis, uveítis, síndrome de shock tóxico estreptocócico, septicemia con shock séptico y fallo multiorgánico.
En nuestro país se han documentado menos de una veintena de casos de infección por S.suis, por lo que creemos de interés comunicar un nuevo caso de meningitis por S.suis.
Streptococcus suis is an important pathogen associated with a wide range of diseases in pigs, constituting one of the most important problems of the swine industry around the world.
However, infection with S.suis in humans is very rare and is considered an unusual zoonosis because from 1968 until 2004 had described only around 250 cases around the world.
The emergence of some very large outbreaks of infection with S.suis in Europe and Southeast Asia from the year 2005, and the increase in the incidence of cases in other European countries, has made to think that we can find about a process of emergence of these infections.
S.suis is a Gram-positive facultative anaerobic coccus, belonging to R, S, and T Lancefield groups. Until recently, there have been major difficulties in the identification and differentiation of this organism of other Streptococcus species, what could be the cause of an underestimation of these infections. It's currently with diagnostic tools and molecular typing that allow a better characterization of the isolates.
The most frequent S.suis in humans infection is meningitis, but endocarditis, pneumonia, cellulitis, rhabdomyolysis, arthritis, spondylodiscitis, abscess epidural, peritonitis, enteritis, endophthalmitis, uveitis, septicemia with septic shock and multiorgan failure streptococcal toxic shock syndrome have also been reported.
In our country less than 20 cases of S.suis infection have been documented, so we believe interest communicate a new case of S.suis meningitis.
Streptococcus suis es un importante patógeno asociado con una amplia gama de enfermedades en cerdos que puede ser trasmitido al hombre, dando lugar a múltiples cuadros clínicos, el más frecuente la meningitis.
La infección por S.suis ha sido establecida como enfermedad ocupacional desde 1987, estimándose que el riesgo de los trabajadores relacionados con ganado porcino es 1.500 veces mayor que en la población no relacionada1.
S. suis es la causa más prevalente de meningitis en Vietnam, la segunda en Tailandia y la tercera en Hong Kong2,3.
En nuestro país —hasta el momento de escribir este artículo— se han documentado menos de una veintena de casos de infección por S.suis, por lo que creemos de interés comunicar un nuevo caso de meningitis por S.suis.
Caso clínicoUn varón de 53 años de edad, esplenectomizado tras un accidente de tráfico hace 35años, acude al Servicio de Urgencias por un cuadro de cefalea, fiebre, escalofríos, odinofagia, dolores osteomusculares, hipoacusia bilateral e inestabilidad para la deambulación de 36h de evolución.
En la exploración inicial destaca una presión arterial de 162/83mmHg, temperatura de 39,2°C, signos meníngeos claramente positivos y el resto de la exploración normal. En la analítica sanguínea tan solo se observa leucocitosis (23.200cél/μl) con neutrofilia (96,3%) y una PCR de 500mg/l. El resto de los parámetros se encuentran dentro de la normalidad. Se realiza TAC craneal, que resulta normal, sin signos de hemorragia intracraneal ni lesiones focales intraparenquimatosas. Se extraen hemocultivos y se realiza una punción lumbar, obteniéndose un líquido cefalorraquídeo (LCR) de aspecto turbio y con presión elevada, con 1.116 leucocitos/μl (85% polimorfonucleares), proteínas 278mg/dl y glucosa 9mg/dl. En la tinción de Gram del LCR se observan abundantes leucocitos y cocos grampositivos en cadenas y en parejas, con aglutinación de antígenos capsulares bacterianos negativa. Ingresa en la unidad de cuidados intensivos por deterioro del nivel de conciencia. Con el diagnóstico de meningitis bacteriana se instaura tratamiento empírico con ceftriaxona 2g/12h i.v. y vancomicina 1g/12h i.v., junto con dexametasona 10mg/6h i.v.
Tras 24h de incubación, los cultivos del LCR y de los hemocultivos mostraron el crecimiento de cocos grampositivos, que formaban colonias grises y lisas, alfahemolíticas, de 0,5-1mm de diámetro, catalasa negativas, que aglutinaban con el grupoD de Lancefield, e identificadas como S.suis tipoii por el sistema VITEK2 (BioMérieuxS.A.). No se realizó serotipado de la cepa.
La cepa resultó sensible a penicilina, ampicilina, cefotaxima, ceftriaxona, vancomicina, levofloxacino, eritromicina y clindamicina, por lo que se suspende la vancomicina, manteniéndose la ceftriaxona durante 21días. La evolución clínica fue muy favorable, con rápida desaparición de la fiebre y de los signos meníngeos en pocas horas. No obstante, permanece con hipoacusia bilateral grave y pérdida de visión.
Al interrogar al paciente, este refiere contacto con cerdos y haberse hecho una herida en el dedo medio de la mano derecha mientras manipulaba los animales.
A las tres semanas del ingreso recibe el alta hospitalaria y se le prescribe tratamiento con cefuroxima 500mg/12h v.o. durante una semana más. Un mes después es valorado por el servicio de otorrinolaringología por su sordera, observándose una hipoacusia neurosensorial con pérdida media de 90dB en todas las frecuencias en el oído derecho, y ausencia total de audición para todas las frecuencias en el oído izquierdo. Así mismo, en la valoración del paciente por el servicio de oftalmología, al realizar el campo visual se objetivó una acentuada pérdida de sensibilidad generalizada, más acusada en el ojo izquierdo, de carácter irreversible y permanente.
DiscusiónS. suis es un importante patógeno asociado con una amplia gama de enfermedades en cerdos, incluyendo meningitis, septicemia, neumonía, endocarditis y artritis. S.suis puede ser transmitido a los humanos por contacto directo1.
Actualmente se ha convertido en una zoonosis grave y ha sido descrita en países en los que la cría de ganado porcino y el procesamiento de sus productos cárnicos constituyen una fuente importante de riqueza1,4.
El primer caso de infección por S.suis en humanos fue descrito en Dinamarca en 19685. Desde entonces se han publicado casos en Holanda y en otros países del norte de Europa6, Hong Kong, Singapur, Tailandia y otros países del Extremo Oriente1,4. Un brote de infección en Sichuan (China) en el año 2005 afectó a más de 200 personas con 38 muertes, enfatizando la importancia de S.suis como un patógeno causante de una zoonosis emergente7.
Desde el año 2005 se han documentado casos de infección por S.suis por todo el mundo, incluso en países donde nunca se habían descrito. Actualmente, la mayoría de los casos ocurren en el Sudeste Asiático, especialmente en Vietnam5.
EpidemiologíaS. suis se ha relacionado como causa de una gran variedad de manifestaciones clínicas en cerdos, y puede ser también encontrado en otros animales, como jabalíes, caballos, perros, gatos y pájaros1,8,9. En los cerdos, el hábitat natural de S.suis es el tracto respiratorio superior, especialmente las amígdalas y las fosas nasales, y el tracto genital y el tubo digestivo1,8-10. El cerdo puede ser portador asintomático o padecer enfermedad8. Los portadores asintomáticos representan una potencial fuente de infección para la manada así como para los humanos1.
Los factores predisponentes se dan en cerdos sometidos a condiciones subóptimas tanto higiénicas como nutricionales (suciedad, humedad, granjas poco ventiladas y comida o bebida contaminadas) y pueden agravarse bajo condiciones que causan estrés y la consiguiente inmunosupresión1.
La infección en los humanos se debe principalmente a contacto con cerdos portadores, cerdos enfermos o carne porcina cruda contaminada a través de heridas en la piel o bien de la mucosa oral y la cavidad nasal. Además de la vía cutánea se han descrito las vías respiratoria y digestiva11. De esta forma, la infección normalmente ocurre en personas cuyos trabajos están asociados a cerdos o a sus productos cárnicos, como granjeros, criadores de cerdos, personas que trabajan en mataderos o matarifes y veterinarios, considerándose en muchos países como una enfermedad ocupacional1,6,12. Se han descrito casos puntuales de infección en personas en contacto con pollos13 o en cazadores en contacto con jabalíes1. También se han descrito casos por ingerir carne de cerdo poco cocinada.
Las personas inmunodeprimidas, especialmente las esplenectomizadas, constituyen un grupo de riesgo importante14. También se han descrito como factores de riesgo la diabetes mellitus, el alcoholismo3 y las neoplasias2,8. Además, los pacientes con enfermedad cardiaca de base tienen una mayor predisposición a padecer endocarditis por este microorganismo2,8.
MicrobiologíaS. suis es un coco grampositivo anaerobio facultativo perteneciente al grupo R, S y T de Lancefield; es de forma esférica u ovoide y se dispone en parejas o en cadenas cortas9. Las colonias son pequeñas (0,5-1mm), grises o transparentes y ligeramente mucosas. Normalmente se muestran α-hemolíticos cuando crecen en agar sangre de cordero1,9. Se han identificado 35 serotipos en base a los polisacáridos capsulares (tipos 1-34 y 1/2). Entre estos serotipos capsulares, el serotipo2 es considerado el más virulento y es el más frecuentemente aislado en todo el mundo1,9. De forma puntual se han comunicado casos descritos por otros serotipos, como el 1, el 4, el 14 y el 16.
Se han llevado a cabo numerosos estudios que revelan ciertos mecanismos de patogenicidad de esta bacteria, describiéndose multitud de factores de virulencia, entre los que destacan el polisacárido capsular (CPS), la proteína suilisina (hemolisina SLY), el factor extracelular (extracellular protein factor [EPF]) y la muramidase-released protein (MRP), varias adhesinas, hyaluronate lyase y el antígeno de superficie115.
Manifestaciones clínicasLa infección más frecuente por S. suis en humanos es la meningitis purulenta (75-85% de los casos), pero se han descrito casos de endocarditis, neumonía, celulitis, rabdomiólisis, artritis, espondilodiscitis, absceso epidural, peritonitis, enteritis, endoftalmitis, uveítis, síndrome de shock tóxico estreptocócico (SSTS), septicemia con shock séptico y fallo multiorgánico, e incluso aneurismas micóticos1,2,8,9.
La presentación clínica de la meningitis por S.suis incluye fiebre alta, dolor de cabeza, escalofríos, náuseas, vómitos y vértigos, seguido de uno o más de los siguientes síntomas: pérdida de audición, ataxia, coma, rigidez de nuca, petequias, púrpura, equimosis, dolor articular, parálisis facial y periférica, mialgia severa y rabdomiólisis1,2. La meningitis por este microorganismo suele ir acompañada de bacteriemia, pudiendo dar lugar a complicaciones como insuficiencia renal aguda, síndrome de distrés respiratorio o coagulación intravascular diseminada (CID)2.
La mortalidad de esta meningitis es baja, del 7-9%, comparada con otras meningitis bacterianas, pero suelen producirse secuelas auditivas en el 40-60% de los casos5. La pérdida de audición es la secuela más importante tras una meningitis por S.suis, variando desde leve a moderada o grave, seguida de lesión vestibular (ataxia)1,2,11,16. Esta hipoacusia parece deberse a una laberintitis supurativa por invasión de S.suis a la perilinfa a través de la cóclea, donde liberaría ciertas exotoxinas4. Otras secuelas neurológicas son excepcionales, habiéndose descrito casos de paresias y parálisis de pares craneales, así como ceguera y diplopía17,18.
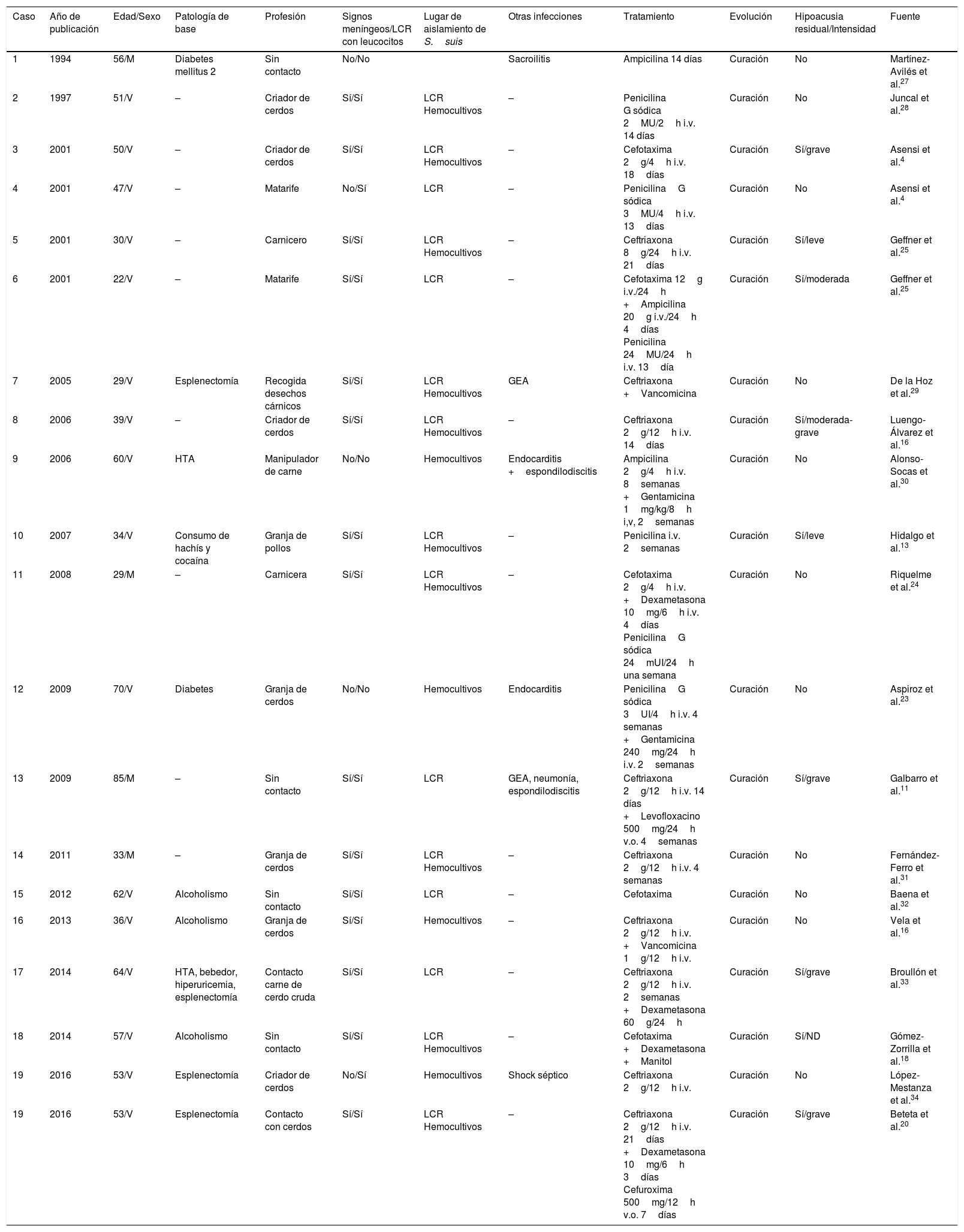
En la tabla 1 se describen las principales características de los casos publicados hasta la fecha en España.
Revisión de las principales características de los casos publicados en España y el ahora descrito
| Caso | Año de publicación | Edad/Sexo | Patología de base | Profesión | Signos meníngeos/LCR con leucocitos | Lugar de aislamiento de S.suis | Otras infecciones | Tratamiento | Evolución | Hipoacusia residual/Intensidad | Fuente |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 1994 | 56/M | Diabetes mellitus 2 | Sin contacto | No/No | Sacroilitis | Ampicilina 14 días | Curación | No | Martínez-Avilés et al.27 | |
| 2 | 1997 | 51/V | – | Criador de cerdos | Sí/Sí | LCR Hemocultivos | – | Penicilina G sódica 2MU/2h i.v. 14 días | Curación | No | Juncal et al.28 |
| 3 | 2001 | 50/V | – | Criador de cerdos | Sí/Sí | LCR Hemocultivos | – | Cefotaxima 2g/4h i.v. 18días | Curación | Sí/grave | Asensi et al.4 |
| 4 | 2001 | 47/V | – | Matarife | No/Sí | LCR | – | PenicilinaG sódica 3MU/4h i.v. 13días | Curación | No | Asensi et al.4 |
| 5 | 2001 | 30/V | – | Carnicero | Sí/Sí | LCR Hemocultivos | – | Ceftriaxona 8g/24h i.v. 21días | Curación | Sí/leve | Geffner et al.25 |
| 6 | 2001 | 22/V | – | Matarife | Sí/Sí | LCR | – | Cefotaxima 12g i.v./24h +Ampicilina 20g i.v./24h 4días Penicilina 24MU/24h i.v. 13día | Curación | Sí/moderada | Geffner et al.25 |
| 7 | 2005 | 29/V | Esplenectomía | Recogida desechos cárnicos | Sí/Sí | LCR Hemocultivos | GEA | Ceftriaxona +Vancomicina | Curación | No | De la Hoz et al.29 |
| 8 | 2006 | 39/V | – | Criador de cerdos | Sí/Sí | LCR Hemocultivos | – | Ceftriaxona 2g/12h i.v. 14días | Curación | Sí/moderada-grave | Luengo-Álvarez et al.16 |
| 9 | 2006 | 60/V | HTA | Manipulador de carne | No/No | Hemocultivos | Endocarditis +espondilodiscitis | Ampicilina 2g/4h i.v. 8semanas +Gentamicina 1mg/kg/8h i,v, 2semanas | Curación | No | Alonso-Socas et al.30 |
| 10 | 2007 | 34/V | Consumo de hachís y cocaína | Granja de pollos | Sí/Sí | LCR Hemocultivos | – | Penicilina i.v. 2semanas | Curación | Sí/leve | Hidalgo et al.13 |
| 11 | 2008 | 29/M | – | Carnicera | Sí/Sí | LCR Hemocultivos | – | Cefotaxima 2g/4h i.v. +Dexametasona 10mg/6h i.v. 4días PenicilinaG sódica 24mUI/24h una semana | Curación | No | Riquelme et al.24 |
| 12 | 2009 | 70/V | Diabetes | Granja de cerdos | No/No | Hemocultivos | Endocarditis | PenicilinaG sódica 3UI/4h i.v. 4 semanas +Gentamicina 240mg/24h i.v. 2semanas | Curación | No | Aspiroz et al.23 |
| 13 | 2009 | 85/M | – | Sin contacto | Sí/Sí | LCR | GEA, neumonía, espondilodiscitis | Ceftriaxona 2g/12h i.v. 14 días +Levofloxacino 500mg/24h v.o. 4semanas | Curación | Sí/grave | Galbarro et al.11 |
| 14 | 2011 | 33/M | – | Granja de cerdos | Sí/Sí | LCR Hemocultivos | – | Ceftriaxona 2g/12h i.v. 4 semanas | Curación | No | Fernández-Ferro et al.31 |
| 15 | 2012 | 62/V | Alcoholismo | Sin contacto | Sí/Sí | LCR | – | Cefotaxima | Curación | No | Baena et al.32 |
| 16 | 2013 | 36/V | Alcoholismo | Granja de cerdos | Sí/Sí | Hemocultivos | – | Ceftriaxona 2g/12h i.v. +Vancomicina 1g/12h i.v. | Curación | No | Vela et al.16 |
| 17 | 2014 | 64/V | HTA, bebedor, hiperuricemia, esplenectomía | Contacto carne de cerdo cruda | Sí/Sí | LCR | – | Ceftriaxona 2g/12h i.v. 2semanas +Dexametasona 60g/24h | Curación | Sí/grave | Broullón et al.33 |
| 18 | 2014 | 57/V | Alcoholismo | Sin contacto | Sí/Sí | LCR Hemocultivos | – | Cefotaxima +Dexametasona +Manitol | Curación | Sí/ND | Gómez-Zorrilla et al.18 |
| 19 | 2016 | 53/V | Esplenectomía | Criador de cerdos | No/Sí | Hemocultivos | Shock séptico | Ceftriaxona 2g/12h i.v. | Curación | No | López-Mestanza et al.34 |
| 19 | 2016 | 53/V | Esplenectomía | Contacto con cerdos | Sí/Sí | LCR Hemocultivos | – | Ceftriaxona 2g/12h i.v. 21días +Dexametasona 10mg/6h 3días Cefuroxima 500mg/12h v.o. 7días | Curación | Sí/grave | Beteta et al.20 |
La identificación de S. suis se puede llevar a cabo mediante pruebas bioquímicas, como catalasa negativa, resistencia a optoquina, Voges-Proskauer negativo, fermentación de la salicina, trehalosa positiva y ausencia de crecimiento en 6,5% de cloruro sódico1,2. Existen sistemas comerciales, como el API Strep® o el VITEK2® (BioMérieux). Sin embargo, las características bioquímicas son variables, haciendo difícil su identificación, lo que puede requerir la confirmación del serotipo según el antígeno polisacárido capsular.
Así, S. suis puede ser subdiagnosticado o identificado erróneamente como otras especies de Streptococcus α-hemolíticos, como Streptococcus del grupo viridans, Enterococcus spp., Aerococcus viridans o incluso Streptococcus penumoniae.
A lo largo de los años noventa se han desarrollado diferentes métodos serológicos que han permitido su identificación, pero con resultados variables. Entre estos métodos se encuentran la inmunocaptura, técnicas basadas en anticuerpos fluorescentes y ELISA indirectos frente a diferentes antígenos de S.suis1,19.
Actualmente S. suis se puede identificar con una excelente sensibilidad y especificidad mediante técnicas moleculares como PCR específica para S.suis serotipo2, o bien PCR seguida de secuenciación del ARN ribosómico16S20.
En los últimos años, la espectrometría de masas (Matrix-Assisted Desorption Ionization Time-of-Flight [MALDI-TOF]) se ha mostrado como una herramienta fiable, rápida y coste-efectiva, así como un recurso valioso para la identificación de S.suis21.
Por otra parte, existen diferentes métodos moleculares para estudiar la diversidad genética entre las distintas cepas de S.suis, así como la patogenicidad de determinados clones. Entre estas técnicas se encuentran el Restriction Fragment Length Polymorphism (RFLP), la huella genética (genome fingerprintig), la electroforesis en gel de campo pulsado (PFGE) y el Multilocus Sequence Typing (MLST)1.
TratamientoPara determinar la sensibilidad de S.suis se deben seguir las recomendaciones del Clinical and Laboratory Standards Institute (CLSI) en su documento M100-S18, bien por el método de difusión en disco, por microdilución o bien mediante E-test. Actualmente no hay establecidos puntos de corte específicos para S.suis, con lo que se deben utilizar los puntos de corte de Streptococcus del grupo viridans22.
S. suis en general es sensible a la mayoría de los antibióticos, incluidos penicilina, ampicilina, amoxicilina, cefalosporinas y ceftriaxona, aunque se han descrito cepas resistentes a penicilinaG1,8. Se ha documentado la resistencia a ofloxacino8 y tetraciclinas23, y se ha demostrado que la resistencia a macrólidos, lincosamidas y estreptograminaB (fenotipo MLSB) está mediada por la metilación ribosómica y codificada por el gen ermB8,23.
La base del tratamiento de la meningitis por S.suis es la misma que para otras meningitis bacterianas. La penicilina G es el tratamiento de elección de la meningitis por S.suis24, y ha sido utilizada por numerosos autores sola o acompañada de otros antibióticos, como ceftriaxona, gentamicina, cloranfenicol o ampicilina1.
El uso de dexametasona como tratamiento coadyuvante para reducir la mortalidad continúa siendo controvertido2. No obstante, numerosos autores creen que los corticoides podrían reducir las secuelas neurológicas en las meningitis por S.suis25,26, aunque no existen evidencias que recomienden su uso16.
Prevención y controlDebido a que la principal vía de transmisión a los hombres son los cerdos enfermos, la prevención de dicha transmisión depende del control de estos animales enfermos. Se han desarrollado varios tipos de vacunas para cerdos, que confieren diferentes grados de protección. La mejora en las condiciones higiénicas de los cerdos, así como su vacunación, son medidas efectivas para disminuir la infección por S.suis en cerdos y, por consiguiente, en humanos1.
La educación y la formación a aquellas personas que trabajan con cerdos o sus productos es fundamental. Así, deben usar guantes cuando manipulan estos animales o sus derivados, así como proceder al lavado posterior de manos. Además, la carne de cerdo debe ser bien cocinada, alcanzando una temperatura interna mínima de 70°C1.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.