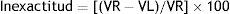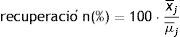El mercurio es un tóxico ambiental que produce numerosos efectos adversos en la salud humana y en los ecosistemas naturales. La ingesta excesiva de metilmercurio procedente del pescado contaminado produce toxicidad neurológica, reproductiva y cardiovascular.
El objetivo de este estudio es validar un método para la medida de mercurio en sangre mediante espectroscopía de absorción atómica con descomposición térmica y amalgamación.
Los límites de detección y cuantificación fueron de 0,103μg/L y 0,313μg/L, respectivamente. La sensibilidad analítica encontrada fue de 12080μAbs/ng Hg. La curva de calibración es lineal entre 0 y 100μg/L. La pendiente obtenida con adiciones estándar de mercurio está incluida dentro del intervalo de confianza de la curva de calibración con patrones acuosos, por tanto no hay efecto matriz. Se comprobó la exactitud y precisión empleando material de referencia Seronorm® Trace Elements Whole Blood. La recuperación media obtenida fue de 97,36%.
El método propuesto se considera sensible, robusto, exacto y preciso para biomonitorizar la concentración de mercurio en sangre como indicador de riesgo para la salud.
Mercury is an environmental toxicant that causes numerous adverse effects in human health and natural ecosystems. The excessive methyl-mercury intake due to consumption of contaminated fish leads to neurological, reproductive and cardiovascular toxicity.
The aim of this study is to validate a method for measuring mercury in blood samples by thermal decomposition, amalgamation and atomic absorption spectrometry.
The detection and quantification limits were 0.103 y 0.313μg/L, respectively. The analytical sensitivity was 12080μAbs/ng Hg. The calibration curve is linear between 0 and 100μg/L. The slope of the standard addition curve is within the confidence interval of the calibration curve using aqueous standards, meaning that there is no matrix effect. The precision and accuracy were tested using Seronorm® Trace Elements Whole Blood reference material. The mean recovery was 97.36%
The proposed method shows to be sensitive, robust, accurate, and precise for biomonitoring the concentration of mercury in blood samples as an indicator of health risk.
El mercurio se puede encontrar en tres estados de oxidación: Hg0 (metálico), Hg+ (mercurioso) y Hg2+ (mercúrico). Las formas mercuriosa y mercúrica pueden formar numerosos compuestos inorgánicos y orgánicos1.
El mercurio es un tóxico ambiental que provoca gran cantidad de efectos adversos tanto en la salud humana como en los ecosistemas naturales. Este elemento contamina el medioambiente a través de erupciones volcánicas, cementeras, minería, combustión de fósiles entre otras, y a partir de depósitos creados por emisiones naturales y antropogénicas, que nuevamente pasan a la atmósfera introduciéndose en los ciclos biológicos2.
La mayor parte de Hg elemental se evapora y permanece en la atmósfera donde reacciona con el ozono y otros oxidantes para formar compuestos iónicos, bastante solubles, que acaban depositándose en la tierra o en el agua con la lluvia o la nieve. El mercurio, una vez depositado, se transforma en metilmercurio por la acción de determinadas bacterias sulfato reductoras y se bioacumula en los organismos acuáticos incorporándose en la cadena trófica de alimentos3.
Las fuentes de exposición principales a mercurio en la población general son el consumo de pescado y otros productos marinos, las amalgamas dentales y algunas vacunas4.
El mercurio y sus compuestos son especialmente tóxicos para el sistema nervioso, riñones y sistema cardiovascular. Otros sistemas que pueden verse afectados son el sistema respiratorio, gastrointestinal, hematológico, y reproductivo4.
Todos los seres humanos estamos expuestos a bajos niveles de mercurio. Los factores que determinan la aparición de efectos adversos y su severidad son: forma química del mercurio, dosis, edad, duración de la exposición, ruta de exposición y el hábito dietético de consumo de pescado y marisco.
En la sangre, el mercurio derivado de las sales de mercurio inorgánico se distribuye igualmente entre las proteínas plasmáticas y hematíes, mientras que el mercurio derivado de los organomercuriales se fija especialmente en los hematíes5, principalmente en los grupos SH de la hemoglobina. Por tanto, la sangre es un buen marcador biológico para evaluar la exposición al metilmercurio procedente principalmente de la ingesta de pescado contaminado6.
El análisis de mercurio se ha realizado principalmente mediante espectroscopía de absorción atómica con vapor frío con inyección de flujo, y más recientemente, por espectrometría de masas con fuente de plasma de acoplamiento inductivo (ICP-MS). Sin embargo, estos métodos presentan algunas limitaciones como la dilución y la digestión de la muestra. Existe la posibilidad de realizar análisis de Hg directos, tanto de muestras sólidas como líquidas, mediante analizadores de mercurio que se basan en una descomposición térmica, amalgamación y medida por espectroscopía de absorción atómica. En los Estados Unidos, la Agencia de Protección Ambiental desarrolló el método 7473 para medir mercurio en líquidos y sólidos mediante descomposición térmica, amalgamación y espectroscopía de absorción atómica, señalando la gran ventaja de evitar el pretratamiento de la muestra y posibles pérdidas de Hg con el consiguiente ahorro de tiempo y costes7.
La necesidad de obtener un método para la determinación de este metal se debe al reciente aumento de la demanda de solicitudes en las determinaciones de mercurio en los laboratorios clínicos. Por lo que la disposición de un método simple de absorción atómica con descomposición térmica y amalgamación para su medida es una gran ventaja para este tipo de laboratorios.
El objeto del presente trabajo es describir la metodología a seguir para la validación de un método directo desarrollado por el propio laboratorio para la determinación de mercurio en sangre por espectroscopía de absorción atómica con descomposición térmica y amalgamación aplicable a los laboratorios clínicos.
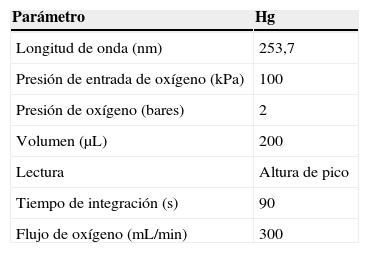
Material y métodosInstrumentaciónPara el análisis de mercurio se utilizó un espectrómetro de absorción atómica con descomposición térmica y amalgamación SMS 100 Perkin Elmer. Se usó una celda de 250mm y una lámpara de mercurio como fuente de alimentación.
ReactivosPara la construcción de la curva de calibrado se emplearon disoluciones estándares de mercurio. La calibración se realizó a partir de una disolución madre de mercurio (Perkin Elmer), cuyo valor de referencia es 1g/L. Las disoluciones patrón se prepararon por diluciones sucesivas de la disolución madre con agua bidestilada libre de metales de Versylene Fresenius.
Los reactivos químicos utilizados son de alta pureza, específicos para el análisis de elementos traza y con un certificado de pureza en el que figura la concentración que contienen de otros elementos.
Los reactivos utilizados para la determinación de mercurio en sangre fueron los siguientes:
- •
Ácido nítrico Suprapur de Merck (65%).
- •
Agua destilada exenta de metales Versylene Fresenius.
Antes de la utilización del material de vidrio, este se limpió por inmersión en ácido nítrico al 10% (v/v) durante 24 horas. Tras dicho lavado se enjuagó el material con agua bidestilada libre de metales.
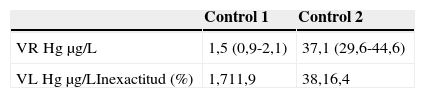
Material de referenciaLas muestras de referencia en sangre (dos niveles refs. 210105 y 210305), cuyos valores de referencia son 1,50 y 37,1μg/L, respectivamente, se facilitaron por Seronorm (Billingstad, Noruega). Este material de referencia se encontraba liofilizado y se reconstituyó mediante la adición de 3mL de agua bidestilada.
Material biológicoLa extracción sanguínea se realizó en ayunas a primera hora de la mañana con método desechable obteniéndose un tubo de sangre anticoagulada con EDTA-K3 para la medición de mercurio de Beckton Dickinson (BD Vacutainer® K3E 7.2mg, ref. 368860; 4,0mL). La localización de la punción venosa se limpió con clorhexidina, un antiséptico con función bactericida y fungicida.
Curva de calibraciónExiste controversia si la calibración debe realizarse con patrones acuosos o con material de referencia. En un trabajo reciente de Herbello-Hermello et al. se recomienda el uso de distintas cantidades de material de referencia con matrices similares a la muestra. Sin embargo, en el método que se describe se utilizaron patrones acuosos, teniendo en cuenta que, tanto la preparación como la medida de los patrones acuosos, se realizó en el momento del análisis, ya que de lo contrario se producirían pérdidas en la concentración de mercurio al evaporarse con el transcurso del tiempo8.
Las concentraciones de la curva de calibración fueron de 25,50 y 100μg/L. No fue necesaria la realización de un pretratamiento de la muestra.
El blanco de la curva de calibración se realizó empleando agua bidestilada libre de metales.
Análisis por espectroscopía de absorción atómica con descomposición térmica y amalgamaciónLas condiciones instrumentales empleadas en el análisis de mercurio se esquematizan en la tabla 1.
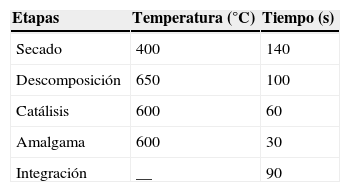
Con el fin de conseguir la mayor sensibilidad analítica posible, se utilizaron unas condiciones analíticas optimizadas (tabla 2), que comienzan por una etapa de secado a 400°C para evaporar el agua de la muestra. Posteriormente se realizó un calentamiento a 650°C en un horno rico en oxígeno con el fin de liberar todos los productos de descomposición, incluido el mercurio. A continuación dichos productos son transportados por una corriente de oxígeno a la sección catalítica del horno, donde cualquier halógeno u óxido de nitrógeno o azufre queda retenido en el catalizador a una temperatura de 600°C. Por último, el vapor restante es transportado a la célula de amalgamación, la cual atrapa selectivamente el mercurio. Dicha célula se calentó rápidamente a 600°C liberando vapor de mercurio, el cual se transporta por una corriente de oxígeno hasta la celda de absorción, donde se realizó la lectura9.
Validación del método analíticoLos parámetros característicos del método analítico se determinaron por medidas de blancos y disoluciones estándar a diferentes concentraciones. Para validar este método se determinaron los siguientes parámetros: límite de detección y cuantificación, rango de linealidad, masa característica, especificidad y exactitud, recuperación y estudio de precisión10.
Para la determinación del límite de detección se analizaron 30 blancos acuosos y se tomó como valor del mismo el triple de la relación entre la desviación típica de las absorbancias de los blancos y la pendiente de la calibración acuosa. El límite de cuantificación se calculó como diez veces la relación antes mencionada.
Con objeto de comprobar la linealidad del procedimiento, se realizó una curva de calibración con patrones acuosos de 3 puntos, con concentraciones desde 25 hasta 100μg/L.
La sensibilidad se define como el cambio en la respuesta de un sistema de medida o instrumento dividido por el correspondiente cambio en el estímulo (modificado de VIM93)10.
Para verificar la ausencia de interferencias provocadas por la matriz se empleó el método de adiciones estándar sobre varias mezclas de muestras reales. En este caso se realizó una curva de calibración por el método de las adiciones estándar, adicionando a un pool de sangre cantidades de mercurio necesarias para alcanzar una concentración final de aproximadamente 12,5; 25; 50 y 100μg/L.
Para determinar la exactitud del método se determinó la veracidad (expresada en términos de inexactitud), el estudio de recuperación y la precisión.
La veracidad se expresó en términos de sesgo o inexactitud (bias) y se calculó hallando la diferencia entre la media aritmética de las concentraciones halladas y el valor de referencia aceptado11.
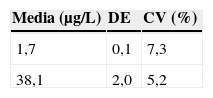
Para evaluar la inexactitud del método se analizaron 2 controles internos (mencionados en el apartado 2.3.) con concentraciones crecientes de mercurio durante 10 días diferentes realizando todos los días una calibración diferente y se aplicó la fórmula:
Donde VR y VL son el valor de referencia y el valor de laboratorio, respectivamente.Para el estudio de recuperación se añadió a una muestra de concentración conocida diferentes cantidades de estándar y se halló la diferencia entre la muestra analizada sin la adición de estándar y las muestras a las que se añadió estándar.
Para estimar el sesgo expresado en términos de recuperación se calculó la media teórica que tendría que dar dependiendo de la cantidad de estándar añadida y se aplicó la fórmula siguiente:
Las concentraciones empleadas para el cálculo de la recuperación fueron de 12,5; 25; 50 y 100μg/L.
La precisión puede considerarse a tres niveles: repetibilidad, precisión intermedia y reproducibilidad.
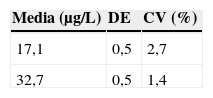
La repetibilidad se obtuvo analizando dos pools de sangre 10 veces, mientras que la precisión intermedia se halló analizando durante 10 días dos controles de calidad internos (mencionados en el apartado 2.3.).
ResultadosLos límites de detección y cuantificación fueron de 0,103 y 0,313μg/L, respectivamente.
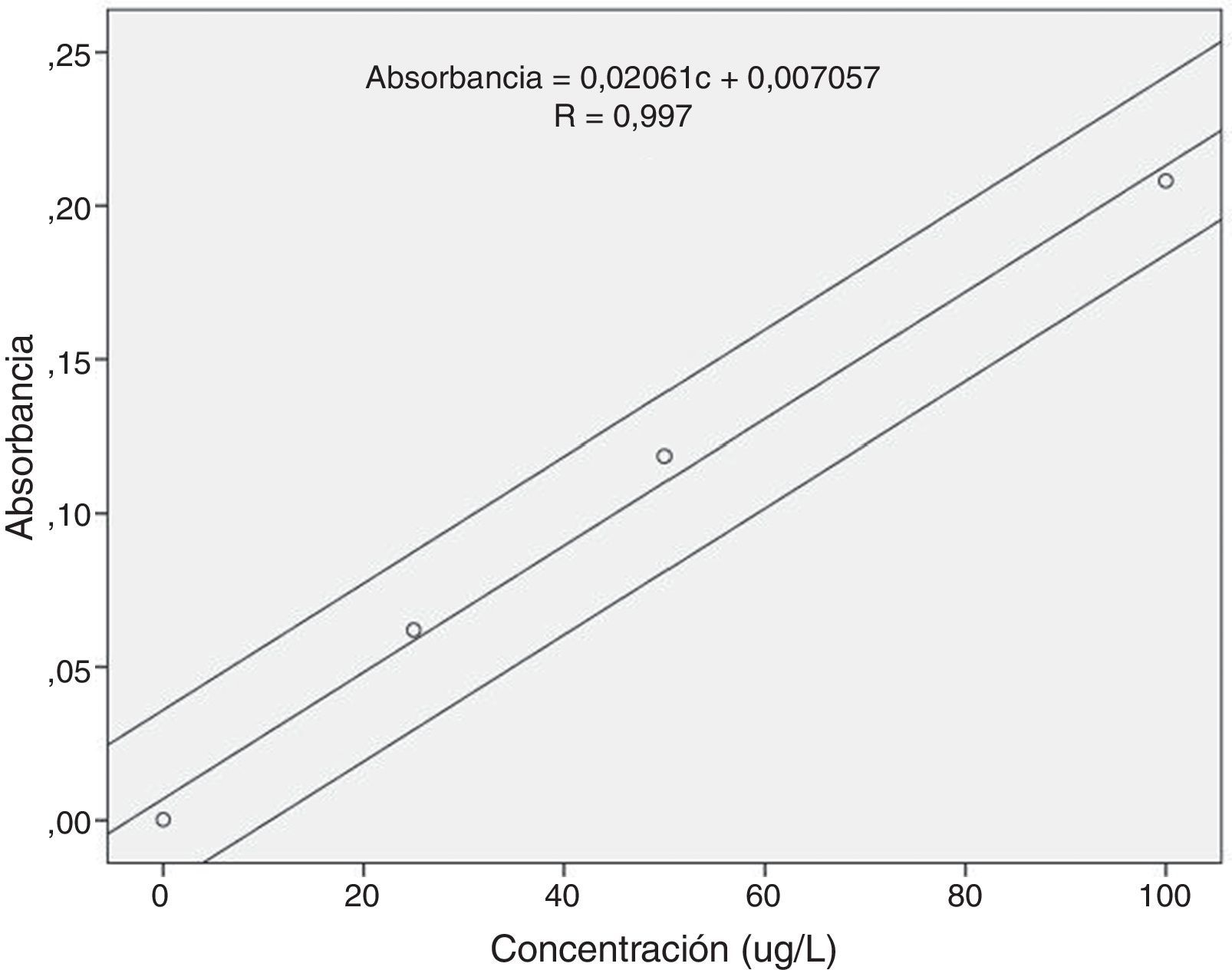
La curva de calibración con patrones acuosos de 3 puntos se observa en la figura 1. El coeficiente de variación de los factores de respuesta, relación entre la absorbancia y la concentración, fue próxima al 5% (5,80%), por lo que la calibración entre 0 y 100μg/L se puede considerar lineal. Además, se puede considerar que la recta de regresión pasa por el origen al estar incluido este valor dentro del intervalo de confianza al 95% del valor de la ordenada en el origen (b=-0,022- 0,036). El coeficiente de correlación al cuadrado de la recta de regresión fue 0,993.
La sensibilidad obtenida fue de 12080μAbs/ng Hg, que se encontró dentro del intervalo establecido por el fabricante: 8000 - 20000μAbs/ng Hg.
La pendiente de la recta de regresión de las adiciones estándar (0,001962 abs·L/μg), cuyo coeficiente de correlación al cuadrado fue 0,999, está incluida dentro del límite de confianza al 95% de la pendiente de la regresión de la curva de calibración realizada con los patrones acuosos (0,001546–0,002577 abs·L/μg), por lo que podemos afirmar que no existe efecto matriz y que se pueden utilizar patrones acuosos para obtener la curva de calibración.
Los resultados obtenidos para evaluar la inexactitud se recogen en la tabla 3.
Se halló una recuperación media de un 97,36%.
Los resultados referentes a la repetibilidad se observan en la tabla 4, mientras que los correspondientes a la precisión intermedia se recogen en la tabla 5.
El método evaluado es lineal en las concentraciones estudiadas, que comprenden desde 0μg/L hasta 100μg/L.
Debido a la existencia de estudios que indican que los efectos beneficiosos de los ácidos grasos omega 3 de cadena larga presentes en el pescado podían haber conducido a una infraestimación de los efectos adversos potenciales del metilmercurio del pescado, se estableció como límite aceptable una concentración total de mercurio en sangre de 6,4μg/L12. Por ello, los resultados obtenidos en cuanto a sensibilidad, límite de detección y límite de cuantificación, nos indican que se trata de un método muy sensible incluso para muestras con concentraciones sanguíneas de mercurio muy bajas.
Es un procedimiento preciso y exacto utilizando material de referencia así como muestras biológicas de sangre.
Es de destacar tanto la rapidez del análisis (tabla 2) como la ausencia de efecto matriz, lo que hace posible el análisis directo de las muestras de sangre evitando cualquier procedimiento de digestión de la muestra y, por tanto, evitando también contaminaciones o pérdidas de mercurio.
Por todo lo anterior, se considera que el método evaluado es eficaz para el análisis de mercurio en sangre, lo que resulta de gran interés para los laboratorios clínicos para biomonitorizar la concentración de metilmercurio en muestras biológicas como indicador de riesgo para la salud humana, ya que dicho compuesto en población general puede producir efectos tóxicos, especialmente para el sistema nervioso, riñones y sistema cardiovascular.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.