Este documento describe las causas de error más frecuentes en la medición de marcadores tumorales séricos proteicos en sus diferentes fases: preanalítica, analítica y postanalítica y recomendaciones para detectar y solventar problemas, así como la interpretación de los resultados de los marcadores tumorales en la práctica clínica.
This document describes the most frequent causes of error in the measurement of 13 serum protein tumour markers in their different phases: preanalytical, analytical and 14 postanalytic and recommendations to detect and solve problems, as well as the 15 interpretation of the results of the Tumor Markers in clinical practice.
Los marcadores tumorales (MT) son un grupo heterogéneo de moléculas de características muy variadas, producidas o inducidas por las células neoplásicas que reflejan su crecimiento y actividad, y que permiten conocer la presencia, evolución o respuesta terapéutica de un tumor maligno.
La medida de su concentración en el plasma o en otros líquidos biológicos ofrece información de utilidad clínica en enfermedades oncológicas en lo que se refiere a la detección precoz, diagnóstico, pronóstico, diagnóstico precoz de recidivas, seguimiento y monitorización del tratamiento1.
Los pacientes a los que se les determinan los MT son muy vulnerables psicológicamente ante las implicaciones clínicas relacionadas con cambios de las expectativas de supervivencia, efectos sobre la calidad de vida y posibles efectos secundarios de los tratamientos de esta enfermedad, pudiendo generar un gran estrés. Estas particularidades hacen que la repercusión de un error tenga una gran relevancia tanto en el coste sanitario como en el bienestar del paciente.
Muchas son las causas que pueden conducir a errores en todas las fases del proceso, desde la preparación del paciente a la interpretación del resultado. En este documento se describen las principales causas de error y las posibles herramientas para detectarlas y evitarlas.
Objeto y campo de aplicaciónEl objetivo de este documento es describir las causas de error más frecuentes de las mediciones de MT séricos proteicos en sus diferentes fases: preanalítica, analítica y postanalítica, de cara a emitir recomendaciones para su detección y para aplicar los criterios de interpretación de resultados de los MT séricos proteicos utilizados habitualmente en la práctica clínica, así como se establecen recomendaciones para los requerimientos técnicos de los equipos de medición.
Este documento es de aplicación en los laboratorios clínicos para interpretación de los MT en los distintos escenarios clínicos: detección precoz, ayuda al diagnóstico, pronóstico, diferenciación de tipo histológico, detección precoz de recidivas y control evolutivo de la enfermedad.
Criterios para optimizar el uso de los marcadores tumoralesPara mejorar el uso de los MT es necesario conocer tanto las causas metodológicas (características del equipo de medición, anticuerpos heterófilos, condiciones de la muestra, etc.) que pueden alterar la medición de su concentración como las condiciones fisiológicas y fisiopatológicas (enfermedades que pueden modificar las condiciones de los MT en ausencia de neoplasia, fármacos, radiación, etc.) que puedan modificarla en los fluidos biológicos2–5.
El conocimiento de los procedimientos para detectar, corregir e informar de las fuentes de error permite una interpretación correcta de los resultados, evitando falsos positivos y negativos, aumentado la sensibilidad y la especificidad de los MT. Estas fuentes de error pueden ser clasificadas en:
- •
Metodológicas.
- •
Características del equipo de medición (especificidad analítica).
- •
Anticuerpos heterófilos.
- •
Condiciones de la muestra (hemólisis, temperatura de almacenamiento, etc.).
- •
Fisiológicas y fisiopatológicas.
- •
Enfermedades que pueden modificar la concentración de los MT en ausencia de neoplasia.
- •
Iatrogénicas (fármacos, radiación, etc.).
Estas condiciones también pueden ser clasificadas siguiendo el proceso analítico en preanalíticas, analíticas y postanalíticas.
Fase preanalíticaTal como sucede en otras determinaciones de laboratorio, la mayoría de los errores preanalíticos encontrados en los MT están relacionados con la calidad de la muestra, como por ejemplo sucede con las muestras hemolizadas que incrementan la enolasa neuronal específica (NSE por su acrónimo en inglés). El tiempo de demora excesivo entre la extracción y centrifugación disminuye la concentración de la NSE, del antígeno prostático específico libre (PSAL) y del propéptido liberador de gastrina (ProGRP de su acrónimo en inglés). Un volumen de muestra insuficiente, la incorrecta identificación del paciente o de la alícuota o los errores en la introducción de los datos, así como el estado fisiopatológico del paciente, son otras causas generales que originan errores preanalíticos4,6.
Condiciones del pacienteEn algunas ocasiones las condiciones fisiológicas pueden ser previstas antes de la obtención de la muestra, tales como la fase del ciclo ovárico. En pacientes con endometriosis las variaciones en la concentración de antígeno carbohidrato 125 (CA125) durante el ciclo ovárico presenta una mayor amplitud de medida que en mujeres sanas. Más del 25% de las pacientes con endometriosis presenta en fase folicular valores superiores a 2 veces el límite superior de referencia, mientras que en la fase luteínica este porcentaje se sitúa en el 10%, mostrando en ambos casos diferencias significativas. Sin embargo, en mujeres sanas no se hallaron diferencias de concentraciones de CA125 en las distintas fases del ciclo7.
Otro MT que se ve afectado por las condiciones preanalíticas del paciente es el PSA. El tacto rectal8 y especialmente el masaje prostático —maniobra necesaria para la obtención de la orina para la determinación de las amplificaciones del ARNm del gen 3 del cáncer prostático (PCA3)— pueden incrementar su concentración, siendo recomendable realizar la extracción antes de dichas exploraciones o manipulaciones9.
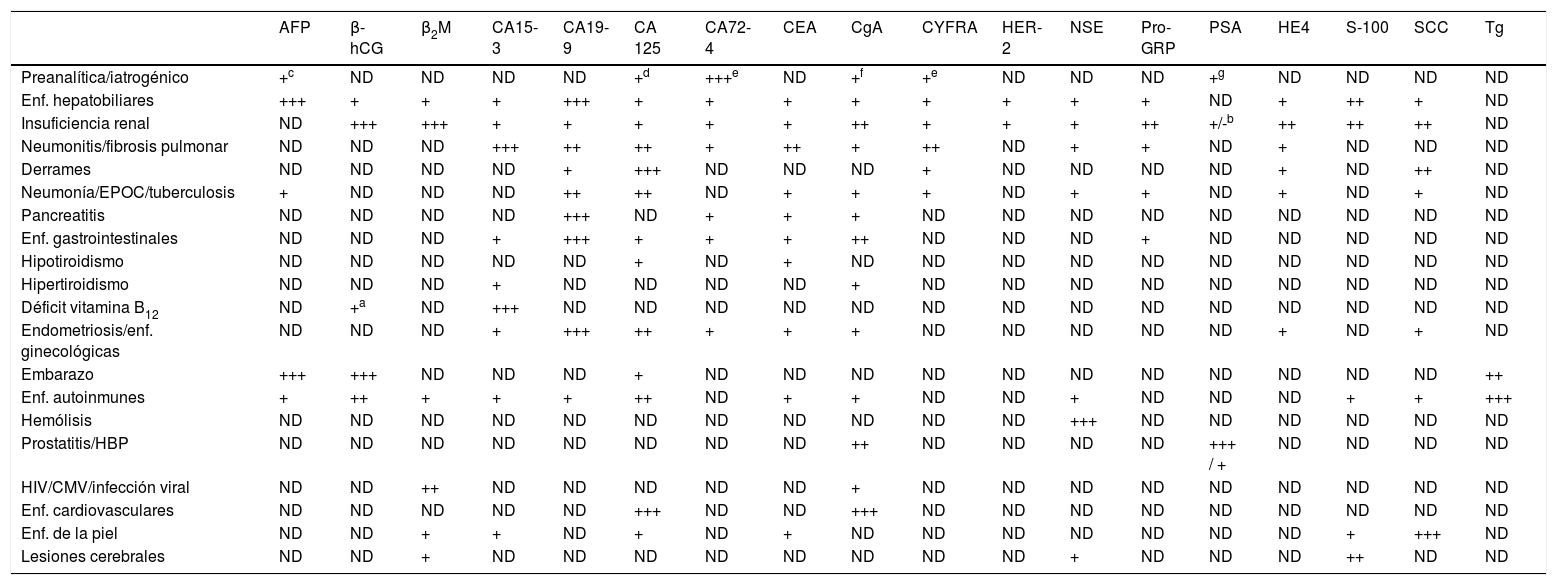
El consumo de fármacos puede afectar a los niveles de algunos MT. Así, los inhibidores de la bomba de protones (omeprazol) incrementan la concentración de cromogranina A10, los antiinflamatorios no esteroideos, los corticoides y la colchicina pueden alterar las concentraciones de antígeno carbohidrato 72-4, y en mucha menor medida las concentraciones de los fragmentos solubles de citoqueratina 19 (CYFRA21-1)11. Debido a ello sería aconsejable suspender el tratamiento antes de su determinación si el estado del paciente lo permite. En caso contrario, el resultado debería ir acompañado de un comentario que indique esta posibilidad de falso positivo debido a estos fármacos. En la tabla 1 se muestran las principales causas de falsos positivos ocasionados en la fase preanalítica.
Principales causas de elevación de la concentración de marcadores tumorales en ausencia de neoplasia
| AFP | β-hCG | β2M | CA15-3 | CA19-9 | CA 125 | CA72-4 | CEA | CgA | CYFRA | HER-2 | NSE | Pro-GRP | PSA | HE4 | S-100 | SCC | Tg | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Preanalítica/iatrogénico | +c | ND | ND | ND | ND | +d | +++e | ND | +f | +e | ND | ND | ND | +g | ND | ND | ND | ND |
| Enf. hepatobiliares | +++ | + | + | + | +++ | + | + | + | + | + | + | + | + | ND | + | ++ | + | ND |
| Insuficiencia renal | ND | +++ | +++ | + | + | + | + | + | ++ | + | + | + | ++ | +/-b | ++ | ++ | ++ | ND |
| Neumonitis/fibrosis pulmonar | ND | ND | ND | +++ | ++ | ++ | + | ++ | + | ++ | ND | + | + | ND | + | ND | ND | ND |
| Derrames | ND | ND | ND | ND | + | +++ | ND | ND | ND | + | ND | ND | ND | ND | + | ND | ++ | ND |
| Neumonía/EPOC/tuberculosis | + | ND | ND | ND | ++ | ++ | ND | + | + | + | ND | + | + | ND | + | ND | + | ND |
| Pancreatitis | ND | ND | ND | ND | +++ | ND | + | + | + | ND | ND | ND | ND | ND | ND | ND | ND | ND |
| Enf. gastrointestinales | ND | ND | ND | + | +++ | + | + | + | ++ | ND | ND | ND | + | ND | ND | ND | ND | ND |
| Hipotiroidismo | ND | ND | ND | ND | ND | + | ND | + | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND |
| Hipertiroidismo | ND | ND | ND | + | ND | ND | ND | ND | + | ND | ND | ND | ND | ND | ND | ND | ND | ND |
| Déficit vitamina B12 | ND | +a | ND | +++ | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND |
| Endometriosis/enf. ginecológicas | ND | ND | ND | + | +++ | ++ | + | + | + | ND | ND | ND | ND | ND | + | ND | + | ND |
| Embarazo | +++ | +++ | ND | ND | ND | + | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND | ++ |
| Enf. autoinmunes | + | ++ | + | + | + | ++ | ND | + | + | ND | ND | + | ND | ND | ND | + | + | +++ |
| Hemólisis | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND | +++ | ND | ND | ND | ND | ND | ND |
| Prostatitis/HBP | ND | ND | ND | ND | ND | ND | ND | ND | ++ | ND | ND | ND | ND | +++ / + | ND | ND | ND | ND |
| HIV/CMV/infección viral | ND | ND | ++ | ND | ND | ND | ND | ND | + | ND | ND | ND | ND | ND | ND | ND | ND | ND |
| Enf. cardiovasculares | ND | ND | ND | ND | ND | +++ | ND | ND | +++ | ND | ND | ND | ND | ND | ND | ND | ND | ND |
| Enf. de la piel | ND | ND | + | + | ND | + | ND | + | ND | ND | ND | ND | ND | ND | ND | + | +++ | ND |
| Lesiones cerebrales | ND | ND | + | ND | ND | ND | ND | ND | ND | ND | ND | + | ND | ND | ND | ++ | ND | ND |
AFP: α-fetoproteína; β-hCG: gonadotropina coriónica (cadena β); β2M: β2-microglobulina; CA 15-3: antígeno carbohidrato 15-3; CA 19-9: antígeno carbohidrato 19-9; CA 125: antígeno carbohidrato 125; CA 72-4: antígeno carbohidrato 72-4; CEA: antígeno carcinoembrionario; CgA: cromogranina A; CYFRA: antígeno CYFRA 21-1; EPOC: enfermedad pulmonar obstructiva crónica; HBP: hipertrofia benigna de próstata; HER-2: HER-2/neu oncogenic protein; NSE: enolasa neuronal específica; ND: no descrito Pro-GRP: Progastrin releasing peptide; S-100: proteína S-100; SCC: antígeno de carcinoma de células escamosas; Tg: tiroglobulina; +: elevación del marcador tumoral hasta a 3 veces el límite superior de referencia; ++: elevación del marcador tumoral entre 4 y 10 veces el límite superior de referencia; +++: elevación del marcador tumoral más de 10 veces el límite superior de referencia.
Deben tenerse en cuenta las diferentes condiciones que pueden afectar a la estabilidad de los especímenes. Por ejemplo, en climas cálidos puede afectarse la estabilidad de cualquier MT en los especímenes según las condiciones en las que se almacenen. Esto puede ser especialmente relevante en el caso de la coriogonadotropina humana (hCG) a temperaturas superiores a 30°C, debiéndose controlar especialmente durante el transporte de muestras al laboratorio, y que dependiendo de la fracción del PSA puede verse incrementada (PSA unido a α-1-antiquimiotripsina o PSA complexed [PSAC]) o disminuida (PSAL) con el almacenaje más de 8horas a 25°C12,13.
Tipo de espécimenTanto las muestras de suero como de plasma (EDTA o heparina de litio) suelen ser apropiadas para la determinación de MT, existiendo escasa variabilidad entre ellas. No obstante, existen algunas excepciones en las cuales existen grandes diferencias entre los distintos especímenes, como en el factor de crecimiento del endotelio vascular, que presenta una concentración entre 7 y 10 veces superior en suero que en plasma. En otros casos el tipo de espécimen afecta a la estabilidad del analito, como se ha descrito en la NSE. También en algunos equipos diagnósticos para la medida del ProGRP, que usan un epítopo lábil al cual se une el anticuerpo, presentando una estabilidad de 2horas a temperatura ambiente en suero y de más de 6horas en plasma con EDTA a la misma temperatura14–17. Por otra parte, existen equipos diagnósticos que utilizan epítopos distintos que no presentan este problema, por lo que siempre es necesario comprobar la estabilidad descrita por el fabricante. Para minimizar las variaciones debidas a los tubos de extracción es recomendable utilizar siempre el mismo espécimen en la determinación de un cierto MT (suero con o sin gel, EDTA…), o realizar una comparativa entre los tubos que pueden utilizarse en caso de muestra insuficiente o de la seroteca, si el tubo es distinto al de rutina, cuando haya una ampliación o comprobación.
Además, es preferible la utilización de tubo primario para minimizar el riesgo de errores en la identificación o en la preparación de alícuotas. En algunos marcadores es crítico el tiempo de separación del coágulo, como en el caso del PSAL, NSE y ProGRP, en donde se recomienda una separación preferentemente antes de las 3horas de la extracción12. En el caso del ProGRP la estabilidad de la muestra es dependiente del equipo diagnóstico14. Esto es especialmente importante para el PSAL, dado que la concentración de PSA no se altera en estas condiciones, y el PSAL disminuye, por lo que en la ratio PSAL/PSA se observa una disminución, pudiendo indicar la realización de una biopsia prostática de manera innecesaria en pacientes con valores entre 3 y 10μg/l de PSA18. Esto no ocurre con el uso del PSAC que es más estable, por lo que la ratio PSAC/PSA no se altera.
Contaminación de la muestraLas concentraciones que consideramos normales en suero pueden no serlo en otros líquidos biológicos. Algunos MT como CA125 y CYFRA 21-1 pueden presentar concentraciones de más de 10 veces el límite superior de referencia (LSR) de suero en líquidos benignos19–21. Diversos estudios han descrito elevadas concentraciones de MT en líquido bronquial, moco bronquial o quistes de diverso origen22–25. La saliva contiene concentraciones de CA125, CEA, antígeno polipeptídico tisular específico (TPS) y antígeno celular del carcinoma escamoso (SCC), comparativamente más elevadas que en el suero, con medianas de 384KU/l, 197,6μg/l, 110U/l y 140μg/l, respectivamente. La contaminación del suero con saliva puede incrementar de forma significativa las concentraciones de los MT, especialmente del SCC26.
Selección de pruebasDeben existir protocolos de petición de MT consensuados con los clínicos, basados en la evidencia científica actual. Para ello es útil el seguimiento de guías nacionales e internacionales.
En algunas condiciones clínicas benignas los MT pueden presentar concentraciones similares a los pacientes con metástasis, haciendo imposible la discriminación entre ellas. Así, en pacientes con insuficiencia renal tratados con diálisis, las concentraciones del SCC, proteína S100B o la β2-microglobulina pueden alcanzar más de 10 veces el LSR, concentraciones que, en pacientes con tumores metastásicos de cérvix, melanoma metastásico o linfomas o mieloma múltiple en fases avanzadas no suelen sobrepasar dichos valores. Por tanto, estos MT no deben ser solicitados en pacientes tratados con diálisis. Estos MT también presentan incrementos importantes en pacientes con enfermedad renal crónica en estadios 3 y 4, lo cual hace recomendable no determinarlos en este tipo de pacientes27.
Marcadores tales como el PSAL, cuya utilidad es la selección de pacientes para la realización de la biopsia prostática en aquellos que presentan un PSAT en el intervalo de 3 a 10μg/l no debería solicitarse en pacientes con cáncer de próstata ya diagnosticados8.
La mayoría de MT no tienen utilidad en el cribado, exceptuando el PSA y la α-fetoproteína (AFP) en determinados grupos poblacionales. El uso del PSA en cáncer de próstata solo se recomienda tras haber informado de beneficios y perjuicios derivados en pacientes con sintomatología prostática y nunca en la población general. En el caso del PSA existe controversia, no por su capacidad de detectar el cáncer de próstata, sino por la incapacidad con los medios actuales de conocer su agresividad una vez detectado el cáncer. La ratio PSAL/PSA no estaría indicada para el cribado de la población general8.También existe controversia en la utilidad de la AFP en el cribado del hepatocarcinoma (HCC) en pacientes con hepatopatías crónicas; la National Academy of Clinical Biochemistry28, la National Comprehensive Cancer Network y todas las sociedades asiáticas de gastroenterología recomiendan su utilización, mientras que algunas de las occidentales como la American Association for the Study of Liver Diseases o la European Association for Study of the Liver no la recomiendan29. El uso de AFP en el cribado del HCC en pacientes con hepatopatía crónica puede ser útil, ya que un 30% de los HCC presentan un incremento del marcador como primer signo meses antes que la ecografía.
El uso de los MT en pacientes con cáncer de origen desconocido, o en pacientes con sintomatología sugestiva de cáncer, ha sido descrito recientemente en varios estudios30–32. Las combinaciones de varios marcadores permiten identificar a aquellos pacientes con un mayor riesgo de presentar cáncer y establecer si la neoplasia es de tipo epitelial o no.
Fase analíticaLos métodos analíticos deben ser validados y definidos mediante protocolos bien caracterizados y basados en las ideas y principios que rigen en los principales organismos reguladores, como el marcado CE en la Unión Europea o la aprobación por la Food and Drug Administration en los EE. UU. de América.
Especificidad analítica: interferenciasReacción cruzada con moléculas relacionadas.
Los fabricantes deben describir si existen, y a qué concentración, interferencias con moléculas relacionadas estructuralmente, tal como ocurre con la hCG y otras hormonas polipeptídicas, por ejemplo folitropina (FSH), lutropina (LH) o tirotropina (TSH).
Si existen diversas formas moleculares, como es el caso de PSAT, es necesario que el ensayo presente equimolaridad en todas las formas y que no sobreestime o infravalore ninguna de ellas33.
Los fabricantes deben proveer una información clara acerca de la especificidad de los anticuerpos usados en sus métodos, así como los datos de las reacciones cruzadas que puedan surgir, e informar de qué acciones pueden realizarse para identificarlas. Ante cualquier resultado inesperadamente alto sin correlación clínica se recomienda determinar con otro método para excluir la reactividad cruzada. Otra información que debe tenerse en cuenta es la posible interferencia de la biotina en los métodos que utilizan anticuerpos biotinados para unirse a la fase sólida. En pacientes tratados con dosis altas (>5mg/día) se debe realizar la extracción al menos 8horas tras la última administración, aunque se recomienda esperar 24horas; en caso de sospecha puede evitarse esta interferencia con un tratamiento previo de la muestra con micropartículas de estreptavidina34.
Anticuerpos heterófilosInterferencia debida a anticuerpos humanos anti-ratón u otros anticuerpos heterófilos.
Se debe revisar la posible interferencia debido a estos anticuerpos, particularmente cuando un resultado de un paciente no está en concordancia con los datos clínicos35,36. Resultados falsamente altos o bajos pueden ser obtenidos de pacientes cuyos especímenes contienen anticuerpos anti-IgG capaces de reaccionar con los anticuerpos utilizados en el ensayo. Este hecho es particularmente frecuente en pacientes sometidos a tratamientos con anticuerpos monoclonales, tanto para ser estudiados en técnicas de imagen o con fines terapéuticos. La no identificación de tales interferencias puede dar lugar a actuaciones clínicas erróneas, hecho especialmente frecuente en la β-hCG37, el CA12538 y el antígeno carbohidrato 19-9 (CA19-9).
Estas interferencias son fácilmente detectables en un paciente en seguimiento, al detectar un incremento o decremento sin razón clínica que lo justifique. Desafortunadamente es mucho más difícil detectarlas en la primera determinación que se le hace al paciente. Se debe sospechar, como se ha dicho anteriormente, en pacientes con tratamientos con anticuerpos, aunque desafortunadamente en muchas ocasiones el laboratorio carece de dicha información. Debe sospecharse también ante resultados extraños, discordantes con la situación clínica, como por ejemplo un paciente con sospecha de cáncer de próstata y niveles indetectables de PSA o un paciente con niveles muy elevados de CA19-9 sin sospecha clínica de neoplasia productora.
La presencia de este tipo de anticuerpos puede ser detectada mediante la utilización de alguno de los siguientes procedimientos2,4–6.
- •
Realizar una prueba de bloqueo de estos anticuerpos.
- •
Precipitación con polietilenglicol.
- •
Repetir la determinación con otro método que utilice anticuerpos de un animal de otra especie (por ejemplo, si nuestro método utiliza anticuerpos de ratón, aplicar otro que utilice anticuerpos de conejo).
- •
Realizar diferentes diluciones de la muestra y comprobar que los resultados mantienen la proporcionalidad.
- •
En el caso de hCG se puede determinar la concentración en orina. Una concentración elevada en suero y no detectable en orina indica con una elevada probabilidad este tipo de interferencia.
Si existe evidencia o sospecha firme de interferencia o reactividad cruzada se realizará un bloqueo con anticuerpos específicos o un cambio de metodología para eliminar esta interferencia, realizando estas mismas acciones en las determinaciones sucesivas. En el caso de que estas acciones no permitan eliminar la interferencia, el laboratorio no emitirá los resultados con el fin de no inducir a errores. En los controles sucesivos se comprobarán las interferencias, ya que en algunos casos pueden ser transitorias. Siempre que se cambie de método se deberá evaluar este tipo interferencias, ya que, si bien pueden desaparecer en los pacientes que las presentaban, también pueden aparecer en pacientes que no las presentaban con el método anterior.
Algunos métodos para evitar este tipo de errores utilizan anticuerpos quiméricos humanizados, fragmentos de anticuerpos (región variable) o agentes bloqueantes de anticuerpos anti-ratón, disminuyendo de forma sustancial el número de errores debidos a estos anticuerpos39–41.
Contaminación entre muestrasLos laboratorios deberían evaluar ocasionalmente la posibilidad de que sus métodos para determinar MT puedan sufrir arrastres de una muestra precedente con altas concentraciones de dicho MT42. Ante un resultado inesperadamente alto se recomienda repetir la determinación de forma aislada, o después de una muestra con concentración baja del MT.
Efecto prozonaLos laboratorios deben de disponer de protocolos para identificar especímenes que presenten el «efecto prozona». Esto sucede cuando las concentraciones de un MT exceden en varios órdenes de magnitud el rango dinámico de la técnica, sobrepasando ampliamente la concentración del anticuerpo de captura, provocando la saturación de la capacidad de la fase sólida en un inmunoanálisis tipo sándwich de un solo paso2,4,5.
Los fallos a la hora de reconocer la existencia de valores extremadamente altos de un determinado MT, por ejemplo, de β-hCG o de AFP, pueden constituir un error clínico crítico. Este efecto es muy fácil de sospechar en pacientes en seguimiento en el que un empeoramiento clínico del paciente coincide con una disminución drástica de los MT, pero no es tan sencillo en pacientes con determinaciones puntuales. Para evitar este efecto es importante utilizar técnicas de amplio rango dinámico, métodos secuenciales con lavado intermedio y, en caso de duda, determinar el MT a 2 diluciones diferentes. En pacientes con sospecha de metástasis por un tumor que usualmente secrete o libere MT (colon, páncreas, pulmón, mama, etc.) y que, en una primera visita, presenten valores bajos o indetectables de MT, se recomienda realizar 2 diluciones: la primera al 1:5 o 1:10 y la segunda al 1:50 o 1:100 para identificar este tipo de error.
Recomendaciones ante un cambio de métodoCambiar de método es un aspecto importante en todas las magnitudes, pero especialmente relevante en el caso de los MT. Existe la falsa idea de que determinar un MT por uno u otro método comercial es irrelevante, y que los resultados serán similares, ya que utilizan las mismas unidades, mismos valores de referencia, e incluso en muchos casos, el anticuerpo empleado en la detección es el mismo. Esta suposición es falsa, ya que pueden existir grandes diferencias en los resultados obtenidos, según el MT, de acuerdo con el método que se emplee43–47. De hecho, debería informarse siempre junto al resultado el método utilizado, el fabricante y el modelo del analizador empleado, para así facilitar el seguimiento de un paciente cuyos resultados procedan de otro laboratorio o que se envíe a otro centro.
Ante el cambio de laboratorio durante el seguimiento de un paciente, ya sea por cambio de domicilio, hospital o laboratorio de referencia (si la muestra se externaliza), deberán tenerse en cuenta las siguientes consideraciones: si el laboratorio utiliza el mismo reactivo y sistema de medida el comportamiento del MT debería ser el mismo, pero si el sistema de medida es distinto, aunque sea del mismo fabricante, pueden existir grandes diferencias, por lo que es recomendable analizar una muestra anterior para poder comparar o realizar valores basales en el paciente.
Hay MT con escasas diferencias asociadas al método comercial, mientras que en otros, como los antígenos carbohidratos, en especial el CA19-9, las diferencias pueden ser muy importantes48,49. Slev et al.47 describen también una gran variabilidad para el CA15-3 cuando comparan materiales de control entre distintos métodos. En algunos casos puntuales estas diferencias pueden ser más de 4 veces su valor, lo que puede ser interpretado como una progresión o remisión de la enfermedad sin existir modificación real de la concentración del MT, lo cual implicaría un cambio en la actitud terapéutica que afectaría a la salud del paciente.
Por ello, se aconseja el siguiente procedimiento basado en recomendaciones de la National Academy of Clinical Biochemistry50:
- 1.
Realizar una validación del nuevo método siguiendo las directrices de la guía de consenso EP9A2 del Clinical and Laboratory Standards Institute que permite la evaluación y la comparación de 2 métodos utilizando muestras de pacientes51,52.
- 2.
Informar del cambio a los facultativos que recibirán los resultados, indicando claramente en el informe el nuevo método utilizado y la fecha del cambio. Esta información debe constar al menos durante 6 meses.
- 3.
Determinar durante un periodo mínimo de 6 meses ambos procedimientos analíticos, indicando en los casos con modificaciones importantes el valor obtenido con el procedimiento anterior. Este procedimiento permite un paulatino y progresivo acondicionamiento a los nuevos valores por parte de los servicios clínicos. En los casos que no sea posible determinar ambos métodos simultáneamente se aconseja conservar las muestras del último control clínico durante un periodo de un año previo al cambio, para poder determinar simultáneamente la nueva muestra y la anterior del paciente con el mismo método. Este procedimiento permite conocer, en los casos con dudas, si el cambio en el resultado es debido a la modificación del método o al estado clínico del paciente.
De la sugerencia anterior se deduce que un cambio de método no es siempre fácil y debe valorarse con cautela. Un cambio motivado por una discreta reducción en el precio de los reactivos debe valorarse globalmente, analizando el coste de las repeticiones, el efecto del cambio en los resultados obtenidos y las repercusiones de los mismos. Incrementos en la concentración del MT en un 5% de los casos pueden motivar la repetición de visitas, exploraciones y pruebas de imagen que no se habrían realizado si el cambio no se hubiese producido53.
Control de la calidad analíticaLos requisitos analíticos son similares a los definidos para otras técnicas de laboratorio, por lo que es necesario el uso de controles internos y la participación en un programa externo de la calidad.
Es de especial importancia que las concentraciones de los materiales de control de la calidad sean cercanas a los puntos de decisión clínica.
No se deberían emplear controles de concentraciones inusuales, muy bajas o muy altas, infrecuentes en la práctica clínica. La exactitud y precisión del método deben ser adecuadas principalmente en la zona de toma de decisiones, cuando menos debemos tener un control cercano al límite superior de referencia (LSR).
Es deseable el empleo de metodologías con una variabilidad intraensayo inferior al 5% e interensayo inferior al 10%50.
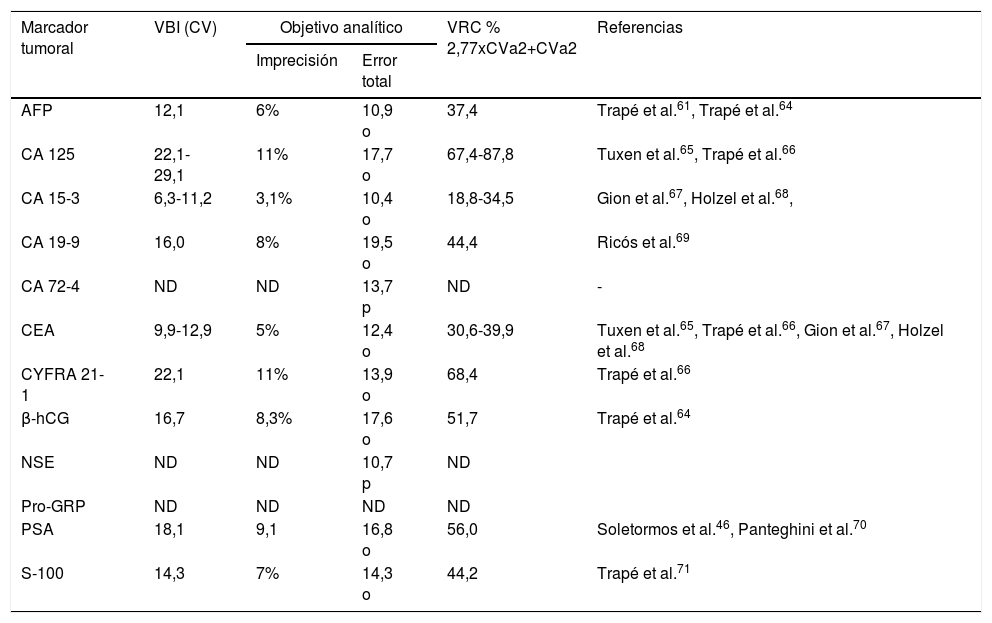
Actualmente la mayoría de MT se pueden determinar en equipos automatizados y con una elevada precisión. En el caso de que se conozca la variabilidad biológica intraindividual (CVbi) podemos aplicar los criterios basados en dicha variabilidad, para establecer objetivos de calidad de la imprecisión analítica, siendo el nivel mínimo exigible 0,75 CVbi, el deseable 0,5 CVbi o el óptimo 0,25 CVbi. En la tabla 2 se describe el objetivo de calidad deseable para los MT que tienen definida la variabilidad biológica54. A partir de la variabilidad biológica podemos hallar el cambio significativo, el valor de referencia de un cambio, los cuales pueden coincidir o no con un cambio clínicamente relevante (ver apartado interpretación).
Variabilidades biológicas, objetivo de calidad y VRC de los MT
| Marcador tumoral | VBI (CV) | Objetivo analítico | VRC % 2,77xCVa2+CVa2 | Referencias | |
|---|---|---|---|---|---|
| Imprecisión | Error total | ||||
| AFP | 12,1 | 6% | 10,9 o | 37,4 | Trapé et al.61, Trapé et al.64 |
| CA 125 | 22,1-29,1 | 11% | 17,7 o | 67,4-87,8 | Tuxen et al.65, Trapé et al.66 |
| CA 15-3 | 6,3-11,2 | 3,1% | 10,4 o | 18,8-34,5 | Gion et al.67, Holzel et al.68, |
| CA 19-9 | 16,0 | 8% | 19,5 o | 44,4 | Ricós et al.69 |
| CA 72-4 | ND | ND | 13,7 p | ND | - |
| CEA | 9,9-12,9 | 5% | 12,4 o | 30,6-39,9 | Tuxen et al.65, Trapé et al.66, Gion et al.67, Holzel et al.68 |
| CYFRA 21-1 | 22,1 | 11% | 13,9 o | 68,4 | Trapé et al.66 |
| β-hCG | 16,7 | 8,3% | 17,6 o | 51,7 | Trapé et al.64 |
| NSE | ND | ND | 10,7 p | ND | |
| Pro-GRP | ND | ND | ND | ND | |
| PSA | 18,1 | 9,1 | 16,8 o | 56,0 | Soletormos et al.46, Panteghini et al.70 |
| S-100 | 14,3 | 7% | 14,3 o | 44,2 | Trapé et al.71 |
AFP: α-fetoproteína; β-hCG: gonadotropina coriónica (cadena β); CA 125: antígeno carbohidrato 125; CA 15-3: antígeno carbohidrato 15-3; CA 19-9: antígeno carbohidrato 19-9; CA 72-4: antígeno carbohidrato 72-4; CEA: antígeno carcinoembrionario; CYFRA 21-1: fragmentos solubles de citoqueratina 19; ND: no determinado; NSE: enolasa neuronal específica; o: óptimo calculado a partir de VB; p: percentil 90; Pro-GRP: propéptido liberador de gastrina; PSA: antígeno prostático específico; S-100: proteína S-100; VBI (CV): variabilidad biológica intraindividual expresado como coeficiente de variación; VRC: valor de referencia del cambio.
El VRC se ha calculado a partir de la variabilidad analítica deseable (0,5CVi) en cada caso.
Los límites para la aceptación del ensayo en cuanto a inexactitud, imprecisión, sensibilidad y especificidad deben ser predefinidos y basados preferiblemente en criterios de organismos reguladores (por ejemplo, Clinical Laboratory Improvement Amendments), variabilidad biológica o las prestaciones basadas en el estado del arte para los MT estudiados. Utilizando criterios lógicos y contrastados para la detección de variaciones en las prestaciones analíticas como las reglas de Westgard55, el facultativo debe establecer el número necesario de controles por serie y cuándo evaluarlos según la frecuencia de realización de las determinaciones de los marcadores tumorales en cada laboratorio (diario, semanal o mensual) (UNE-EN-ISO 15189:2012).
Origen de los controles de la calidadEs recomendable utilizar controles diferentes a los que suministra el fabricante del método. Los controles preparados con una matriz artificial suelen dar una imprecisión menor que los procedentes de mezclas de sueros50. Al menos debería incluirse un control con una matriz sérica y/o similar a la muestra en cada caso y procedente de una fuente independiente, adicional a los materiales de control suministrados por el fabricante. Debe comprobarse la reproducibilidad y exactitud de los métodos empleados en los casos en que la determinación de MT se realice en otros líquidos biológicos (derrames, orina).
Concentraciones de los controles internos de la calidad apropiados a la aplicación clínicaSe deben emplear controles con valores dentro del intervalo de referencia y concentraciones próximas a los valores discriminantes. Por ejemplo, para el PSA se deberían incluir controles en el rango 0,1-0,2μg/l, 3-4μg/l y 25-35μg/l para el control de pacientes con prostatectomía radical en seguimiento, pacientes con manifestaciones urológicas y seguimiento de pacientes metastásicos, junto con un control periódico de las diluciones50.
Comprobación del método cuando sobrepasa el intervalo de medidaEstudio de la linealidad del métodoMuchas determinaciones de los MT pueden sobrepasar el intervalo de medición, requiriendo dilución. Por ello, la exactitud y precisión de los distintos métodos utilizados debe ser estudiada tanto en el intervalo de medición, como en las diluciones. Los estudios de recuperación deben ser adecuados, ya que en muchas ocasiones la evolución del MT pasará de un valor superior del intervalo analítico a otro dentro del intervalo. Desviaciones muy grandes en la recuperación podrían enmascarar cambios significativos o sobrevalorar cambios mínimos.
Fase postanalíticaIntervalos de referenciaEs aconsejable confirmar y valorar en cada laboratorio los intervalos de referencia de cada MT, sobre todo teniendo en cuenta la variabilidad que tienen los distintos métodos comerciales entre sí. Los intervalos de referencia deben ser apropiadamente determinados usando una población sana y otras que tengan enfermedades benignas que puedan alterar las concentraciones de los MT.
No hay evidencias de que existan variaciones circadianas en la mayoría de los MT, por lo que las muestras pueden extraerse a cualquier hora del día. Sin embargo, desde un punto de vista práctico, la posible existencia de estas variaciones no tendría significación clínica al ser inferiores a las producidas por la actividad tumoral.
Los intervalos de referencia no tienen por qué coincidir con los valores discriminantes utilizados en ayuda al diagnóstico y pronóstico.
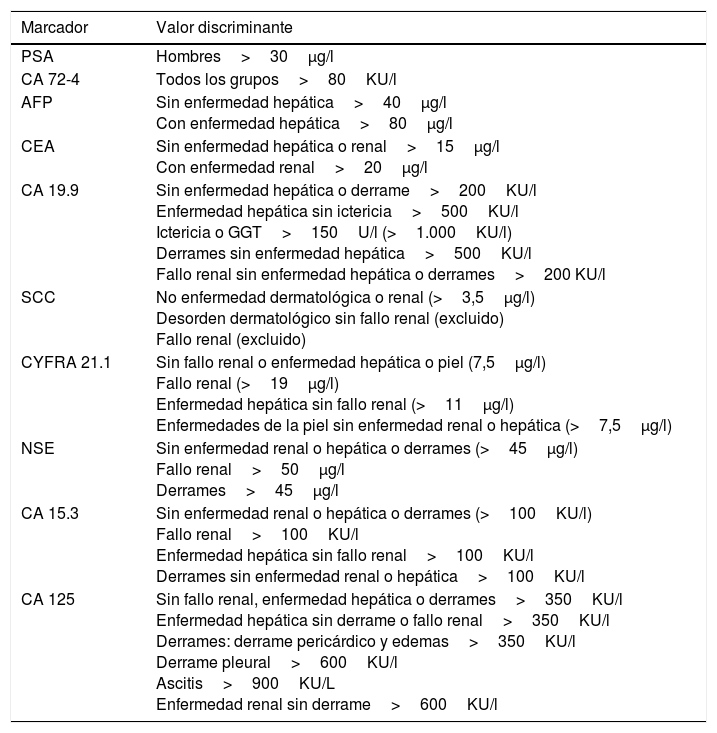
Así, Molina et al.30 establecen valores discriminantes teniendo en cuenta distintas enfermedades (tabla 3), obteniendo una sensibilidad del 67,5% y una especificidad del 97,5% en pacientes con síntomas o signos de cáncer, permitiendo orientar al diagnóstico. En este mismo sentido Trapé et al.32 describen una sensibilidad del 62,1% con una especificidad del 100% en un escenario similar, clasificando a los pacientes según presentaban o no insuficiencia renal y/o hiperbilirrubinemia con valores discriminantes similares a los descritos por Molina et al., siendo para CYFRA 21-1, CEA y CA19-9 de 7,8μg/l, 13,8μg/l y 101KU/l, respectivamente, en pacientes sin disfunción renal y hepática; y de 15μg/l, 43,8μg/l y 7.458KU/l, respectivamente, en pacientes con insuficiencia renal y/o hiperbilirrubinemia. Para una mejor interpretación, en el caso que los MT se utilicen como ayuda al diagnóstico, los valores discriminantes deben establecerse para cada tipo de enfermedad en la que se usan los MT como se describen en la tabla 3.
Valores discriminantes sugeridos para el uso de los marcadores tumorales en pacientes con signos y síntomas de cáncer
| Marcador | Valor discriminante |
|---|---|
| PSA | Hombres>30μg/l |
| CA 72-4 | Todos los grupos>80KU/l |
| AFP | Sin enfermedad hepática>40μg/l Con enfermedad hepática>80μg/l |
| CEA | Sin enfermedad hepática o renal>15μg/l Con enfermedad renal>20μg/l |
| CA 19.9 | Sin enfermedad hepática o derrame>200KU/l Enfermedad hepática sin ictericia>500KU/l Ictericia o GGT>150U/l (>1.000KU/l) Derrames sin enfermedad hepática>500KU/l Fallo renal sin enfermedad hepática o derrames>200 KU/l |
| SCC | No enfermedad dermatológica o renal (>3,5μg/l) Desorden dermatológico sin fallo renal (excluido) Fallo renal (excluido) |
| CYFRA 21.1 | Sin fallo renal o enfermedad hepática o piel (7,5μg/l) Fallo renal (>19μg/l) Enfermedad hepática sin fallo renal (>11μg/l) Enfermedades de la piel sin enfermedad renal o hepática (>7,5μg/l) |
| NSE | Sin enfermedad renal o hepática o derrames (>45μg/l) Fallo renal>50μg/l Derrames>45μg/l |
| CA 15.3 | Sin enfermedad renal o hepática o derrames (>100KU/l) Fallo renal>100KU/l Enfermedad hepática sin fallo renal>100KU/l Derrames sin enfermedad renal o hepática>100KU/l |
| CA 125 | Sin fallo renal, enfermedad hepática o derrames>350KU/l Enfermedad hepática sin derrame o fallo renal>350KU/l Derrames: derrame pericárdico y edemas>350KU/l Derrame pleural>600KU/l Ascitis>900KU/L Enfermedad renal sin derrame>600KU/l |
AFP: α-fetoproteína; CA 15-3: antígeno carbohidrato 15-3; CA 19-9: antígeno carbohidrato 19-9; CA 72-4: antígeno carbohidrato 72-4; CA 125: antígeno carbohidrato 125; CEA: antígeno carcinoembrionario; SCC: antígeno de carcinoma de célula escamosos; CYFRA 21-1: fragmentos solubles de citoqueratina 19; GGT: gamma glutamil transpeptidasa; NSE: enolasa neuronal específica; PSA: Antígeno prostático específico.
Fuente: Molina et al.30.
El LSR puede coincidir o no con los valores utilizados como pronósticos en determinados escenarios clínicos; así, en pacientes con cáncer de colon el valor discriminante es el mismo cuando planificamos el tratamiento quirúrgico, pero es de 6 veces mayor en pacientes sometidos a resección de metástasis, ya sean pulmonares o hepáticas56,57.
Es especialmente importante determinar en cada paciente cuál es su propio nivel basal, principalmente en los pacientes que van a ser monitorizados durante el tratamiento. Si esto está bien establecido los incrementos —incluso dentro del intervalo de referencia— pueden ser significativos, siempre que se descarten otros procesos que puedan incrementar los MT y repitiendo la determinación en un mes para verificar la tendencia del incremento1.
Establecimiento de los niveles basalesLos MT, como la mayoría de parámetros de laboratorio, tienen un intervalo de referencia calculado a partir de una población sana. Este valor es importante como punto de partida en la orientación de un paciente, para comparar resultados entre distintos centros o en las publicaciones. En estos pacientes es importante determinar los valores basales pretratamiento para poder interpretar correctamente las concentraciones obtenidas después del tratamiento. Algunos pacientes pueden tener comorbilidades que modifiquen las concentraciones plasmáticas de estos analitos (tabla 1). Hay pacientes que tienen concentraciones superiores al límite de referencia en el diagnóstico de la neoplasia, manteniendo valores similares después de la exéresis del tumor, indicando que la concentración del MT no tenía relación con la neoplasia. En otros casos sin evidencia de enfermedad residual la concentración postexéresis disminuye, pero sin llegar al intervalo de referencia, manteniéndose durante un tiempo prolongado estableciendo el nadir para la posterior evaluación del MT.
La utilidad más aceptada de los MT es en el seguimiento de los pacientes, tanto en los casos sin evidencia de enfermedad (diagnóstico precoz de recidiva) como en la monitorización terapéutica de pacientes con tumores en estadios avanzados. En estos casos lo importante es valorar el cambio (puede ser en cualquier rango y es especialmente importante en los casos indetectable/detectable: PSA, Tg, hCG...). Para ello deben valorarse los cambios significativos.
En la mayoría de MT no hay recomendaciones para que sean empleados para el diagnóstico, ya que su sensibilidad es baja en estadios iniciales, pero son de ayuda y orientación al diagnóstico en pacientes con neoplasias avanzadas en que la sensibilidad es de moderada a elevada. En pacientes con signos o síntomas de cáncer o con síndromes paraneoplásicos se han descrito sensibilidades entre el 56% y 67,5% con especificidades del 97,5% al 100%30,31. En pacientes con sintomatología sugestiva de cáncer de pulmón, Molina et al.32 obtienen una sensibilidad de 88,5% y una especificidad de 82%, con la siguiente combinación de MT: CEA, CA15-3, CYFRA21-1, NSE, Pro-GRP y SCC. Un MT positivo (superior al rango de referencia) en un paciente con signos o síntomas de neoplasia indica con elevada probabilidad neoplasia. Un valor elevado de un MT en un paciente sin causa conocida que lo explique (insuficiencia renal, hepatopatía, etc.) debe considerarse de riesgo y ser monitorizado. Se debería investigar si estos son los valores basales del paciente realizando una nueva determinación en un periodo de 3 o 4 semanas y observando la magnitud del cambio entre las 2 determinaciones. Un incremento significativo sugiere la presencia de neoplasia. En los casos de incrementos moderados podría realizarse una nueva determinación en un intervalo de tiempo similar.
Interpretación de un cambioUnas de las principales aplicaciones de los MT son la detección precoz de recidivas y el control evolutivo de la enfermedad. Por ello es recomendable que los laboratorios clínicos emitan informes acumulados de los resultados de sus MT.
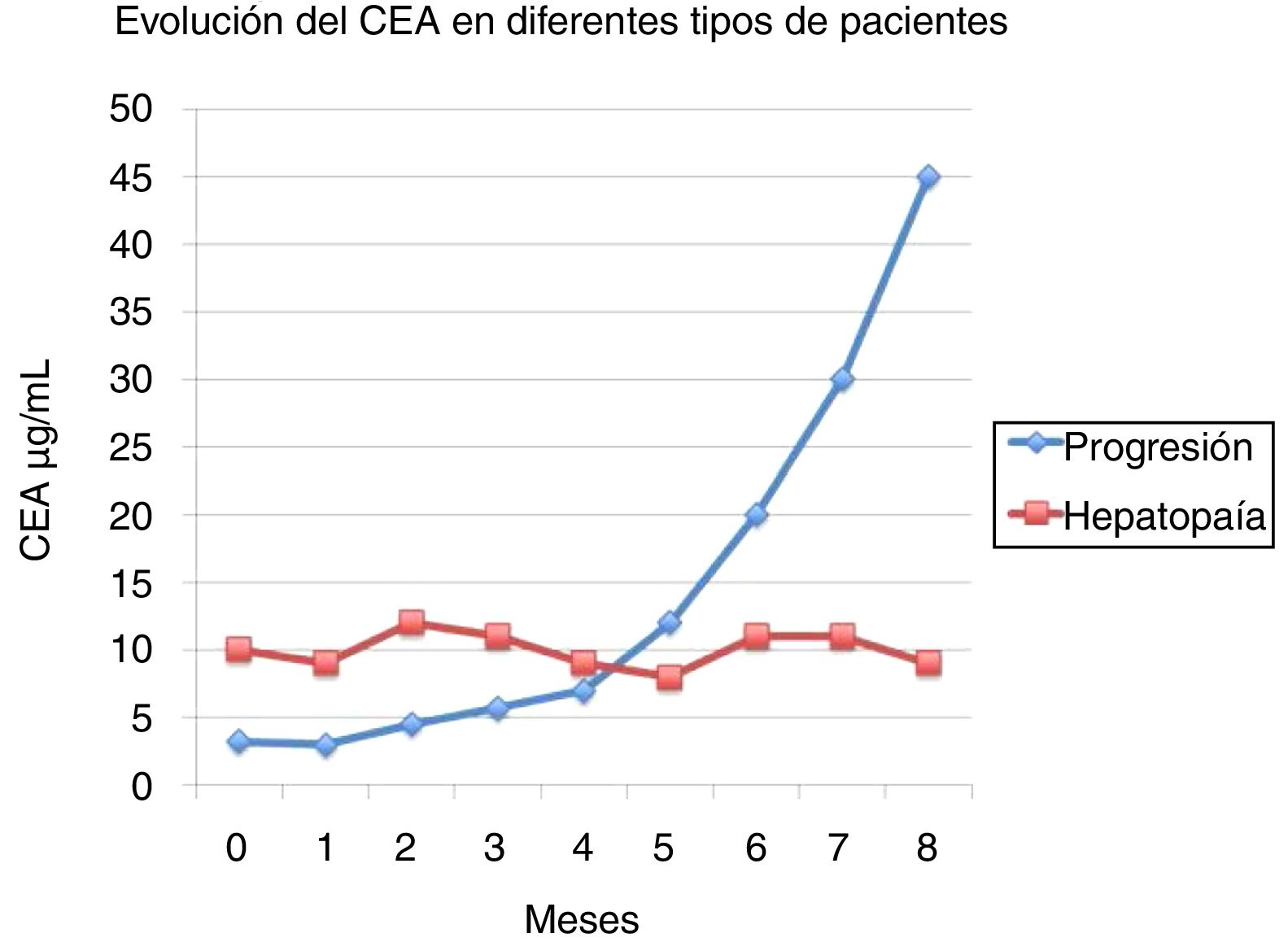
Un cambio en la concentración de un MT puede ser debido a una variación en el crecimiento del tumor, o a la instauración de una enfermedad intercurrente, a la exacerbación de una enfermedad crónica preexistente en el paciente o a la iatrogenia de las medidas terapéuticas utilizadas para tratar el tumor, como la quimioterapia o la radioterapia. Siempre que exista un cambio significativo en el seguimiento del paciente oncológico con MT debe excluirse la etiología benigna del incremento, utilizando una nueva determinación en un periodo de tiempo más reducido, en general de 2 a 4 semanas, que confirme o no la tendencia de la variación (fig. 1). En los pacientes en que la enfermedad benigna es la responsable del incremento de los MT las variaciones se producen en forma de «dientes de sierra», mientras que en los pacientes en los que el incremento es debido a la progresión de la enfermedad se produce incremento constante que puede ser incluso exponencial. Las determinaciones seriadas permiten detectar cambios sin significación clínica. Observando resultados podemos conocer si existe un incremento puntual o una tendencia al incremento o la disminución.
Un cambio clínicamente relevante en la concentración del MT es aquel que está relacionado con la supervivencia total o el periodo libre de enfermedad. Una disminución del marcador implica un mejor pronóstico, mientras que un aumento implica una disminución de la supervivencia o detección de progresión que de confirmarse puede ser tratada. Un cambio significativo analítico en la concentración del MT sería aquel en que la variación entre 2 resultados es superior a la variabilidad analítica y a la variabilidad biológica intraindividual. Esta se expresa como el valor de referencia de cambio cuya expresión matemática es:
VRC=2xZxCVi2+CVa2
VRC: valor de referencia de un cambio.
Z=1,96 para p<0,05.
VRC=2,77xCVi2+CVa2
CVi2: variabilidad biológica intraindividual expresado como coeficiente de variación.
CVa2: variabilidad analítica expresado como coeficiente de variación.
Suponiendo que el MT se realiza en un equipo automático, la CVa es mucho menor que la CVi, es decir, por debajo de las especificaciones de calidad óptimas (0,25 CVi) por ejemplo CA125 o CYFRA 21-1, por lo que el VRC puede ser calculado del siguiente modo:
VRC=2,82×CVi para p<0,05.
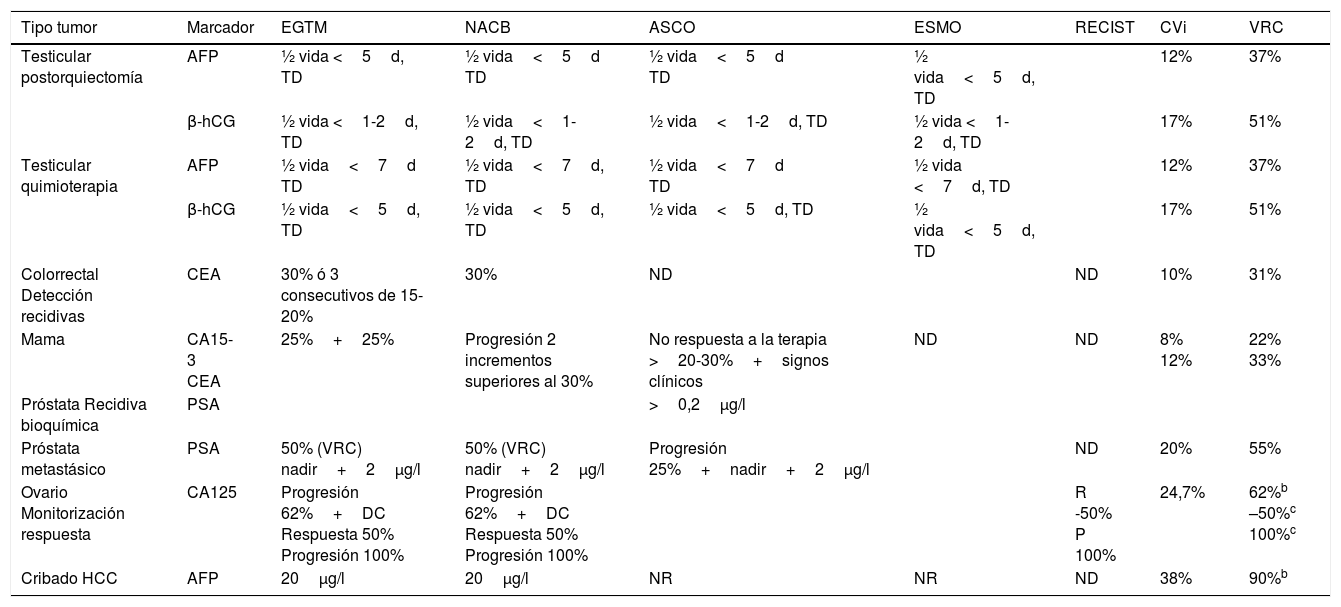
El cambio clínicamente relevante puede coincidir con el cambio significativo o no. En algunos casos, como en la detección de progresión en el cáncer de mama o el colorrectal, existe una coincidencia, el VRC es similar a la detección de progresión. No existe un criterio único para establecer la magnitud de un cambio para que se considere significativo para todos los MT. Las recomendaciones de las distintas sociedades científicas para la interpretación de los marcadores tumorales se basan en estudios en los que se utilizan valores discriminantes o incrementos obtenidos empíricamente, pocos de ellos basados en la variabilidad biológica. Un mismo marcador puede tener distintas interpretaciones según el tipo de tumor estudiado. La magnitud de los incrementos que nos permiten sospechar progresión o remisión no es la misma para los distintos MT ni para cada tipo de tumor, e incluso puede haber pequeñas diferencias entre las recomendaciones de distintas sociedades científicas. Por ejemplo, la American Society of Clinical Oncology56 recomienda valorar variaciones de CEA del 20% al 30% para detectar progresión en cáncer de colon; el European Group on Tumor Markers (EGTM)58 del 30%, así como también 2 incrementos consecutivos comprendidos entre el 15% y el 20%. Para evaluar la progresión en el cáncer de mama la American Society of Clinical Oncology57 no define incrementos, mientras que el EGTM59 considera progresión 2 incrementos del 25% para CEA y CA15-3. En la neoplasia de ovario un incremento superior al 100% de la concentración más baja obtenida después del tratamiento oncológico (sobrepasar el doble del nadir) es indicativo de progresión, mientras que una disminución del 50% es indicativo de respuesta60. En la tabla 4 se describen las principales recomendaciones de las distintas sociedades en la evaluación de progresión y remisión para los distintos tumores comparándolas con el valor de referencia de un cambio. Aunque la mayoría de estudios son empíricos los incrementos son similares a los basados en la variabilidad biológica, es decir, al VRC en algunos casos. En los cánceres germinales las sociedades científicas recomiendan como parámetro para evaluar la respuesta al tratamiento y la progresión la vida media y el tiempo de duplicación del marcador.
Recomendaciones de uso y los criterios de interpretación
| Tipo tumor | Marcador | EGTM | NACB | ASCO | ESMO | RECIST | CVi | VRC |
|---|---|---|---|---|---|---|---|---|
| Testicular postorquiectomía | AFP | ½ vida <5d, TD | ½ vida<5d TD | ½ vida<5d TD | ½ vida<5d, TD | 12% | 37% | |
| β-hCG | ½ vida <1-2d, TD | ½ vida<1-2d, TD | ½ vida<1-2d, TD | ½ vida <1-2d, TD | 17% | 51% | ||
| Testicular quimioterapia | AFP | ½ vida<7d TD | ½ vida<7d, TD | ½ vida<7d TD | ½ vida <7d, TD | 12% | 37% | |
| β-hCG | ½ vida<5d, TD | ½ vida<5d, TD | ½ vida<5d, TD | ½ vida<5d, TD | 17% | 51% | ||
| Colorrectal Detección recidivas | CEA | 30% ó 3 consecutivos de 15-20% | 30% | ND | ND | 10% | 31% | |
| Mama | CA15-3 CEA | 25%+25% | Progresión 2 incrementos superiores al 30% | No respuesta a la terapia >20-30%+signos clínicos | ND | ND | 8% 12% | 22% 33% |
| Próstata Recidiva bioquímica | PSA | >0,2μg/l | ||||||
| Próstata metastásico | PSA | 50% (VRC) nadir+2μg/l | 50% (VRC) nadir+2μg/l | Progresión 25%+nadir+2μg/l | ND | 20% | 55% | |
| Ovario Monitorización respuesta | CA125 | Progresión 62%+DC Respuesta 50% Progresión 100% | Progresión 62%+DC Respuesta 50% Progresión 100% | R -50% P 100% | 24,7% | 62%b –50%c 100%c | ||
| Cribado HCC | AFP | 20μg/l | 20μg/l | NR | NR | ND | 38% | 90%b |
AFP: α-fetoproteína; ASCO: American Society of Clinical Oncology; β-hCG: gonadotropina coriónica (cadena β);CA 15-3: antígeno carbohidrato 15-3. CA 125: antígeno carbohidrato 125; CEA: antígeno carcinoembrionario; CVi: variabilidad biológica intraindividual; DC: determinación confirmatoria; EGTM: European Group on Tumor Markers; ESMO: European Society of Medical Oncology; HCC: carcinoma hepatocelular; NACB: National Academy Clinical Biochemistry; ND: no descrito; NR: no recomendado; PSA: antígeno prostático específico; RECIST: Response Evaluation Criteria in Solid Tumors; TD: tiempo de duplicación; VD: valores discriminantes; VRC: valor de referencia de un cambio; ½ vida: semivida o tiempo de vida media del marcador.
aVRC calculado bidireccional al 95% o unidireccional al 97,5%, para una variabilidad analítica 0,5 CVI.
La detección de un cambio significativo depende teóricamente de la velocidad de crecimiento del tumor (subrogada a la variación de la concentración del MT) y de la variabilidad biológica del MT. En algunos casos, como en la detección precoz de recidivas, el cambio significativo puede ser similar al de los individuos sanos. Pero en algunas situaciones los pacientes tienen una enfermedad de base, por lo que presentan concentraciones y variabilidades biológicas intraindividuales mayores, lo que implica conocer qué variabilidad biológica intraindividual tenemos que aplicar en esta población. Aunque en el cribado del HCC con AFP no hay acuerdo entre todas las sociedades científicas, aquellas que la recomiendan, como la National Comprehensive Cancer Network y el resto de sociedades que recomiendan su uso, utilizan valores discriminantes de 20μg/l para obtener sensibilidades entre 49% y 71%, con especificidades entre el 49% y el 86%. Para valores de 200μg/l la sensibilidad descrita es del 4% al 31% y la especificidad del 76% al 100%29. Como se ha descrito que la forma más adecuada de interpretar los MT es utilizando criterios dinámicos, en los pacientes en cribado de HCC existe una monitorización del MT y sería fácil la interpretación dinámica de la AFP. La aplicación del VRC podría aportar una mayor claridad a la interpretación de la AFP, especialmente en aquellos pacientes que presentan valores superiores a los valores discriminantes. Para la AFP existe una gran diferencia entre la variabilidad biológica intraindividual de los pacientes con hepatopatía (35%) y sin hepatopatía (12%). Si se aplica el VRC basado en pacientes hepatópatas el incremento a valorar sería del 97%, mientras que para los pacientes no hepatópatas sería del 33,8%. Cuando se estudian poblaciones con hepatopatías en el cribado del HCC, utilizar el VRC obtenido para los individuos sanos aumentaría el número de falsos positivos hasta el 23%, mientras que si se utiliza el VRC específico de los pacientes hepatópatas el número de falsos positivos es del 6%61. El uso del VRC específico para hepatópatas presentó una sensibilidad del 60% para todos los pacientes y del 89% en los pacientes con AFP superior a 20μg/l, con una especificidad del 91% y 94% respectivamente, indicando una mayor rentabilidad diagnóstica de la interpretación dinámica con valores específicos por enfermedades que utilizando cualquier valor discriminante. En la actualidad no se dispone de este tipo datos para otros MT.
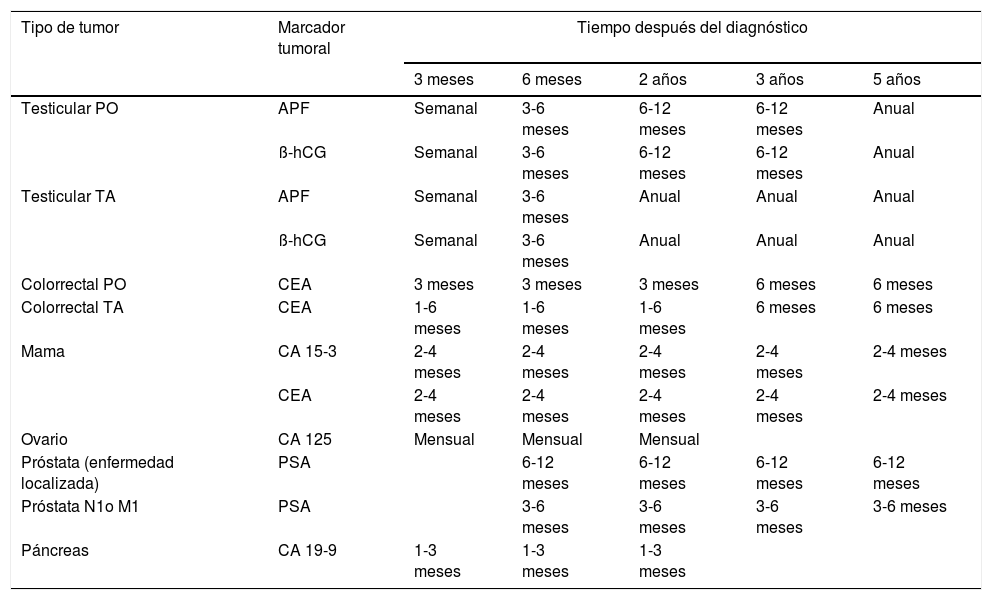
Recomendaciones acerca de la frecuencia apropiada de la medida de un marcador tumoralLa tabla 5 describe los tiempos de la determinación de MT recomendados por las sociedades científicas.
Tiempos de extracción recomendados para la monitorización
| Tipo de tumor | Marcador tumoral | Tiempo después del diagnóstico | ||||
|---|---|---|---|---|---|---|
| 3 meses | 6 meses | 2 años | 3 años | 5 años | ||
| Testicular PO | APF | Semanal | 3-6 meses | 6-12 meses | 6-12 meses | Anual |
| ß-hCG | Semanal | 3-6 meses | 6-12 meses | 6-12 meses | Anual | |
| Testicular TA | APF | Semanal | 3-6 meses | Anual | Anual | Anual |
| ß-hCG | Semanal | 3-6 meses | Anual | Anual | Anual | |
| Colorrectal PO | CEA | 3 meses | 3 meses | 3 meses | 6 meses | 6 meses |
| Colorrectal TA | CEA | 1-6 meses | 1-6 meses | 1-6 meses | 6 meses | 6 meses |
| Mama | CA 15-3 | 2-4 meses | 2-4 meses | 2-4 meses | 2-4 meses | 2-4 meses |
| CEA | 2-4 meses | 2-4 meses | 2-4 meses | 2-4 meses | 2-4 meses | |
| Ovario | CA 125 | Mensual | Mensual | Mensual | ||
| Próstata (enfermedad localizada) | PSA | 6-12 meses | 6-12 meses | 6-12 meses | 6-12 meses | |
| Próstata N1o M1 | PSA | 3-6 meses | 3-6 meses | 3-6 meses | 3-6 meses | |
| Páncreas | CA 19-9 | 1-3 meses | 1-3 meses | 1-3 meses | ||
AFP: α-fetoproteína; β-hCG: gonadotropina coriónica (cadena β); CA 15-3: antígeno carbohidrato 15-3; CA 19-9: antígeno carbohidrato 19-9; CA 125: antígeno carbohidrato 125; CEA: antígeno carcinoembrionario;PO: postoperatorio; PSA: antígeno prostático específico; TA: tratamiento activo.
La frecuencia de determinación de los MT dependerá fundamentalmente del motivo por el cual fueron solicitados. En general, es absurdo repetir los MT en un intervalo inferior a la vida media del marcador, salvo en casos que existan dudas sobre el origen de la muestra. En pacientes en los que la determinación de MT sirva de ayuda para el diagnóstico diferencial, y existan dudas sobre su interpretación, deberán solicitarse de nuevo en un intervalo no inferior a las 3-4 semanas (según concentración del MT), ya que, en un período inferior, los posibles cambios pueden solaparse con el coeficiente de variación interensayo y la variabilidad biológica, dependiendo de la velocidad de crecimiento del tumor.
En los pacientes en los cuales la determinación del MT se hizo para la detección precoz de recidiva, la frecuencia de la determinación también puede variar según el MT, la neoplasia a estudiar y el objetivo de su estudio. En general, se considera que los controles deben ser al menos trimestrales durante los primeros 2-3 años, disminuyendo la frecuencia después. En los casos con incremento debe seguirse la recomendación anterior: repetición a las 3-4 semanas. Para poder sospechar recidiva tumoral se deben cumplir los criterios anteriormente indicados para un cambio significativo.
En los pacientes en seguimiento para valoración de la terapia, los intervalos varían según el tipo de tratamiento. Es aconsejable protocolizar dicha determinación con los facultativos responsables. El EGTM aconseja la determinación de MT en los controles inmediatamente antes de la administración de cada ciclo en los pacientes en quimioterapia, y al menos una vez cada 3 meses en los pacientes en hormonoterapia.
Validación de resultadosEn la validación de resultados de MT deben tenerse en cuenta, además de los procedimientos habituales del laboratorio clínico, los resultados previos (si existen), las concentraciones de los MT determinados y la situación clínica del paciente, para excluir las posibles causas de falsos positivos. La interpretación de los resultados debería basarse en los 3 criterios siguientes1:
- •
Magnitud de la concentración del marcador.
- •
Descartar falsos positivos.
- •
Control evolutivo.
En los apartados anteriores se describe la información necesaria para una correcta validación de los resultados (tablas 2 y 3, interpretación de un cambio significativo).
Podría ser de gran utilidad utilizar comentarios para facilitar la interpretación de los MT especialmente en los casos de sospecha de falsos positivos.
Por ejemplo:
- •
No se realiza SCC, la insuficiencia renal puede incrementar la concentración a más de 10 veces el límite superior de referencia.
- •
Para CA15-3 y NSE la anemia hemolítica puede incrementar la concentración a más de 10 de veces el límite superior de referencia.
- •
Elevaciones moderadas de SCC o S100B, descartar enfermedad dermatológica.
- •
Elevaciones moderadas de CA19-9 o CEA, descartar enfermedad gastrointestinal especialmente gastritis, esofagitis, enfermedad de Crohn o diverticulitis. Se recomienda control evolutivo en un mes.
- •
Tener especial cuidado en la integridad de la muestra (hemólisis, temperatura de transporte, de almacenaje y tiempo hasta la centrifugación y el análisis).
- •
Selección adecuada de los MT para las características patológicas de cada paciente: seguimiento, ayuda al diagnóstico y pronóstico.
- •
Los MT no son útiles como prueba de cribado en la población general. Los MT no deben solicitarse en pacientes sin síntomas o criterios sugestivos de neoplasia.
- •
Selección de otras magnitudes biológicas para una correcta interpretación de los MT como marcadores de la función renal, hepática, hemólisis intravascular, hemograma, etc. Evaluación conjunta con los MT.
- •
Verificar técnicas de medida con los criterios de Clinical and Laboratory Standards Institute o similares.
- •
Instaurar controles alrededor de los valores discriminantes: límite de detección (PSA y tiroglobulina), límite superior de referencia y un valor alto 5-20 veces el límite superior de referencia.
- •
Selección del valor discriminante adecuado según estado clinicopatológico, ayuda al diagnóstico o seguimiento (prostatectomía radical, monitorización de pacientes metastásicos en tratamiento farmacológico).
- •
Comprobar los incrementos de los MT con una nueva determinación a las 3-4 semanas, interpretando incrementos superiores al 25% o al VRC como muy sugestivo de progresión.