El infliximab (IFX), un anticuerpo quimérico contra el factor de necrosis tumoral-alfa, es utilizado en el tratamiento de pacientes con diversas enfermedades inflamatorias, pero puede originar la formación de anticuerpos antiquiméricos humanos (HACA). La presencia de HACA y niveles séricos de IFX bajos se han asociado con falta o pérdida de respuesta y con la aparición de reacciones infusionales. Evaluamos la utilidad de la cuantificación de IFX y HACA.
Material y métodosIFX y HACA se midieron utilizando una técnica ELISA relativamente nueva en una cohorte de 110 pacientes tratados con IFX. Se recogieron muestras de suero inmediatamente antes de la siguiente infusión del fármaco. Los pacientes habían recibido una mediana de dosis de 5mg/kg, con intervalos de dosis ajustados a la actividad de la enfermedad, habitualmente cada 8 semanas. La mediana del número de infusiones fue 17.
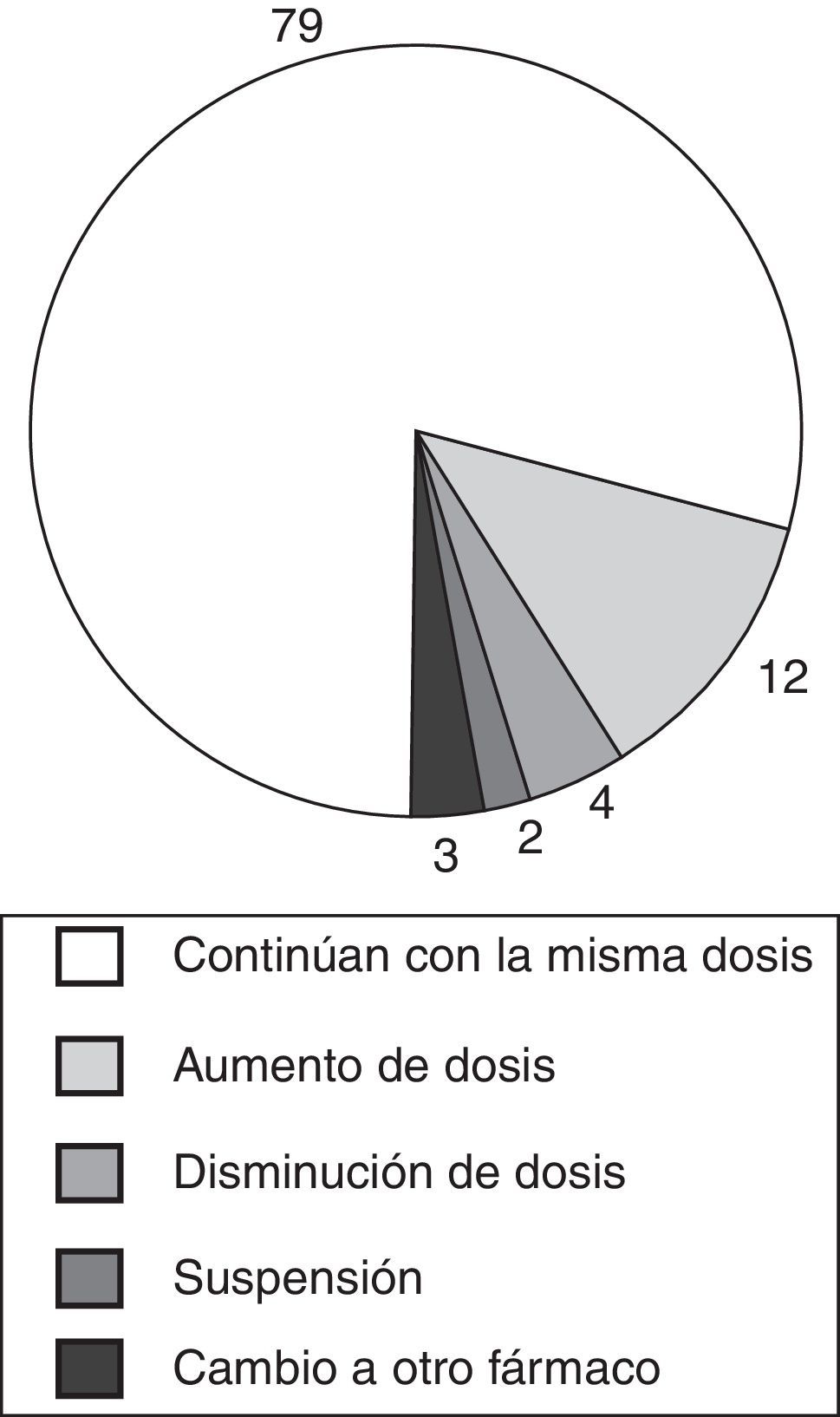
ResultadosLos HACA se detectaron en 10 pacientes y se midieron concentraciones terapéuticas de IFX en 37 casos. Ocho de los 10 pacientes con HACA positivos tenían trastornos digestivos y en 9 de ellos el tratamiento fue suspendido. El uso concomitante de inmunosupresores no redujo el riesgo de formación de HACA. Entre los 100 pacientes sin HACA, 79 continuaron con la misma dosis, 16 requirieron un ajuste de dosis, en 2 se suspendió el tratamiento y 3 pacientes fueron cambiados a otro agente biológico.
ConclusionesLas concentraciones de IFX y HACA en sangre deberían ser monitorizadas en pacientes que reciben IFX, ya que puede ser útil para optimizar los regímenes de dosis o evitar el uso de terapias inadecuadas.
infliximab (IFX), a chimeric antibody against tumour necrosis factor-alpha, is used in the treatment of patients with several inflammatory diseases, but it can lead to the formation of human anti-chimeric antibodies (HACA). HACA and low IFX serum levels have been associated with lack or loss of response, and infusion reactions. The usefulness of measuring the IFX and HACA concentrations is evaluated.
Material and methodsIFX and HACA were measured using a relatively new ELISA technique in a cohort of 110 patients treated with IFX. Serum samples were collected immediately before patients were given the next drug infusion. The patients had received a median dose of 5mg/kg, with dose intervals adjusted to the patient's disease activity, usually every 8 weeks. The median number of infusions was 17.
ResultsHACA were identified in 10 patients, and therapeutic IFX concentrations were observed in 37 patients. Eight out of 10 positive HACA patients had gastrointestinal disorders, and the therapy was discontinued in 9 of them. The concomitant use of immunosuppressants did not reduce the risk of HACA formation. Among 100 patients with no HACA, 79 continued on the same dose, 16 required a dose adjustment, 2 discontinued treatment, and 3 were switched to another biological agent.
ConclusionsBlood IFX and HACA concentrations should be monitored in patients receiving IFX, as it may be useful to optimize dose regimens or avoid use of inadequate therapy.
El infliximab (IFX) es un anticuerpo monoclonal quimérico que bloquea selectivamente el factor de necrosis tumoral alfa (TNF-α), al que se une con alta afinidad impidiendo la unión a sus receptores TNF-RIp55 y TNF-RIIp75, y por tanto sus acciones. El TNF-α está involucrado en varios procesos biológicos tales como aquellos que modulan la inducción de citocinas proinflamatorias, la apoptosis o la adhesión celular, jugando un papel destacado en la patogénesis de varias enfermedades. El IFX está indicado en el tratamiento de patologías que tienen como característica común la presencia de inflamación1.
Al igual que cualquier otra proteína, el IFX puede producir inmunogenicidad dando lugar a la aparición de anticuerpos antiquiméricos humanos (HACA) también denominados anticuerpos antiinfliximab. Estos anticuerpos están relacionados con la aparición de reacciones infusionales, las cuales pueden obligar a la interrupción de la infusión o incluso a la suspensión del tratamiento2. Además, los HACA pueden facilitar el rápido aclaramiento del fármaco, lo cual origina una concentración valle baja de la droga y por tanto una pérdida de eficacia del tratamiento3.
La utilidad de la cuantificación de IFX y HACA es su contribución en la detección de las posibles causas del fallo del tratamiento en pacientes no respondedores. Existen pacientes no respondedores primarios (NR1°) cuya definición clínica es la falta de respuesta al tratamiento en la fase de inducción, y pacientes no respondedores secundarios (NR2°) con pérdida de eficacia en la fase de mantenimiento. Cuando un paciente es un NR1° está indicado el cambio de fármaco a otro con diferente diana terapéutica, por ejemplo interleucina 6, linfocitos T o B, mientras que en los casos de NR2° está recomendado cambiar a otro anti-TNF-α (adalimumab, etanercept, etc.). Por tanto, la ausencia o pérdida de respuesta al tratamiento debe ser identificada tan pronto como sea posible y la cuantificación de IFX y HACA contribuirá a conocer la causa.
El objetivo de este estudio fue medir IFX y HACA en pacientes tratados con IFX en el curso de diversas enfermedades inflamatorias, para contribuir a la evaluación del estado clínico de los pacientes y tomar las decisiones terapéuticas apropiadas, o incluso anticipar el fracaso terapéutico en los casos en que los HACA sean detectados.
Material y métodosSe ha realizado un estudio transversal. Un total de 110 pacientes que estaban recibiendo tratamiento con IFX (Remicade®) en el Complejo Hospitalario de Navarra, 61 varones (edad 47 años, [rango intercuartílico {IQR} 40-57]) y 49 mujeres (edad 50 años, [IQR 38-61]) fueron incluidos. El tratamiento estándar consistía en infusiones de 3-5mg/kg en las semanas 0, 2 y 6, y posteriormente cada 8 semanas. Los pacientes habían recibido una dosis de 5mg/kg (IQR 5-5, rango de 3 a 10mg/kg) con intervalos de dosis ajustados a la actividad de la enfermedad. La mediana del número de infusiones fue de 17 (IQR 10-30). Además, 38, 14, 5 y un paciente habían sido tratados concomitantemente con metotrexato (MTX), azatioprina, leflunomida y 6-mercaptopurina respectivamente. Veintisiete pacientes diagnosticados de espondilitis anquilosante (EA), 26 con enfermedad de Crohn (EC), 14 con colitis ulcerosa (CU), 19 con artritis reumatoide (AR), 15 con artritis psoriásica (APSO), 4 con psoriasis (PSO), 4 con artritis asociada a enfermedad inflamatoria intestinal (A+EII), y uno con vasculitis sistémica (VS) conformaron la población de estudio. El estudio fue aprobado por el Comité Ético de Investigación Clínica de Navarra (CEIC).
Inmediatamente antes de la siguiente infusión se recogieron datos clínicos y se registraron las reacciones infusionales que habían presentado los pacientes durante la infusión previa. Una reacción infusional se definió como cualquier evento razonablemente compatible con reacción de hipersensibilidad durante la infusión del tratamiento.
Se extrajo sangre en tubo Vacutainer con gel separador justo antes de la siguiente infusión. El suero obtenido tras centrifugación fue alicuotado y almacenado a -20°C hasta el momento de la determinación de IFX y HACA. La concentración de IFX y HACA libres se midió mediante ELISA cuantitativo (Promonitor, ref. PIFX-10200PG, Proteomika S.L., Vizcaya, España) que había sido adaptado en un equipo System DSX (Dynex Technologies). Dado que los HACA son anticuerpos neutralizantes del fármaco IFX y que la técnica solo detecta HACA e IFX libres, solo puede ser detectado en un mismo paciente HACA o IFX, el que de los dos esté en exceso. El fabricante del ELISA recomienda valores terapéuticos de IFX solo para pacientes con AR. Categorizamos los sujetos en tres grupos conforme a dichos puntos de corte preestablecidos: concentración de IFX<0,05μg/mL era considerada indetectable, 0,05-1,5μg/mL subterapéutica y >1,5μg/mL era terapéutica.
El análisis estadístico se realizó usando el programa estadístico SPSS versión 20. La distribución de variables se analizó mediante la aplicación de la prueba de Shapiro-Wilk. Una vez comprobada la distribución no normal de la población (p=0,000) se aplicó estadística no paramétrica, siendo su descriptiva mostrada como mediana y rango intercuartílico (IQR). Las diferencias entre grupos se analizaron mediante la prueba exacta de Fisher. Valores de p<0,05 se consideraron significativos.
ResultadosEn los 110 pacientes estudiados la concentración de IFX fue de 0,67μg/mL (IQR 0,05-2,75). Un 24% de los pacientes tenía IFX indetectable, el 42% IFX sub-terapéutico y el 34% IFX en concentración terapéutica. La mediana de concentración (IQR) de IFX fue de 0,39μg/mL (0,17-0,79) y 4,95μg/mL (2,45-11,21) en los pacientes con IFX en rango subterapéutico y terapéutico, respectivamente.
Se detectaron HACA (>37 UA/mL) en 10 pacientes (9%), por lo que su concentración de IFX libre fue indetectable. La concentración de HACA osciló entre 40 y 46.705 UA/mL. El tratamiento inmunosupresor concomitante no se asoció significativamente con la ausencia de HACA cualquiera que fuera el agente utilizado: MTX (p=0,328), azatioprina (p=0,285), leflunomida (p=0,755) y 6-mercaptopurina (p=0,209).
La figura 1 recoge la decisión tomada respecto al tratamiento en los 100 pacientes en los que no se detectaron HACA.
La tabla 1 muestra las principales características de los pacientes con HACA positivos, así como en orden cronológico sus principales hallazgos clínicos en el momento de la cuantificación de IFX y HACA, y a partir de entonces, la decisión terapéutica tomada. Se detectaron HACA en un paciente (caso 8) que solo había recibido 4 infusiones. Cabe reseñar que 5 de 10 pacientes tenían CU y 3 de 10 tenían A+EII. Por tanto, la prevalencia de HACA fue mucho más alta en enfermedades digestivas inflamatorias que en enfermedades reumatológicas (p=0,014).
Estado clínico y decisión terapéutica en el momento de la detección de HACA
| Caso | Sexo | Inf. n° | HACA UA/mL | Diagnóstico | Decisión |
| 1 | V | 6 (rt) | 1.003 | CU | Brote: dolor abdominal, rectorragia, NR2°. Cambio biológico: adalimumab. |
| 2 | M | 5 (rt) | 40 | CU | 2.ª reacción infusional: prurito, aumento TA. Brote: rectorragia, tenesmo. NR2°. Cambio biológico: adalimumab. |
| 3 | M | 18 | 353 | CU | Mejoría: suspensión. HACA: predictor NR2°. Vigilar |
| 4 | V | 6 | 96 | CU | Enfermedad activa. Aumento dosis: negativización HACA, IFX indetectable. No mejoría: incontinencia fecal. Probable cambio biológico. Continúa |
| 5 | M | 15 | 46.705 | CU | 2.a reacción infusional: náuseas, erupción. HACA: predictor NR2°, suspensión. Vigilar |
| 6 | M | 18 | 50 | A+EII | Brote A: dolor, inflamación. NR2°. Cambio biológico: adalimumab. |
| 7 | V | 27 | 119 | A+EII | Estable. Reacción infusional: urticaria durante la siguiente inf. HACA: predictor NR2°, suspensión. Vigilar |
| 8 | V | 4 | 1.248 | A+EII | Presíncope: bradicardia. HACA: predictor NR2°, suspensión. Cambio biológico: etanercept. |
| 9 | M | 41 | 380 | AR | Estable. HACA: predictor NR2°, suspensión. Vigilar |
| 10 | M | 6 | 66 | APSO | Adelanto dosis: HACA 62 UA/mL. No mejoría: dolor, inflamación. Vigilar. Brote poliarticular. NR2°. Cambio biológico: adalimumab |
A: artritis; A+EII: artritis asociada a enfermedad inflamatoria intestinal; APSO: artritis psoriásica; AR: artritis reumatoide; CU: colitis ulcerosa; HACA: anticuerpos antiquiméricos humanos; IFX: infliximab; Inf. n.°: número de infusiones recibidas; M: mujer; NR2°: no respondedor secundario; TA: tensión arterial; V: varón; rt: retratamiento.
La AR es la enfermedad en la que hay más experiencia con el uso de IFX como inmunomodulador. El estuche analítico aquí utilizado es relativamente nuevo habiendo obtenido el marcado CE en el año 2010; establece únicamente rangos terapéuticos de fármaco para AR. No existen todavía criterios aceptados respecto a puntos de corte terapéuticos de fármaco en otras enfermedades inflamatorias distintas a la AR. Así por ejemplo, Steenholdt4 y Baert5 en pacientes con EC establecieron puntos de corte de IFX tan dispares como 0,5μg/mL y 12μg/mL, respectivamente. Arbitrariamente, Van den Bemt6 utilizó tres niveles de IFX, bajo <1mg/L, medio 1-5mg/L y alto >5mg/L en pacientes con AR. Se ha publicado igualmente un punto de corte de IFX de <1μg/mL en la PSO7. Estas diferencias se fundamentan principalmente en la falta de uniformidad en las poblaciones estudiadas, posologías, duración de los estudios y también de forma importante en las diferentes técnicas utilizadas. No existe actualmente una técnica «gold standard» para la determinación del fármaco y sus anticuerpos. Sería pues necesario establecer puntos de corte propios en cada enfermedad para así ajustar mejor las dosis.
La población estudiada es muy heterogénea, tanto en términos de número de enfermedades como en el número de pacientes incluidos en cada grupo, así como en el número de infusiones recibidas. Esto se refleja en el rango de concentración de IFX que osciló entre <0,05 y 72μg/mL. A falta de puntos de corte terapéuticos propios para cada enfermedad asumimos genéricamente los recomendados por el fabricante del ELISA para AR. Se puso en evidencia nuevamente la heterogeneidad poblacional al encontrar un 24, 42 y 34% de pacientes con concentración indetectable, subterapéutica y terapéutica, respectivamente. No obstante a lo anterior, las decisiones terapéuticas fueron tomadas teniendo en cuenta la concentración del fármaco y la presencia o ausencia de HACA y se realizaron individualizadas paciente por paciente.
Las estrategias de manejo del paciente incluyen el aumento o disminución de dosis, el acortamiento de los intervalos entre infusiones, cambios a otro anti-TNF-α o cambio de diana terapéutica2. En los pacientes sin HACA, la decisión de aumentar, disminuir o interrumpir el tratamiento, tuvo en cuenta en primer lugar el estado clínico del paciente y en segundo lugar la concentración de IFX. El 79% de los pacientes sin anticuerpos antiinfliximab continuaron con la misma dosis. Se aumentó la dosis en 12 pacientes en los que se había observado un empeoramiento clínico o el paciente tenía una concentración de IFX subterapéutica. Los 4 pacientes en los que se redujo la dosis estaban clínicamente estables. La interrupción del tratamiento se produjo en 2 pacientes, en un caso debido a remisión clínica y en el otro debido a falta de respuesta, siendo probablemente este paciente un NR1° ya que solo había recibido 3 dosis (fase de inducción). Dos pacientes fueron cambiados a otro anti-TNF-α (adalimumab y golimumab) y un tercer paciente fue cambiado a abatacept, un agente inhibidor de la coestimulación de linfocitos T, debido a que el paciente prefería continuar con medicación intravenosa.
El desarrollo de anticuerpos está relacionado con la dosis de fármaco y disminuido con el uso de inmunosupresores como el MTX. De acuerdo a la bibliografía, el MTX y la azatioprina parecen proteger contra el desarrollo de HACA5,8, aunque también han sido publicados datos en sentido contrario9,10. En este estudio la presencia de HACA fue similar en el grupo que había recibido MTX que en el que no. En los pacientes con HACA detectados, 4, 2 y un paciente estaban siendo tratados concomitantemente con MTX, azatioprina y 6-mercaptopurina, respectivamente. Aunque en la población total de 110 pacientes el MTX no parece proteger frente a la inmunogenicidad, solo el 14% de los pacientes con EII recibió MTX, frente al 57, 34, 64 y 100% de pacientes con AR, EA, APSO y PSO, respectivamente que estaban siendo tratados con el mismo. Ello podría explicar que 8 de 10 pacientes con HACA detectados tuvieran patologías digestivas. Respecto a los otros inmunosupresores, también habían sido menos prescritos en patologías digestivas que reumatológicas, a excepción de en la EA.
El tratamiento con IFX se suspendió en el 90% de los pacientes que desarrollaron HACA al considerar en 5 casos que los anticuerpos eran un factor predictivo de pérdida de respuesta (NR2°) y en 4 un empeoramiento de la clínica, siendo en ese momento clasificados como NR2°. Es ampliamente aceptado que la inmunogenicidad de las drogas biológicas es la causa principal de pérdida de respuesta clínica al tratamiento y está relacionada con una pobre supervivencia farmacológica7,11.
Los HACA también han sido asociados con un aumento del riesgo de reacciones infusionales y ambos están relacionados con la suspensión del tratamiento5,12. En nuestra población, entre los pacientes con HACA un 40% tuvieron al menos una reacción infusional en comparación con el 2% de aparición en pacientes sin HACA. Las reacciones infusionales pueden obligar a premedicar al paciente, enlentecer la perfusión, interrumpirla o incluso suspender el tratamiento13.
En el presente estudio, los HACA se detectaron antes de la quinta infusión, lo cual sustenta la observación de que la inmunización puede iniciarse pronto tras el comienzo del tratamiento9. Por tanto, la concentración circulante de IFX libre debiera conocerse cuanto antes, estando recomendada su determinación a partir de la 3.ª infusión en caso de falta de respuesta clínica.
Aun cuando la presencia de anticuerpos está relacionada con el cese del tratamiento, en pacientes con títulos relativamente bajos de HACA libres un aumento de dosis de fármaco puede resultar beneficioso para el paciente. El propósito del aumento de dosis es alcanzar una concentración de IFX superior a la de HACA, de modo que los HACA no neutralicen todo el fármaco, dejando IFX libre y por tanto activo y eficaz en el tratamiento. En estos casos parece haber dos tipos de respuesta. En la primera, una dosis mayor de anti-TNF-α neutraliza los HACA (caso 4, tabla 1), y en la segunda en la que los anticuerpos continúan siendo detectados posteriormente (caso 10, tabla 1). En ambos pacientes el IFX continuó indetectable y ninguno de ellos mejoró. Pascual et al.9 han publicado igualmente dos tipos de respuestas tras el incremento de dosis, sin embargo según estos autores los pacientes que negativizaron los HACA mejoraron clínicamente alcanzando concentraciones mensurables de fármaco, mientras que en aquellos en los que no se neutralizaron, los HACA aumentaron progresivamente llegando incluso a producir reacciones infusionales. Factores genéticos podrían explicar esta diferencia en la respuesta farmacológica.
Teniendo en consideración la condición clínica del paciente, podemos concluir que la medición de HACA y de IFX es útil en la práctica clínica, no solo para optimizar la dosis o cambiar la diana terapéutica, sino también para prevenir reacciones infusionales y la administración de tratamientos ineficaces.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.