Únicamente el 25-30% de los pacientes sometidos a biopsia prostática por un antígeno prostático específico (PSA) sérico elevado padecen cáncer de próstata (CP). La consideración de la variación biológica del PSA en la interpretación de los resultados, mediante el valor de referencia del cambio (VRC), puede ser una herramienta eficaz para mejorar la selección de pacientes candidatos a este procedimiento invasivo. Se ha estudiado su utilidad para establecer la significación clínica de los incrementos anuales del PSA y se ha evaluado la capacidad diagnóstica combinada del VRC, la velocidad de crecimiento de PSA (VcPSA), la densidad de PSA (dPSA) y el cociente PSA libre/PSA total (IPSA).
Material y métodosSe realizó un estudio retrospectivo en 69 pacientes que presentaban VcPSA>0,75 ng/mL/año y estudio anatomopatológico tras biopsia, 15 de ellos con diagnóstico de CP, recopilándose también los valores de IPSA y dPSA. El VRC del PSA se estimó a partir de los datos de variación de biológica recogidos en las bases de datos internacionales.
ResultadosCon una imprecisión de 3,4%, el VRC obtenido para el PSA total fue de 42%, con el que se reevaluaron los incrementos anuales observados. Con este valor discriminante solo 16 (23,2%) pacientes habrían sido biopsiados, 7 de ellos con diagnóstico de CP, duplicando el valor predictivo positivo (VPP) de la prueba. La utilización conjunta de todos los parámetros calculados demostró un incremento notable del VPP de la prueba.
ConclusionesEl empleo del VRC del PSA como valor de decisión clínica podría reducir sustancialmente el número de biopsias innecesarias.
Only 25-30% of patients undergoing prostate biopsy due to an abnormal serum prostate specific antigen (PSA) suffer from prostate cancer (PC). The consideration of PSA biological variation, using the reference change value (RCV), in the interpretation of laboratory values can be an effective tool to identify candidate patients for this invasive procedure. The aim of the study was to establish the usefulness of the RCV to assess the clinical significance of annual PSA increases and evaluate the combined diagnostic capacity of RCV, PSA velocity (VPSA), PSA density (DPSA) and ratio of free PSA/total PSA (PSAI).
Material and methodsWe performed a retrospective study in 69 patients with VcPSA>0.75 ng/mL/year and histopathological studies after prostate biopsy, 15 of them with PC diagnosis. IPSA and PSAd values for those subjects were also collected. RCV for PSA was calculated from the biological variation data collected from international databases.
ResultsWith a 3.4% analytical imprecision, the RCV for total PSA was 42% and this cut-off was used in the assessment of the annual PSA increase. Only 16 (23.2%) patients would have undergone biopsy, 7 of them with PC diagnosis, which doubles the positive predictive value (PPV) of the test. Further increases of PPV could be shown with the combined assessment of all derived parameters.
ConclusionsThe use of RCV for PSA as the value of clinical decision could substantially reduce the number of unnecessary biopsies.
El cáncer de próstata (CP) es una de las principales causas de morbi-mortalidad en varones a nivel mundial1,2. En España, el CP es el tercer tumor más frecuente en varones, con una incidencia estimada de 77,2 casos por 100.000 habitantes, lo que nos sitúa en una posición intermedia baja dentro del contexto de la Unión Europea2,3. En cuanto a la tasa de mortalidad, el CP es también el tercer tumor maligno en hombres españoles, tras el cáncer de pulmón y el colorrectal, superando las 5.000 muertes al año4. Esta elevada mortalidad se debe a que los tratamientos disponibles sólo son eficaces en estadios precoces de la enfermedad (estadios A y B), cuando el tumor es intracapsular. Por lo tanto, el principal objetivo de las campañas de prevención del CP es su detección en estadios precoces mediante la realización de un cribado poblacional basado en la determinación sérica del antígeno prostático específico (PSA), el mejor marcador tumoral disponible en la actualidad, en combinación con un tacto rectal5,6.
Los datos epidemiológicos recogidos en la última década muestran un incremento en la detección del CP1,2 y una disminución en la mortalidad2 desde la implantación del cribado de PSA. Sin embargo, no existe consenso a este respecto entre los distintos autores, estando fuertemente cuestionado su empleo rutinario debido, entre otras cosas, a la falta de sensibilidad y especificidad de la determinación de PSA, especialmente con valores moderadamente elevados (4-10 ng/mL).
Con el fin de aumentar la sensibilidad y la especificidad de la determinación de PSA, se han desarrollado diversas estrategias de valoración, entre las que destacan, la velocidad de crecimiento de PSA (VcPSA), la densidad de PSA (dPSA) y el cociente PSA libre/PSA total (IPSA). La utilidad de la observación de los incrementos anuales en la concentración de PSA (VcPSA) para diferenciar entre CP e hipertrofia benigna de próstata (HBP) ha sido señalada por diversos autores, recomendándose emplear un punto de corte de 0,75 ng/mL/año para la identificación de pacientes con CP7,8. Otros autores destacan el interés de la densidad de PSA, definida como el índice resultante del cociente entre el PSA sérico y el volumen prostático obtenido mediante ecografía transrectal, para el diagnóstico diferencial de CP, empleándose como punto de corte valores de dPSA superiores a 0,15 ng/mL9,10. En los últimos años, el método más extendido para mejorar la especificidad del PSA es el estudio del IPSA, ya que se ha comprobado que los pacientes con CP tienen un IPSA inferior al de pacientes con HBP o individuos sanos. La mayoría de los autores aconsejan el empleo de un cociente inferior al 15% como sospecha de neoplasia11,12.
Ninguno de estos parámetros permite alcanzar unos valores de sensibilidad y especificidad adecuados, lo que provoca que sólo un 25-30% de los pacientes identificados con riesgo de CP presentan resultados positivos tras la biopsia13,14. Un concepto que podría ser de gran utilidad para una correcta interpretación de los resultados bioquímicos es la variación biológica inherente a las concentraciones séricas de PSA. La variación biológica de una magnitud bioquímica es la responsable de las fluctuaciones aleatorias que no pueden ser explicadas por cambios asociados a la edad, presencia de procesos patológicos o ritmos cíclicos y combina la variación biológica intraindividual (CVI) e interindividual (CVG). La CVI se define como una fluctuación aleatoria alrededor de un punto de ajuste homeostático, mientras que la CVG se define como la diferencia entre los puntos de ajuste homeostáticos de los individuos15,16. Una de las principales aplicaciones de los datos de variación biológica es la estimación del valor de referencia del cambio (VRC), el cual proporciona información sobre cual es el cambio mínimo necesario para que las diferencias entre dos resultados consecutivos de un individuo sean consideradas clínicamente significativas16,17.
La naturaleza de la variación biológica del PSA total ha sido ampliamente estudiada por numerosos autores18–21, encontrándose en las bases de datos internacionales de variación biológica22. Sin embargo, su utilización rutinaria está muy poco extendida, aún cuando el empleo del VRC podría ser una herramienta altamente eficaz para la adecuada interpretación de los cambios en la concentración de PSA a lo largo del tiempo y reducir de este modo el número de pacientes sometidos a biopsias innecesarias.
El objetivo de este estudio ha sido analizar la utilidad del VRC para evaluar la significación clínica de los incrementos anuales observados en la concentración sérica del PSA. Así mismo, se evaluó si el empleo combinado del VRC junto a la determinación del índice y la densidad de PSA incrementa la capacidad diagnóstica de la prueba para la detección de cáncer de próstata.
Material y métodosDiseño del estudioSe realizó un estudio retrospectivo sobre la población incluida en el protocolo de diagnóstico y detección precoz de CP del área de atención del Hospital San Agustín (Avilés, Asturias). Se recopilaron los resultados de PSA total (ECLIA, Roche Diagnostics) obtenidos durante 12 meses, con el fin de calcular los valores de VcPSA. Los criterios de incorporación al estudio fueron: a) edad: 50-74 años; b) VcPSA antes del diagnóstico>0,75 ng/mL/año, y c) estudio anatomopatológico tras biopsia prostática. Debido a las complicaciones logísticas y éticas asociadas, no es posible disponer de un grupo control de individuos sanos, por lo que se ha realizado una comparación del rendimiento diagnóstico de las diferentes estrategias disponibles con respecto a la biopsia prostática, prueba considerada “gold estándar” para el diagnóstico de cáncer de próstata.
El número de sujetos seleccionados fue de 69 (edad media: 66,7 años), 15 de ellos con diagnóstico de CP. Para estos sujetos el estudio se completó con la recopilación de datos de PSA libre (ECLIA, Roche Diagnostics) y del volumen prostático obtenido por ecografía transrectal. Los valores de PSA libre recogidos coinciden con la fecha de la última determinación de PSA total empleada en el cálculo de la VcPSA, mientras que los volúmenes prostáticos recopilados se corresponden con ecografías transrectales realizadas en un periodo no superior a±1 mes con respecto a esta fecha. De los 69 sujetos iniciales, se obtuvieron valores de PSA libre y del volumen prostático en 48 y 33, respectivamente. Estos datos fueron empleados en el cálculo del IPSA y de la dPSA.
Estimación del VRCLa estimación del VRC para PSA total, es decir el cambio necesario para que la diferencia entre dos resultados consecutivos de un individuo sea considerada clínicamente significativa, se realizó mediante la fórmula16:
donde: Z=1,64; estadístico unidireccional para una probabilidad del 95%; CVA; coeficiente de variación analítico; CVI; coeficiente de variación intraindividual.El CVA para la determinación de PSA total en nuestro laboratorio es del 3,4%, valor promedio de la imprecisión obtenida durante un período de dos meses al procesar diariamente un liofilizado de origen humano con dos niveles de concentración (Preci-Control Tumor Marker, Roche Diagnostics). El CVI del PSA total es 18,1%, dato recogido de las bases de datos internacionales de variación biológica22.
Análisis estadísticoEl análisis de los datos se realizó con el programa SPSS (versión 11.0 para Windows, SPSS Inc, Chicago, IL, USA). La distribución de las variables se estudió mediante la prueba de Shapiro-Wilk, mientras que la comparación de las medias se realizó mediante la prueba t de Student para variables independientes. En todos los casos se consideró estadísticamente significativo un valor de p<0,05. Los resultados obtenidos se expresan como media±desviación estándar.
Para la estimación de los valores de sensibilidad, especificidad, falsos positivos y valores predictivos, así como sus respectivos intervalos de confianza al 95% (IC 95%), se empleó el programa estadístico EpiDat (versión 3.1 para Windows, Xunta de Galicia, Organización Panamericana de la Salud).
La aplicación de las formulas para el cálculo del VRC y la estimación de los parámetros IPSA y dPSA, se realizó en una hoja de cálculo Excel.
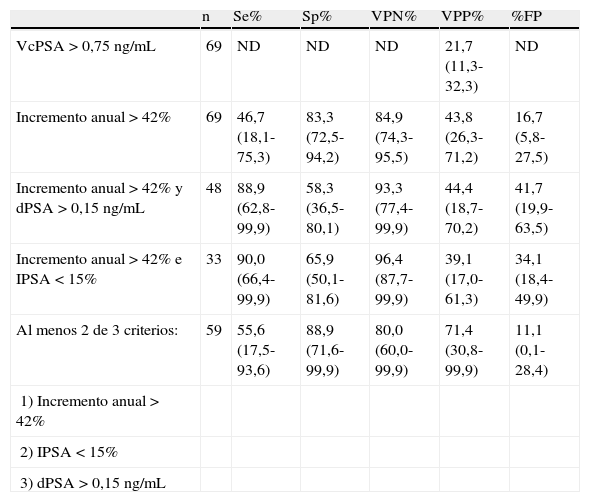
ResultadosLa VcPSA media observada en el grupo de estudio es de 2,16±1,42 ng/mL/año, encontrándose diferencias estadísticamente significativas (p<0,05) entre los valores medios del grupo de pacientes diagnosticados a posteriori de cáncer de próstata (2,83±1,23 ng/mL/año) y el grupo de pacientes libres de enfermedad (1,97±0,44 ng/mL/año) (tabla 1). El valor predictivo positivo (VPP) para la VcPSA, empleándose el punto de corte clásico de 0,75 ng/mL/año, fue únicamente del 21,7% (IC 95%: 11,3-32,3%). El diseño del estudio, que implicó sólo a sujetos presentando resultados >0,75 ng/mL/año para la VcPSA, impide la estimación de la sensibilidad, la especificidad y el valor predictivo negativo (VPN).
Valores medios de VcPSA, IPSA y dPSA hallados en el grupo de pacientes libres de enfermedad y el grupo diagnosticado a posteriori de CP
| VcPSA (ng/mL/año) | IPSA | dPSA (ng/mL) | |
| Grupo pacientes libres de enfermedad | 1,97±0,44a | 16,31±4,70 | 0,16±0,07 |
| Grupo pacientes con CP | 2,83±1,23 | 10,63±4,91 | 0,30±0,19 |
CP: cáncer de próstata; dPSA: densidad de PSA; IPSA: cociente PSA libre/PSA total; VcPSA: velocidad de crecimiento de PSA.
El VRC obtenido para el PSA total teniendo en cuenta sus datos de variación biológica fue del 42%. Los incrementos anuales recogidos para los sujetos del estudio fueron reevaluados frente a este valor discriminante, encontrándose que de los 69 pacientes de riesgo según el valor de VcPSA, y por tanto sometidos a biopsia prostática, sólo 16 (23,2%) habrían sido biopsiados, 7 de ellos con diagnóstico de CP. Los valores de sensibilidad, especificidad, VPN y VPP se recogen en la tabla 2. Debido al diseño experimental, estos resultados no deben considerarse como valores absolutos sino como variaciones sobre el rendimiento diagnóstico que obtendríamos sólo con la VcPSA.
Rendimiento diagnóstico de la velocidad de crecimiento de PSA, individualmente y de forma combinada con la densidad de PSA y el cociente PSA libre/PSA total
| n | Se% | Sp% | VPN% | VPP% | %FP | |
| VcPSA>0,75 ng/mL | 69 | ND | ND | ND | 21,7 (11,3-32,3) | ND |
| Incremento anual>42% | 69 | 46,7 (18,1-75,3) | 83,3 (72,5-94,2) | 84,9 (74,3-95,5) | 43,8 (26,3-71,2) | 16,7 (5,8-27,5) |
| Incremento anual>42% y dPSA>0,15 ng/mL | 48 | 88,9 (62,8-99,9) | 58,3 (36,5-80,1) | 93,3 (77,4-99,9) | 44,4 (18,7-70,2) | 41,7 (19,9-63,5) |
| Incremento anual>42% e IPSA<15% | 33 | 90,0 (66,4-99,9) | 65,9 (50,1-81,6) | 96,4 (87,7-99,9) | 39,1 (17,0-61,3) | 34,1 (18,4-49,9) |
| Al menos 2 de 3 criterios: | 59 | 55,6 (17,5-93,6) | 88,9 (71,6-99,9) | 80,0 (60,0-99,9) | 71,4 (30,8-99,9) | 11,1 (0,1-28,4) |
| 1) Incremento anual>42% | ||||||
| 2) IPSA<15% | ||||||
| 3) dPSA>0,15 ng/mL |
Entre paréntesis se muestra el intervalo de confianza al 95%.
% FP: porcentaje de falsos positivos; dPSA: densidad de PSA; IPSA: cociente PSA libre/PSA total; n: número de datos; ND: dato no disponible por diseño experimental; PSA: antígeno prostático específico; Se: sensibilidad; Sp: especificidad; VcPSA: velocidad de crecimiento de PSA; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Los valores medios de IPSA obtenidos en el grupo de pacientes con CP y en el grupo libre de enfermedad fueron 10,63±4,91 y 16,31±4,70, respectivamente. La dPSA obtenida en los grupos de CP y libre de enfermedad fue, respectivamente, de 0,30±0,19 y 0,16±0,07 ng/mL (tabla 1). En ambas magnitudes se observaron diferencias estadísticamente significativas entre los dos grupos (p<0,01).
La capacidad diagnóstica combinada de la dPSA junto con el estudio de los incrementos anuales en la concentración de PSA total empleando como punto de corte de significación clínica el VRC, no mostró mejoras significativas sobre los datos individuales presentados por el VRC, especialmente en lo que se refiere a especificidad y valor predictivo positivo. Resultados similares se obtuvieron cuando se estudio la capacidad diagnóstica combinada del VRC junto con el IPSA, como puede observarse en la tabla 2.
Se evaluó la capacidad diagnóstica combinada de la VcPSA, el IPSA y la dPSA, considerando un resultado de riesgo el que se cumplan al menos dos de los tres criterios de positividad individuales (tabla 2). Los resultados obtenidos muestran un incremento notable en el VPP, si bien no alcanza significación estadística.
DiscusiónEl empleo del cribado con PSA para el diagnóstico precoz de CP es una práctica ampliamente extendida desde su introducción hace más de una década. Sin embargo, tanto su empleo de forma generalizada como su utilidad real en la disminución de la mortalidad por CP son ampliamente discutidas. Entre las organizaciones que no apoyan el cribado se encuentran: US Preventive Services Task Forces23, Canadian Task Force on Preventive Health Care24 y la Red Internacional de Agencias de Evaluación de Tecnologías Sanitarias (INHATA)25. Por su parte, The Nacional Cancer Institute define el cribado con PSA como una estrategia que continua en fase de investigación26. Las principales razones que alegan sus detractores para desaconsejar el empleo del cribado con PSA son: la elevada tasa de sobrediagnóstico asociado al cribado (definido como aquellos pacientes diagnosticados de CP que no desarrollarían síntomas clínicos a lo largo de su vida); la falta de especificidad de la determinación de PSA para la detección de CP con valores moderadamente elevados (4-10 ng/mL) y tacto rectal normal; y el elevado porcentaje de biopsias innecesarias a las que son sometidos los pacientes de cribado.
Por todo ello, hoy en día se continúan ensayando estrategias que permitan mejorar la precisión diagnóstica de la determinación de PSA, entre las que se encuentran la determinación de la fracción libre del PSA o el cálculo de la dPSA y la VcPSA. Sin embargo, algo tan básico como una guía clínica que ayude a interpretar resultados aislados, repeticiones y resultados seriados de PSA teniendo en cuenta tanto la influencia de la variación analítica como la variación biológica del propio PSA sigue sin estar disponible.
El VRC, obtenido a partir de los datos de variación biológica, ha mostrado ser una herramienta altamente eficaz en la interpretación de la significación clínica de los cambios en los resultados bioquímicos de un individuo16,17, pudiendo encontrarse estudios sobre su aplicación en la detección precoz de cáncer hepático mediante la determinación de alfa-fetoproteína27 o en la detección temprana de fallo renal post-transplante mediante la combinación de los VRC de creatinina, urea y ácido úrico28.
De forma similar, hemos empleado el VRC del PSA total para la evaluación de la significación clínica de los incrementos anuales observados en un grupo de pacientes sometidos a biopsia prostática por presentar valores de VcPSA > 0,75 ng/mL/año, con el fin de establecer su utilidad para aumentar la capacidad diagnóstica del PSA en la detección precoz de CP. Los datos obtenidos muestran, que de los 69 pacientes sometidos a biopsia prostática solo 16 (23,2%) habrían sido sometidos a este procedimiento invasivo a costa de clasificar 8 (53%) casos de CP como falsos negativos.
EL VPP obtenido cuando se emplea el VRC como umbral de significación clínica para los incrementos anuales de PSA total superiores a 0,75 ng/mL duplica al observado cuando se emplea sólo el punto de corte basal de 0,75 ng/mL/año, aunque debido al pequeño tamaño muestral no se alcanza significación estadística. Igualmente reseñable es el considerable incremento en especificidad que se obtiene al emplear el VRC en la evaluación de los incrementos anuales de PSA total, la cual alcanza el 83,3% (IC 95%: 72,5-94,2), por tanto, el empleo del VRC daría como resultado una disminución en el número de biopsias innecesarias. Aunque la biopsia prostática se considera habitualmente segura, se han publicado complicaciones asociadas, infecciones entre un 1 y un 7% de los casos29 y hematuria en un 2-4%30, además de un estrés psicológico asociado. Por otra parte, es también posible que el incremento en la especificidad y en el VPP derivado del empleo del VRC conlleve una disminución de la tasa de sobrediagnóstico asociada al cribado, la cual en algunos estudios alcanza valores de hasta un 50%31. Parece lógico pensar, que aquellos individuos con un cáncer de próstata latente, que no produciría síntomas clínicos a lo largo de la vida, presentarán incrementos anuales de PSA total que no superarían los límites para ser considerados dentro del grupo de riesgo según los datos de variación biológica. Sin embargo, serían necesarios estudios más amplios para poder confirmar esta hipótesis.
Ante valores de PSA total entre 4-10 ng/mL es habitual que la indicación diagnóstica se establezca empleando no sólo los valores de la VcPSA, sino también de la dPSA y, fundamentalmente, del IPSA. Por esa razón, hemos evaluado si el empleo combinado de estos parámetros produciría un aumento en la capacidad diagnóstica para el CP. Los resultados obtenidos en nuestro estudio muestran que únicamente el empleo conjunto de todos los parámetros produciría un incremento del VPP sin reducción importante del VPN, con respecto a los encontrados cuando se emplea el VRC en combinación con el VcPSA, no alcanzando sin embargo significación estadística.
En conclusión, los resultados muestran que el empleo combinado del VcPSA y del VRC del PSA total como valor de decisión clínica puede conllevar un importante incremento del VPP del PSA, por lo que su empleo podría reducir sustancialmente el número de biopsias innecesarias y posiblemente la tasa de sobrediagnóstico asociada al cribado de CP. El empleo combinado de los parámetros dPSA, IPSA, VcPSA y VRC para la adecuada indicación de biopsia prostática podría dar resultados beneficiosos. En todo caso, son necesarios estudios adicionales con un mayor número de pacientes para confirmar los resultados aquí presentados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo corresponde a una comunicación científica presentada y premiada en el III Congreso Nacional del Laboratorio Clínico celebrado en Valencia del 14 al 16 de octubre de 2009.