Se ha sugerido que los niveles plasmáticos elevados del factor de crecimiento transformante beta 1 (TGF-beta 1) juegan un papel clave para el desarrollo de las enfermedades que cursan con fibrosis.
ObjetivosEste estudio observacional, transversal, retrospectivo de casos controles busca evaluar si existe asociación entre los niveles plasmáticos de TGF-beta 1 como factor causal en la patogénesis de la hipertensión arterial (HT-A) esencial y la lesión de órganos diana, en pacientes con HT-A esencial refractaria comparado con un grupo de sujetos sanos y comprobar si existe una correlación entre los niveles de TGF-beta 1 y los de PICP (propéptido C-terminal de la molécula de procolágeno tipo I), de degradación MMP-1 (metaloproteinasa de la matriz tipo 1) y degradación del colágeno ICTP (telopéptido C-terminal de la molécula de colágeno tipo I) en el grupo de sujetos hipertensos.
Pacientes y métodosSe estudiaron 52 pacientes diagnosticados de HT-A con edad media de 53 años y se comparó con grupo control de 24 voluntarios sanos con edad media de 45 años. TGF-beta 1 fue medido por método ELISA previa activación de la muestra.
ResultadosLas concentraciones de TGF-beta 1 no fueron mayores en el grupo de hipertensos. La media±desviación estándar fue de 40±13 pg/mL, mientras que en el grupo control fue de 50±23 pg/mL. La t de Student no estableció diferencias significativas.
Conclusionesno se han encontrado niveles elevados de TGF-beta 1 en pacientes con hipertensión esencial en contra de lo evidenciado por otros autores. La exclusión en este estudio de pacientes que presentaban insuficiencia renal moderada o severa, asumimos que pudiera ser la causa de no encontrar elevados los niveles plasmáticos de TGF-beta 1.
It has been suggested that elevated serum transforming growth factor beta1 (TGF-beta 1) levels plays a key role to develope of diseases associated with fibrosis.
ObjectiveThis observational, transversal, retrospective case control study was designed to evaluate the association between TGF-beta 1 as causal factor for the hypertension arterial pathogenesis and damage on target organ. This study was designed to evaluate the association between circulating biomarkers of collagen metabolism and fibrosis in serum to compare TGF-beta1 levels obtained in a group of essential hypertension patients with a group of normotensive healthy subjects.
Patients and methods46 essential hypertension patients, mean age: 53 years versus a control group of 20 healthy volunteers, mean age: 45 years. TGFβ1 was quantitated by a commercial ELISA technique, samples were previously activated.
ResultsTGF-beta 1 concentrations were not higher in essential hypertension patients, mean serum concentration (40±13ng/mL) than in normal group, mean serum concentration (50±23ng/mL). No significant differences were showed between two groups using t- student test.
ConclusionWe have not found elevated TGF-beta 1 concentrations in essential hypertension patients in contrast to what has been shown by other authors. Exclusion of patients with mild or severe renal insufficiency should be considered to be a cause for not obtaining elevated TGF-beta 1 concentrations.
La hipertensión arterial (HT-A) es uno de los problemas de salud más importantes de los países desarrollados y uno de los motivos de consulta más frecuente en Atención Primaria1. En la práctica asistencial se ha optado por una definición operativa de HT-A (cifras de presión arterial; PA ≥ 140/90mmHg) como ayuda para decidir a quién tratar. En España su prevalencia en adultos mayores de 18 años es de aproximadamente un 35%, 40% en edades medias y 68% en mayores de 60 años. La HT-A afecta a un total de 10 millones de sujetos adultos2.
La HT-A es una enfermedad asintomática, fácil de detectar, no complicada de tratar y que con frecuencia tiene graves repercusiones si no recibe tratamiento. Sin embargo, y a pesar de que en los últimos años ha aumentado considerablemente los conocimientos sobre su fisiopatología, el 90-95% de los casos sigue teniendo una etiología desconocida (HT-A esencial o idiopática). Se trata de una patología que tiene repercusiones sobre los diferentes órganos de la economía humana, siendo la afectación cardiaca una de las más importantes por sobrecarga crónica de presión al ventrículo izquierdo, lo que origina una hipertrofia concéntrica del mismo que actúa como mecanismo protector y reparador3. No obstante, esta circunstancia es potencialmente dañina porque estimula la producción de fibrosis reparativa y reactiva, afectando a la reserva vasodilatadora con disminución de la contractilidad y aumento de la rigidez de la cámara ventricular4.
Diversos estudios han sugerido la asociación de esta respuesta hipertrófica con la activación de diversos factores de crecimiento y de citocinas profibróticas5. Otros autores especulan con la existencia de un posible nexo entre inflamación vascular crónica y la HT-A, en un contexto con descenso en las células endoteliales progenitoras circulantes, presencia de disfunción endotelial y aumento de niveles plasmáticos de TGF-beta 16.
Además, TGF-beta 1 se ha sugerido como biomarcador de fibrosis en enfermedad renal, hipertensión pulmonar, enfermedad hepática e insuficiencia cardiaca donde se ha evidenciado la acumulación de fibras de colágeno tipo I y tipo III debido a que su síntesis por los fibroblastos está estimulada y su degradación está inhibida o es normal. El origen de este desequilibrio entre la síntesis y la degradación del colágeno se ha relacionado tanto con factores hemodinámicos como no hemodinámicos y ambientales7–11.
Recientes investigaciones clínicas han permitido identificar un panel de moléculas circulantes que cumplen los criterios para ser considerados como biomarcadores del metabolismo del colágeno en miocardio en pacientes con HT-A12.
En concreto, el propéptido C-terminal de la molécula de procolágeno tipo I (PICP) como marcador de síntesis de colágeno tipo 113, mientras que la metaloproteinasa de la matriz 1 (MMP-1) y un pequeño telopéptido C-terminal de la molécula de colágeno tipo I (ICTP) se han propuesto como biomarcadores de la degradación del colágeno. La actividad de la MMP determina la tasa de recambio de la matriz extracelular, las alteraciones que se generan en este proceso se asocian con la aparición de fibrosis tisular14.
Otros estudios experimentales y clínicos han demostrado en condiciones de normofunción hepática y renal, correlación entre los niveles plasmáticos de TGF-beta 1 y la PA y en pacientes hipertensos con microalbuminuria e hipertrofia del ventrículo izquierdo15–17, hoy éstas y otras investigaciones que estudian las conexiones entre la angiotensina II, funcionalidad mitocondrial, proteínas del citoesqueleto y matriz extracelular cuestionan el papel de TGF-beta 1 como molécula clave que modifica la cantidad y calidad de matriz extracelular con influencia sobre el crecimiento, diferenciación, morfología, supervivencia y movilidad celular; sobre la reorganización del citoesqueleto y modificación de la función mitocondrial18.
Aunque se ha evidenciado niveles circulantes alterados en suero y plasma de TGF-beta 1, PICP, MMP-1 e ICTP en pacientes hipertensos, sigue el debate entre la comunidad científica.
Objetivos del estudioPor lo tanto, el objetivo del presente estudio fue evaluar si existe asociación entre los niveles plasmáticos de TGF-beta 1, como factor causal en la patogénesis de la HT-A esencial y la lesión de órganos diana, en pacientes con HT-A esencial refractaria comparado con un grupo de sujetos sanos y comprobar si existe una correlación entre los niveles de TGF-beta 1 y los de PIP, ICTP y MMP-1 en el grupo de sujetos hipertensos.
Material y métodosPacientesEl diseño del estudio fue observacional, transversal, retrospectivo de casos-controles. Se realizó en el Servicio de Análisis Clínicos en colaboración con la Unidad de Hipertensión del Servicio de Medicina Interna de Hospital Virgen del Rocío de Sevilla. Todos los sujetos estudiados dieron su consentimiento informado para participar en el estudio. El protocolo de estudio se desarrolló de acuerdo a los principios recogidos en la Declaración de Helsinki.
La población estuvo compuesta por 52 enfermos (28 mujeres y 24 varones) con una edad media de 53 años diagnosticados de hipertensión arterial esencial refractaria. Se seleccionaron los pacientes que en la visita de inclusión tenían una PA en consulta > 140mmHg para la sistólica o PAD > 90mmHg para la diastólica, medida con un tensiómetro digital de brazo (OMRON, M6 Comfort) por tres veces, separadas cada dos minutos y se obtuvo la media de las tres determinaciones. Se recomendó a los pacientes que evitasen el ejercicio o cualquier actividad mayor de la usual que pudiese alterar la PA. Las tomas de PA fueron realizadas con el individuo sentado, relajado y en reposo desde al menos 5 minutos antes, sin haber fumado o comido recientemente, con la vejiga urinaria vacía y con el brazo sin ropa, apoyado sobre alguna superficie.
No existe constancia de que ningún enfermo tuviera proceso inflamatorio agudo conocido en el momento de la realización del ensayo. Se excluyen pacientes con insuficiencia renal moderada o severa, enfermedad hepática aguda o crónica, hipertiroidismo, enfermedad autoinmunitaria o del metabolismo óseo, mieloma múltiple, traumatismo mayor, cirugía reciente, heridas extensas, HT-A secundaria o enfermedades del tejido conectivo.
Grupo controlComo grupo control de los parámetros estudiados se reclutaron 24 sujetos sanos (10 varones y 14 mujeres) con una edad media de 45 años y con una PA por debajo de 130/85. Estos individuos no presentaban antecedentes de HT-A ni de otras enfermedades cardiovasculares. La PA se tomó en las primeras horas de la mañana mediante un manómetro electrónico validado y siguiendo las normas básicas explicadas anteriormente para la medida correcta de la PA.
Procedimientos analíticosSe extrajo sangre para la realización de las pruebas analíticas y se procedió a su centrifugación a 3.500rpm durante 10 minutos, los sueros fueron separados, alicuotados y congelados a –70°C hasta su determinación.
La concentración del TGF-β1 se determinó mediante técnica cuantitativa con un enzimoinmunoensayo tipo sándwich (test Quantikine TGFβ1 ELISA en suero que contiene TGFβ1 recombinante humano).
La concentración del PICP se determinó mediante el ensayo Metra CICP que consiste en un enzimoinmunoensayo tipo sándwich en placa de microtitulación que utiliza un anticuerpo anti-PICP monoclonal recubierto sobre la placa, un antisuero anti- PICP de conejo, un conjugado de fosfatasa alcalina anti-conejo de cabra y un sustrato pNPP para la cuantificación del PICP en el suero humano.
La concentración del telopéptido C-terminal de la molécula de colágeno tipo I se realizó mediante el test Elecsys B-CrossLaps en suero que consiste en un inmunoensayo de electroquimioluminiscencia (ECLIA) destinado específicamente a determinar los fragmentos reticulados isomerizados de colágeno tipo I. El test cuantifica los fragmentos de la degradación del colágeno tipo I que contienen el octapéptido beta-8AA isomerizado por partida doble. El principio del test se basa en una técnica sándwich con una duración total de 18 minutos.
El análisis de la colagenasa intersticial se realizó mediante el test Quantikine proMMP-1 ELISA en suero, que contiene pro-MMP1 recombinante humano y anticuerpos contra el factor recombinante. Este test utiliza la técnica cuantitativa del enzimoinmunoensayo tipo sándwich.
Estudio de la calidad analíticaPara el estudio de la calidad analítica de cada método se obtuvieron los indicadores de imprecisión, inexactitud y error total para comprobar si se ajustan a los requisitos recomendados en la bibliografía. Para el cálculo de la imprecisión se indica el CV total de los controles utilizados, para la inexactitud o error sistemático se calcula el porcentaje de la diferencia entre la media de cada técnica y el valor diana considerado como media por el fabricante para cada grupo, uno de normotensos y el otro de hipertensos. El error total se calcula mediante la fórmula (% inexactitud + 1,96 CV total) para cada uno de los grupos normotensos e hipertensos.
Tratamiento estadísticoLas diferencias clínicas entre los dos grupos de pacientes fueron analizadas con la t de Student para datos no pareados cuando se demostró distribución normal, y la U. de Mann-Whitney con una distribución no normal. Para analizar las diferencias entre los biomarcadores del metabolismo del colágeno entre los sujetos controles y los dos grupos de pacientes se realizó ANOVA de un factor una vez que la normalidad fue chequeada con el test de Shapiro-Wilks. Para el estudio de correlación entre los diferentes biomarcadores se utilizó la Rho de Spearman. La influencia de posibles factores de confusión en las correlaciones fue tenida en cuenta. Las concentraciones de biomarcadores se registran como la media±desviación estándar. Un valor de p<0,05 se consideró como estadísticamente significativo. El análisis estadístico de los datos se realizó mediante el programa SPSS version 13.0.
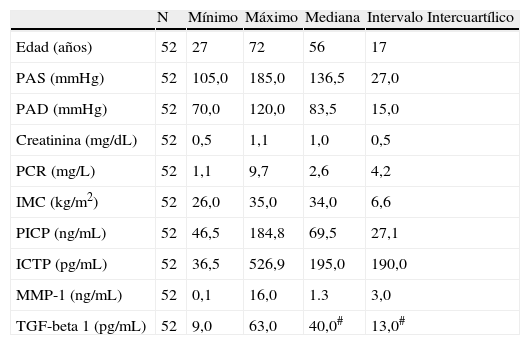
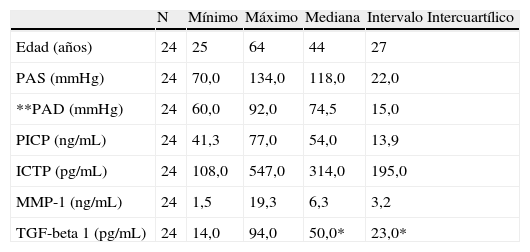
Características clínicasLas características clínicas y variables bioquímicas estudiadas en el grupo de hipertensos y en el grupo control se muestran en las tablas 1 y 2.
Grupo de hipertensos. Variables estudiadas
| N | Mínimo | Máximo | Mediana | Intervalo Intercuartílico | |
| Edad (años) | 52 | 27 | 72 | 56 | 17 |
| PAS (mmHg) | 52 | 105,0 | 185,0 | 136,5 | 27,0 |
| PAD (mmHg) | 52 | 70,0 | 120,0 | 83,5 | 15,0 |
| Creatinina (mg/dL) | 52 | 0,5 | 1,1 | 1,0 | 0,5 |
| PCR (mg/L) | 52 | 1,1 | 9,7 | 2,6 | 4,2 |
| IMC (kg/m2) | 52 | 26,0 | 35,0 | 34,0 | 6,6 |
| PICP (ng/mL) | 52 | 46,5 | 184,8 | 69,5 | 27,1 |
| ICTP (pg/mL) | 52 | 36,5 | 526,9 | 195,0 | 190,0 |
| MMP-1 (ng/mL) | 52 | 0,1 | 16,0 | 1.3 | 3,0 |
| TGF-beta 1 (pg/mL) | 52 | 9,0 | 63,0 | 40,0# | 13,0# |
IMC: índice de masa corporal; PAD: presión arterial diastólica media; PAS: presión arterial sistólica media; PCR: proteína C reactiva.
*Corresponde a la media y desviación estándar.
Grupo control. Variables estudiadas
| N | Mínimo | Máximo | Mediana | Intervalo Intercuartílico | |
| Edad (años) | 24 | 25 | 64 | 44 | 27 |
| PAS (mmHg) | 24 | 70,0 | 134,0 | 118,0 | 22,0 |
| **PAD (mmHg) | 24 | 60,0 | 92,0 | 74,5 | 15,0 |
| PICP (ng/mL) | 24 | 41,3 | 77,0 | 54,0 | 13,9 |
| ICTP (pg/mL) | 24 | 108,0 | 547,0 | 314,0 | 195,0 |
| MMP-1 (ng/mL) | 24 | 1,5 | 19,3 | 6,3 | 3,2 |
| TGF-beta 1 (pg/mL) | 24 | 14,0 | 94,0 | 50,0* | 23,0* |
IMC: índice de masa corporal; PAD: presión arterial diastólica media; PAS: presión arterial sistólica media; PCR: proteína C reactiva.
*Corresponde a la media y desviación estándar.
La prueba de Kolmogorow-Smirnov mostró que los resultados no se distribuyeron normalmente para PIP, ICTP y MMP-1, por lo que los valores se describen a través de la mediana y del intervalo intercuartil y la comparación de los grupos se realizó por la prueba U. de Mann-Whitney. Los resultados para TGF-beta 1 siguieron una distribución normal siendo representados sus valores mediante la media±desviacion estándar. La prueba de Shapiro-Wilk mostró que los resultados para PIP, ICTP, TGF-beta 1 seguían una distribución normal. El TGF-beta 1 sigue una distribución normal tanto en el grupo de hipertensos como en el control, estando representados sus valores mediante la media±desviación estándar. Para la comparación de medias utilizaremos pues la prueba t de Student con una p<0,05, dicha prueba no estableció diferencias significativas tras la comparación de los niveles de TGF-beta 1 en el grupo de hipertensos respecto al grupo control con una p>0,05.
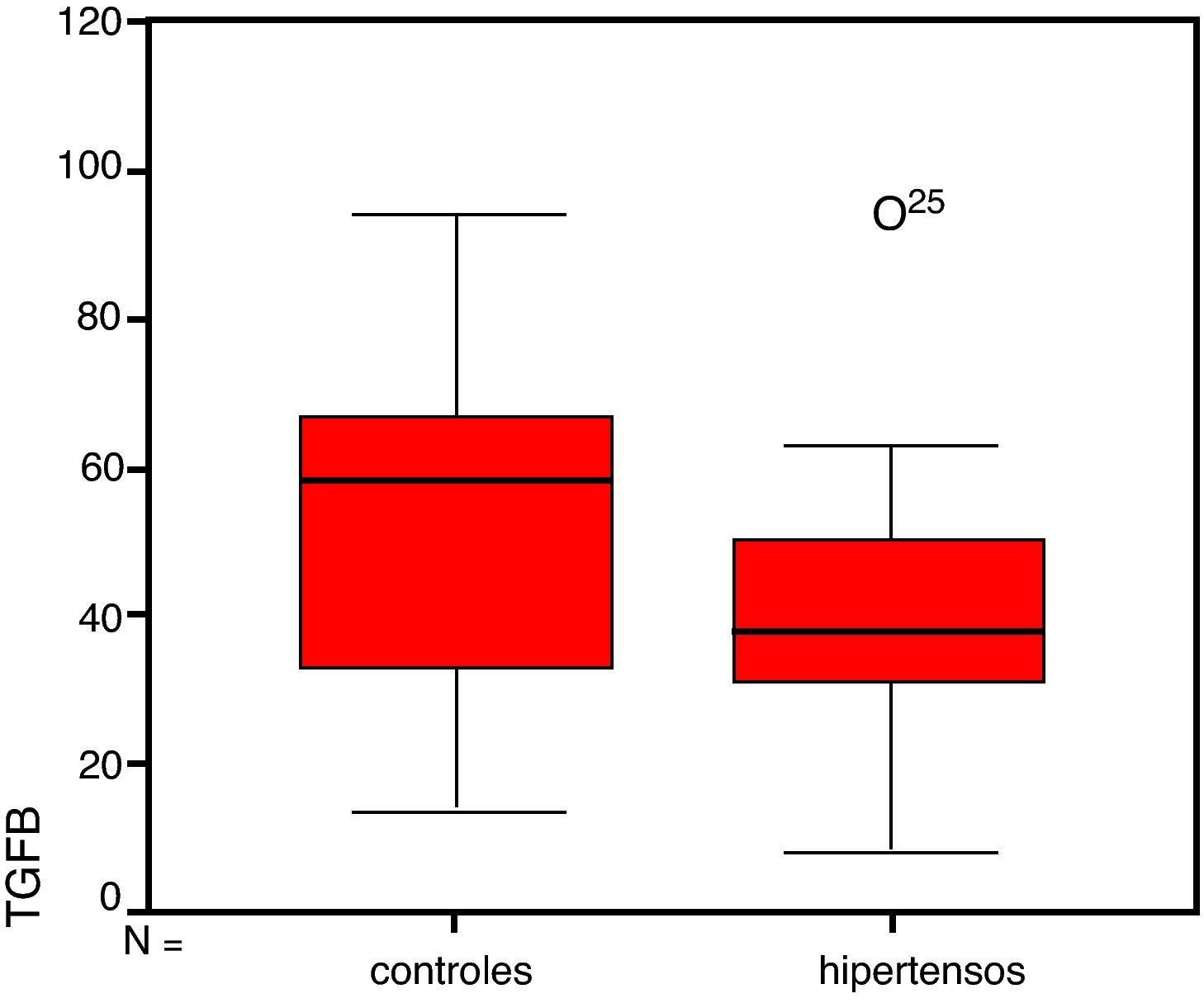
En contra de lo esperado las concentraciones de TGF-beta 1 no fueron mayores en el grupo de hipertensos sino todo lo contrario, éstas resultaron más elevadas en el grupo control pero la prueba estadística t de Student no estableció diferencias estadísticamente significativas entre ellos con una p>0,05 (fig. 1).
En el grupo de hipertensos la media de los valores de TGF-beta 1 fue de 40 (13) pg/ml mientras que en el grupo control fue de 50 (23) pg/ml.
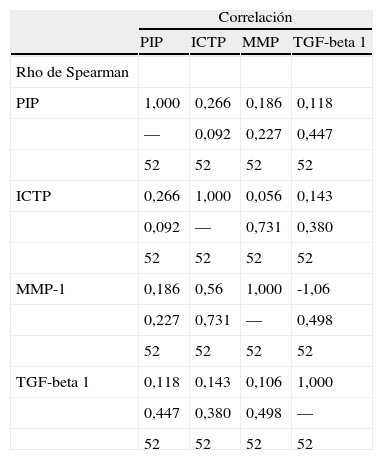
Análisis de asociaciónPara comprobar si existía una correlación entre los parámetros estudiados utilizamos el coeficiente de correlación de Spearman. En todos ellos la p fue > 0,05 por lo que podemos afirmar que ninguno de ellos se relacionaba entre sí (tabla 3).
Análisis de asociación entre los distintos parámetros estudiados
| Correlación | ||||
| PIP | ICTP | MMP | TGF-beta 1 | |
| Rho de Spearman | ||||
| PIP | 1,000 | 0,266 | 0,186 | 0,118 |
| — | 0,092 | 0,227 | 0,447 | |
| 52 | 52 | 52 | 52 | |
| ICTP | 0,266 | 1,000 | 0,056 | 0,143 |
| 0,092 | — | 0,731 | 0,380 | |
| 52 | 52 | 52 | 52 | |
| MMP-1 | 0,186 | 0,56 | 1,000 | -1,06 |
| 0,227 | 0,731 | — | 0,498 | |
| 52 | 52 | 52 | 52 | |
| TGF-beta 1 | 0,118 | 0,143 | 0,106 | 1,000 |
| 0,447 | 0,380 | 0,498 | — | |
| 52 | 52 | 52 | 52 | |
El hallazgo principal de este estudio es que en contra de lo esperado, las concentraciones de TGF-beta 1 no fueron mayores en el grupo de hipertensos sino todo lo contrario, éstas resultaron más elevadas en el grupo control. Las concentraciones plasmáticas elevadas de TGF-beta 1 se han asociado a enfermedad primaria en humanos al actuar como promotor de la fibrosis. Diversos estudios han presentado a esta citocina como un factor causal de reestenosis tras angioplastias, aterosclerosis, angiogénesis y fibrosis cardíaca. Recientemente también se ha asociado con la hipertensión. Algunos autores han demostrado la relación directa entre cifras de PA y niveles plasmáticos de esta citocina y otros la asociación de polimorfismos en el gen del TGF-beta 1 y la presencia de hipertensión18–21. La última asociación que podemos constatar es la relación entre TGF-beta 1 y la masa del ventrículo izquierdo en pacientes hipertensos22.
Por ello se ha postulado la determinación de las concentraciones plasmáticas de TGF-beta 1 como método rutinario y sencillo para evaluar la actividad fibrogénica en pacientes con HTA refractaria. En nuestro trabajo no hemos podido demostrar que existan concentraciones elevadas de TGF-beta 1 en pacientes con HTA esencial en concordancia con lo publicado por Derhaschnig et al15 que subraya la implicación de esta citocina en la patogénesis de la HTA únicamente cuando se encuentre en fases avanzadas, con lesión de órganos diana, y sobre todo cuando se evidencie daño renal. En ese mismo trabajo y otro aun más reciente16 no se pudo encontrar una relación entre los niveles de PA y TGF-beta 1, hallazgo similar al que observamos en nuestros pacientes.
Por el contrario, sí se ha encontrado una asociación directa entre TGF-beta 1 y estimulación en la síntesis de colágeno tipo I, así como inhibición de la degradación de colágeno tipo I en daño cardiorrenal en pacientes con HTA esencial en la línea de lo publicado por Lijnen et al17. Nuestros resultados permiten afirmar que si excluimos un daño renal en hipertensos esenciales no se demuestra correlación entre TGF-beta 1 y los distintos marcadores séricos del metabolismo del colágeno tipo I (PIP, ICTP y MMP-1). Esto permite asumir la hipótesis que señala que el papel fibrogénico del TGF-beta 1 tiene predilección a nivel de las células renales causando su hipertrofia y produciendo un exceso de matriz extracelular en las células glomerulares, tubulares y en los fibroblastos intersticiales. Todo ello está avalado por las investigaciones18 en pacientes con enfermedad renal terminal que demuestran una estimulación excesiva del sistema renina-angiotensina-aldosterona, lo que representa un potente estímulo de la expresión de TGF-beta 1. La angiotensina II induce la síntesis de matriz extracelular y la expresión de TGF-beta 1 en los fibroblastos cardíacos.
Otro aspecto de gran actualidad es la relación de la producción de TGF-beta 1 y los aportes dietéticos de sal y potasio. Sanders et al23 señalan que las dietas ricas en sal influyen de manera independiente a PA y eje renina-angiotensina-aldosterona en la producción de eventos cardiovasculares en modelos animales y humanos. El marco teórico propuesto, muestra la presencia de un desequilibrio en la producción de óxido nítrico (NO) que se presenta en todos los estados patológicos donde se identifica disfunción endotelial. Este hecho desenlaza un mecanismo compensatorio que concluye con un aumento en la producción de TGF-beta 1 que promueve a su vez el aumento de la vasoconstricción arterial periférica e hipertensión. Por otra parte, Ying et al24 en un estudio con ratas demuestran la interesante interacción entre el aporte dietético de potasio y las dietas ricas en sal, dichos autores señalan que los niveles de TGF-beta 1 en orina están aumentados en animales con dieta rica en sal que no recibieron aporte suplementario de potasio. Este hecho pone de manifiesto el papel fundamental de los canales de potasio dependientes de calcio en la respuesta del endotelio vascular en una situación de ingesta elevada de sal. Los pacientes de nuestro estudio, como se reflejó anteriormente, fueron pacientes con estricto control farmacológico y dietético de sal y suplementos de potasio por lo que se discute en contra de que este hecho hubiera podido influir en las concentraciones de TGF-beta 1 que se han presentado en nuestro estudio.
ConclusionesEn conclusión, nuestros datos indican que la medida de TGF-beta 1 no cumple con las expectativas postuladas inicialmente. Estos resultados no han incluido a pacientes que presentan insuficiencia renal moderada o severa asumiéndose que ésta pudiera ser la causa de no encontrar elevados los niveles plasmáticos de TGF-beta 1. Además, entre las hipótesis a descartar como causa de la no elevación de los niveles de TGF-beta 1 en los individuos hipertensos por encima de los normotensos habría que tener en cuenta el hecho de que los pacientes estudiados tomaron fármacos antihipertensivos (todos ellos con pautas terapéuticas que incluyeron al menos un fármaco). Todo ello hace, sin embargo, que se perfile como una citocina a tener en cuenta en relación a futuras terapias antihipertensivas, pues podría ser utilizada como marcador plasmático de respuesta al tratamiento en pacientes con HTA.
Limitaciones del estudioEste estudio presenta algunas limitaciones como son: el reducido número de pacientes estudiados, hecho que podría haber limitado el poder estadístico para encontrar diferencias entre los grupos, el tratamiento previo de muchos de los pacientes con fármacos, que pueden haber alterado el proceso de fibrosis en los pacientes y la elección de criterios de exclusión restrictivos en el grupo de estudio, que se sugiere como posible causa de no encontrar elevados los niveles de TGF-beta 1.
Finalmente, indicar que para contrastar estos resultados se propone la realización de estudios con un mayor número de sujetos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.