Streptococcus vestibularis, cuya descripción se remonta a comienzos del siglo pasado, ha sido aislada en diferentes puntos del cuerpo (cavidad bucal, estómago y yeyuno). Su denominación se refiere a su primer aislamiento a partir de la mucosa del vestíbulo bucal. A pesar de la difícil taxonomía de este grupo de estreptococos, S. vestibularis ha sido claramente diferenciada de otras especies mediante estudios genéticos, incluso de aquellas especies filogenéticamente más próximas (Streptococcus salivarius y Streptococcus thermophilus). El estudio de los factores de virulencia de cepas de este microorganismo ha revelado la presencia de un nutrido grupo de estos, lo que otorgaría a este microorganismo una virulencia notable con independencia de su acción patógena oportunista. Al igual que la distinción inequívoca de las especies del grupo viridans ha resultado compleja desde un punto de vista taxonómico, no han sido menores las dificultades en la identificación de estas. Si bien la identificación fenotípica presenta una escasa utilidad para una discriminación precisa entre los miembros del grupo viridans, son los sistemas de identificación basados en secuencias (ARNr16S) o el MALDI-TOF los que están contribuyendo a la clarificación de este ámbito. No obstante, para que dichas identificaciones sean precisas es necesario completar previamente la carencia de información relativa a esta especie, al igual que ocurre con los datos acerca de su sensibilidad a los antibióticos.
Streptococcus vestibularis, which has been described at the beginning of last century, has been isolated from different sources (oral cavity, stomach or jejunum, for instance). Regarding its denomination, this microorganism was named after its first isolation source (mucosa from oris vestibulum). In spite of great difficulties in the taxonomy of viridans group streptococci, genetic tests have recently made it possible to distinguish S. vestibularis from other species of the same group, even from those phylogenetically close to it (Streptococcus salivarius and Streptococcus thermophilus). Studies on this bacteria have revealed it possess a considerable number of virulence factors, which may provide it with notable virulence regardless of its opportunistic pathogen behaviour. Identification of viridans group streptococci is also difficult, as phenotypic methods have shown to be troublesome. Nevertheless, sequence-based methods (rRNA 16S) or MALDI-TOF offer relatively reliable identifications, despite the lack of information about these species. Antibiotic susceptibility of S. vestibularis has been poorly studied, as this species is rarely isolated in day-to-day clinical practice in relation to infections. As a result of this, the antibiotic susceptibility profile of this bacteria is based on general information about antibiotic susceptibility of viridans group streptococci.
Streptococcus vestibularis es un microorganismo del que existe escasa información en la literatura médica a día de hoy, mínima en comparación con otros microorganismos como las enterobacterias, aunque su descripción creciente como microorganismo patógeno oportunista contribuirá decididamente a aumentar ese conocimiento. Los campos de estudio relativos a S. vestibularis se revelan enormemente amplios y diversos. Una mayor compresión de su papel como especie comensal del ser humano, así como de las funciones que desempeña como microbiota y de qué manera lo hace en cada una de ellas, qué relaciones establece con el resto de los componentes de la microbiota humana, cómo desempeña su papel de especie patógena oportunista, qué factores predisponen a la infección por S. vestibularis, qué infecciones son capaces de causar y qué patrones de sensibilidad antibiótica presentan son ejemplos de campos de estudio relacionados con el microorganismo objeto de este artículo de revisión que todavía adolecen de falta de información suficiente. En este trabajo se revisa la participación de S. vestibularis en patología humana.
Síntesis de la revisiónTaxonomíaStreptococcus vestibularis es un estreptococo del grupo viridans. Al hablar de estreptococos del grupo viridans se hace referencia a un conjunto microbiano que engloba especies comensales y, por ende, patógenas oportunistas, cuyo hábitat comprende mucosa oral, tracto gastrointestinal y tracto genitourinario. De acuerdo con Doern y Burnham1, esta denominación microbiana refleja un «cajón de sastre» que resulta una vez excluidos los estreptococos β-hemolíticos, enterococos y neumococos. La taxonomía de este grupo microbiano, como se puede presuponer a partir de la heterogeneidad de sus componentes, ha sido un aspecto ampliamente discutido. La primera referencia a los estreptococos del grupo viridans en la literatura médica mundial es atribuida, hasta el día de hoy, al artículo de Andrewes y Horder2, autores que identificaron a comienzos del siglo xx 3especies diferentes de este grupo (Streptococcus anginosus, Streptococcus mitis y Streptococcus salivarius). Más adelante fueron descritas las especies de Streptococcus bovis y Streptococcus mutans3. Estos primeros apuntes taxonómicos de los estreptococos del grupo viridans fueron experimentando gran número de modificaciones hasta que en 2002 Facklam4 organizó 5grupos diferentes (S. anginosus, S. mitis, S. mutans, S. salivarius y Streptococcus sanguinis) que agrupaban en total 26 especies diferentes, tomando como base la clasificación propuesta previamente por Bruckner y Colonna5. Por último, se incluyen también en el grupo de S. bovis a estreptococos no enterococos agrupables en el serogrupo D de Lancefield.
El nombre de S. vestibularis se debe a que fue primariamente aislado a partir de la mucosa del vestíbulo bucal6, estructura anatómica limitada externamente por labios-mejillas e internamente por apófisis alveolares-dientes. Según Liébana et al.7, S. vestibularis, junto con otros estreptococos del grupo viridans, se distribuiría sobre todo en la placa supragingival madura, en las superficies lisas, saliva y mucosa bucal.
S. vestibularis es un microorganismo perteneciente al grupo de los S. salivarius, junto a S. salivarius y Streptococcus thermophilus. Junto a S. salivarius son bacterias comensales del ser humano, mientras que, por otra parte, S. thermophilus es una bacteria empleada en la industria láctea. Estas 3especies presentan una semejanza destacable desde un punto de vista genético, aunque su separación biológica como especies diferentes ha sido claramente establecida. Delorme et al.8, empleando la secuenciación MLST de los genes conservados ddlA (de la ligasa de la D-alanina-D-alanina), dnaE (de la ADN polimerasa III), glcK (de la glucosa cinasa), ilvC (de la reductoisomerasa de cetoácidos), pepO (de la endopeptidasa), pyrE (de la orotato-fosforribosiltransferasa), sodA (de la superóxido-dismutasa), thrS (de la treonil-ARNt-sintetasa), tkt (de la transcetolasa), demostraron que S. salivarius y S. vestibularis, las 2especies orales del grupo de S. salivarius, son especies diferentes a pesar de compartir material genético; el estudio de estos autores indica, incluso, que S. vestibularis es una especie filogenéticamente más reciente que S. salivarius, ya que este microorganismo presenta una menor diversidad alélica respecto del S. vestibularis. Estos resultados obtenidos por Delorme et al. son confirmados en estudios posteriores9.
Factores de virulenciaEl análisis mediante BLAST (Basic Local Alignment Search Tool)10-12, herramienta del National Center for Biotechnology Information (NCBI) que posibilita comparar secuencias biológicas (de aminoácidos o nucleótidos) con una base de datos para encontrar semejanzas con una secuencia previamente registrada de los genomas de 2cepas de S. vestibularis (ATCC 49124 y F0396) disponibles en la Base de Datos del Microbioma Oral Humano (HOMD), posibilita establecer posibles factores de virulencia de la cepa F0396 tales como ureasa, fosfolipasa, proteína de sistema de secreción de los tipos II/IV, sistema Sec, β-lactamasa, proteína de unión con fibronectina, toxina zeta, transportadores de bacitracina y macrólidos, proteínas de síntesis de polisacáridos capsulares o hemolisina.
Por otra parte, el mismo análisis referido a la cepa ATCC 49124 evidencia posibles factores de virulencia tales como β-lactamasa, toxina exfoliativa, hemolisina, toxina zeta, proteína asociada a virulencia, sistema Sec, sistemas de transporte independientes del sistema Sec, transportadores de macrólidos, proteínas de resistencia a bacitracina o transportadores de bacitracina, transportadores de antibióticos, proteínas de resistencia a múltiples fármacos o transportadores de múltiples fármacos, proteína MATE, ureasa, fosfodiesterasa, fosfoesterasa, proteína de unión a fibronectina/fibrinógeno o proteínas de síntesis de polisacárido capsular.
Aislamiento e identificación en el laboratorioS. vestibularis es un comensal del ser humano que se aisla principalmente a partir de muestras de la cavidad bucal. No obstante, otros autores han publicado su aislamiento, en ausencia de infección asociada, en emplazamientos tales como estómago13, yeyuno14, leche15 u orina16.
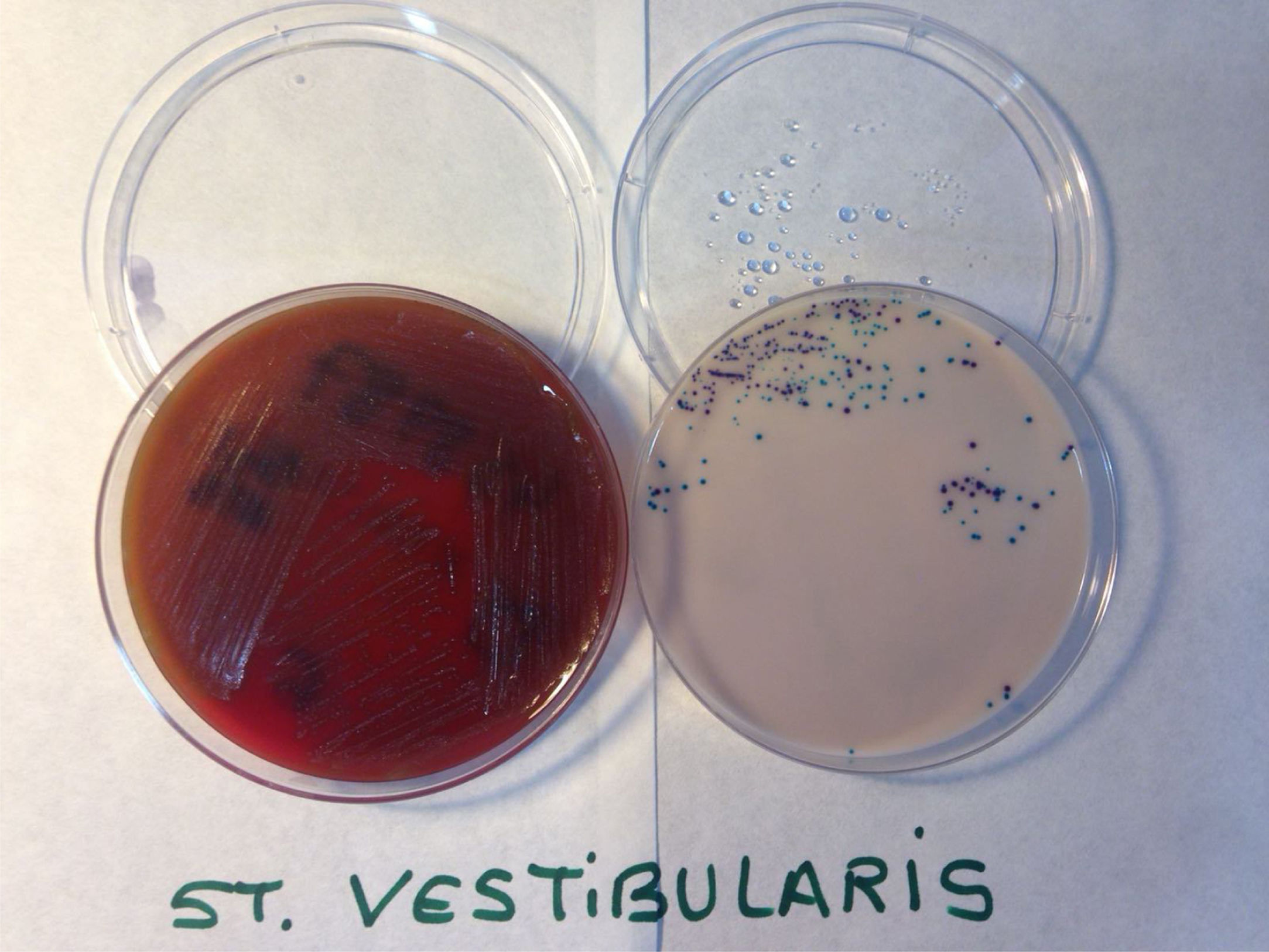
Para su identificación17-19, esta especie crece en aerobiosis (fig. 1), en medios selectivos, como el agar mitis-salivarius rico en sacarosa, produce colonias, a las 48 h, entre 1 y 2mm de color azul oscuro-mate, umbilicadas y de bordes ondulados, mientras que, por el contrario, el cultivo de este microorganismo en atmósfera anaerobia en el mismo medio da lugar a colonias convexas, brillantes y de bordes definidos. Por otra parte, el cultivo de S. vestibularis en agar TYC, también con alto contenido en sacarosa, da lugar a colonias de diámetro de tamaño similar, de color blanco, convexo, brillante y de bordes definidos, en aerobiosis y anaerobiosis (tabla 1).
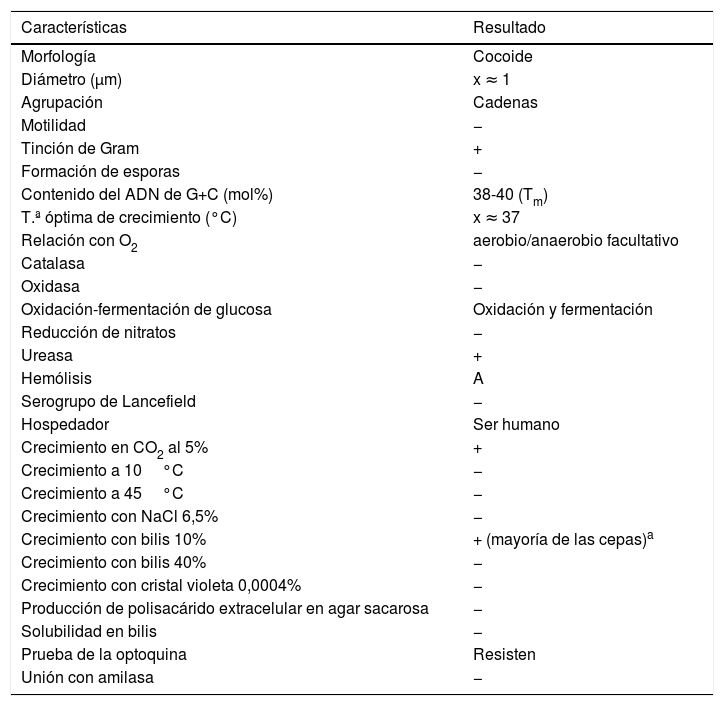
Características microbiológicas de Streptococcus vestibularis
| Características | Resultado |
|---|---|
| Morfología | Cocoide |
| Diámetro (μm) | x ≈ 1 |
| Agrupación | Cadenas |
| Motilidad | − |
| Tinción de Gram | + |
| Formación de esporas | − |
| Contenido del ADN de G+C (mol%) | 38-40 (Tm) |
| T.ª óptima de crecimiento (°C) | x ≈ 37 |
| Relación con O2 | aerobio/anaerobio facultativo |
| Catalasa | − |
| Oxidasa | − |
| Oxidación-fermentación de glucosa | Oxidación y fermentación |
| Reducción de nitratos | − |
| Ureasa | + |
| Hemólisis | A |
| Serogrupo de Lancefield | − |
| Hospedador | Ser humano |
| Crecimiento en CO2 al 5% | + |
| Crecimiento a 10°C | − |
| Crecimiento a 45°C | − |
| Crecimiento con NaCl 6,5% | − |
| Crecimiento con bilis 10% | + (mayoría de las cepas)a |
| Crecimiento con bilis 40% | − |
| Crecimiento con cristal violeta 0,0004% | − |
| Producción de polisacárido extracelular en agar sacarosa | − |
| Solubilidad en bilis | − |
| Prueba de la optoquina | Resisten |
| Unión con amilasa | − |
La mayoría de las cepas de S. vestibularis producen ácido a partir de celobiosa y amigdalina, mientras que, por otra parte, pocas cepas producen ácido a partir de trehalosa. La fermentación de arbutina es variable entre cepas. Aquellas cepas de S. vestibularis que fermentan trehalosa pero no celobiosa y amigdalina componen un serotipo que difiere de la mayoría de las cepas (tablas 2 y 3).
Producción de ácidos a partir de compuestos por Streptococcus vestibularis
| Compuestos | Metabolización |
|---|---|
| N-acetil-glucosamina | I |
| Adonitol | − |
| Almidón | − |
| Amigdalina | I |
| Arabinosa | − |
| Arbutina | I |
| Arabitol | − |
| Celobiosa | I |
| Ciclodextrina | − |
| Dulcitol | − |
| Fructosa | + |
| Fucosa | − |
| Galactosa | + |
| Glicerol | − |
| Glucógeno | − |
| Glucosa | + |
| Inositol | − |
| Inulina | − |
| Lactosa | I |
| Maltosa | + |
| Manosa | + |
| Manitol | − |
| Melibiosa | − |
| Melecitosa | − |
| Metil-D-glucósido | I |
| Pululano | − |
| Rafinosa | − |
| Ribosa | − |
| Salicina | + |
| Sorbitol | − |
| Sacarosa | + |
| Tagatosa | − |
| Trehalosa | I |
| Xilosa | − |
El avance de las ciencias biológicas ha dado pie a la aparición de nuevas formas de identificación microbiana diferentes de las identificaciones fenotípicas que incluyen las pruebas bioquímicas clásicas, métodos de identificación aplicables, asimismo, al resto de los estreptococos del grupo viridans, tales como sistemas de identificación basados en secuencias (genes del ARNr 16S u otros conservados, por ejemplo) y MALDI-TOF. A pesar de las dificultades iniciales para el empleo de las técnicas ya referidas, principalmente debidas a la ausencia de información suficiente y específica, la identificación de estos microorganismos por sistemas automatizados de identificación por pruebas bioquímicas, identificación basada en secuencias y MALDI-TOF está aumentando su fiabilidad20,21 para su empleo en la clínica (tabla 4).
Hidrólisis de compuestos por Streptococcus vestibularis
| Compuestos | Resultados |
|---|---|
| α-D-galactosidasa | − |
| β-D-galactosidasa | + |
| α-D-glucosidasa | I |
| β-D-glucosidasa | − |
| α-L-fucosidasa | − |
| β-D-fucosidasa | − |
| β-D-glucuronidasa | − |
| β-manosidasa | − |
| N-acetil-β-D-galactosaminidasa | − |
| N-acetil-β-D-glucosaminidasa | − |
| Acetoína (Voges-Proskauer) | Variable [+, i] |
| Ácido glutámico arilamidasa | − |
| Ala-fe-pro-arilamidasa | + |
| Fosfatasa alcalina | − |
| Glicil-triptófano arilamidasa | − |
| Hialuronidasa | − |
| H2O2 | + |
| Pirrolidonil arilamidasa | − |
| Sialidasa (neuraminidasa) | − |
A pesar de de lo anterior, es indudable la necesidad de un mayor desarrollo de las técnicas referidas a la identificación de estos microorganismos, haciendo especial hincapié en grupos microbianos poco estudiados o especialmente problemáticos, como es el caso de los estreptococos del grupo viridans, para así aumentar su frecuencia de aislamientos en la clínica. Años atrás, la relativamente escasa fiabilidad de las técnicas con fundamentos bioquímicos, al considerar los estreptococos del grupo viridans, ha contribuido a numerosos errores en su identificación rutinaria.
Enfermedades relacionadasAl igual que otros estreptococos del grupo viridans, S. vestibularis se ha relacionado con las caries. Sin embargo, el potencial cariogénico de los integrantes de este grupo varía entre especies, siendo S. mutans y S. sobrinus las más sobresalientes a este respecto. Castillo et al. propusieron el efecto post-PH como un «determinante ecológico in vitro para ayudar a cuantificar el potencial cariogénico de la microflora »22. Aunque S. vestibularis no fue incluido en las especies y cepas analizadas en dicho estudio, cabría esperar un resultado consistente con su potencial cariogénico reflejado en la literatura médica. Por ello, es importante resaltar, como afirman Concha et al.23, la necesidad de estudios más extensos acerca del potencial cariogénico de especies orales de estreptococos a las que, como a S. vestibularis, clásicamente se ha relegado a un segundo plano. La cuantificación del efecto post-PH, como asimismo la cuantificación del efecto post-antibiótico o el efecto post-H2O224, no deja de ser una herramienta para aproximarse hacia un conocimiento más exacto acerca del papel de S. vestibularis tanto en condiciones de salud como de enfermedad.
En lo que respecta a la clínica, S. vestibularis ha sido identificado como causa de absceso odontogénico25, bacteriemia (en pacientes con cáncer, hematológicos, neutropénicos o no y en hemodiálisis crónica)26-29, caries30-32, endocarditis infecciosa de válvula nativa o protésica (complicada con embolia pulmonar, espondilodiscitis)33-38, infección de herida quirúrgica39, mastitis infecciosa40, meningitis41, peritonitis (espontánea, tras diálisis peritoneal o secundaria)42-45, queratitis infecciosa46 y sepsis47. De igual modo, recientemente ha sido descrito el aislamiento de S. vestibularis a partir de abscesos hepáticos piógenos asintomáticos en un paciente inmunocompetente, atribuyéndose dichos abscesos a una perforación diverticular asintomática48.
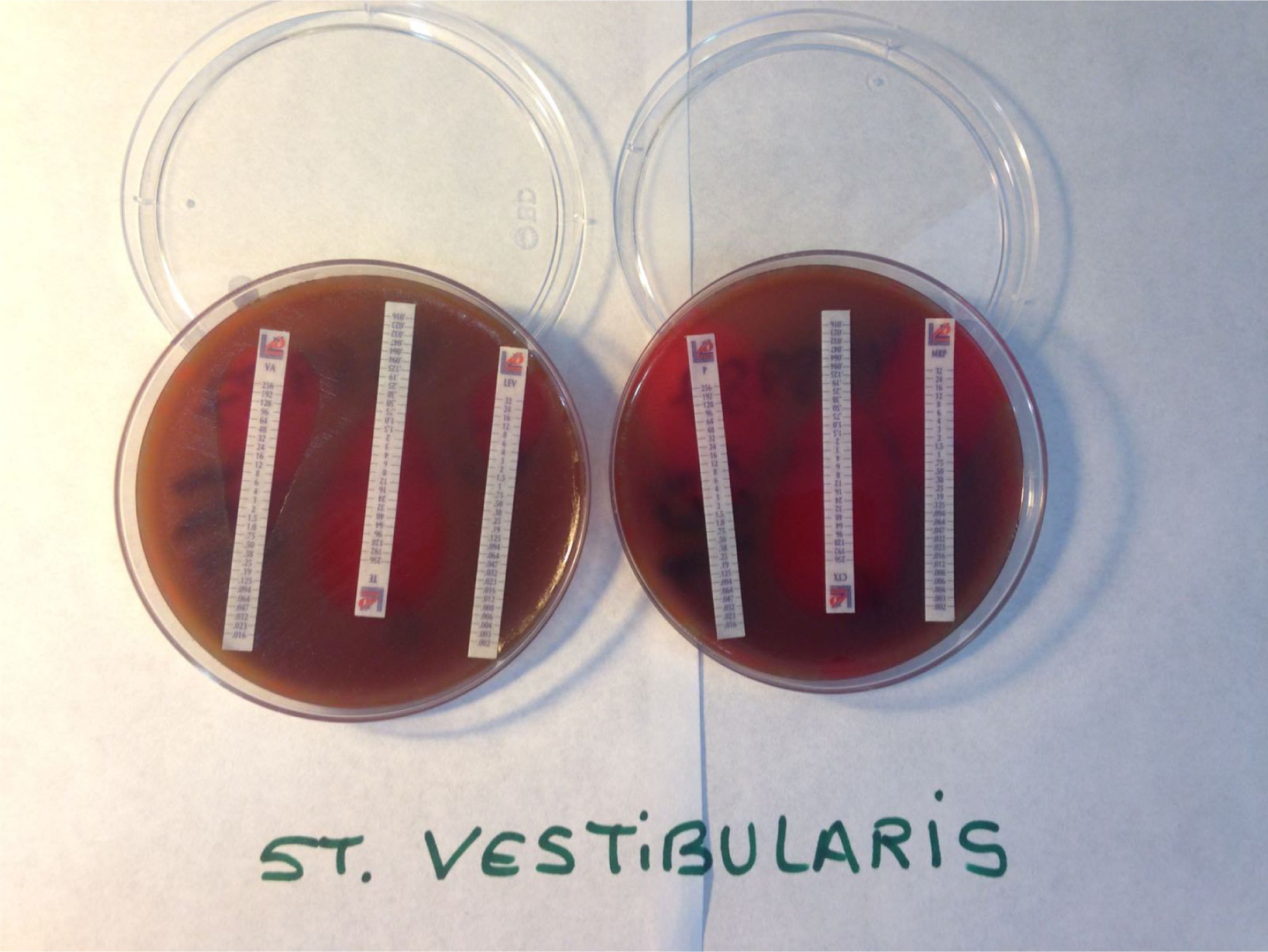
Sensibilidad a los antibióticosEn la literatura médica se encuentran referidos escasos aislamientos de S. vestibularis en los cuales se haya estudiado la sensibilidad antibiótica de manera específica. Por consiguiente, resulta difícil establecer con exactitud perfiles de sensibilidad-resistencia antibiótica (fig. 2) de S. vestibularis que puedan ser extrapolados a nivel general. No obstante, en la literatura médica es posible encontrar gran número de aislamientos de estreptococos del grupo viridans acompañados de estudios de sensibilidad antibiótica. En lo que respecta a estos, en los últimos años, se ha observado un aumento progresivo de la resistencia a penicilina, macrólidos, lincosamidas y estreptogramina B, mientras que, por el contrario, son raras las resistencias documentadas frente a daptomicina, linezolid y vancomicina1,49,50. De igual modo, al no producir glicocálix, la antibioticoterapia de infecciones por S. vestibularis ofrece un resultado más favorable que otros estreptococos del grupo viridans, como S. mutans, productores de glicocálix; esto se desprende del estudio de De la Higuera et al., en el que tomaron como referencia la endocarditis infecciosa51.
Aunque las resistencias que están desarrollando estos microorganismos no son desdeñables, sino que constituyen un problema que habrá de abordarse en el futuro, todavía existen numerosos fármacos activos frente a ellos.
Por otra parte, debido a la falta de estudios de sensibilidad antibiótica referidos exclusivamente a S. vestibularis, es necesaria la realización de dichas pruebas, considerando un número de aislados suficientes como para que los resultados obtenidos sean representativos de la población de S. vestibularis; a ello ayudará el aumento de la frecuencia de aislamientos de este microorganismo derivados de la mejora de las técnicas de identificación microbiana.
ConclusiónLos estreptococos del grupo salivarius son de reciente interés en patología humana. Incluye 3especies genéticamente relacionadas: S. salivarius, S. thermophilus y S. vestibularis. Esta es una bacteria comensal que puede causar infecciones oportunistas. Su genoma es especialmente rico en genes que codifican, potencialmente, factores de virulencia. Las cepas estudiadas hasta la fecha se aislaron de diferentes muestras clínicas relacionadas con el cuerpo humano e incluyeron cepas clínicas. La resistencia a macrólidos de los aislados es importante, aunque son muy sensibles a cefalosporinas y linezolid.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al profesor Liébana por sus comentarios en la revisión previa de este trabajo.