La creación de un acceso arteriovenoso es obligatorio en pacientes con enfermedad renal terminal para tratamiento con hemodiálisis. Habitualmente implica disección a nivel axilar o en la parte superior de brazo, y la anestesia general es usada predominantemente debido a que la inervación axilar es compleja. Evitar la anestesia general podría ser beneficioso en estos pacientes de riesgo. Presentamos dos casos en los que se empleó el bloqueo serrato-intercostal/BRILMA, junto con bloqueo supraclavicular ecoguiado y analgesia multimodal para cirugía de acceso arteriovenoso axilar o de brazo proximal. La combinación de técnicas de anestesia regional mediante bloqueo supraclavicular y serrato-intercostal/BRILMA en cirugía de fístula arteriovenosa fue exitosa y debe ser considerada por el anestesiólogo con el fin de evitar la anestesia general.
access creation is mandatory in patients with end stage renal disease for hemodialysis treatment. It frequently involves upper arm or axillary dissection and general anesthesia is predominantly used as axillary compartment innervation is complex. Avoiding general anesthesia may be beneficial in these risk patients. We present two cases where serratus-intercostal plane block (SIPB/BRILMA) was used, along with ultrasound guided supraclavicular block and multimodal analgesia for proximal arm and axillary AV access surgery. Regional anesthesia combination of supraclavicular and serratus-intercostal/BRILMA block in arteriovenous fistula surgery was successful and should be considered by anesthesiologist in order to avoid general anesthesia.
La estrategia preferida para la creación de acceso vascular (AV) en pacientes con enfermedad renal terminal (ERT) es la realización de fístula arteriovenosa (FAV) autógena lo más distal posible1.
Se puede emplear anestesia regional (AR) para estos fines quirúrgicos. Bloquear el nervio intercostobraquial (ICB) es la piedra angular cuando el acceso quirúrgico implica a la axila o a la parte superior del brazo, como en la creación de acceso de FAV para hemodiálisis. El bloqueo del plano serrato-intercostal (SIPB/BRILMA) es un bloqueo fascial recientemente descrito para bloquear los ramos intercostales laterales y mediales, al igual que para el nervio ICB2.
En este artículo describimos dos casos en los que se empleó SIPB/BRILMA con el fin de bloquear el ICB y el compartimento axilar combinado con bloqueo supraclavicular de plexo braquial (BPB) para cirugía de creación de FAV. Se obtuvo consentimiento informado de ambos pacientes para la publicación.
Caso 1Mujer de 82 años (peso: 68kg; altura: 154cm; IMC:28,6), con historial médico de fallo renal crónico, diabetes mellitus no insulinodependiente e hipotiroidismo, que fue programada para la creación de una fístula humeroaxilar.
Tras monitorización estándar, se administraron 2l/min de oxígeno a través de cánula nasal. A continuación se administraron 50μg de fentanilo y 1mg de midazolam para conseguir un grado de sedación leve.
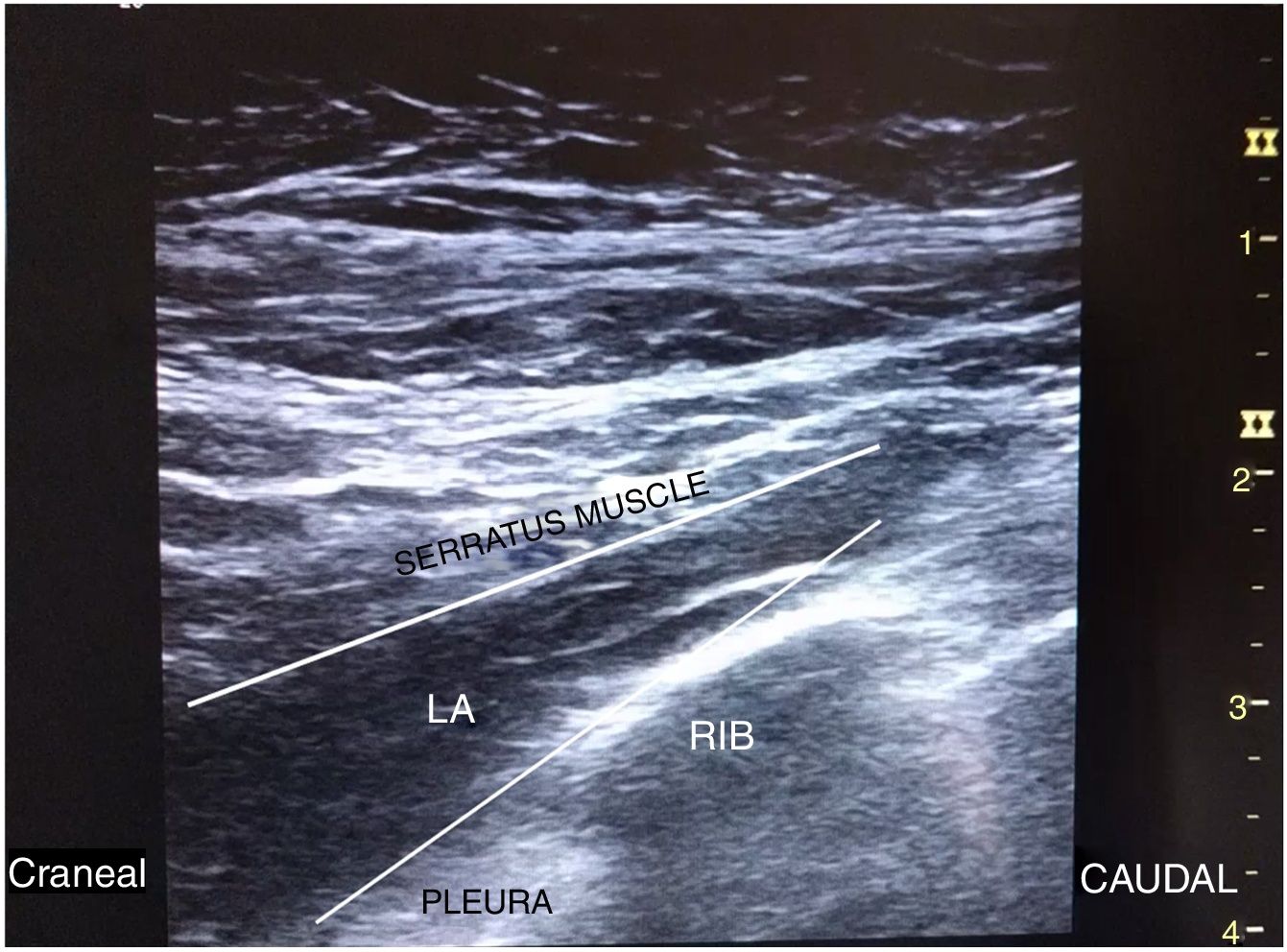
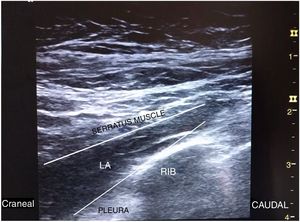
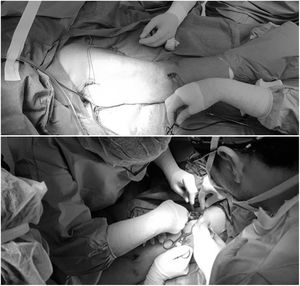
Después, bajo condiciones asépticas, se realizó SIPB con el paciente en ligero decúbito contralateral y con el brazo abducido. Con una sonda lineal de 12Mhz (LOGIQe, GE Healthcare) en la línea media axilar, se identificó el plano serrato-intercostal a nivel de la segunda costilla. Visualizamos tres capas, identificando, en el plano superficial, el tejido subcutáneo; en el plano medio, el músculo serrato y las costillas, mientras que la pleura y el pulmón estaban en el plano profundo. Una aguja ecogénica 22G (Stimuplex Ultra 360, B.Braun Medical) fue introducida en plano y caudocranealmente hasta contactar con la segunda costilla. Tras aspiración negativa, se inyectaron 18ml de ropivacaína al 0,375% bajo el músculo serrato y sobre las costillas, observando su distribución a lo largo del plano (fig. 1).
Posteriormente, la sonda se colocó en la fosa supraclavicular para realizar un BPB supraclavicular. Cuando el plexo braquial fue identificado, se introdujo una aguja ecogénica de 35mm en plano de lateral a medial hasta el plexo. A continuación se inyectaron 18ml de ropivacaína. También se administró paracetamol intravenoso para completar el abordaje multimodal.
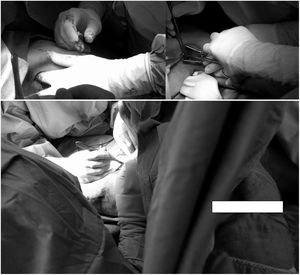
Se creó una fístula humeroaxilar con prótesis PTFE. Las incisiones longitudinales en la axila y el codo se realizaron en el brazo izquierdo. Se procedió a la tunelización subcutánea de la prótesis (fig. 2). La cirugía duró 70min.
La ventilación espontánea fue mantenida durante todo el procedimiento y no hubo necesidad de refuerzo anestésico local o tópico por parte de los cirujanos.
Caso 2Varón de 68 años (peso: 69kg; altura: 170cm; IMC:23,8) que fue programado para creación de FAV humeroaxilar. Los informes médicos revelaron enfermedad renal crónica debido a trombosis de la arteria renal derecha y oclusión del stent de la arteria renal izquierda, dislipemia, EPOC moderada e hidatidosis pulmonar en la infancia.
Como en el primer caso, se realizó un SIPB/BRILMA junto con a un bloqueo supraclavicular. Se implantó y se tunelizó una prótesis de Gore Acuseal (fig. 3). La cirugía duró 105min. Como sedación ligera se administró paracetamol, 75μg de fentanilo, 1mg de midazolam y 20mg de propofol. Inicialmente se requirió una suplementación de 5ml de mepivacaína al 1%, administrada por los cirujanos, debido a dolor moderado durante la incisión cutánea en el antebrazo. Se mantuvo la ventilación espontánea.
DiscusiónVarios son los abordajes anestésicos para la creación de un acceso arteriovenoso. Aunque los fármacos sistémicos pueden mostrar efectos farmacocinéticos y farmacodinámicos impredecibles en pacientes con ERT, la gran mayoría de los pacientes reciben anestesia general (AG). Sin embargo, en los últimos años la evidencia acumulada sugiere que la AR puede funcionar mejor, ya que el éxito de la creación y maduración de las FAV depende de muchos factores: no solo del plano quirúrgico, sino también de la técnica anestésica, y la AR tiene ventajas en términos de empleo de opiáceos, duración de la estancia, flujo regional vascular, reducción del tiempo de maduración, permeabilidad de la fístula y tasas de reoperación. De hecho, la AR puede incluso modificar el plan quirúrgico inicial y crear una FAV más distal, al producir vasodilatación1,3,4.
El confort del paciente y las condiciones quirúrgicas apropiadas para la creación de la fístula pueden obtenerse con el BPB. Pero debido a la compleja inervación sensorial de la axila, un BPB aislado no puede asegurar una anestesia completa para una cirugía de acceso arteriovenoso a nivel proximal en la axila o la parte más alta del brazo, y para evitar la aparición variable de dolor perioperatorio es obligado bloquear el nervio ICB y el compartimento axilar.
Los principales nervios implicados en la inervación del compartimento axilar son el nervio ICB, la rama cutaneomedial, el torácico largo y el toracodorsal. Las paredes de la axila crean una forma piramidal y el depósito de anestésico local (AL) en su pared medial puede facilitar un mejor alcance de la región axilar a través de los planos interfasciales musculares.
El nervio ICB es puramente sensitivo y aporta inervación a la axila, a la parte superior del brazo y a la parte lateral y superior de la pared torácica. Como emerge del segundo nervio intercostal, no es bloqueado cuando se realiza un BPB para cirugía de FAV.
Una revisión de la literatura muestra descripciones selectivas y no selectivas de técnicas de bloqueo del nervio ICB. Entre las selectivas, la infiltración de AL en forma de anillo subcutáneo próximo a la axila con el fin de bloquear periféricamente las terminaciones nerviosas continúa siendo la técnica más popular. Sin embargo, varias investigaciones en cadáver e intervenciones quirúrgicas han documentado la alta incidencia de ramificaciones y bifurcaciones del nervio ICB, mostrando que esta infiltración superficial de AL puede ser insuficiente cuando es necesaria la disección axilar o en la parte superomedial del brazo5.
Previamente se han descrito abordajes proximales no selectivos. Así, el nervio ICB ha sido bloqueado junto a otros nervios como los pectorales, los intercostales y el torácico largo con el recientemente descrito bloqueo PECS-II depositando AL entre el músculo pectoral menor y el músculo serrato para la creación de FAV con disección axilar o de la parte superior del brazo6, al igual que para la escisión de un lipoma axilar7.
El SIPB/BRILMA (bloqueo del ramo intercostal en la línea media axilar) ha sido también descrito para la analgesia del compartimento axilar y se ha usado como anestesia única junto a sedación para disección de ganglio centinela y mastectomía en cirugía oncológica mamaria8. Nosotros nos sentimos más seguros realizando SIPB/BRILMA que con la técnica de depósito de AL por encima del músculo serrato, por nuestra mayor experiencia en la misma y, de acuerdo con Torre et al.2, porque es de más fácil realización, ya que las costillas son fácilmente observadas, visualizando una diana más clara que dirigiéndose hacia el plano entre dos músculos. También se ha publicado una modificación del SIPB/BRILMA con depósito de AL a nivel de la octava costilla para nefrectomía y cirugía abdominal superior, con resultados prometedores9.
Esta es la primera vez, hasta donde sabemos, que se usa el bloqueo del nervio ICB con SIPB/BRILMA para anestesia quirúrgica, en combinación con un bloqueo supraclavicular, como técnica anestésica para la cirugía de creación de acceso arteriovenoso. El abordaje subpectoral-intercostal por vía anterior también ha sido descrito por Seidel et al.10 en cadáveres, con un abordaje medial hacia lateral para alcanzar el compartimento axilar, junto al BPB. Un inconveniente de las técnicas combinadas es que necesitan una punción más, aparte del BPB.
Los bloqueos torácicos fasciales son procedimientos superficiales guiados por ultrasonidos con un perfil favorable. Entre sus ventajas podemos encontrar reducción del riesgo de hipotensión al no bloquear los ganglios simpáticos torácicos, al contrario que los bloqueos centrales, reducción del riesgo de punción neural y cobertura de múltiples dermatomas con una sola inyección. Los riesgos teóricos del SIPB/BRILMA incluyen los riesgos habituales de las técnicas de AR (punción vascular, fallo del bloqueo) y específicos relacionados con el lugar de punción (punción pleural o pulmonar)2.
Otra cuestión importante en AR es la absorción sistémica del AL. No ha sido estudiada todavía en bloqueos fasciales torácicos y puede ser similar a la absorción del bloqueo intercostal, que es una de las tasas más altas del organismo.
En pacientes con ERT, las dosis máximas de AL deben reducirse un 25% para evitar la toxicidad sistémica. Se recomienda calcular la dosis máxima y adherirse estrictamente a ella. Reducir el volumen inyectado de AL y su concentración puede ayudar a minimizar los niveles sistémicos de AL1,3. Los bloqueos fasciales suelen requerir grandes volúmenes de AL, pero se han publicado dosis y concentraciones variables de AL.
Dado que el volumen óptimo para el SIPB/BRILMA aún está por determinar, nosotros empleamos 20ml, ya que facilita que el AL llegue al compartimento axilar, y con una concentración al 0,375%, que permite una anestesia quirúrgica. No obstante, también añadimos un abordaje analgésico multimodal para complementar la AR.
El abordaje por ultrasonidos y el lugar de punción óptimos en estos bloqueos fasciales torácicos deben aún determinarse también para cirugías de axila.
ConclusionesEn cirugía de acceso vascular en pacientes con ERT puede obtenerse un excelente manejo anestésico perioperatorio con la combinación de SIPB/BRILMA y bloqueo supraclavicular.
Para definir claramente su valor en este escenario deben realizarse estudios clínicos adicionales, incluyendo ensayos prospectivos aleatorizados y controlados.
Los anestesiólogos deben considerar el empleo de la combinación de bloqueos regionales en pacientes sometidos a cirugía de acceso para hemodiálisis cuando es necesaria la disección de la axila o la parte superior del brazo.
FinanciaciónLos autores declaran no haber dispuesto de financiación para este manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Queremos agradecer la disposición del equipo de enfermería y de los cirujanos vasculares.