En los últimos años existe una creciente preocupación acerca del efecto que los fármacos anestésicos utilizados durante una cirugía oncológica pueden tener sobre la progresión tumoral a largo plazo. Se ha observado en estudios de laboratorio como algunas sustancias utilizadas durante un proceso anestésico influyen en la inmunovigilancia tumoral, la proliferación celular o los procesos de angiogénesis tumoral. La posible relevancia clínica de la técnica anestésica utilizada respecto a la progresión tumoral a largo plazo y la supervivencia, está aún por determinar. Sin embargo, en base a estudios retrospectivos, parece que aquellas técnicas anestésicas combinadas con la utilización de anestesia y analgesia regional pueden resultar beneficiosas respecto a aquellas que se sustentan en la utilización de opioides. Futuras investigaciones deben ayudar a esclarecer la relevancia clínica a largo plazo del proceso anestésico durante una cirugía oncológica.
There has been growing concern over the last few years on the effect that the anaesthetic drugs used during oncological surgery could have on long-term tumour progression. In laboratory studies, it has been observed how some substances used during the anaesthetic procedure influence tumour immunosurveillance, cell proliferation or tumour angiogenesis processes. The possible clinical relevance of the anaesthetic technique used as regards long-term tumour progression and survival is still to be determined. However, based on retrospective studies, it appears that those anaesthetic techniques combined with the use of regional anaesthesia and analgesia may be beneficial compared to those that are maintained on the use of opioids. Further research should help to clarify the long-term clinical relevance of the anaesthetic process during oncological surgery.
La anestesia, local regional o general, es necesaria para la cirugía tumoral. Existe poca información sobre el papel de los fármacos anestésicos en la enfermedad oncológica, la mayor parte derivada de datos que han aportado los estudios de laboratorio. Es difícil pensar que con la utilización de fármacos anestésicos cuyos efectos son de corta duración (horas), podamos influir sobre cualquier enfermedad que tenga un curso crónico y recurrente como es el cáncer. Sin embargo, los fármacos anestésicos pueden inducir cambios biomoleculares y/o procesos moleculares involucrados en las funciones fisiopatológicas celulares, tales como la proliferación, la angiogénesis y la apoptosis celular, que pueden ser determinantes de la progresión de la enfermedad oncológica de los pacientes por la cual son intervenidos. Presentamos un resumen de cuáles son los principales hallazgos que existen en la actualidad sobre este tema.
Se ha realizado una búsqueda bibliográfica utilizando la base de datos Medline/Pubmed (http://www.ncbi.nlm.nih.gov/pubmed) incluyendo en la búsqueda los términos «anesthesia and cancer», «opioids and cancer», «opioids and angiogenesis», «regional anesthesia and cancer», «halogenated and immunity», «propofol and immunity», «cicloxygenase and cancer», «prostanglandins and cancer» y «prostaglandins and angiogenesis» incluyendo todos los trabajos en lengua inglesa o española. El período de búsqueda incluyó de julio a septiembre de 2011, seleccionándose los artículos más recientes y de mayor interés para el objetivo de esta revisión.
Agentes anestésicos hipnóticosMelamed et al.1 publicaron un estudio en ratas a las que se administraron células tumorales del cáncer de mama, manteniéndose anestesiadas (sin cirugía) con ketamina, tiopental, halotano o propofol. Observaron una reducción de la actividad de las células natural killer (NK) y un incremento del número de metástasis pulmonares, con todos los anestésicos excepto propofol. La ketamina era el fármaco que reducía de manera más potente la actividad y el número de las células NK. Estos efectos protumorales eran atenuados por la coadministración de un bloqueador beta (nadolol). Los resultados de este estudio experimental han abierto una prometedora línea de investigación para determinar el papel de los anestésicos generales sobre el curso de la enfermedad oncológica de los pacientes sometidos a cirugía de resección tumoral.
Óxido nitrosoEl óxido nitroso interfiere en la síntesis de ADN, purina y timidilato y, deprime la quimiotaxis neutrofílica. Así, inhibe la formación de células hematopoyéticas que pueden ser importantes en la vigilancia tumoral. Adicionalmente, la función de los neutrófilos está deprimida y la producción de células mononucleares reducida. En ratones, se ha visto que el óxido nitroso está asociado a una aceleración en el desarrollo de metástasis pulmonares y hepáticas, siendo el más potente estimulador de metástasis hepáticas de los anestésicos estudiados2. Al contrario, en un estudio en el que se realizó un seguimiento de entre 4 y 8 años a pacientes operados de cáncer colorrectal, no se detectaron diferencias en relación a la recurrencia tumoral entre los pacientes anestesiados con óxido nitroso al 65% y aquellos pacientes a los cuales se les había administrado un 65% de nitrógeno más oxígeno3.
Agentes inhalatoriosLos anestésicos volátiles inducen la apoptosis en linfocitos, reducen la citotoxicidad mediada por las células NK y alteran la elevación de citocinas generadas por las células NK en respuesta a las células tumorales4. Halotano, sevoflurano e isoflurano son citotóxicos para las líneas celulares del carcinoma pobremente diferenciado y podrían ayudar a contrarrestar la migración de células cancerígenas5. Los datos encontrados hasta la fecha en la mayoría de los estudios in vitro del posible papel prometastásico de los anestésicos volátiles se basan en sus efectos inhibitorios tiempo y dosis-dependiente de la función de los neutrófilos, la supresión de citocinas liberadas por las células mononucleares en sangre periférica, la disminución en la proliferación linfocitaria y el efecto favorecedor sobre la inducción de la apoptosis linfocitaria6. Adicionalmente, en los macrófagos expuestos a halotano, isoflurano, enflurano y desflurano (CAM: 0,25-2,0) se observa una disminución de la producción de óxido nítrico (NO) y de la expresión de óxido nítrico sintasa inducible. El sevoflurano in vitro altera la elevación de las citocinas IL-1 beta y el factor de necrosis tumoral alfa (TNF-α), pero no de IL-2 en células NK7. Además, el precondicionamiento con este halogenado promueve el crecimiento y proliferación de las células madre progenitoras del endotelio (efecto proangiogénico), lo cual podría promover el crecimiento tumoral y/o la teratogenicidad8.
En general, los estudios en animales han corroborado estos efectos inmunosupresores de los anestésicos inhalatorios. Han demostrado tanto en ratones como in vitro, la inducción en la formación de células CD8+, células que suprimen la estimulación de las células NK citotóxicas, efecto mediado a través del interferón9,10. Sin embargo, en la práctica clínica no se ha comprobado claramente un efecto inmunosupresor de los inhalatorios. Así, Goto et al.11 en cirugía de cataratas, comprobaron que concentraciones clínicamente relevantes de sevoflurano no influían en la apoptosis y número de neutrófilos, ni en la concentración de citocinas.
PropofolEl propofol, parece tener efectos opuestos al resto de anestésicos generales. Diferentes estudios han observado efectos beneficiosos antimetastásicos, de mecanismo incierto. Se ha propuesto que la inhibición de la COX-2, y por ende de la prostaglandina E2 (PGE2), podría resultar en una mejora de la respuesta antitumoral del sistema inmune12. Otros autores han propuesto que el débil mecanismo antagonista beta adrenérgico del propofol pudiera estar involucrado en su protección antitumoral13. Se ha observado que el propofol diluido en triglicéridos de cadena larga produce una disminución en la actividad de los neutrófilos, pero no cuando es diluido en triglicéridos de cadena larga y media. Se deduce que las preparaciones de los fármacos también pueden influir en la actividad de los neutrófilos, hallazgo similar observado con etomidato14. Kushida et al.12, en un modelo experimental animal, estudiaron el efecto sobre la actividad antimetastásica del propofol y de intralipid, tras la inoculación subcutánea de células tumorales. La actividad de las células NK estaba disminuida cuando se administraba intralipid o suero salino, manteniéndose dicha actividad con propofol. También el crecimiento del tumor fue menor con propofol que con suero salino. Siddiqui et al.15 describieron que el propofol conjugado a ácidos omega-3 poliinsaturados (propofol-docosahexaenoato y propofol-eicosapentaenoato), compuestos que no pueden emplearse en la anestesia general, inhiben la adhesión celular (15-30%), migración (50%) y apoptosis (40%) en las células tumorales del cáncer de mama. Mammoto et al.16, estudiando el efecto inmunomodulador del propofol en ratones, observaron como después de administrar cepas de células cancerosas humanas (melanoma, cáncer de cérvix, osteosarcoma o fibrosarcomas) disminuían las metástasis pulmonares en los animales tratados con propofol sin afectar al crecimiento de los tumores primarios inoculados. Sin embargo, las dosis administradas y la duración del tratamiento eran mayores que en la práctica clínica habitual. Sin embargo, Garib et al.17,18 mostraron un aumento de la migración de las células del cáncer de mama en ratones a los que se les inoculan dichas células y se mantenían anestesiados con propofol.
Existen diferentes estudios clínicos en los que se ha comparado los efectos del propofol con los de la anestesia inhalatoria sobre marcadores responsables de progresión tumoral, aunque es difícil precisar si los efectos se deben a un agente en concreto o a otros anestésicos empleados. Se ha descrito un mayor descenso del número de células CD3+, CD4+ y CD8+, de la expresión de HLA-DR y de los marcadores de activación CD25+, CD26+ y CD69+, cuando es utilizada una anestesia inhalatoria en vez de una intravenosa pura con propofol-sufentanilo19. Inada et al.20 observaron, en pacientes sometidos a craneotomía, como la anestesia inhalatoria (isoflurano) en comparación con la intravenosa con propofol, producía una disminución del cociente linfocitos T helper tipo 1 y 2 (Th1/Th2) lo cual facilitaría la progresión tumoral, y Ren et al.21 confirmaron estos hallazgos con isoflurano frente a propofol en lobectomía por cáncer de pulmón. Hipotetizan que el propofol promueve la activación y diferenciación de las células Th periféricas, con lo que se salvaguardaría la inmunidad celular antimetastásica perioperatoria. Deegan et al.22 al estudiar a las pacientes sometidas a extirpación de cáncer de mama, observaron que la aplicación de una técnica anestésica basada en propofol más bloqueo paravertebral torácico (BPVT) en comparación con las que recibieron sevoflurano más BPVT mostraban una inhibición in vitro de la proliferación, pero no de la migración celular de las células del cáncer de mama. Describiendo en otro estudio, que existía una atenuación de la IL-1A (citocina protumoral) y un aumento de la IL-10 (citocina antitumoral), así como una disminución de las metaloproteinasas de matriz extracelular, (enzimas proteolíticas que favorecen la invasión celular, angiogénesis y metástasis) en el grupo propofol23. Ke et al.24, observaron que la anestesia intravenosa (remifentanilo más propofol) atenuaba en mayor proporción la respuesta inflamatoria frente a la inhalatoria (isoflurano), evaluado mediante el análisis de los valores de TNF-alfa, IL-6 e IL-10, citocinas relacionadas con la actividad antitumoral.
En nuestra opinión, para el mantenimiento de la hipnosis durante la anestesia general, con los datos experimentales y clínicos disponibles actualmente, podemos deducir que aunque el efecto de los anestésicos inhalatorios y del propofol sobre el sistema inmune con capacidad antimetastásica no está completamente aclarado, aunque la comparación de ambas técnicas en este aspecto favorecería al propofol.
Fármacos analgésicosAntiinflamatorios no esteroideosLos AINE inhiben la ciclooxigenasa (COX), enzima fundamental de la cascada del ácido araquidónico que finaliza con la síntesis de los distintos eicosanoides (prostaglandinas, tromboxanos y leucotrienos). La influencia de las prostaglandinas sobre el cáncer parece mediada por 2 mecanismos. Uno indirecto a través de su interacción con el sistema inmune antitumoral. La PGE2, sintetizada por los macrófagos, produce una disminución en el número de células NK con una reducción de la actividad citotóxica, afectando también a la respuesta mediada por linfocitos T citotóxico25, favoreciendo la secreción de citocinas de tipo Th2 respecto a las Th1, fenómeno que se da en el período perioperatorio26–28. El segundo es un mecanismo directo de interacción con el crecimiento y la diseminación tumoral29. La PGE2 posee efectos proangiogénicos en las células tumorales30–32.
Teniendo en cuenta los efectos protumorales de las PG, parece lógico pensar que los AINE pudieran tener un posible efecto antitumoral. Así, indometacina perioperatoria, sola o en asociación con nadolol, mostró en roedores una reducción en la diseminación metástasica tumoral (con mayor preservación en el número de células NK sistémicas y en tejido pulmonar)33. También indometacina pareció restaurar la función de los macrófagos que se alteraba por el aumento de PG, asociándose este efecto a un menor desarrollo de metástasis pulmonares de cáncer de mama34. La utilización perioperatoria de ketorolaco a pacientes con cáncer de mama ha demostrado conseguir una reducción en la recidiva postoperatoria tumoral, pero no con diclofenaco35.
Se ha descrito la expresión de COX-2 en las células del carcinoma colorrectal, así como en cáncer de pulmón, mama, cérvix, piel o vejiga36,37. Además, existió una relación entre la expresión a nivel tumoral de la COX-2 y del VEGF y a una mayor densidad microvascular intratumoral38. Incluso la administración de celecoxib se relacionó con una menor proliferación de células de cáncer de colon, así como a una disminución en los fenómenos de neovascularización y un menor desarrollo de metástasis39. Actualmente el celecoxib está aprobado por la FDA para la prevención de cáncer de colon en pacientes con poliposis adenomatosa familiar.
Recientemente, un metaanálisis concluye un efecto antitumoral de la aspirina a dosis de 75mg diarios (efecto predominante sobre COX-1) en la prevención primaria y disminución de la mortalidad del cáncer de colon40.
OpioidesSon fundamentales en el tratamiento del dolor agudo y crónico en el paciente oncológico, así como el perioperatorio de la cirugía oncológica, pero uno de los efectos no deseados de estos fármacos es la inmunosupresión. Los opioides producen una inhibición de la inmunidad celular y en menor grado también de la humoral, de manera dosis dependiente y que parece de mayor relevancia para la morfina41. En este sentido son varios los estudios que han encontrado una asociación entre la administración de opioides y la susceptibilidad a infecciones42,43. Actualmente existe una creciente preocupación del efecto que pueden tener los opioides en la progresión oncológica, favoreciendo la diseminación de las células tumorales y el establecimiento de metástasis a través de 2 mecanismos fundamentales, la interacción con el sistema inmunológico y la estimulación de la angiogénesis44–46.
La administración de opioides se ha relacionado con una disminución en el número y actividad de las células NK, inhibición en la producción de citocinas inmunoestimulantes como el interferón-γ (IFN-γ) y la interleucina-2 (IL-2), menor proliferación y activación linfocitaria T, así como con una menor producción de anticuerpos47.
La interacción de los opioides con el sistema inmune se produce de manera indirecta, a través del eje hipotálamo-hipófisis-suprarrenal y de manera directa a través de receptores específicos para opioides como el μ348. Estos receptores μ3 y otros como el OGFr (receptor del factor crecimiento opioide), intervienen en los procesos de señalización celular que median la producción de anticuerpos y la citotoxicidad mediada por células NK. Martin-Kleiner et al.49 observaron que la morfina es capaz de unirse a estos receptores, mientras que la unión de otros opioides sintéticos como el fentanilo y los opioides endógenos se produce con mucha menor afinidad49. Empieza a haber evidencia de que las células tumorales son capaces de secretar por sí mismas péptidos opioides que los activan, resultando por tanto un mecanismo de regulación autocrina, por lo que parece que estas moléculas podrían tener un papel importante en la regulación del crecimiento tumoral50. Los efectos inmunomoduladores son más relevantes en la administración aguda (cirugía-anestesia o reanimación), que en aquellos sometidos a tratamientos crónicos51,52.
También los opioides afectan a la integridad del endotelio vascular, donde producen proliferación y migración de las células endoteliales (angiogénesis)53. La morfina, en modelos in vitro e in vivo y en concentraciones habituales en la práctica clínica, estimula la angiogénesis y la proliferación de las células del endotelio microvascular a través de una vía de señalización muy similar a la descrita para el VEGF, esto ha sido demostrado en un modelo de cáncer de mama en roedores54.
Pero por otra parte, el dolor postoperatorio se relaciona con la disminución de los mecanismos fisiológicos antimetastásicos, por lo que el efecto de los mórficos en el escenario de un dolor perioperatorio refractario a otros tratamientos podría ser beneficioso para la inmunidad celular. En modelos animales la supresión de hiperalgesia utilizando morfina frenaba el crecimiento de las metástasis pulmonares55,56.
La administración intraoperatoria de fentanilo también suprime la citotoxicidad mediada por las células NK, pero los estudios clínicos (inmunosupresión mediada por células NK, de duración dosis dependiente)57 o experimentales58 (desarrollo de metástasis y dosis de fentanilo) que si hallan relación deben enfretarse a otros que no la encuentran59.
Existe menos información de los efectos inmunes del remifentanilo y además esta es contradictoria60,61. El tramadol además de su efecto sobre el receptor μ tiene efectos adrenérgicos y serotoninérgicos, y parece preservar la función inmune perioperatoria en comparación con la morfina62,63. Tampoco hidromorfona, oxicodona, oximorfona y buprenorfina tendrían un efecto inmunosupresor significativo64. Probablemente los opioides con menor similitud estructural con la morfina y menor afinidad por los receptores μ sean los menos inmunosupresores.
Los antagonistas opioides pueden contrarrestar los efectos de la morfina sobre las células inmunes y la progresión tumoral54,65. Se está investigando el papel de la metilnaltrexona, antagonista opioide que no es capaz de atravesar la barrera hematoencefálica, para antagonizar selectivamente los efectos periféricos de los opioides sobre la angiogénesis y el sistema inmune. In vitro atenúa el crecimiento tumoral y la aparición de metástasis pulmonares, sugiriendo una influencia directa de los opiáceos en el crecimiento del cáncer de pulmón66 y, potencia el efecto antitumoral de quimioterápicos como el bevacizumab y el 5-flurouracilo67.
Por tanto, a pesar de no poseer datos concluyentes en humanos como para conocer de forma precisa la relevancia clínica de los efectos prooncogénicos de los opioides, parece probable que la administración aguda de opioides en altas dosis en un contexto quirúrgico puede favorecer la diseminación tumoral en los casos de la cirugía oncológica, tanto por sus efectos sobre la inmunidad celular como por su efecto proangiogénico. El dolor agudo se considera un factor prometástasico, el alivio del dolor será una medida eficaz antimetástasica, pero analgésicos como AINE, anestesia regional o tramadol, parecerían preferibles a los mórficos.
Anestesia regionalLa correcta utilización de anestesia-analgesia regional proporciona un buen control del dolor, atenúa la respuesta neuroendocrina al estrés y conlleva un menor requerimiento de inhalatorios y mórficos. También es bien conocido que la anestesia regional, asociada o no a general, produce una atenuación de la inmunosupresión relacionada con la cirugía, evaluada mediante citocinas, o número y actividad de las células NK68–70.
En un modelo en roedores se obtuvo una de las primeras evidencias experimentales de que la anestesia regional en comparación con morfina sistémica, era capaz de atenuar la susceptibilidad postoperatoria a metástasis pulmonares71. Se han obtenido resultados similares con otros modelos (por ejemplo anestesia subaracnoidea y metástasis hepáticas en laparotomías, con mejor preservación de inmunidad celular frente a humoral)72.
En seres humanos, en cirugía oncológica mamaria, la realización de un BPVT se relacionó con unos niveles menores de IL-1β e IL-8 y un aumento en los de IL-10 en comparación con la anestesia general23. IL-10 se ha relacionado a efectos antiproliferativos sobre las células tumorales y contra del desarrollo de metástasis73. En otro estudio similar hubo menor concentración del VEGF y un aumento en los niveles de factor de crecimiento transformante beta (TGF-β), moléculas con influencia demostrada en la progresión del cáncer de mama74. Sin embargo, O¿Riain et al.75 no han podido corroborarlo con BPVT asociado a anestesia general frente a esta aislada.
Le Cras et al.76 en pacientes sometidos a resección prostática transuretral con anestesia subaracnoidea frente a general, el cociente Th1/Th2 fue superior, sin observarse un aumento en el número total de linfocitos Th22.
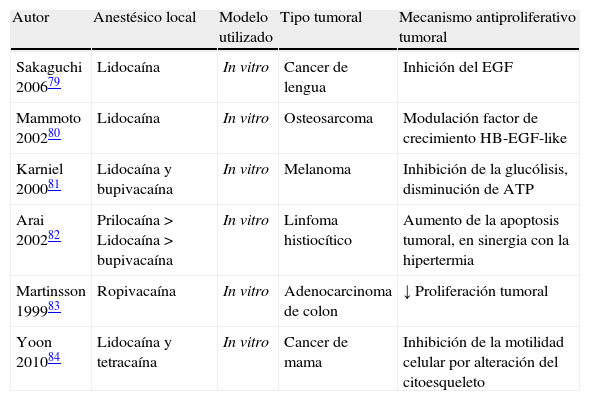
Por otro lado, el efecto beneficioso de la anestesia regional sobre la recurrencia tumoral pudiera estar relacionado con los efectos sistémicos de los anestésicos locales. Estos poseen unos efectos denominados pleiotrópicos, que no están relacionados con el bloqueo de los canales de Na+ y que se han relacionado con efectos neuroprotectores, antiinflamatorios, broncodilatadores, antitrombóticos o antiinfecciosos77. Investigaciones clínicas demuestran los efectos beneficiosos de la administración de lidocaína iv durante la cirugía de colon sobre el control del dolor, el acortamiento del íleo y la inmunomodulación perioperatoria78. La mayoría de ellos aparecen con dosis por debajo de las utilizadas en los bloqueos regionales. También hay estudios que extienden los efectos pleiotrópicos a la capacidad antiproliferativa de los AL frente a las células tumorales79–84 (tabla 1).
Efectos antiproliferativos de los anestésicos locales
| Autor | Anestésico local | Modelo utilizado | Tipo tumoral | Mecanismo antiproliferativo tumoral |
| Sakaguchi 200679 | Lidocaína | In vitro | Cancer de lengua | Inhición del EGF |
| Mammoto 200280 | Lidocaína | In vitro | Osteosarcoma | Modulación factor de crecimiento HB-EGF-like |
| Karniel 200081 | Lidocaína y bupivacaína | In vitro | Melanoma | Inhibición de la glucólisis, disminución de ATP |
| Arai 200282 | Prilocaína > Lidocaína > bupivacaína | In vitro | Linfoma histiocítico | Aumento de la apoptosis tumoral, en sinergia con la hipertermia |
| Martinsson 199983 | Ropivacaína | In vitro | Adenocarcinoma de colon | ↓ Proliferación tumoral |
| Yoon 201084 | Lidocaína y tetracaína | In vitro | Cancer de mama | Inhibición de la motilidad celular por alteración del citoesqueleto |
ATP: adenosin trifosfato; EGF: factor de crecimiento epidérmico; HB-EGF-like: factor de crecimiento epidérmico ligado a heparina.
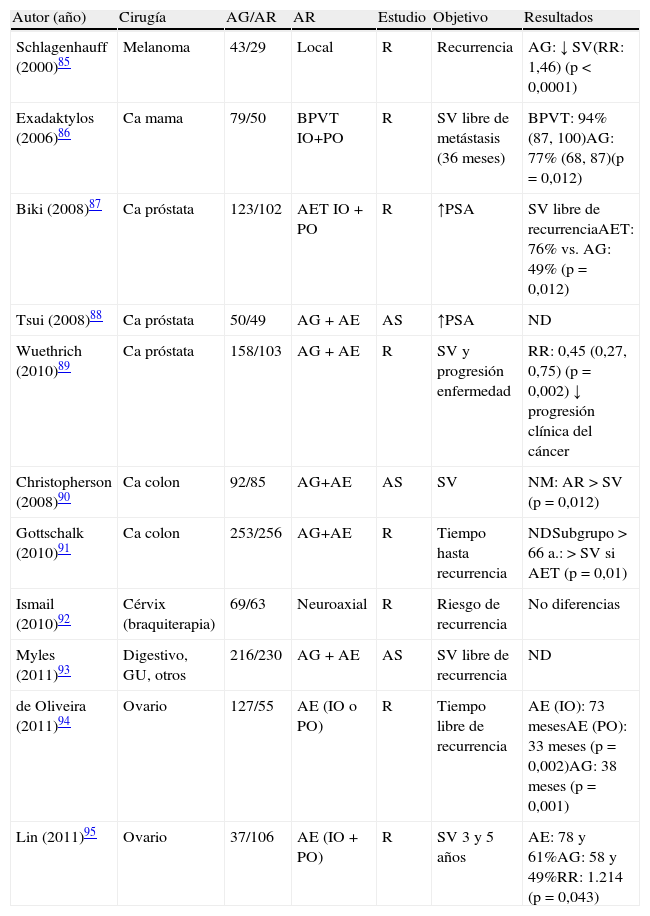
En el año 2000 se publicó el primer estudio clínico comparando el pronóstico oncológico en función de la técnica anestésica empleada, y se observó mayor supervivencia tras resección de melanoma con anestesia local en comparación con anestesia general (recurrencia de melanoma 40% mayor con anestesia general)85. Posteriormente, en cáncer de mama86 tras cirugía con anestesia general y analgesia intravenosa con opioides había 4 veces más recaídas tumorales, más metástasis y menor supervivencia frente a anestesia/analgesia paravertebral. Sin embargo, hasta ahora no hay trabajos puramente prospectivos, por lo que no hay una clara evidencia87–95 (tabla 2).
Estudios clínicos comparativos: anestesia regional frente a general sobre el pronóstico tumoral
| Autor (año) | Cirugía | AG/AR | AR | Estudio | Objetivo | Resultados |
| Schlagenhauff (2000)85 | Melanoma | 43/29 | Local | R | Recurrencia | AG: ↓ SV(RR: 1,46) (p<0,0001) |
| Exadaktylos (2006)86 | Ca mama | 79/50 | BPVT IO+PO | R | SV libre de metástasis (36 meses) | BPVT: 94% (87, 100)AG: 77% (68, 87)(p=0,012) |
| Biki (2008)87 | Ca próstata | 123/102 | AET IO+PO | R | ↑PSA | SV libre de recurrenciaAET: 76% vs. AG: 49% (p=0,012) |
| Tsui (2008)88 | Ca próstata | 50/49 | AG+AE | AS | ↑PSA | ND |
| Wuethrich (2010)89 | Ca próstata | 158/103 | AG+AE | R | SV y progresión enfermedad | RR: 0,45 (0,27, 0,75) (p=0,002) ↓ progresión clínica del cáncer |
| Christopherson (2008)90 | Ca colon | 92/85 | AG+AE | AS | SV | NM: AR>SV (p=0,012) |
| Gottschalk (2010)91 | Ca colon | 253/256 | AG+AE | R | Tiempo hasta recurrencia | NDSubgrupo >66 a.: >SV si AET (p=0,01) |
| Ismail (2010)92 | Cérvix (braquiterapia) | 69/63 | Neuroaxial | R | Riesgo de recurrencia | No diferencias |
| Myles (2011)93 | Digestivo, GU, otros | 216/230 | AG+AE | AS | SV libre de recurrencia | ND |
| de Oliveira (2011)94 | Ovario | 127/55 | AE (IO o PO) | R | Tiempo libre de recurrencia | AE (IO): 73 mesesAE (PO): 33 meses (p=0,002)AG: 38 meses (p=0,001) |
| Lin (2011)95 | Ovario | 37/106 | AE (IO+PO) | R | SV 3 y 5 años | AE: 78 y 61%AG: 58 y 49%RR: 1.214 (p=0,043) |
AE: anestesia epidural; AET: anestesia epidural torácica; AG: anestesia general; AR: anestesia regional; AS: análisis secundario; BPVT: bloqueo paravertebral torácico; GU: genitourinario; IO: intraoperatorio; M: metástasis; ND: no diferencias; NM: no metástasis; PCA: analgesia controlada por paciente; PO: postoperatorio; PSA: antígeno prostático específico; R: retrospectivo; RR: riesgo relativo; SV: supervivencia.
Se han diseñado 3 estudios prospectivos que están evaluando el papel de la técnica anestésica sobre la recurrencia tumoral en cáncer colorrectal (NCT00684229)96, mama (NCT00418457)97 o pulmón (NCT01179308)98.
ConclusionesAunque la evidencia clínica que valora la influencia de los fármacos anestésicos sobre la progresión tumoral es escasa, sí que se puede reconocer en base a los estudios experimentales y clínicos, que la utilización de técnicas anestésicas/analgésicas basadas en el uso de propofol, tramadol, AINE y anestesia regional con anestésicos locales y la consiguiente disminución del consumo perioperatorio de opiáceos, pueden resultar favorecedoras para proteger la respuesta inmune antimetastásica del organismo en un período de especial susceptibilidad protumoral como es el perioperatorio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este artículo pertenece al Programa de Formación Médica Continuada en Anestesiología y Reanimación. La evaluación de las preguntas de este artículo se podrá realizar a través de internet accediendo a la siguiente página web: www.elsevierfmc.com