Los pacientes COVID-19 presentan una coagulopatía caracterizada por una elevada incidencia de complicaciones tromboembólicas. Ante la controversia existente sobre el manejo de la tromboprofilaxis, se llevó a cabo un estudio con el objetivo de analizar el efecto de las diferentes dosis de heparina de bajo peso molecular (HBPM) utilizadas en los pacientes críticos con COVID-19.
Material y métodosSe evaluaron datos del Reg-COVID-19. Se compararon 2 grupos de pacientes según la dosis de HBPM administrada: profilaxis y tratamiento. El objetivo primario fue determinar si había relación de la dosis de HBPM con la mortalidad. Los objetivos secundarios incluyeron la incidencia de eventos trombóticos y hemorrágicos, la duración de la estancia en la UCI, la ventilación mecánica invasiva y los parámetros trombóticos e inflamatorios.
ResultadosSe analizaron datos de 720 pacientes, 258 en el grupo de profilaxis y 462 en el de tratamiento. La proteína C reactiva, la ventilación mecánica invasiva y el tratamiento con tocilizumab o corticosteroides se relacionaron con la elección de la dosis de HBPM. La incidencia de complicaciones hemorrágicas (66/720, 9,2%) y trombóticas (69/720, 9,6%) fue similar en ambos grupos, al igual que el curso temporal de los eventos trombóticos, que ocurrieron antes que los hemorrágicos (9 [3-18] y 12 [6-19] días, respectivamente). La mortalidad fue menor en el grupo de profilaxis (25,2 frente al 35,1%), pero al aplicar un modelo de ponderación de probabilidad inversa, no se encontraron diferencias entre los grupos.
ConclusiónNo se encontraron efectos beneficiosos ni perjudiciales relacionados con la administración de dosis profilácticas o terapéuticas de HBPM en pacientes críticos COVID-19, con una tasa similar de complicaciones hemorrágicas o trombóticas. A partir de estos resultados, consideramos que son necesarios más estudios para determinar el protocolo óptimo de tromboprofilaxis en estos pacientes.
COVID-19 induces coagulopathy associated with an increase of thromboembolic events. Due to the lack of agreement on recommendations for thromboprophylactic management, the aim of this study was to study the dosages of LMWH used in critically ill COVID-19 patients assessing the effect on their outcome.
MetohdsWe evaluated data of the Reg-COVID19. According to LMWH dose two groups were analyzed: prophylaxis and treatment. Primary outcome was the relationship of LMWH dosage with mortality. Secondary outcomes included the incidence of thrombotic and bleeding events, length of ICU stay, invasive mechanical ventilation, and thrombotic and inflammatory parameters.
ResultsData of 720 patients were analyzed, 258 in the prophylaxis group and 462 in the treatment group. C Reactive Protein, invasive mechanical ventilation, tocilizumab and corticosteroid treatments were related with the choice of LMWH dose. Hemorrhagic events (66/720, 9.2%) and thrombotic complications (69/720, 9.6%) were similar in both groups (P=.819 and P=.265), as was the time course of the thrombotic events, earlier than hemorrhagic ones (9 [3-18] and 12 [6-19] days respectively). Mortality was lower in prophylaxis group (25.2% versus 35.1%), but once an inverse probability weighting model was applied, we found no effect of LMWH dose.
ConclusionWe found no benefit or harm with the administration of therapeutic or prophylactic LMWH dose in COVID19 critically ill patients. With a similar rate of hemorrhagic or thrombotic events, the LMWH dose had no influence on mortality. More studies are needed to determine the optimal thromboprophylaxis protocol for critically ill patients.
Las observaciones clínicas han revelado el papel de la inflamación sistémica en la fisiopatología de la infección por SARS-CoV-2. El SARS-CoV-2 se une al receptor celular anti-inflamatorio resultando en un aumento de la señalización en los receptores de trombina y en la activación de las plaquetas1,2. Se ha sugerido que la coagulopatía inducida por COVID-19 puede ser debida a una respuesta inmunotrombótica no controlada a la COVID-19, con una respuesta inflamatoria masiva como principal mecanismo responsable, que incluye una tormenta de citoquinas y de trampas extracelulares de neutrófilos (NET)3.
La sinergia entre la inflamación y la trombosis ha sido bastante descrita por la literatura. Inicialmente fueron descritas vías antinflamatorias dirigidas específicamente a mitigar enfermedades cardiovasculares en pacientes con enfermedades inflamatorias, pero también durante las infecciones4. El 30% de los pacientes con COVID-19 ingresados en unidades de cuidados intensivos (UCI) presentan complicaciones trombóticas macrovasculares a pesar de la tromboprofilaxis3. Incluso bajo tratamiento antitrombótico profiláctico (heparina no fraccionada o heparina de bajo peso molecular [HBPM] capaces de alterar los NET entre otros efectos antiinflamatorios4), se ha observado un número inesperadamente alto de embolia pulmonar (20,6%) en pacientes críticamente enfermos. Esto representa hasta el doble de la frecuencia encontrada en pacientes con puntuaciones de gravedad similares. La trombosis microvascular también se ha relacionado con la progresión de la enfermedad, habiéndose propuesto que los coágulos pulmonares contribuyen a la insuficiencia respiratoria4,5, y los coágulos en otros lechos vasculares a la insuficiencia orgánica múltiple6.
Estas observaciones clínicas han llevado al tratamiento empírico de pacientes hospitalizados con COVID-19 con tromboprofilaxis por HBPM en dosis superiores a las habituales7. Aunque algunas guías señalan que se puede considerar la anticoagulación a dosis intermedias para pacientes en estado crítico8, no está claro si los pacientes con COVID-19 más gravemente enfermos tienen un nivel diferente de riesgo de tromboembolismo venoso (TEV) que otros pacientes ingresados en las UCI. Además, se ha demostrado que la HBPM tiene propiedades antiinflamatorias que pueden ser un beneficio adicional en COVID-19, al cursar con aumento de las citoquinas proinflamatorias9.
Los estudios in vitro dirigidos a investigar el perfil de coagulación en pacientes con COVID-19 muestran un aumento dramático de la generación de trombina ex vivo. En efecto, a pesar de la anticoagulación, la capacidad de generación de trombina no disminuye, el pico de trombina y el potencial endógeno de trombina (ETP) se encuentran en el rango normal10. Concomitantemente, la COVID-19 se asocia con anomalías fibrinolíticas con niveles elevados de PAI-1, TAFI y tPA (liberados debido a una lesión endotelial) que resultan en hipofibrinólisis, la cual desempeña un papel importante en la coagulopatía asociada a COVID-1911.
Al comienzo de la pandemia, según los primeros estudios publicados, no había una recomendación unificada para la prevención y el tratamiento del TEV en pacientes con COVID-19, por lo tanto, la dosis recomendada de tromboprofilaxis varió de la profilaxis estándar actual a la intermedia (HBPM bidosis o aumento de la dosis basada en el peso) o la dosis de anticoagulación plena. Sin embargo, se habían tomado decisiones individualizadas sobre la dosificación de anticoagulantes en todos los estudios y el riesgo de eventos trombóticos o hemorrágicos cuando se trataba con el estándar o más alto de lo habitual seguía sin estar claro. Además, se desconoce el riesgo de sangrado en pacientes críticamente enfermos con COVID-19 y se han reportado datos contradictorios que sugieren un frágil equilibrio en el estado hemostático de estos pacientes12.
La discrepancia entre los datos clínicos junto con los nuevos hallazgos de laboratorio es interesante, las estrategias anticoagulantes para manejar de manera segura y efectiva a estos pacientes siguen siendo un problema desafiante sin resolver para los médicos. Por lo tanto, nuestro objetivo fue estudiar las dosis de HBPM utilizadas en pacientes con COVID-19 en estado crítico y el efecto de estas sobre los resultados.
Material y métodosDiseño del estudioReg-COVID.19 (CoVid19.ubikare.io) es un registro llevado a cabo por un grupo de trabajo colaborativo español (UCI-Network) en el que se recopilaron prospectivamente los datos de las historias clínicas electrónicas de los pacientes ingresados en 36 UCI de España y Andorra, por insuficiencia respiratoria aguda debida a una infección por SARS-CoV-2, siguiendo un protocolo estandarizado que protege la confidencialidad del paciente mediante la seudoanonimización de los datos.
En el presente estudio se llevó a cabo un análisis de la cohorte Reg-COVID-19 de pacientes ingresados entre el 12 de marzo y el 1 de septiembre de 2020, habiendo sido registrado en clinicaltrials.com NCT04623177. El protocolo del estudio fue aprobado por un Comité Ético de referencia (Comité Ético de Euskadi, España) y por el Comité Ético de cada hospital participante. Se obtuvo un consentimiento informado verbal de los familiares de los pacientes por parte de los investigadores, en presencia de un testigo independiente en algunos centros. En otros centros se consideró no necesario dicho consentimiento informado por decisión del Comité de Ética.
Población del estudioSe incluyeron todos los pacientes mayores de 18 años diagnosticados de insuficiencia respiratoria aguda debida a infección por SARS-CoV-2 (confirmada por el estudio de reacción en cadena de la polimerasa en muestras obtenidas a partir de frotis respiratorios) ingresados en la UCI, que recibieron HBPM y se registraron en el registro Reg-COVID-19. El periodo de seguimiento fue el tiempo transcurrido desde el ingreso hasta el alta a la sala COVID del hospital o hasta el fallecimiento. Los criterios de exclusión fueron la ausencia de confirmación de la infección por SARS-CoV-2, la negativa a participar en el estudio, la ausencia de datos clínicos o de laboratorio el primer día de ingreso en la UCI, la existencia de indicaciones de «no reanimación» al ingreso en la UCI y el no cumplimiento de los resultados pre-especificados o no haber sido dado de alta de la UCI en el momento del cierre del estudio.
Recogida de datos, variables y criterios de valoraciónSe analizaron los pacientes en 2 grupos según la dosis de HBPM administrada: grupo de profilaxis (menos de 100UI/kg/24h) y grupo de tratamiento (150UI/kg/24h o más).
El objetivo primario fue evaluar los efectos de la dosis de HBPM en la mortalidad durante la estancia en la UCI. Los objetivos secundarios fueron evaluar los efectos de la dosis de HBPM en la incidencia de eventos trombóticos y hemorrágicos, en la duración de la estancia en la UCI y la ventilación mecánica invasiva, y en los parámetros trombóticos e inflamatorios (véase el material suplementario 1 para los detalles de los parámetros investigados).
Análisis estadísticoSiguiendo el protocolo del estudio, se incluyó a los pacientes que reunían los criterios de inclusión. Las variables de esta población se describieron empleando, según su naturaleza, porcentajes, medias y desviaciones estándar o medianas y rangos intercuartílicos. Para comparar la distribución de dichas variables, entre los 2 grupos (bien definidos por el grado de exposición a la HBPM, bien por el desenlace fallecimiento o supervivencia), se emplearon: a) para las variables medidas en escala de intervalo el test de la t de Student o la U de Mann-Whitney, según tuvieran o no distribución normal; b) para variables categóricas, los test Chi-cuadrado o exacto de Fisher, según la frecuencia esperada de sus categorías. En todos los contrastes, la hipótesis alternativa fue de 2 colas y se empleó una p<0,05 como umbral para el rechazo de la hipótesis nula. Los análisis se realizaron con el programa estadístico STATA® versión 16 (StataCorp LLC, Texas, EE. UU.).
Los datos incluidos en el análisis fueron demográficos y clínicos: previos al ingreso en la UCI (edad, IMC, diabetes, eventos trombóticos, tratamiento antiagregante o anticoagulante y fecha de admisión); en las primeras 48h del ingreso en la UCI (puntuaciones APACHE II y SOFA, relación PaO2/FiO2, ferritina, dímero-D y relación proteína C reactiva [PCR]/linfocitos) y durante la estancia en la UCI (dosis máxima de noradrenalia, número de días con ventilación mecánica, necesidad de técnicas de depuración extrarrenal, niveles máximos de procalcitonina y de creatinina plasmática).
La relación entre las dosis de HBPM (profiláctica frente a tratamiento) y la mortalidad fueron analizados usando técnicas de ponderación por el inverso de la probabilidad de tratamiento, para construir grupos equivalentes en término de las variables previas y asociables a la decisión del tipo de dosis a emplear. Para ello se ajustó un modelo logístico multivariante con la categoría de dosis como variable dependiente, y como explicativas aquellas variables asociadas a la dosis en los análisis bivariantes. Cada paciente fue al final ponderado por el inverso de la probabilidad de ser incluido en la dosis de tratamiento y en esta población se aplicó un modelo logístico para determinar la asociación entre estrategia de anticoagulación y mortalidad intrahospitalaria.
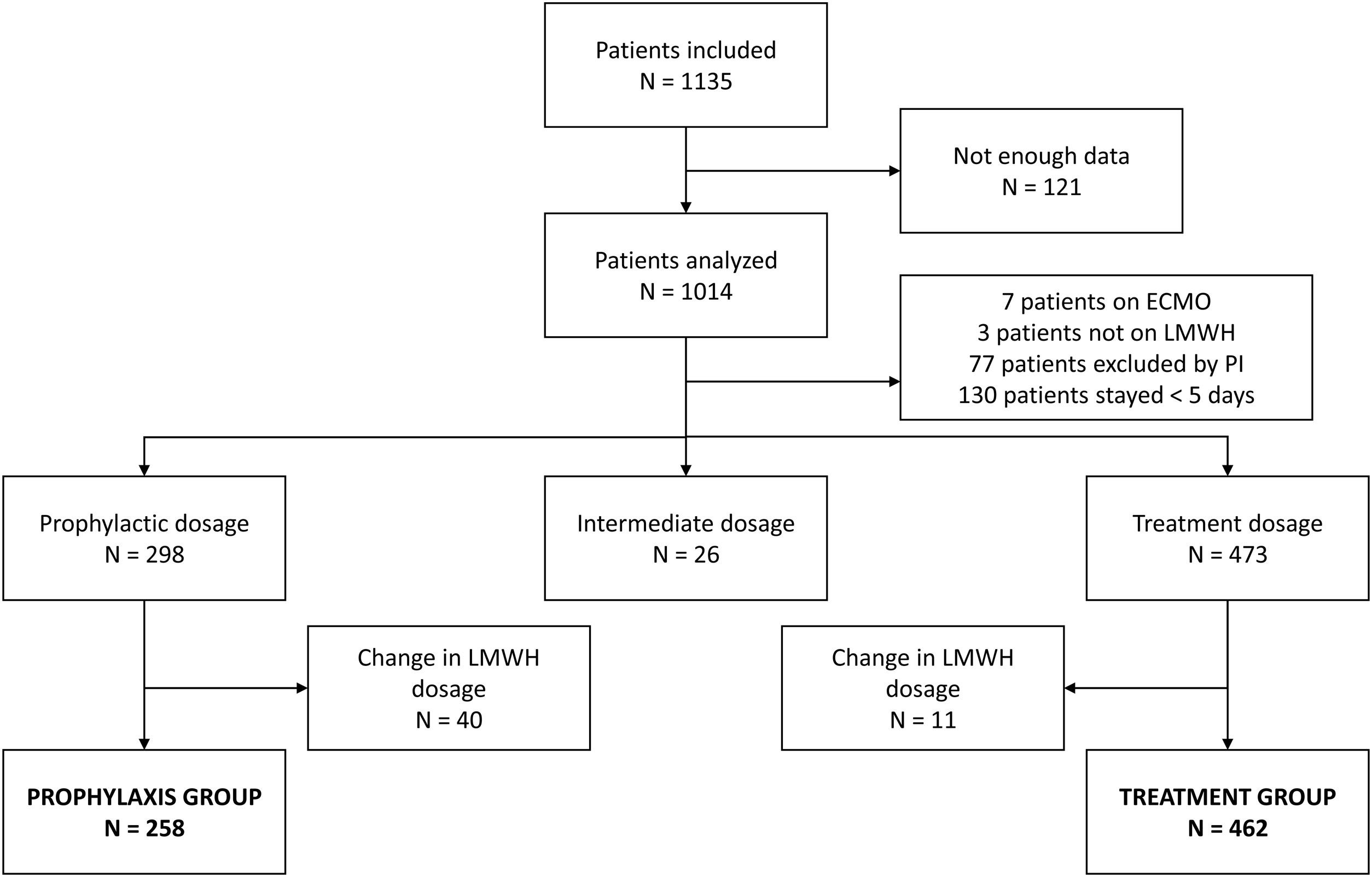
ResultadosSe analizaron 720 pacientes, 258 pertenecientes al grupo de profilaxis y 462 al de tratamiento (fig. 1). Los datos basales y de evolución en la UCI de los grupos de tromboprofilaxis y anticoagulación se describen en la tabla 1. La mayoría de los datos y el uso de apoyo respiratorio con oxigenoterapia de alto flujo como primera opción al ingreso en la UCI fueron similares entre los grupos. Los requerimientos de ventilación mecánica invasiva, las maniobras de reclutamiento y las sesiones de prono fueron significativamente más bajos en el grupo de tromboprofilaxis en las primeras 48h. El uso de bloqueantes neuromusculares, tocilizumab y corticosteroides fue significativamente menor en el grupo de tromboprofilaxis.
Datos demográficos y datos de manejo en la UCI
| GlobalN=720 | ProfilaxisN=258 | TratamientoN=462 | Valor de p | MortalidadN=227 | SupervivenciaN=493 | Valor de p | |
|---|---|---|---|---|---|---|---|
| Datos dek ingreso en la UCI | |||||||
| Edad (años) | 63 [56-71] | 63 [55-70] | 63,50 [56,00-71,00] | 0,196 | 67 [61-72] | 61 [54- 69] | <0,001 |
| Sexo: mujeres | 233 (33) | 84 (33) | 149 (32) | 1,000 | 85 (38) | 148 (30) | 0,05 |
| Índice de masa corporal (kg/m2) | 29 [26-32] | 29 [26-32] | 29,00 [26,00-32,00] | 0,803 | 28 [26-32] | 29 [26-32] | 0,834 |
| Tratamiento crónico: | 25 (11,0) | ||||||
| Antiagregante | 69 (10) | 30 (12) | 39 (8) | 0,207 | 16 (7,0) | 44 (8,9) | 0,454 |
| Anticoagulante | 43 (6) | 16 (6) | 27 (6) | 0,976 | 40 (17,6) | 27 (5,5) | 0,511 |
| Combinado | 110 (15) | 45 (17) | 65 (14) | 0,272 | 70 (14,2) | 0,283 | |
| Días de síntomas hasta la hospitalización | 7 [5-9] | 7 [5-9] | 7 [5-9] | 0,658 | 7 [4-8] | 7 [5-9] | 0,228 |
| Días de síntomas hasta el ingreso en la UCI | 10 [7-13] | 9 [7-12] | 10 [7-13] | 0,547 | 10 [7-13] | 9 [7-13] | 0,797 |
| Ingreso en marzo de 2020 | 574 (80) | 203 (79) | 371 (80) | 0,673 | 192 (84,6) | 382 (77,5) | 0,036 |
| Estancia en la UCI (días) | 15 [9-20] | 15 [8-26] | 16 [10-26] | 0,292 | 16 [10-26] | 15 [9-26] | 0,413 |
| APACHE II | 1 [9-17] | 12 [8-16] | 12 [9-17] | 0,775 | 15 [12-20] | 11 [8-16] | <0,001 |
| SOFA | 7 [4-9] | 7 [4-8] | 7 [4-9] | 0,228 | 8 [6-11] | 6 [4-8] | <0,001 |
| Ratio PaO2/FiO2(%): | |||||||
| 41-100 | 96 (14) | 25 (10,8) | 71 (15,9) | 0,112 | 31 (14,6) | 65 (13,9) | 0,011 |
| 100-200 | 361 (53) | 134 (57,8) | 227 (50,8) | 129 (60,6) | 232 (49,8) | ||
| 200-486 | 222 (33) | 73 (31,5) | 149 (33,3) | 53 (24,9) | 169 (36,3) | ||
| Laboratorio | |||||||
| Ferritina (ng/ml) | 1.564 [854-3.718] | 1.474 [780- 3.732] | 1.613 [907-3.655] | 0,380 | 1.706 [1.077-7.124] | 1.514 [810-3.151] | 0,065 |
| Dímero D (ng/ml) | 2.088 [897-7.185] | 2.200 [800-6.500] | 2.040 [936-7.675] | 0,177 | 3.801 [1.183-14.400] | 1.694 [814-5.438] | <0,001 |
| Proteína C reactiva (mg/l) | 29 [13-162] | 19,76 [10,41-44,72] | 44,75 [16,22-196,00] | <0,001 | 36,15 [14,97-190,50] | 25,57 [12,97-147,54] | 0,017 |
| Recuento linfocitario (×109/l) | 0,7 [0,5-1,08] | 0,70 [0,50-1,00] | 0,74 [0,50-1,10] | 0,388 | 0,70 [0,48-1,04] | 0,74 [0,50-1,10] | 0,221 |
| PCR/recuento linfocitario | 42,8 [15,86-195,6] | 29,45 [13,39-69,36] | 66,67 [17,56-254,75] | <0,001 | 66,34 [20,52-291,03] | 39,40 [15,10-167,74] | 0,006 |
| Plaquetas (×109/l) | 272 [204-607] | 275 [209-390] | 269 [202-434] | 0,768 | 295 [217-1.408] | 266 [201-376] | 0,003 |
| Interleukina 6 (pg/l) | 773 [140-1.732] | 276 [102-1.328] | 0,076 | 277 [74-1.246] | 353 [154-1.575] | 0,239 | |
| Lactato deshidrogenasa (IU/l) | 477 [383-607] | 471 [372-614] | 479 [386-603] | 0,552 | 525 [417-683] | 456 [363-582] | <0,001 |
| Procalcitonina (ng/ml) | 0,26 [0,12-0,6] | 0,28 [0,13-0,67] | 0,24 [0,12-0,60] | 0,304 | 0,43 [0,16-1,00] | 0,23 [0,11-0,51] | <0,001 |
| Aclaramiento de creatinina (ml/min) | 95 [61-120] | 89,54 [63,61-123,00] | 87,01 [60,13-116,50] | 0,443 | 73,05 [48,66-101,69] | 94,73 [70,66-126,88] | <0,001 |
| Soporte extracorpóreo | |||||||
| Oxigenoterapia alto flujo | 28 | 13 (5,0) | 15 (3,2) | 0,321 | 11 (4,8) | 17 (3,4) | 0,488 |
| Ventilación invasiva: | |||||||
| <3 días de ingreso | 598 (83) | 193 (74,8) | 405 (87,7) | <0,001 | 214 (94,3) | 384 (77,9) | <0,001 |
| >2 días de ingreso | 24 (3,3) | 6 (2,3) | 18 (3,9) | 8 (3,5) | 16 (3,2) | ||
| Maniobras de reclutamiento: | |||||||
| <3 días de ingreso | 333 (46) | 93 (36,0) | 240 (51,9) | <0,001 | 122 (53,7) | 211 (42,8) | 0,006 |
| >2 días de ingreso | 84 (12) | 27 (10,5) | 57 (12,3) | 29 (12,8) | 55 (11,2) | ||
| Sesiones decúbito prono: | |||||||
| <3 días de ingreso | 402 (56) | 119 (46,1) | 283 (61,3) | <0,001 | 147 (64,8) | 255 (51,7) | |
| >2 días de ingreso | 106 (15) | 34 (13,2) | 72 (15,6) | 49 (21,6) | 57 (11,6) | <0,001 | |
| Extracción de CO2: | |||||||
| <3 días de ingreso | 1 (0,14) | 0 (0,0) | 1 (0,2) | 0,742 | 1 (0,4) | 0 (0,0) | <0,001 |
| >2 días de ingreso | 13 (1,8) | 5 (1,9) | 8 (1,7) | 12 (5,3) | 1 (0,2) | ||
| Terapia reemplazo renal: | |||||||
| <3 días de ingreso | 20 (2,8) | 6 (2,3) | 14 (3,0) | 0,559 | 11 (4,8) | 9 (1,8) | <0,001 |
| >2 días de ingreso | 68 (9,4) | 21 (8,1) | 47 (10,2) | 46 (20,3) | 22 (4,5) | ||
| Tratamiento farmacológico | |||||||
| Relajación neuromuscular: | |||||||
| <3 días de ingreso | 430 (60) | 136 (52,7) | 294 (63,6) | <0,001 | 169 (74,4) | 261 (52,9) | <0,001 |
| >2 día de ingreso | 71 (9,9) | 18 (7,0) | 53 (11,5) | 32 (14,1) | 39 (7,9) | ||
| Lopinavir/ritonavir: | |||||||
| <3 días de ingreso | 423 (59) | 150 (58,1) | 273 (59,1) | 0,967 | 125 (55,1) | 298 (60,4) | 0,087 |
| >2 días de ingreso | 8 (1,1) | 3 (1,2) | 5 (1,1) | 5 (2,2) | 3 (0,6) | ||
| Hidroxicloroquina: | |||||||
| <3 días de ingreso | 615 (85) | 212 (82,2) | 403 (87,2) | 0,109 | 187 (82,4) | 428 (86,8) | 0,063 |
| >2 días de ingreso | 18 (2,5) | 6 (2,3) | 12 (2,6) | 10 (4,4) | 8 (1,6) | ||
| Remdesivir: | |||||||
| <3 días de ingreso | 12 (0,02) | 6 (2,3) | 6 (1,3) | 0,179 | 3 (1,3) | 9 (1,8) | 0,627 |
| >2 días de ingreso | 9 (1,3) | 1 (0,4) | 8 (1,7) | 4 (1,8) | 5 (1,0) | ||
| Interferón: | |||||||
| <3 días de ingreso | 164 (22,8) | 53 (20,5) | 111 (24,0) | 0,301 | 67 (29,5) | 97 (19,7) | 0,005 |
| >2 días de ingreso | 10 (1,4) | 2 (0,8) | 8 (1,7) | 5 (2,2) | 5 (1,0) | ||
| Tocilizumab: | |||||||
| <3 días de ingreso | 280 (38,9) | 93 (36,0) | 187 (40,5) | 0,006 | 80 (35,2) | 200 (40,6) | 0,393 |
| >2 días de ingreso | 49 (6,8) | 9 (3,5) | 40 (8,7) | 16 (7,0) | 33 (6,7) | ||
| Inmunomoduladores: | |||||||
| <3 días de ingreso | 382 (53,0) | 126 (48,8) | 256 (55,4) | 0,122 | 129 (56,8) | 253 (51,3) | 0,262 |
| >2 días de ingreso | 2 (0,3) | 0 (0,0) | 2 (0,4) | 0 (0,0) | 2 (0,4) | ||
| Azitromicina: | |||||||
| <3 días de ingreso | 495 (68,8) | 181 (70,2) | 314 (68,0) | 0,630 | 140 (61,7) | 355 (72,0) | 0,019 |
| >2 días de ingreso | 38 (5,3) | 11 (4,3) | 27 (5,8) | 16 (7,0) | 22 (4,5) | ||
| Corticoesteroides: | |||||||
| <3 días de ingreso | 419 (58,2) | 135 (52,3) | 284 (61,5) | 0,053 | 121 (53,3) | 298 (60,4) | 0,010 |
| >2 días de ingreso | 151 (21) | 60 (23,3) | 91 (19,7) | 63 (27,8) | 88 (17,8) | ||
| Tratamiento vasopresor | 701 (97,4) | 248 (96,1) | 453 (98,1) | 0,192 | 224 (98,7) | 477 (96,8) | 0,213 |
Los datos se presentan como la mediana [RIQ] para variables continuas y como n (%) para variables dicotómicas.
PCR: proteína C reactiva; UCI: unidad de cuidados intensivos.
Los factores relacionados con la selección precoz de la dosis de HBPM fueron las cifras de PCR, los requerimientos de ventilación mecánica invasiva, y el tratamiento con tocilizumab o corticosteroides (tabla 2).
Relación entre riesgo o factores de severidad de COVID-19 y dosis de tromboprofilaxis
| Predictores | Odds ratio | IC | Valor de p |
|---|---|---|---|
| Edad | 1,01 | 0,99-1,02 | 0,226 |
| Varones | 0,99 | 0,70-1,40 | 0,977 |
| Proteína C reactiva | 1,00 | 1,00-1,01 | <0,001 |
| Ventilación mecánica | 2,58 | 1,63-4,12 | <0,001 |
| Maniobras de reclutamiento | 0,84 | 0,49-1,46 | 0,521 |
| Sesiones decúbito prono | 1,00 | 0,62-1,64 | 0,993 |
| Relajación neuromuscular | 1,76 | 0,96-3,37 | 0,075 |
| Tocilizumab | 2,57 | 1,25-5,85 | 0,015 |
| Corticoesteroides | 0,63 | 0,42-0,94 | 0,022 |
IC: intervalo de confianza.
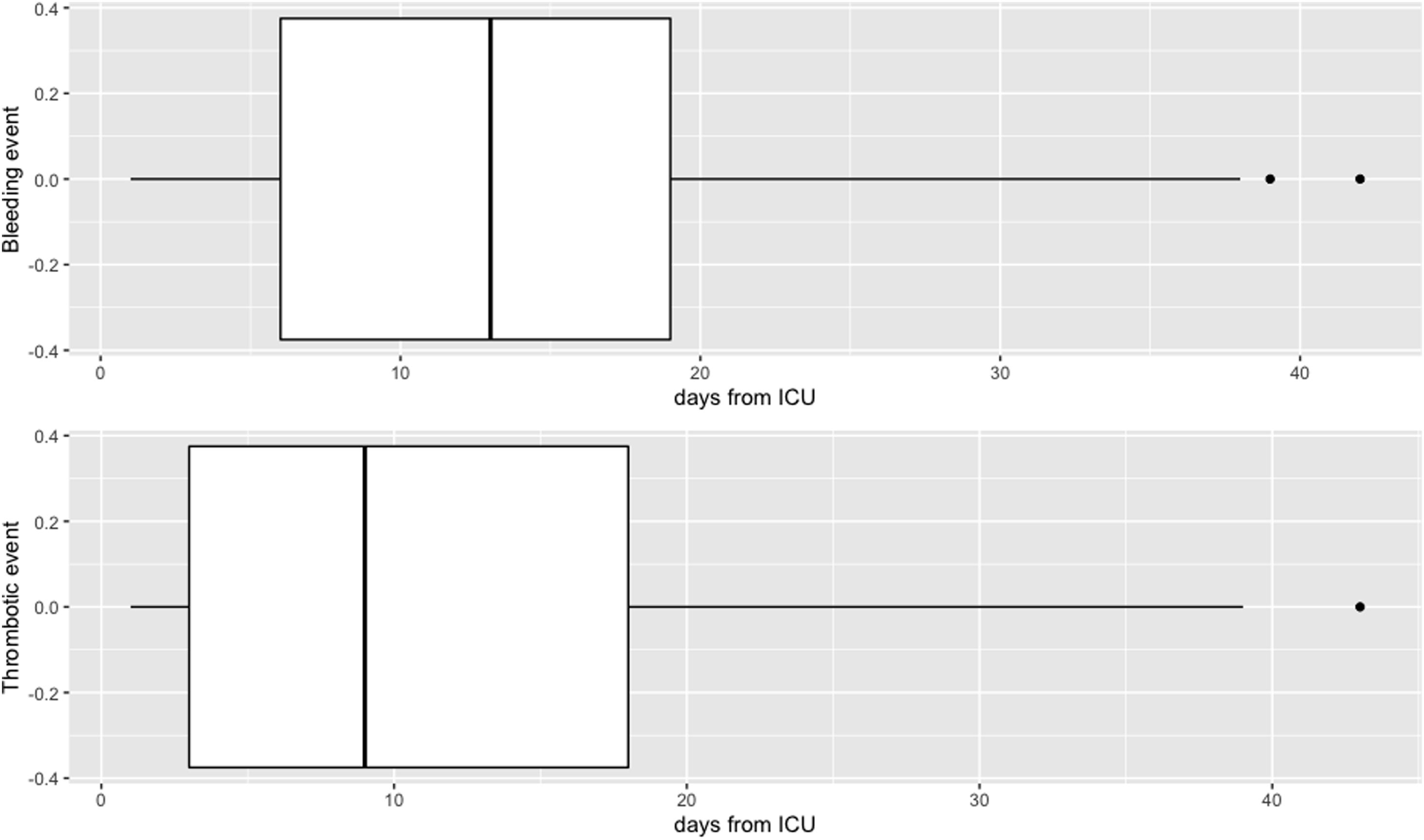
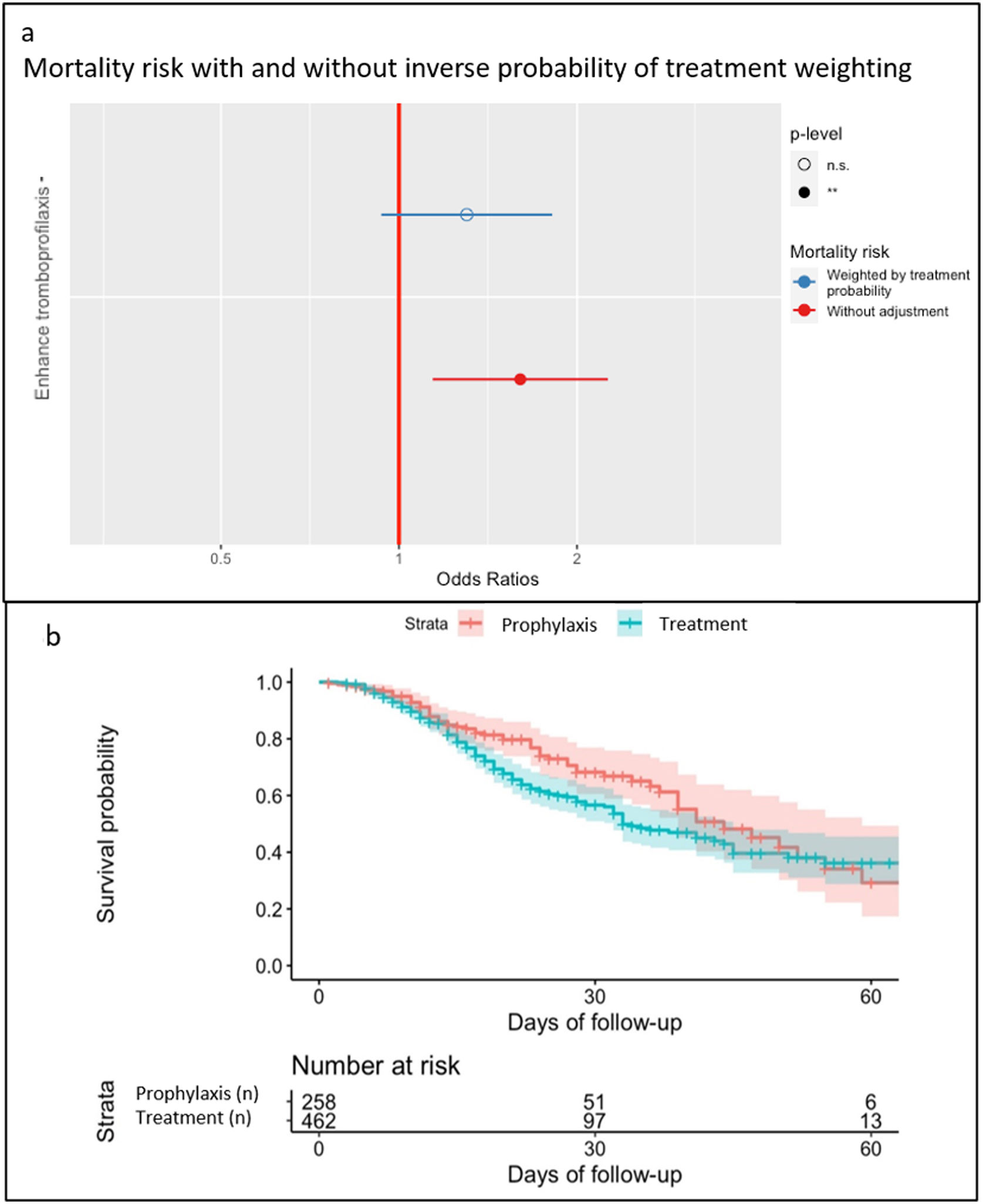
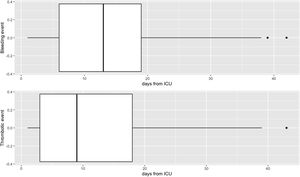
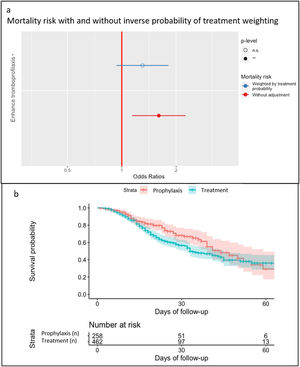
Se observaron 66 hemorragias (9,2%, 37 menores y 29 mayores) y 69 (9,6%) complicaciones trombóticas. Los eventos hemorrágicos y trombóticos (véase el material suplementario 2) tuvieron una presentación diferente en el tiempo, aunque sin diferencias estadísticamente significativas (fig. 2). Las dosis de HBPM no influyeron en las complicaciones, presentando una incidencia similar, de eventos hemorrágicos y trombóticos en ambos grupos, aunque la mortalidad fue significativamente menor en el grupo de tromboprofilaxis (tabla 3). En el grupo de tromboprofilaxis murieron 65/258 (25,2%) pacientes y en el grupo de tratamiento 162/462 (35.1%). No obstante, cuando se aplicó el modelo de ponderación de probabilidad inversa se determinó que no hubo efecto de la dosis de HBPM en la mortalidad (OR: 1,14; CI: 0,82-1,59; p 0,429) (fig. 3a). El shock séptico fue la principal causa de mortalidad en ambos grupos (véase el material suplementario 3). La probabilidad de supervivencia durante la estancia en UCI se muestra en la figura 3b.
El estudio describe, mediante la inclusión de más de 1.000 pacientes, la práctica clínica habitual en enfermos críticos COVID-19 ingresados en la UCI en España. Los resultados muestran la ausencia de beneficio o de daño significativo en términos de incidencia acumulada de mortalidad y de complicaciones trombóticas o hemorrágicas al comparar a los pacientes que recibieron una HBPM a dosis terapéuticas frente a los que recibieron dosis profilácticas.
Al ingreso en la UCI, la decisión sobre la dosis de HBPM dependía del médico responsable y del protocolo de cada hospital. De forma sorprendente, algunos parámetros analíticos descritos en los pacientes del COVID-19 como los incrementos de dímero-D o de ferritina, no influyeron en la decisión sobre la dosis de HBPM que se administró. Sin embargo, los niveles séricos de PCR, la relación PCR/linfocitos y la necesidad de iniciar ventilación mecánica o de realizar maniobras de pronación en los 2 primeros días de ingreso en la UCI, el tratamiento previo con tocilizumab o corticoides, sí fueron factores que condicionaron, aparentemente, la elección de la dosis de HBPM.
Diversos ensayos han tratado de definir el protocolo óptimo de anticoagulación en pacientes críticos, comparando dosis de HBPM profilácticas, intermedias o terapéuticas13–16, poniendo de manifiesto la incertidumbre existente al respecto. Además, durante la primera oleada de la pandemia, cuando se cumplimentó este registro, las dudas eran todavía mayores. Las directrices existentes no coincidían en recomendar uno u otro protocolo de anticoagulación, variando desde la dosis profiláctica para todos los pacientes hasta la anticoagulación a dosis terapéuticas para aquellos pacientes con alta sospecha de haber desarrollado un evento trombótico debido al rápido e inesperado aumento de los parámetros analíticos protrombóticos, o bien solo para aquéllos en los que se hubiera diagnosticado la trombosis17–21.
Nuestro análisis incluyó 720 de los 1.135 pacientes recogidos en el registro UBIKARE, con el objetivo de comparar las 2 estrategias principales para la prevención de eventos trombóticos en pacientes críticos de COVID-19: el 64% de los pacientes recibió una dosis de tratamiento (462/720) y el 36% una dosis profiláctica (258/720). Para disminuir el sesgo y permitir una comparación fiable entre los grupos teniendo en cuenta los factores de confusión, solo se analizaron los pacientes en tratamiento con HBPM y se excluyó de los análisis tanto a los que recibieron dosis intermedias como a aquellos en los que se realizó un cambio en la dosis de HBPM (de profiláctica a terapéutica o viceversa).
Los resultados obtenidos sugieren que la administración sistemática de dosis terapéuticas de HBPM en pacientes ingresados en una UCI, sin diagnóstico confirmado de evento trombótico, no disminuye su incidencia, aunque tampoco influye en la incidencia de eventos hemorrágicos. Por otra parte, si bien en el grupo de pacientes que recibieron una HBPM a dosis terapéuticas se observó una mayor tasa de mortalidad (35 frente al 25% de los pacientes que recibieron la dosis profiláctica), una vez aplicado un modelo de ponderación de probabilidad inversa, no se encontró que la dosis de HBPM tuviera influencia sobre la mortalidad. Este resultado apoyaría una eventual ausencia de beneficio o daño directamente relacionados con la dosis de HBPM.
Estos datos son coincidentes con los comunicados procedentes de ensayos randomizados22,23, que demuestran la ineficacia de la administración de dosis terapéuticas de anticoagulación comparada con dosis profilácticas en pacientes críticos, con el objetivo de disminuir el deterioro multiorgánico y/o la mortalidad. En esta misma línea, otras recomendaciones recientes24,25, también aconsejan no administrar de forma sistemática dosis terapéuticas de anticoagulación. Por último, un metaanálisis26 sugiere igualmente que el aumento de la dosis de HBPM no determinaría ningún beneficio sobre el resultado final.
La confirmación de estos resultados requiere, probablemente, otros estudios, ya que en otros artículos aparecen conclusiones controvertidas. Nadkarni et al.27, en un análisis observacional en el que se compararon 3 ramas con diferentes dosis de anticoagulación (terapéutica, profiláctica o sin anticoagulación), concluyeron que cualquier dosis implica una menor mortalidad y un mejor resultado en los pacientes hospitalizados por COVID-19. Se encontró una asociación no significativa de la anticoagulación terapéutica con una mejora de estos resultados en comparación con la dosis profiláctica. Meizlish et al.15, en un análisis de propensión que comparaba la mortalidad intrahospitalaria en pacientes que recibieron dosis de anticoagulación intermedia frente a la profiláctica (datos retrospectivos que incluían una cohorte de 1.624 pacientes hospitalizados tanto en la sala como en la UCI), concluyeron que la dosis intermedia se asociaba a una menor incidencia acumulada de mortalidad. En el estudio de Lavinio et al.13, realizado con el objetivo de encontrar la dosis óptima, se concluye que una estrategia basada en la denominada «tromboprofilaxis reforzada», podría disminuir la mortalidad de los pacientes ingresados en una UCI sin aumentar las complicaciones hemorrágicas. En el registro Reg-COVID-19, de donde se extraen los datos para este trabajo, solo 33 pacientes recibieron dosis intermedias, por lo que no fue posible realizar un análisis comparativo con este grupo.
En el grupo que recibió dosis terapéuticas, no fue mayor la incidencia de eventos hemorrágicos ni menor la de eventos trombóticos. La COVID-19 grave provoca un incremento de las citoquinas proinflamatorias y de un amplio espectro de células como neutrófilos o plaquetas que poseen una importante influencia sobre los leucocitos mononucleares y las células endoteliales, lo que parece que podría determinar una activación «en bucle» de la coagulación. Por otra parte, la hipoxia tendría también un papel importante en la hipercoagulabilidad a través de la activación del endotelio, con una disminución de la trombomodulina y de la proteína S. De este modo, la fisiopatología de la COVID-19, que combina la tromboinflamación, la inmunotrombosis y la endoteliopatía, podría cuestionar el papel real de la anticoagulación terapéutica con la excepción de los pacientes con un diagnóstico establecido de TEV.
Las complicaciones trombóticas aparecieron más precozmente que las hemorrágicas (9 [3-18] y 12 [6-19] días, respectivamente), de forma similar a los resultados obtenidos por Godier et al. (9 [3-11] días frente a 17 [14-23] días, respectivamente)28. Aunque no es posible extraer ninguna conclusión definitiva, incluso con la baja tasa de complicaciones hemorrágicas observada en nuestro estudio (4%, 29/720 de complicaciones hemorrágicas mayores), una vez que la inflamación disminuya siguiendo el propio curso de la enfermedad, la reducción de la dosis de HBPM podría disminuir también el riesgo hemorrágico asociado.
La incidencia de complicaciones trombóticas clínicamente significativas encontrados en nuestro registro fue del 9,6% (69/720 pacientes), sin que se observaran diferencias entre los grupos (7,8 frente al 10,6%; p=0,265). En los primeros estudios en pacientes COVID-19 en los que se realizó un cribado sistemático de la ETV, se comunicó una tasa más elevada de complicaciones trombóticas, llegando incluso al 70-80%29,30 en pacientes críticos, lo que plantea la posibilidad de casos no diagnosticados que podrían haberse perdido en nuestro registro. En el ensayo INSPIRATION14, en el que se compararon dosis intermedias y estándar de enoxaparina, se notificó una tasa global de TEV del 3,4% (3,3 y 3,5%, respectivamente), lo cual puede hacer pensar que la falta de una búsqueda dirigida de complicaciones trombóticas en el Reg-COVID-19, no debe haber tenido probablemente ninguna influencia sobre el resultado final de las mismas.
Este estudio presenta algunos puntos fuertes. En primer lugar, se trata de un estudio prospectivo y multicéntrico a nivel nacional con más de 1.000 pacientes de 36 UCI proporcionando una descripción detallada de todos los datos recopilados desde el ingreso en la UCI hasta el fallecimiento o el alta de la misma. En segundo lugar, hemos utilizado la herramienta estadística de ponderación por el inverso de la probabilidad de tratamiento para disminuir los sesgos al controlar los factores de confusión demográficos, de comorbilidades y de gravedad previamente especificados.
Por otra parte, también es necesario señalar las limitaciones del estudio. Los datos del registro proceden de pacientes de la primera oleada (marzo-mayo de 2020), cuando la enfermedad superó en muchos casos la capacidad de atención médica y no se disponía los conocimientos suficientes sobre aspectos como la inflamación y su implicación fisiopatológica en el desarrollo de la trombosis. Una limitación evidente es el carácter observacional del estudio, que puede implicar ciertos sesgos. Aunque, como se ha comentado, se ajustaron los posibles factores de confusión, es posible que haya otros que no se hayan tenido en cuenta. Por lo tanto, la principal debilidad de nuestro trabajo es el propio registro, con la pérdida de diversos datos de algunos pacientes. Al tratarse de un registro real, fuera de un ensayo, con muchos hospitales implicados, la decisión sobre la administración de la dosis de HBPM dependió de cada facultativo responsable, de forma individual siguiendo el protocolo local aceptado en cada hospital, que se modificó siguiendo las directrices de las autoridades sanitarias. Por ello, también podríamos encontrar otra limitación en la no diferenciación de resultados entre los hospitales participantes. Finalmente, tampoco había información suficiente sobre la profilaxis o el tratamiento anticoagulante antes del ingreso en la UCI y su posible impacto en dicho ingreso o en los resultados globales del estudio. Sin embargo, creemos que, en el momento de la recogida de datos, la mayoría de los protocolos consideraban más adecuado el tratamiento profiláctico de los pacientes ingresados en las salas de hospitalización.
Por último, al tratarse de un conjunto de datos observacionales y de un análisis retrospectivo, no puede obtenerse de este estudio ninguna relación causa/efecto. Los resultados deben interpretarse como una aproximación a lo que podría ser la estrategia de tromboprofilaxis ideal para los pacientes críticos con COVID-19.
ConclusiónEn este estudio prospectivo observacional de pacientes críticos COVID19 ingresados en la UCI, la administración sistemática de una dosis terapéutica de HBPM al compararla con una dosis profiláctica no mostró ningún beneficio o perjuicio. Nuestros datos respaldan que la anticoagulación terapéutica sistematizada no mejora el resultado y que quizás debería reservarse para pacientes con confirmación o con alta sospecha de la existencia una complicación trombótica, adaptándose individualmente en función de la evolución clínica. La dosis de HBPM no influyó en la mortalidad ni en las complicaciones hemorrágicas o trombóticas. Es necesario esperar a las conclusiones definitivas de los ensayos aleatorizados, principalmente en pacientes críticos, para determinar el protocolo óptimo de tromboprofilaxis en cada caso.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro especial agradecimiento a todos los pacientes y familiares que han participado en el estudio. Así mismo, agradecemos el indispensable trabajo realizado por todos los investigadores del COVID-19 Spanish ICU Network Group, por lo que agradeceríamos que sus nombres se registraran en PubMed.