Recientes publicaciones han puesto en duda la eficacia de la utilización de dosis terapéuticas o intermedias de heparina de bajo peso molecular (HBPM) en pacientes COVID-19, especialmente en los pacientes más graves. Con el objetivo de actualizar estas recomendaciones se ha realizado una revisión no sistemática en las principales bases de datos médicas. Se seleccionaron un total de 14 ensayos clínicos aleatorizados, 14 metaanálisis y las recomendaciones de 12 sociedades científicas, estratificadas según el tipo de paciente (ambulatorio, hospitalizado, ingresado en cuidados críticos o post-alta). Se ha analizado la eficacia de HBPM y también de otras aproximaciones terapéuticas (rivaroxabán, apixabán, sulodexida, ácido acetilsalicílico e inhibidores P2Y12). Los hallazgos recomiendan utilizar dosis estándar de HBPM como tromboprofilaxis en los pacientes COVID-19 hospitalizados críticos y dosis terapéutica en hospitalizados no críticos si el riesgo de sangrado es bajo. En los pacientes ambulatorios y dados de alta del hospital podría utilizarse HBPM a dosis profiláctica si existen factores de riesgo trombótico y el riesgo hemorrágico es bajo. No se recomienda asociar antiagregantes plaquetarios a la HBPM salvo indicación previa.
Recent publications have questioned the efficacy of using therapeutic or intermediate doses of low molecular weight heparin (LMWH) in COVID-19 patients, especially in the most severe patients. In order to update these recommendations, a non-systematic review has been carried out in the main medical databases. A total of 14 randomized clinical trials, 14 meta-analyses and the recommendations of 12 scientific societies were selected, stratified according to the type of patient (outpatient, hospitalized, admitted to critical care or post-discharge). The efficacy of LMWH and other therapeutic approaches (rivaroxaban, apixaban, sulodexide, acetylsalicylic acid and P2Y12 inhibitors) has been analyzed. The findings recommend using standard doses of LMWH as thromboprophylaxis in critically hospitalized COVID-19 patients and therapeutic doses in non-critically hospitalized patients with low bleeding risk. In outpatients and those discharged from the hospital, LMWH could be used at a prophylactic dose if there are thrombotic risk factors, and the bleeding risk is low. It is not recommended to associate antiplatelet agents with LMWH unless previously indicated.
La infección por SARS-CoV-2 (COVID-19) se caracteriza por la presencia de una respuesta inflamatoria grave asociada a una elevada tasa de mortalidad acompañada de una alta prevalencia de complicaciones trombóticas. Un metaanálisis1 ha comunicado una prevalencia general de tromboembolismo venoso de 14,1% que se incrementa hasta el 45,6% en los pacientes ingresados en unidades de cuidados críticos (UCC).
Los estudios anatomopatológicos de pacientes fallecidos por COVID-19 confirman una alta incidencia de macroembolias pulmonares, lesión endotelial grave, aumento de la angiogénesis, macroembolias y oclusión de capilares alveolares2. Esta situación de hipercoagulabilidad se refleja por el aumento de las características viscoelásticas, hiperactivación plaquetaria y, sobre todo, por el aumento del dímero-D, habiéndose encontrado una relación directa entre el aumento de la concentración de dímeros-D y el mal pronóstico3.
En respuesta a las complicaciones trombóticas observadas, se han desarrollado diversas estrategias preventivas que incluyen anticoagulantes parenterales, y, más recientemente, anticoagulantes orales y antiagregantes.
En mayo de 2020 se publicó un documento de consenso SEDAR-SEMICYUC4 sobre el manejo de las alteraciones de la hemostasia en los pacientes COVID-19 graves con especial énfasis en las recomendaciones de profilaxis anticoagulante. En el documento se recomendaban 3 posologías de heparina de bajo peso molecular (HBPM): estándar (equivalente a 40mg de enoxaparina para un peso corporal inferior o igual a 80kg), intermedia (1mg/kg/24h) y terapéutica (1mg/kg/12h), en función del riesgo trombótico del paciente. En artículos aparecidos desde la publicación del consenso se ha puesto en duda la utilidad de realizar tromboprofilaxis con dosis superiores a la estándar, especialmente en los pacientes críticos tanto fuera como dentro de nuestro país5–7.
A la vista de las nuevas evidencias, es preciso actualizar esas recomendaciones para adaptarlas a las vigentes en la actualidad. Por ese motivo, se ha realizado una revisión no sistemática de la literatura científica aparecida en los dos últimos años relacionada con la tromboprofilaxis en pacientes COVID-19.
Material y métodosSe ha realizado una búsqueda en PubMed, Google Academic, Embase y Cochrane utilizando las palabras clave COVID-19, thromboprophylaxis, heparin, low molecular weight heparin, anticoagulant, aspirin, clinical trial, meta-analysis, clinical practice guideline en publicaciones realizadas entre los años 2020-2022. Solo se seleccionaron ensayos clínicos aleatorizados, metaanálisis y guías de práctica clínica procedentes de sociedades científicas o grupos de trabajo específicos.
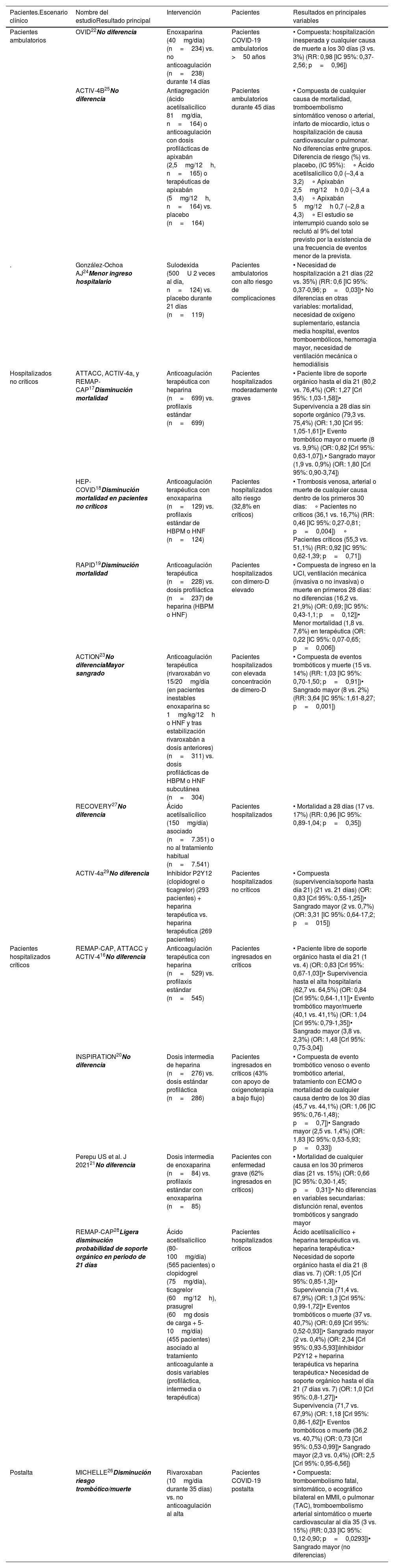
ResultadosSe seleccionaron un total de 14 ensayos clínicos aleatorizados; en 7 se utilizó HBPM, en 2 rivaroxabán, en 1 apixabán, en 1 sulodexida, en 3 ácido acetilsalicílico y en 2 inhibidores P2Y12. La tabla 1 muestra las características y referencias de estos estudios. Asimismo, se analizaron 14 metaanálisis o revisiones sistemáticas que compararon diversas dosis de heparina (estándar, intermedia o terapéutica) como tratamiento tromboprofiláctico. Finalmente, se recogieron las recomendaciones de 12 sociedades científicas y grupos de trabajo estratificadas según el tipo de paciente (ambulatorio, hospitalizado, ingresado en cuidados críticos o postalta). La tabla 2 muestra las características y referencias.
Ensayos clínicos prospectivos aleatorizados de tromboprofilaxis en COVID-19
| Pacientes.Escenario clínico | Nombre del estudioResultado principal | Intervención | Pacientes | Resultados en principales variables |
|---|---|---|---|---|
| Pacientes ambulatorios | OVID22No diferencia | Enoxaparina (40mg/día) (n=234) vs. no anticoagulación (n=238) durante 14 días | Pacientes COVID-19 ambulatorios >50 años | • Compuesta: hospitalización inesperada y cualquier causa de muerte a los 30 días (3 vs. 3%) (RR: 0,98 [IC 95%: 0,37-2,56; p=0,96]) |
| ACTIV-4B25No diferencia | Antiagregación (ácido acetilsalicílico 81mg/día, n=164) o anticoagulación con dosis profilácticas de apixabán (2,5mg/12h, n=165) o terapéuticas de apixabán (5mg/12h, n=164) vs. placebo (n=164) | Pacientes ambulatorios durante 45 días | • Compuesta de cualquier causa de mortalidad, tromboembolismo sintomático venoso o arterial, infarto de miocardio, ictus o hospitalización de causa cardiovascular o pulmonar. No diferencias entre grupos. Diferencia de riesgo (%) vs. placebo, (IC 95%):∘ Ácido acetilsalicílico 0,0 (–3,4 a 3,2)∘ Apixabán 2,5mg/12h 0,0 (–3,4 a 3,4)∘ Apixabán 5mg/12h 0,7 (–2,8 a 4,3)∘ El estudio se interrumpió cuando solo se reclutó al 9% del total previsto por la existencia de una frecuencia de eventos menor de la prevista. | |
| . | González-Ochoa AJ24Menor ingreso hospitalario | Sulodexida (500U 2 veces al día, n=124) vs. placebo durante 21 días (n=119) | Pacientes ambulatorios con alto riesgo de complicaciones | • Necesidad de hospitalización a 21 días (22 vs. 35%) (RR: 0,6 [IC 95%: 0,37-0,96; p=0,03])• No diferencias en otras variables: mortalidad, necesidad de oxígeno suplementario, estancia media hospital, eventos tromboembólicos, hemorragia mayor, necesidad de ventilación mecánica o hemodiálisis |
| Hospitalizados no críticos | ATTACC, ACTIV-4a, y REMAP-CAP17Disminución mortalidad | Anticoagulación terapéutica con heparina (n=699) vs. profilaxis estándar (n=699) | Pacientes hospitalizados moderadamente graves | • Paciente libre de soporte orgánico hasta el día 21 (80,2 vs. 76,4%) (OR: 1,27 [Crl 95%: 1,03-1,58])• Supervivencia a 28 días sin soporte orgánico (79,3 vs. 75,4%) (OR: 1,30 [Crl 95: 1,05-1,61])• Evento trombótico mayor o muerte (8 vs. 9,9%) (OR: 0,82 [Crl 95%: 0,63-1,07]).• Sangrado mayor (1,9 vs. 0,9%) (OR: 1,80 [Crl 95%: 0,90-3,74]) |
| HEP-COVID18Disminución mortalidad en pacientes no críticos | Anticoagulación terapéutica con enoxaparina (n=129) vs. profilaxis estándar de HBPM o HNF (n=124) | Pacientes hospitalizados alto riesgo (32,8% en críticos) | • Trombosis venosa, arterial o muerte de cualquier causa dentro de los primeros 30 días:∘ Pacientes no críticos (36,1 vs. 16,7%) (RR: 0,46 [IC 95%: 0,27-0,81; p=0,004])∘ Pacientes críticos (55,3 vs. 51,1%) (RR: 0,92 [IC 95%: 0,62-1,39; p=0,71]) | |
| RAPID19Disminución mortalidad | Anticoagulación terapéutica (n=228) vs. dosis profiláctica (n=237) de heparina (HBPM o HNF) | Pacientes hospitalizados con dímero-D elevado | • Compuesta de ingreso en la UCI, ventilación mecánica (invasiva o no invasiva) o muerte en primeros 28 días: no diferencias (16,2 vs. 21,9%) (OR: 0,69; [IC 95%: 0,43-1,1; p=0,12])• Menor mortalidad (1,8 vs. 7,6%) en terapéutica (OR: 0,22 [IC 95%: 0,07-0,65; p=0,006]) | |
| ACTION23No diferenciaMayor sangrado | Anticoagulación terapéutica (rivaroxabán vo 15/20mg/día (en pacientes inestables enoxaparina sc 1mg/kg/12h o HNF y tras estabilización rivaroxabán a dosis anteriores) (n=311) vs. dosis profilácticas de HBPM o HNF subcutánea (n=304) | Pacientes hospitalizados con elevada concentración de dímero-D | • Compuesta de eventos trombóticos y muerte (15 vs. 14%) (RR: 1,03 [IC 95%: 0,70-1,50; p=0,91])• Sangrado mayor (8 vs. 2%) (RR: 3,64 [IC 95%: 1,61-8,27; p=0,001]) | |
| RECOVERY27No diferencia | Ácido acetilsalicílico (150mg/día) asociado (n=7.351) o no al tratamiento habitual (n=7.541) | Pacientes hospitalizados | • Mortalidad a 28 días (17 vs. 17%) (RR: 0,96 [IC 95%: 0,89-1,04; p=0,35]) | |
| ACTIV-4a29No diferencia | Inhibidor P2Y12 (clopidogrel o ticagrelor) (293 pacientes) + heparina terapéutica vs. heparina terapéutica (269 pacientes) | Pacientes hospitalizados no críticos | • Compuesta (supervivencia/soporte hasta día 21) (21 vs. 21 días) (OR: 0,83 [Crl 95%: 0,55-1,25])• Sangrado mayor (2 vs. 0,7%) (OR: 3,31 [IC 95%: 0,64-17,2; p=015]) | |
| Pacientes hospitalizados críticos | REMAP-CAP, ATTACC y ACTIV-416No diferencia | Anticoagulación terapéutica con heparina (n=529) vs. profilaxis estándar (n=545) | Pacientes ingresados en críticos | • Paciente libre de soporte orgánico hasta el día 21 (1 vs. 4) (OR: 0,83 [Crl 95%: 0,67-1,03])• Supervivencia hasta el alta hospitalaria (62,7 vs. 64,5%) (OR: 0,84 [Crl 95%: 0,64-1,11])• Evento trombótico mayor/muerte (40,1 vs. 41,1%) (OR: 1,04 [Crl 95%: 0,79-1,35])• Sangrado mayor (3,8 vs. 2,3%) (OR: 1,48 [Crl 95%: 0,75-3,04]) |
| INSPIRATION20No diferencia | Dosis intermedia de heparina (n=276) vs. dosis estándar profiláctica (n=286) | Pacientes ingresados en críticos (43% con apoyo de oxigenoterapia a bajo flujo) | • Compuesta de evento trombótico venoso o evento trombótico arterial, tratamiento con ECMO o mortalidad de cualquier causa dentro de los 30 días (45,7 vs. 44,1%) (OR: 1,06 [IC 95%: 0,76-1,48); p=0,7])• Sangrado mayor (2,5 vs. 1,4%) (OR: 1,83 [IC 95%: 0,53-5,93; p=0,33]) | |
| Perepu US et al. J 202121No diferencia | Dosis intermedia de enoxaparina (n=84) vs. profilaxis estándar con enoxaparina (n=85) | Pacientes con enfermedad grave (62% ingresados en críticos) | • Mortalidad de cualquier causa en los 30 primeros días (21 vs. 15%) (OR: 0,66 [IC 95%: 0,30-1,45; p=0,31])• No diferencias en variables secundarias: disfunción renal, eventos trombóticos y sangrado mayor | |
| REMAP-CAP28Ligera disminución probabilidad de soporte orgánico en periodo de 21 días | Ácido acetilsalicílico (80-100mg/día) (565 pacientes) o clopidogrel (75mg/día), ticagrelor (60mg/12h), prasugrel (60mg dosis de carga + 5-10mg/día) (455 pacientes) asociado al tratamiento anticoagulante a dosis variables (profiláctica, intermedia o terapéutica) | Pacientes hospitalizados críticos | Ácido acetilsalicílico + heparina terapéutica vs. heparina terapéutica:• Necesidad de soporte orgánico hasta el día 21 (8 días vs. 7) (OR: 1,05 [Crl 95%: 0,85-1,3])• Supervivencia (71,4 vs. 67,9%) (OR: 1,3 [Crl 95%: 0,99-1,72])• Eventos trombóticos o muerte (37 vs. 40,7%) (OR: 0,69 [Crl 95%: 0,52-0,93])• Sangrado mayor (2 vs. 0,4%) (OR: 2,34 [Crl 95%: 0,93-5,93])Inhibidor P2Y12 + heparina terapéutica vs heparina terapéutica:• Necesidad de soporte orgánico hasta el día 21 (7 días vs. 7) (OR: 1,0 [Crl 95%: 0,8-1,27])• Supervivencia (71,7 vs. 67,9%) (OR: 1,18 [Crl 95%: 0,86-1,62])• Eventos trombóticos o muerte (36,2 vs. 40,7%) (OR: 0,73 [Crl 95%: 0,53-0,99])• Sangrado mayor (2,3 vs. 0,4%) (OR: 2,5 [Crl 95%: 0,95-6,56]) | |
| Postalta | MICHELLE26Disminución riesgo trombótico/muerte | Rivaroxaban (10mg/día durante 35 días) vs. no anticoagulación al alta | Pacientes COVID-19 postalta | • Compuesta: tromboembolismo fatal, sintomático, o ecográfico bilateral en MMII, o pulmonar (TAC), tromboembolismo arterial sintomático o muerte cardiovascular al día 35 (3 vs. 15%) (RR: 0,33 [IC 95%: 0,12-0,90; p=0,0293])• Sangrado mayor (no diferencias) |
Crl: intervalo creíble; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; UCI: unidad de cuidados intensivos; ECMO: oxigenación por membrana extracorpórea.
Recomendaciones guías de práctica clínica sobre tromboprofilaxis en COVID-19
| Fuente | Ambulatorios | Hospitalizados | Cuidados críticos | Post-alta |
|---|---|---|---|---|
| WHO guidance(enero, 2021)39 | — | Dosis tromboprofilaxis rutinaria | Dosis tromboprofilaxis rutinaria | No tromboprofilaxis rutinaria |
| European Respiratory Society (abril 2021)40 | — | Recomendación anticoagulación vs. no anticoagulación (no acuerdo en dosis) | Recomendación anticoagulación vs no anticoagulación (no acuerdo en dosis) | — |
| French working group on perioperative haemostasis (GIHP) and the French study group on thrombosis and haemostasis (GFHT), in collaboration with the French society of anaesthesia and intensive care (SFAR) (agosto 2021)41 | Dosis tromboprofilaxis rutinaria en pacientes con movilidad reducida asociada con al menos un factor de riesgo: IMC> 30kg/m2, edad >70 años, cáncer activo, historia de ETV o cirugía mayor <3 meses | Dosis tromboprofilaxis rutinaria (mantener AVK y cambiar ACOD a vía parenteral para evitar interacciones) | Dosis intermedia en pacientes con alto requerimiento de oxigenoterapia o ventilación mecánica.Dosis terapéutica en pacientes con muy alto riesgo trombótico: dinero-D>5mg/ml (o rápido incremento, por ejemplo, al menos 2 veces, desde un valor base >2mg/ml en un plazo de 24-48h). Realizar despistaje de trombosis | — |
| American Society of Hematology guidelines (octubre, 2021)42 | Dosis tromboprofilaxis rutinaria (en ausencia de ETV sospechada o confirmada) | Dosis tromboprofilaxis rutinaria (en ausencia de ETV sospechada o confirmada) | — | |
| Grupo Cooperativo Latinoamericano en Hemostasia y Trombosis (CLAHT) (diciembre 2021)43 | — | Dosis tromboprofilaxis rutinaria | Sin consenso. Valorar dosis terapéutica si ventilación mecánica invasiva, hipoxemia resistente, inestabilidad hemodinámica vinculable a la enfermedad subyacente o una calificación de coagulopatía inducida por sepsis (CIS) ≥4.Dosis terapéutica casos de sospecha o confirmación de TEV aguda o en pacientes ya anticoagulados | Dosis tromboprofilaxis rutinaria |
| European Society of Cardiology (diciembre 2021)44 | — | Dosis tromboprofilaxis rutinaria | Dosis tromboprofilaxis rutinaria, valorando dosis intermedia o terapéutica en función del riesgo trombótico | — |
| Italian Society of Anti-Infective Therapy (SITA) and the Italian Society of Pulmonology (SIP). (diciembre 2021)45 | — | Dosis tromboprofilaxis rutinaria. En anticoagulados previamente mantener tratamiento.Valorar anticoagulación terapéutica en pacientes con elevado riesgo trombótico o alta sospecha de complicación trombótica | — | |
| American Society of Hematology guidelines(enero, 2022)46 | — | — | No profilaxis rutinaria (en ausencia de ETV sospechada o confirmada) | |
| Saudi Critical Care Society(enero 2022)47 | — | — | Dosis tromboprofilaxis rutinaria (en ausencia de sospecha clínica de ETV) | — |
| A national German living guideline using an Evidence to Decision Framework (febrero 2022)48 | — | Dosis tromboprofilaxis rutinaria, Incrementar si factores de riesgo de ETV y riesgo de sangrado bajo. Riesgos incluye obesidad (IMC>35kg/m2), ETV previa, trombofilia, tratamiento en la UCI y dímero-D incrementado (>2-3mg/l) | Dosis tromboprofilaxis rutinaria, incrementar si factores de riesgo de ETV y riesgo de sangrado bajo. Riesgos incluye obesidad (IMC>35kg/m2), ETV previa, trombofilia, tratamiento en críticos y dímero-D incrementado (>2-3mg/l) | — |
| CHEST Guideline and Expert Panel Report (febrero 2022)49 | — | Dosis terapéutica (si bajo riesgo de sangrado) | Dosis tromboprofilaxis rutinaria | — |
| International Society on Thrombosis and Haemostasis (cctubre, 2022)50 | Mantener antiagregación si profilaxis secundaria indicada previamenteMantener anticoagulación oral si indicada previamenteMantener HBPM si indicada previamentePrecaución interacción ACODNo iniciar HBPMNo iniciar AAS | Dosis terapéutica (si bajo riesgo de sangrado)Mantener antiagregantes si profilaxis secundaria indicada previamenteNo iniciar antiagregantesNo iniciar ACOD | Dosis tromboprofilaxis rutinariaNo asociar antiagregantes | Tromboprofilaxis rutinaria extendida podría ser razonable en pacientes con factores de riesgo |
AAS: ácido acetilsalicílico; ACOD: anticoagulantes orales directos; AVK: anticoagulantes anti-vitamina K; ETV: enfermedad tromboembólica venosa; HBPM: heparina de bajo peso molecular; IMC: índice de masa corporal; TEV: tromboembolismo venoso.
En las siguientes secciones se describen los principales hallazgos obtenidos con los fármacos utilizados.
Tromboprofilaxis con heparinaMúltiples estudios, la mayoría de ellos retrospectivos, observacionales y metaanálisis han proporcionado evidencia sobre el potencial beneficio del tratamiento anticoagulante parenteral (especialmente con HBPM). Sin embargo, los resultados no han sido siempre comparables debido a diferencias metodológicas en el diseño de los estudios, básicamente por las diferentes dosis de HBPM utilizadas. Estas diferencias justificaron la necesidad de realizar ensayos controlados aleatorios bien diseñados y suficientemente grandes para valorar la eficacia y la seguridad del tratamiento anticoagulante en pacientes con COVID-19, muchos de los cuales han terminado recientemente o se encuentran en fase de ejecución.
Al menos 14 metaanálisis y una revisión sistemática Cochrane reciente han analizado el efecto de diversas dosis de heparina profiláctica sobre la evolución clínica de los pacientes. En la mayoría de los estudios8–14 (casi todos retrospectivos) las variables analizadas han sido supervivencia a los 30 días, necesidad de ingreso en la UCC, necesidad y días de soporte ventilatorio (invasivo y no invasivo), complicaciones trombóticas y eventos hemorrágicos entre otros. La mayoría de estas publicaciones concluyen que el incremento de dosis de heparina aporta pocas o ninguna ventaja neta respecto a la administración de una dosis tromboprofiláctica estándar. Si bien algunas de estas publicaciones afirman que altas dosis de heparina se asocian con una ligera reducción de embolismo pulmonar o trombosis venosa profunda (TVP), este beneficioso efecto se contrarresta con un incremento del riesgo de hemorragia, lo que probablemente conduzca a que la mortalidad se mantenga en similar proporción.
A principios de la pandemia, se diseñaron diversos estudios clínicos prospectivos y aleatorizados destinados a investigar la acción tromboprofiláctica con heparina no fraccionada (HNF) y HBPM en la evolución del COVID-1915 (tabla 1). Cuatro estudios han comparado el efecto de la anticoagulación terapéutica con heparina vs. anticoagulación profiláctica en la tasa de eventos trombóticos y mortalidad en pacientes, 1 de ellos en pacientes críticos16 y 3 en pacientes hospitalizados moderadamente graves o considerados de alto riesgo trombótico (estudios de LAWLER, SPYROPOULOS y SHOLZBERG)17–19.
En el estudio realizado exclusivamente en pacientes críticos16 hubo menos eventos trombóticos en pacientes asignados a anticoagulación terapéutica (6 vs. 10%), pero la mortalidad intrahospitalaria fue similar entre los grupos (37,3 vs. 35,5%).
En el primero de los estudios en pacientes hospitalizados moderadamente graves o de alto riesgo, el estudio de LAWLER,17 se incluyeron pacientes hospitalizados no críticos y las variables de estudio fueron las mismas. A diferencia del estudio anterior, la anticoagulación terapéutica se asoció con un discreto incremento de la supervivencia a los 28 días (79,3 vs 75,4%) en pacientes que no requirieron soporte orgánico. Los otros 2 (estudios HEP-COVID y RAPID) también investigaron si la anticoagulación terapéutica precoz mostraba algún efecto positivo respecto a la evolución de la enfermedad. El estudio HEP-COVID18 incluyó 253 pacientes (dosis terapéuticas de HBPM vs. dosis profiláctica estándar de HBPM o HNF). El 32,8% de los pacientes estaban ingresados en la UCC. La variable primaria fue trombosis venosa, arterial o muerte de cualquier causa y la principal variable de seguridad fue sangrado mayor, dentro de los primeros 30 días. Los resultados mostraron que la variable primaria fue reducida en pacientes no UCC (36,1 vs. 16,7%; riesgo relativo (RR): 0,46; [IC 95%: 0,27-0,81]; p=0,004), pero no en pacientes UCC (55,3 vs. 51,1%; RR: 0,92 [IC 95%: 0,62-1,39]; p=0,71). Similar resultado se obtuvo en otro estudio de las mismas características (RAPID)19, confirmando una menor proporción de muerte (1,8%) en el grupo de anticoagulación terapéutica que en profiláctica (7,6%) (OR: 0,22 [IC 95%: 0,07-0,65]; p=0,006) en pacientes no críticos.
El hallazgo aparentemente paradójico de una significativa disminución de la mortalidad en pacientes no críticos al utilizar dosis terapéuticas de heparina vs profiláctica descrito en estos 3 estudios anteriores sugiere que la anticoagulación terapéutica puede ser efectiva en fases tempranas del proceso, en los que la menor incidencia de hemorragias mayores observada, respecto a pacientes críticos, podría contribuir a disminuir la mortalidad.
Otros 2 estudios prospectivos han comparado la eficacia y la seguridad de las dosis profilácticas intermedias de HBPM vs. la dosis profiláctica estándar (tabla 1). En el primer estudio (INSPIRATION20) no se encontraron diferencias en la variable primaria (una variable compuesta de trombosis venosa o arterial, tratamiento con oxigenación por membrana extracorpórea, o mortalidad en 30 días) con ligero incremento del sangrado mayor en el grupo de dosis intermedia (2,5 vs. 1,4%). En el segundo estudio, de similar diseño, pero con menor número de pacientes, tampoco halló diferencias entre ambos regímenes posológicos21. En ambos prácticamente la mitad de los pacientes incluidos se encontraban ingresados en la UCC.
Finalmente, también se ha estudiado el efecto de la administración de dosis profilácticas de enoxaparina (40mg/día) vs. no anticoagulación en pacientes COVID-19 ambulatorios (no hospitalizados) (estudio OVID22). La variable principal de estudio (una variable compuesta de hospitalización inesperada y cualquier causa de muerte a los 30 días) no se modificó por la administración de heparina respecto al control.
Tromboprofilaxis con otros anticoagulantesLa tabla 1 muestra las características principales de las 4 publicaciones que han analizado el efecto de: a) rivaroxaban en pacientes moderadamente enfermos hospitalizados, b) sulodexida en pacientes ambulatorios, c) apixaban en pacientes ambulatorios, y d) rivaroxabán en pacientes postalta hospitalaria.
El descenso en la mortalidad observado tras la administración de dosis terapéuticas de heparina en pacientes COVID-19 moderadamente enfermos no se ha observado al desarrollar la anticoagulación con otro compuesto anticoagulante. Así, al realizar la anticoagulación con rivaroxabán (estudio ACTION23, 15/20mg/día vo durante 31 días) vs. dosis profilácticas de HBPM o heparina no fraccionada (HNF) subcutánea no se observaron diferencias entre los grupos en las variables analizadas (muerte, duración hospitalización, tiempo de apoyo con oxigenoterapia o eventos trombóticos) pero sí un incremento de sangrado mayor en el grupo anticoagulado con rivaroxabán.
Otro estudio aleatorizado controlado analizó el uso de sulodexida (tabla 1) en 243 pacientes no hospitalizados con COVID-19 que tenían un alto riesgo de progresión clínica grave debido a comorbilidades crónicas24. La sulodexida, un glicosaminoglicano natural con actividades antitrombóticas y profibrinolíticas, afecta la hemostasia en menor medida que la heparina con un riesgo muy bajo de sangrado. En el estudio, 22 de 124 pacientes requirieron ingreso hospitalario a los 21 días de seguimiento en el grupo de sulodexida en comparación con 35 de 119 en el grupo de placebo (RR: 0,6 [IC 95%: 0,37-0,96]; p=0,03). El número de eventos trombóticos venosos fue bajo y similar en ambos grupos, y no se observó diferencia estadísticamente significativa en la mortalidad ni en la duración de la estancia hospitalaria.
Otro estudio (ACTIV-4B)25 (tabla 1), también realizado en pacientes COVID-19 ambulatorios, ha analizado la eficacia preventiva de la administración de apixabán (2,5 o 5mg/12h vo) sin encontrar diferencias respecto al placebo en su variable primaria compuesta de cualquier causa de mortalidad, tromboembolismo sintomático venoso o arterial, infarto de miocardio, ictus u hospitalización de causa cardiovascular o pulmonar.
Finalmente, el estudio MICHELLE26 (tabla 1) comparó la administración de rivaroxabán (10mg/día vs. placebo vo durante 35 días en pacientes dados de alta tras hospitalización (52% ingresados en la UCC). La administración de rivaroxabán disminuyó (3 vs. 9%; p=0,0293) la posibilidad de una variable compuesta de complicaciones tromboembólicas o muerte de origen cardiovascular.
En consecuencia, las evidencias actuales no parecen apoyar la utilización de otros anticoagulantes que no sean heparina salvo en pacientes post-alta, donde rivaroxabán podría tener algún papel.
Tromboprofilaxis con antiagregantesHasta el momento actual, solo se han comunicado cuatro estudios prospectivos aleatorizados que hayan analizado el efecto de la administración de antiagregantes en la tromboprofilaxis del COVID-19 (tabla 1). El efecto de ácido acetilsalicílico (AAS) ha sido valorado en pacientes ambulatorios, hospitalizados no críticos y hospitalizados críticos. En ambulatorios (ACTIV-4B25), la administración de AAS (81mg/día) vs. apixabán o placebo no modificó la variable principal del estudio compuesta de cualquier causa de mortalidad, tromboembolismo sintomático venoso o arterial, infarto de miocardio, ictus u hospitalización de causa cardiovascular o pulmonar. En pacientes hospitalizados no críticos (RECOVERY27), la administración de AAS (150mg/día vo) asociada o no a dosis profilácticas de heparina no produjo reducción de la mortalidad a los 28 días ni del riesgo de ventilación mecánica. En pacientes hospitalizados en UCC (REMAP-CAP28) se estudió el efecto de la administración de AAS (75-100mg/día vo) asociada o no a heparina a diversas dosis (profiláctica rutinaria, intermedia o terapéutica). La asociación de AAS no aportó ventajas significativas al tratamiento con heparina en ninguna de las variables estudiadas (días libres de soporte orgánico, supervivencia o número de eventos trombóticos), pero si incrementó el riesgo de sangrado mayor.
También se ha comunicado el efecto de los fármacos inhibidores P2Y12 (iP2y12) en la profilaxis antitrombótica del COVID-19 (ACTIV-4A29 y REMAP-CAP28) (tabla 1). El primer trabajo se realizó en pacientes hospitalizados no críticos y analizó el efecto de la administración de dosis estándar de clopidogrel, ticagrelor o prasugrel al asociarlo a heparina a dosis terapéuticas frente a heparina sola. La adición de iP2Y12 no modificó la variable principal (compuesta de supervivencia o días libres de soporte orgánico a los 21 días), aunque incrementó la probabilidad de sangrado mayor (2 vs. 0,7%). El segundo trabajo comparó el efecto de diversas dosis de heparina (profiláctica rutinaria, intermedia o terapéutica) solas o asociadas al tratamiento con iP2Y12 en pacientes críticos. Al igual que ocurrió con AAS, la asociación de iP2Y12 no aportó ninguna ventaja (no redujo los días libres de soporte orgánico, supervivencia o número de eventos trombóticos) y también incrementó el riesgo de sangrado mayor.
Las nulas ventajas de la asociación de antiagregantes a la administración de heparina en pacientes COVID-19 comunicadas por estos trabajos no han corroborado los resultados de estudios observacionales previos. En este sentido, 2 amplios metaanálisis30,31 (que incluyeron 34.415 y 14.000 pacientes, respectivamente) de trabajos básicamente retrospectivos, si encontraron un efecto beneficioso, consistente en reducción de la mortalidad, si se mantenía o se iniciaba la administración de AAS en el momento del ingreso. Un estudio de cohorte prospectiva tampoco encontró grandes ventajas. Así, Santoro et al.32 comunicaron en un amplio estudio que el uso de antiagregantes (acetilsalicílico y otros, en tratamiento único o terapia dual) no mostraba diferencias en términos de mortalidad hospitalaria (18 vs. 19%; p=0,64), necesidad de ventilación invasiva (8,7 vs. 8,5%; p=0,88), eventos embólicos (2,9 vs. 2,5%; p=0,34) y sangrado (2,1 vs. 2,4%; p=0,43), aunque sí tenía un efecto beneficioso sobre la reducción de la duración de la ventilación mecánica (8±5 días vs. 11±7 días; p=0.01). Además, los pacientes tratados exclusivamente con antiagregantes (sin anticoagulación simultánea) tuvieron menor mortalidad (RR: 0,39; [IC 95%: 0,48-0,32]; p<0,001), lo que podría demostrar que el efecto beneficioso del tratamiento antiagregante pudiera quedar enmascarado por el tratamiento anticoagulante.
En base a los trabajos aleatorizados publicados recientemente, se puede concluir que la asociación de fármacos antiagregantes a la profilaxis con heparina no aporta ventajas significativas.
Anticoagulacion previa y COVIDComo se ha mencionado anteriormente, esta enfermedad se asocia con un alto riesgo protrombótico que justifica el establecimiento de profilaxis antitrombótica en los pacientes más graves. Un porcentaje significativo de estos se encuentran en tratamiento con fármacos anticoagulantes por diversas indicaciones (enfermedad tromboembólica venosa, fibrilación auricular o prótesis valvular cardiaca). Debido a esto, se planteó la hipótesis de que el tratamiento anticoagulante oral previo con antivitaminas K (acenocumarol o warfarina) o anticoagulantes orales directos (ACOD) podrían tener un efecto beneficioso en el curso de la enfermedad. Para comprobar este supuesto se realizaron diversos trabajos, la mayoría cohortes retrospectivas y 2 metaanálisis.
El estudio más amplio ha sido el comunicado por Rivera-Caravaca et al.33 que seleccionó 26.006 pacientes (13.003 de ellos en tratamiento con ACOD en el momento del diagnóstico) de una cohorte de 738.423 pacientes COVID-19. Se realizó un seguimiento de 30 días y el estudio concluyó que el grupo en tratamiento con ACOD mostró un mayor riesgo relativo de mortalidad de cualquier causa (RR: 1,27 [IC 95%: 1,12-1,44]), de hospitalización o re-hospitalización en el momento del diagnóstico de la enfermedad (RR: 1,72 [IC 95%: 1,64-1,82]) y de padecer un tromboembolismo venoso (RR: 4,51 [IC 95%: 3,91-5,82]). Sin embargo, otros tres estudios34–36 sí han descrito un efecto beneficioso del tratamiento anticoagulante previo en diversas variables compuestas que incluían mortalidad en un plazo de 30-60 días y/o riesgo de hospitalización. El más extenso34 (23.159 pacientes tratados con warfarina o ACOD en el momento del diagnóstico) informó del efecto positivo de la anticoagulación previa en una variable compuesta de proporción de muerte u hospitalización dentro de 60 días (29,2% [IC 95%: 27,4–31,2%]) para pacientes anticoagulados y el 32,1% (IC 95%: 30,7-33,5) sin anticoagulación.
Los metaanálisis tampoco han resuelto las dudas existentes. Uno de ellos37, ha comunicado que el tratamiento previo con anticoagulantes orales en pacientes con COVID-19 se relaciona con una reducción de la mortalidad mientras que otro38 no ha encontrado diferencias significativas con los controles.
Se observa, por tanto, que no existe una evidencia clara sobre si el tratamiento previo con anticoagulantes orales (antivitaminas K o ACOD) tiene un efecto protector sobre la evolución de la enfermedad reduciendo la mortalidad o las complicaciones trombóticas.
Recomendaciones de guías de practica clínicaLa tabla 239-50 ofrece una visión general de las recomendaciones de varias guías de práctica clínica publicadas sobre tromboprofilaxis en COVID-19 en base a su estadio clínico (ingresado en la UCC, hospitalario no crítico, ambulatorio o postalta). La ausencia de ensayos aleatorizados de alta calidad impide que algunas de estas recomendaciones no tengan la firmeza deseada, si bien los resultados de ensayos clínicos recientes han determinado que las recomendaciones más actualizadas disientan notablemente de las hace tan solo un año. Básicamente las conclusiones de estas guías son:
- 1.
Debido a la alta trombogenicidad de la COVID-19, todas las guías coinciden en que se debe administrar tromboprofilaxis con heparina a los pacientes ingresados en el hospital con COVID-19.
- 2.
Al inicio de la epidemia, la tromboprofilaxis con heparina a dosis intermedias se recomendaba en algunas guías en pacientes ingresados en unidades de críticos o pacientes no críticos con factores de riesgo trombótico. Sin embargo, esta recomendación no ha sido avalada por dos ensayos clínicos posteriores20,21 y es desaconsejada por las guías más recientes49,50.
- 3.
Tampoco se recomienda en el momento actual la utilización de heparina a dosis terapéutica en pacientes ingresados en unidades de críticos aconsejándose su reducción a dosis profiláctica estándar, ya que una dosis terapéutica de HBPM o HNF no mejora el desenlace clínico y se asocia con un mayor riesgo de complicaciones hemorrágicas.
- 4.
Sí se recomienda utilizar una dosis terapéutica de heparina en pacientes hospitalizados no críticos si tienen bajo riesgo de sangrado, ya que se ha comunicado que esta estrategia disminuye la mortalidad17–19.
- 5.
Aunque no se recomienda iniciar tratamiento antiagregante o anticoagulante con ACOD en pacientes con COVID-19 en pacientes hospitalizados, se aconseja mantener la antiagregación si el paciente lo tenía prescrito como profilaxis secundaria.
- 6.
En los pacientes ambulatorios con COVID-19, la guía más reciente50 no recomienda la administración rutinaria de tromboprofilaxis con heparina22 o ácido acetilsalicílico por falta de eficacia25. Sin embargo, aconseja mantener el tratamiento antitrombótico (con heparina, anticoagulantes orales o antiagregantes) si el paciente lo tenía indicado previamente. Algunas guías menos recientes aconsejan la administración de heparina a dosis profiláctica en pacientes con riesgo más elevado de tromboembolismo sin factores de riesgo de sangrado.
- 7.
En los pacientes que se han recuperado de COVID-19 y son dados de alta del hospital, no se recomienda de forma rutinaria la tromboprofilaxis extrahospitalaria prolongada. Sin embargo, en aquellos con inmovilidad persistente o alta actividad inflamatoria, o ambos, la tromboprofilaxis anticoagulante podría considerarse si no existe un riesgo elevado de sangrado. Ninguna guía ha incorporado todavía en sus recomendaciones los positivos resultados obtenidos con rivaroxabán en esta población26.
Aunque existe un acuerdo sobre la necesidad de establecer tromboprofilaxis con heparina en los pacientes hospitalizados afectados de COVID-19, no existe unanimidad respecto a la posología. En pacientes ingresados en las UCC, las recomendaciones más recientes, basadas en resultados de estudios prospectivos aleatorizados, coinciden en desaconsejar dosis elevadas (terapéuticas) de heparina de bajo peso molecular y utilizar dosis estándar de tromboprofilaxis. En el paciente hospitalizado no crítico, la mayoría de las guías más antiguas recomiendan utilizar dosis estándar, pero los resultados de varios estudios aleatorizados recientes han aconsejado incrementar a dosis terapéuticas si el riesgo de sangrado es bajo. Estudios prospectivos aleatorizados no han encontrado ventajas en la utilización de dosis intermedias de heparina de bajo peso molecular, en la asociación de antiagregantes a la heparina o en la sustitución de heparina por rivaroxabán.
En pacientes post-alta, predominan las recomendaciones de no utilizar tromboprofilaxis de forma rutinaria, tan solo en aquellos pacientes considerados de alto riesgo trombótico y bajo riesgo hemorrágico. No obstante, hay ausencia de consenso, y un numeroso grupo de guías de práctica clínica no se han pronunciado sobre este particular. Ante esta falta de consenso, quizás pueda ser razonable mantener la tromboprofilaxis a dosis estándar durante 7-10 días o hasta la plena deambulación del paciente.
En pacientes infectados que se encuentren en régimen ambulatorio nuevamente existe falta de pronunciamiento de numerosos documentos de opinión. Algunos recomiendan utilizar dosis estándar de tromboprofilaxis si existen determinados factores de riesgo (dímero-D>1.500ng/ml, y/o movilidad reducida asociada con al menos un factor de riesgo: obesidad, edad >70 años, cáncer activo, historia de enfermedad tromboembólica o cirugía mayor <3 meses), especialmente si existen datos clínicos de neumonía. Sin embargo, una reciente guía de práctica clínica, que recoge los resultados más novedosos de estudios aleatorizados, desaconseja la utilización generalizada de heparina o ácido acetilsalicílico. El tratamiento antitrombótico con antiagregantes o anticoagulantes (oral o parenteral) se mantendrá solo si estaba previamente indicado.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNinguno de los autores presenta conflicto de intereses.