Evaluación comparativa de los índices proporcionados por BIS® y AEP Monitor® durante el mantenimiento de la anestesia en pacientes pediátricos. Objetivos secundarios comparar el consumo anestésico y el tiempo de despertar.
Material y métodoPacientes con edades entre 6 meses y 12 años sometidos a anestesia inhalatoria con sevoflurano, bloqueo nervioso peneano o caudal y monitorización con BIS®, y AEP Monitor®. Se aleatorizaron en tres grupos según el monitor utilizado para dosificar sevoflurano: grupo BIS, grupo AAI y control. Se recogieron automáticamente BIS y AAI, fracción espirada de sevoflurano, parámetros hemodinámicos y tiempo de despertar.
ResultadosSe incluyeron 35 pacientes. Se encontraron diferencias significativas entre los índices recogidos dependiendo del monitor utilizado. El AAI fue más bajo en el grupo controlado por BIS respecto al controlado por AEP Monitor/2 (media [SD], 19 [2] vs 22 [4]; p=0,04). Hubo una buena concordancia entre BIS y AAI salvo en los valores extremos, sobre todo, los inferiores (ecuación de Bland-Altman). El consumo de sevoflurano y el tiempo de despertar no fueron diferentes entre grupos. Se estableció correlación positiva entre los dos índices (coeficiente de correlación de Pearson 0,207; p<0,001).
ConclusionesLa guía de la anestesia con BIS, respecto al AEP Monitor proporcionó un índice más estable y profundizó más la hipnosis. Ambos índices presentaron una buena correlación durante el mantenimiento. Ninguno de los monitores presentó ventajas respecto a una práctica clínica estándar en la incidencia de movimiento, gasto anestésico o tiempo de despertar.
To compare the indices computed by a bispectral (BIS) monitor and an auditory evoked potential (AEP) monitor during maintenance of anesthesia in pediatric patients. A secondary objective was to compare anesthetic consumption and recovery times.
Material and methodsPatients aged 6 months to 12 years under inhaled anesthesia with sevoflurane were administered a penile or caudal nerve block. BIS and AEP monitoring was then started. The patients were randomized to 3 groups in which the sevoflurane dosage was guided by the BIS index, the A-line ARX index (AAI), or standard procedures (control group). The BIS index, the AAI, the fraction of expired sevoflurane, hemodynamic parameters, and recovery time were the variables recorded for all patients.
ResultsThirty-five patients were enrolled. Significant differences between the 2 monitor groups were observed. The mean (SD) AAI was lower in patients whose dosage was controlled by the BIS index (19 [2]) than in those whose dosage was based on the AEP monitor's reading (22 [4]) (P=.04). According to a Bland and Altman plot, there was good agreement between the BIS index and the AAI except for the highest and, in particular, the lowest values. The volumes of sevoflurane used and the recovery times were similar between groups. There was a positive correlation between the 2 indices (Pearson correlation coefficient, 0.207; P<.001).
ConclusionsBIS monitoring provided a more stable index than did AEP monitoring and BIS-index guidance achieved a deeper level of hypnosis. There was good correlation between the 2 indices during maintenance of anesthesia. Neither monitor offered advantages over standard procedures with regard to movement, volume of anesthetic consumed, or recovery time.
La verificación de la profundidad hipnótica ha constituido desde siempre uno de los retos de la práctica anestésica. Clásicamente se han usado parámetros clínicos relacionados con la actividad adrenérgica como indicadores de anestesia superficial. La aparición de monitores de hipnosis de aplicación sencilla, con respuesta rápida a las variaciones en el estado de vigilia y pérdida de consciencia ha abierto un amplio campo, hasta hace algunos años desconocido. La introducción en clínica de estos monitores, inicialmente tenía el objetivo de evitar el recuerdo intraoperatorio. Además, la estratificación de la profundidad anestésica permitiría cuantificar la dosificación del hipnótico y determinaría la sobredosificación, que es aquella situación en que el paciente recibe más dosis de fármaco de la estrictamente necesaria para el sueño. La sobredosificación de un hipnótico conlleva el aumento de sus efectos indeseables, del tiempo de despertar y del gasto anestésico.
El índice biespectral (BIS) es un parámetro multifactorial derivado del electroencefalograma. El BIS es un parámetro sin dimensión cuyo valor puede oscilar entre 0 y 100 que se correlaciona con el nivel de sedación e hipnosis. El algoritmo para su obtención ha sido empíricamente derivado de los datos recolectados de adultos. Diversos trabajos han demostrado una buena correlación entre BIS y concentración de sevoflurano en equilibrio en niños1,2, equiparable a la demostrada en adultos.
El AEP Monitor/2, tras una estimulación auditiva, es capaz de procesar y extraer de una forma rápida y fiable los potenciales de latencia media del EEG cortical derivado en la ventana de tiempo que va de los 20 a los 80 mseg tras la estimulación. Esto también proporciona un número entre 0 y 100 (AAI). Weber et al. en un estudio correlacionan bien el AAI con los diferentes momentos de la inducción inhalatoria con sevoflurano en niños y los equipara a los proporcionados por los adultos3.
El objetivo principal de nuestro estudio es la evaluación comparativa en pacientes pediátricos de los índices proporcionados por los monitores de hipnosis BIS y AEP Monitor/2 durante el mantenimiento de la anestesia y la correlación de estos índices con la clínica. Como objetivos secundarios se compara el consumo anestésico y el tiempo de despertar utilizando cada uno de estos índices frente a la práctica habitual (basada en datos clínicos de anestesia).
Material y métodosTras la obtención de la aprobación del Comité Ético de nuestra institución se recabó el consentimiento informado de los progenitores de pacientes consecutivos con edades comprendidas entre los 6 meses y 12 años que estaban programados para cirugía urológica menor (fimosis, hipospadias, criptorquidia, excisión de varicocele y orquidopexia) o herniorrafia inguinal o umbilical. Los pacientes fueron excluidos del estudio si existía contraindicación para la anestesia regional, la cirugía no se podía llevar a cabo con mascarilla laríngea, necesitaban relajación neuromuscular o bien presentaban déficit auditivo conocido. Por otro lado, los criterios de salida del estudio eran el fallo del bloqueo regional elegido y la necesidad de medicación endovenosa de rescate para mantenimiento de la anestesia (hipnóticos, relajantes o analgésicos), la imposibilidad de mantener una ventilación eficaz a través de la mascarilla laríngea o bien la imposibilidad de mantener la hipnosis de forma efectiva entre niveles de BIS o AAI especificados en el protocolo.
Los niños incluidos en el estudio no recibían ningún tipo de premedicación para que no interfiriese en la posterior dosificación de la hipnosis durante la cirugía.
De acuerdo con los protocolos de nuestro hospital se aplicaba a todos los niños crema anestésica (EMLA®, Astra Zeneca) en el dorso de ambas manos 45 minutos antes de la inducción anestésica.
A su llegada a quirófano los niños eran monitorizados con pulsioximetría, ECG en dos derivaciones (DII y V5) y tensión arterial no invasiva. A continuación se procedía a la inducción inhalatoria a través de mascarilla facial con sevoflurano a concentración de 8% y mezcla del oxígeno y N2O al 50%. La concentración inspirada y espirada de gases anestésicos, oxígeno y CO2 también era monitorizada durante todo el proceso.
En el momento en que el paciente perdía clínicamente la consciencia, se verificaba cada 30 segundos la desaparición del reflejo corneal, y en el momento en que éste se abolía se procedía a la instauración de un acceso venoso en el dorso de la mano, donde previamente se había colocado la crema anestésica. Tras ello, y en el momento en que clínicamente se evidenciaba relajación de la mandíbula, se procedía a colocación de mascarilla laríngea (ML).
Una vez verificada la correcta ventilación se realizaba bloqueo caudal en el caso de cirugía de hernia o testicular y bloqueo dorsal del pene en el caso de cirugía peneana. El bloqueo caudal se realizaba con bupivacaína 0,25% a 1ml kg−1, mientras que en el bloqueo del nervio dorsal del pene se administró una mezcla de bupivacaína 0,25% y mepivacaína 1% entre 3 y 6ml.
En este momento se instauraba la monitorización de la hipnosis con la colocación de los electrodos pediátricos del BIS® (versión XP, Aspect Medical Systems Inc., Norwood, UK) y del AEP Monitor/2TM Scientific Version (Danmeter A/S, Odense, Denmark).
La colocación de los electrodos era siempre la misma: primero la tira de BIS y en situación craneal a ésta los electrodos del AEP Monitor, con el electrodo negativo (negro) sobre la región malar contralateral al electrodo temporal del BIS. De acuerdo con las recomendaciones de Danmeter para niños menores de 10 años (www.Danmeter.dk), el electrodo negativo no se situó en la zona mastoidea (tal y como se hubiera hecho en el caso de adultos). Cuando se obtenía una buena señal sin artefactos de ambos monitores, se procedía entonces a la aleatorización del paciente en uno de los tres grupos posibles. La aleatorización se llevaba a cabo por asignación a través de programa informático de un número asociado a un sobre sellado en que se indicaba el grupo. En el grupo AAI la dosis de anestésico inhalatorio se ajustaba para obtener un índice derivado (AAITM) entre 20 y 25; en el grupo BIS el inhalatorio se dosificaba mediante un índice bispectral entre 50 y 60, y en el grupo control, en el que el anestesiólogo era ciego para los dos monitores de hipnosis, la guía de la dosis de sevoflurano se basaba en la práctica clínica estándar (manteniendo tensión arterial sistólica basal ± 20% y frecuencia cardiaca basal ± 20%, y vigilando la aparición de signos clínicos de superficialidad como lagrimeo, movimientos, esfuerzo ventilatorios, etc.). En el grupo AAI el anestesiólogo era ciego para el BIS y viceversa, en el grupo control el anestesiólogo era ciego para ambos monitores.
La elección de los intervalos de referencia para el mantenimiento de la anestesia se realizó en base a las recomendaciones de los fabricantes.
En el caso de AEP Monitor se recomiendan índices entre 15 y 25 (www.danmeter.dk/products/neuromonitoring/aepmonitor2/index.html) y en el del BIS entre 40 y 604. En nuestro trabajo planteamos acotar los intervalos en el rango alto de las recomendaciones, manteniendo la proporción, dado que los pacientes no recibirían relajante muscular y esto esperábamos que pudiera artefactar al alza los índices en algún momento.
La recogida de datos de los monitores de hipnosis se empezó cuando los índices estaban dentro del rango deseado, y en el grupo control cuando la frecuencia cardiaca y la tensión arterial estaban un 20% en torno a la basal. El índice AAI se recogía cada segundo en la memoria Flash del monitor AAI y cada cinco segundos en un ordenador (utilizando el programa Hyperterminal de Windows, Microsoft) en el caso del BIS. También se recogieron de forma automática en un ordenador los parámetros hemodinámicos (frecuencia cardiaca y tensión arterial) y respiratorios [fracción espirada de CO2 (Et CO2), fracción espirada de sevoflurano (% vol. Et sevoflurano)] (Solar 8000, Marquette, GE Healthcare, Helsinki, Finland), en este caso cada cinco minutos. El flujo de gas fresco se ajustó a 200-250ml Kg−1 (O2/N2O al 50%) y el volumen minuto también se estandarizó para obtener un EtCO2 entre 29 y 35 mmHg.
En el momento en que la cirugía finalizó se cerraron los gases anestésicos y se abrió el flujo de oxígeno hasta 15 litros por minuto para lavado rápido del circuito. El paciente no recibió ningún tipo de estimulación durante este periodo más allá que la propia de la mascarilla laríngea y la ventilación mecánica.
La mascarilla laríngea se retiró en el momento en que el niño hizo muestras de intolerancia (movimientos bruscos espontáneos de la cabeza o los brazos hacia la boca). Se esperó entonces a que iniciara llanto espontáneo o apertura ocular, para la retirada de los monitores y finalización del caso.
El tiempo de despertar se definió como el tiempo que pasó desde el cierre de los gases hasta la retirada de la mascarilla laríngea. El consumo medio de sevoflurano se calculó como la media de sevoflurano espirado por minuto medido desde el inicio de la cirugía hasta que se retiró la mascarilla. Durante el estudio se registró cualquier episodio de movimiento sugestivo de despertar intraoperatorio. El análisis estadístico entre grupos se centró en la comparación de las características demográficas de los pacientes, la duración de la anestesia y tiempo de despertar, las concentraciones espiradas de sevoflurano, el consumo total anestésico y la comparación de los índices proporcionados por ambos monitores. Los tests estadísticos empleados para comparar los grupos fueron test de ANOVA, test Chi-Square o de Fisher exacto, correlación lineal de Pearson y concordancia de Bland-Altman. Se aceptó como significativa una diferencia con una p < 0,05.
ResultadosSe incluyeron en el estudio 35 pacientes, tuvieron que excluirse 3 pacientes por fallo del bloqueo regional (2 en el grupo control y 1 en el grupo BIS). Otro paciente se excluyó por no ceñirse a los márgenes de BIS establecidos en el protocolo, puesto que se profundizó demasiado en la anestesia y el anestesista responsable no aplicó los límites protocolizados (grupo BIS). De los 31 casos que finalizaron el estudio; 9 fueron casos control, 12 pertenecían al grupo AAI y 10 al grupo BIS. Los niños fueron catalogados como ASA I el 93,5% y ASA II el resto. Se realizó un bloqueo dorsal del pene en 18 pacientes (6 control, 6 AAI, 6 BIS) y bloqueo caudal en 13 (3 control, 6 AAI y 4 BIS). No hallamos diferencias significativas en los parámetros demográficos (Tabla 1), así como en los tiempos de duración de la anestesia y la cirugía. Nueve pacientes experimentaron movimiento en algún momento del estudio que requirió un aumento de la concentración de sevoflurano (2 grupo control, 5 AAI, 2 BIS) aunque no existieron diferencias significativas entre los grupos respecto al movimiento (p> 0,05).
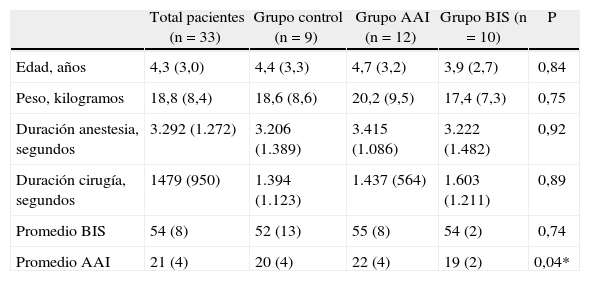
Datos demográficos y de la cirugía
| Total pacientes (n=33) | Grupo control (n=9) | Grupo AAI (n=12) | Grupo BIS (n=10) | P | |
| Edad, años | 4,3 (3,0) | 4,4 (3,3) | 4,7 (3,2) | 3,9 (2,7) | 0,84 |
| Peso, kilogramos | 18,8 (8,4) | 18,6 (8,6) | 20,2 (9,5) | 17,4 (7,3) | 0,75 |
| Duración anestesia, segundos | 3.292 (1.272) | 3.206 (1.389) | 3.415 (1.086) | 3.222 (1.482) | 0,92 |
| Duración cirugía, segundos | 1479 (950) | 1.394 (1.123) | 1.437 (564) | 1.603 (1.211) | 0,89 |
| Promedio BIS | 54 (8) | 52 (13) | 55 (8) | 54 (2) | 0,74 |
| Promedio AAI | 21 (4) | 20 (4) | 22 (4) | 19 (2) | 0,04* |
No existen diferencias estadísticamente significativas entre los grupos en cuanto a edad peso, duración de anestesia o cirugía. No hay diferencias entre los grupos en los promed ios de BIS. *Hay diferencias estadísticas en el promedio de AAI entre los grupos BIS y AAI (p<0,05). Valores expresados en media (desviación estándar).
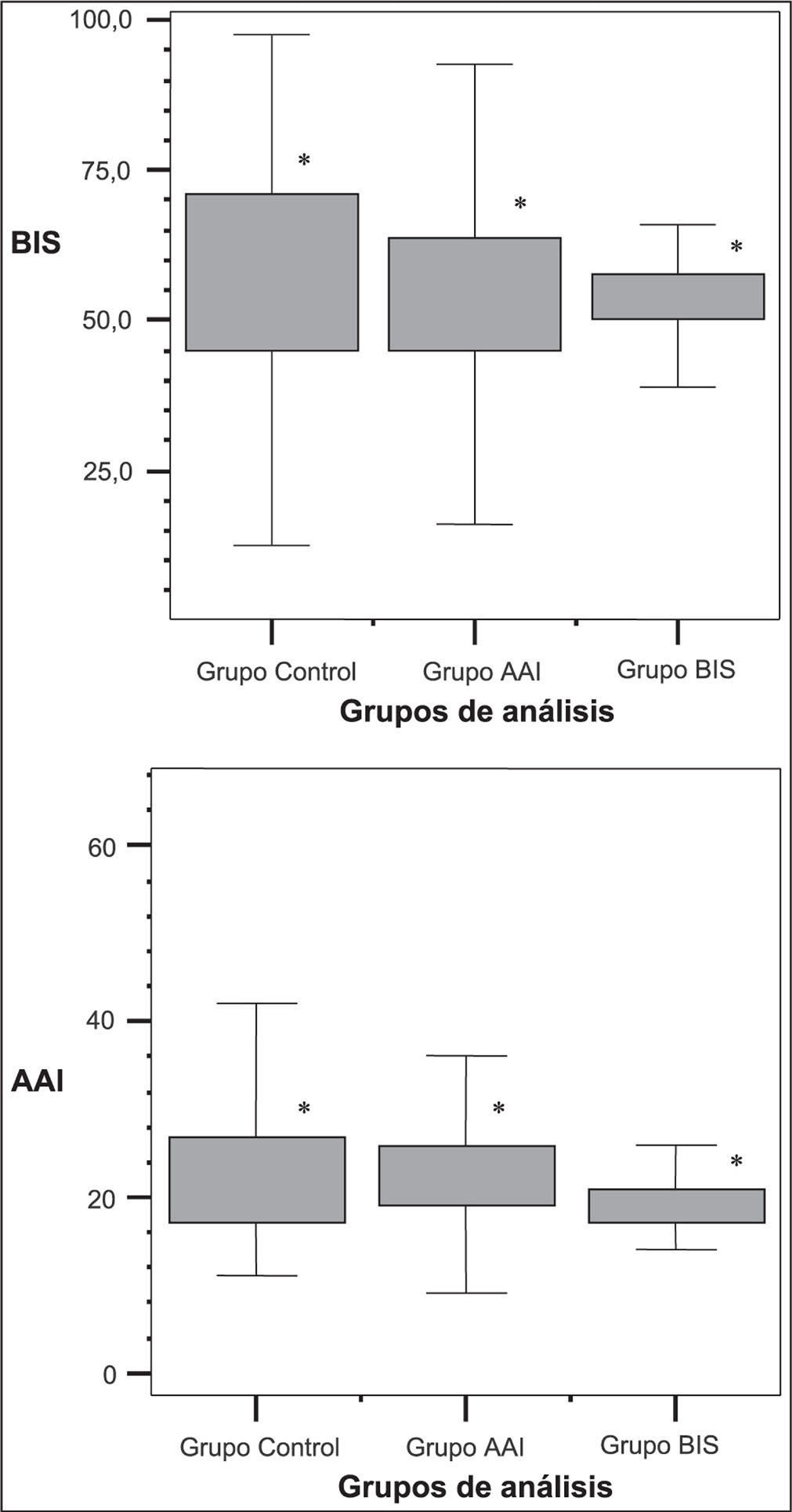
En la Figura 1 se reflejan los diagramas de caja (mediana y su IC del 95%) de los valores de los índices (BIS y AAI) recogidos en los diferentes grupos de estudio durante el mantenimiento. Existieron diferencias estadísticamente significativas (p<0,001) entre los índices recogidos dependiendo del método utilizado para guiar la anestesia. Esto también se refleja en la Tabla 1 con la media de los índices durante el mantenimiento, aunque en este caso sólo es significativa la diferencia en el AAI: es más bajo en el grupo que se controla por BIS respecto al que se controla por el monitor AEP Monitor/2.
Diagramas de caja con la mediana y su intervalo de confianza del 95% de los diferentes monitores y sus índices (BIS y AAI) de acuerdo con los grupos de análisis durante el mantenimiento de la anestesia. Existen diferencias estadísticamente significativas entre los índices registrados de BIS y AAI en función del grupo (en los tres grupos) y su distribución intercuartil. *P<0.001 (Chi-cuadrado).
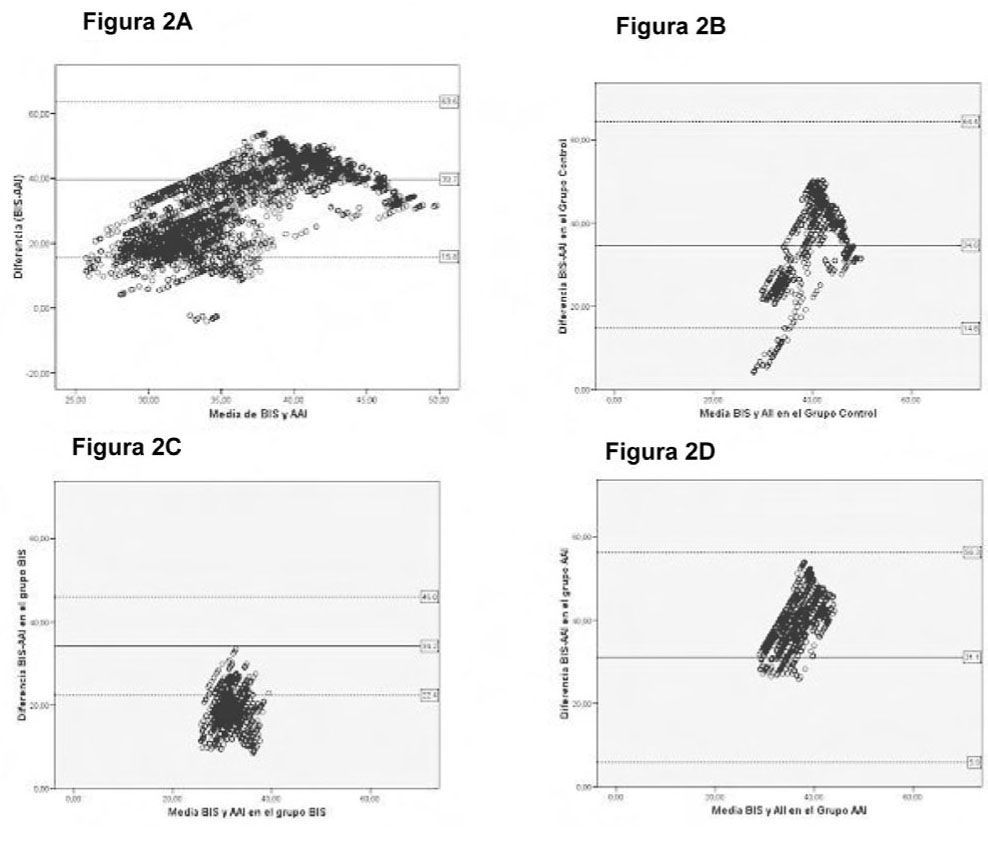
La diferencia media entre los dos grupos de medición (BIS y AAI) o error sistemático fue significativo entre grupos. El menor error sistemático (ES) se produjo con el grupo AAI. Se usó el método de Bland y Altman para determinar los valores de ES y IC del 95% de la diferencia. El ES entre BIS y AAI fue de 39,7±11,4 con una concordancia peor en los valores bajos (Figura 2A). El ES de los grupos fue de 34,6±14,9 para el grupo control (Figura 2B), 34,2±5,9 para el grupo BIS (Figura 2C) y 31,1±14,6 en el grupo AAI (Figura 2D). La anestesia en el grupo que usó el AEP/Monitor proporcionó un menor error sistemático y una curva con buena concordancia entre los monitores (Figura 2D).
La Figura 2A expresa la ecuación de Bland-Altman entre BIS y AAI con el error sistemático en línea continua y su índice de confianza del 95% en discontinua. La Figura 2B representa la Ecuación de Bland-Altman entre las dos mediciones para el grupo control. La Figura 2C representa la Ecuación de Bland-Altman entre las dos mediciones para el grupo BIS. La Figura 2D representa la Ecuación de Bland-Altman entre las dos mediciones para el grupo AAI.
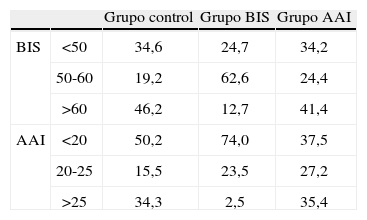
En la Tabla 2 se muestra el porcentaje de los índices recogidos que se ajustan al rango definido para el mantenimiento (BIS entre 50 y 60; AAI entre 20 y 25) en cada uno de los grupos. Como es de esperar en el grupo AAI la mayoría de los pacientes se encuentran por debajo de 25 para este monitor y en el grupo BIS, a su vez, por debajo de 60.
Proporciones (%) de BIS y AAI por debajo, dentro y por encima del segmento de referencia asumido en la metodología para el mantenimiento de la anestesia
| Grupo control | Grupo BIS | Grupo AAI | ||
| BIS | <50 | 34,6 | 24,7 | 34,2 |
| 50-60 | 19,2 | 62,6 | 24,4 | |
| >60 | 46,2 | 12,7 | 41,4 | |
| AAI | <20 | 50,2 | 74,0 | 37,5 |
| 20-25 | 15,5 | 23,5 | 27,2 | |
| >25 | 34,3 | 2,5 | 35,4 |
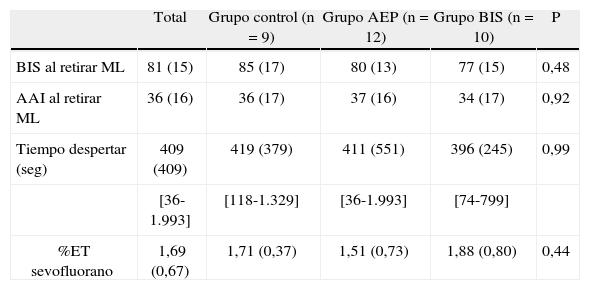
En la Tabla 3 se recogen los parámetros referentes al despertar de los pacientes. No hay diferencias entre los grupos en cuanto al BIS y AAI en el momento en que intoleran la mascarilla laríngea. Tampoco se evidencia diferencia en el tiempo que pasa desde que se acaba la cirugía y se cierran los gases anestésicos y el momento en que el niño intolera la mascarilla laríngea. Las medias de los tiempos de despertar difieren entre los grupos un máximo de 23 segundos con una gran variabilidad. Tampoco hay diferencias estadísticamente significativas en cuanto al consumo de sevoflurano en cada uno de los grupos de estudio (Tabla 3), aunque sí hay una ligera tendencia a consumir menos anestésico el grupo guiado por el AEP Monitor frente al BIS y control (%ETsevoflurano medio 1,55 vs 1,88 y 1,71, respectivamente).
Datos al despertar
| Total | Grupo control (n=9) | Grupo AEP (n=12) | Grupo BIS (n=10) | P | |
| BIS al retirar ML | 81 (15) | 85 (17) | 80 (13) | 77 (15) | 0,48 |
| AAI al retirar ML | 36 (16) | 36 (17) | 37 (16) | 34 (17) | 0,92 |
| Tiempo despertar (seg) | 409 (409) | 419 (379) | 411 (551) | 396 (245) | 0,99 |
| [36-1.993] | [118-1.329] | [36-1.993] | [74-799] | ||
| %ET sevofluorano | 1,69 (0,67) | 1,71 (0,37) | 1,51 (0,73) | 1,88 (0,80) | 0,44 |
No existen diferencias s gnificativas entre los diferentes grupos con respecto a los índices que nos ofrecen los monitores en el momento del despertar. Tampoco hay diferencias estadísticas en el tiempo de despertar ni en el consumo medio de sevoflurano. ML: mascarilla laríngea. Seg: segundos. %ET: Fracción espirada Valores expresados en media (d esviación estándar) [rango].
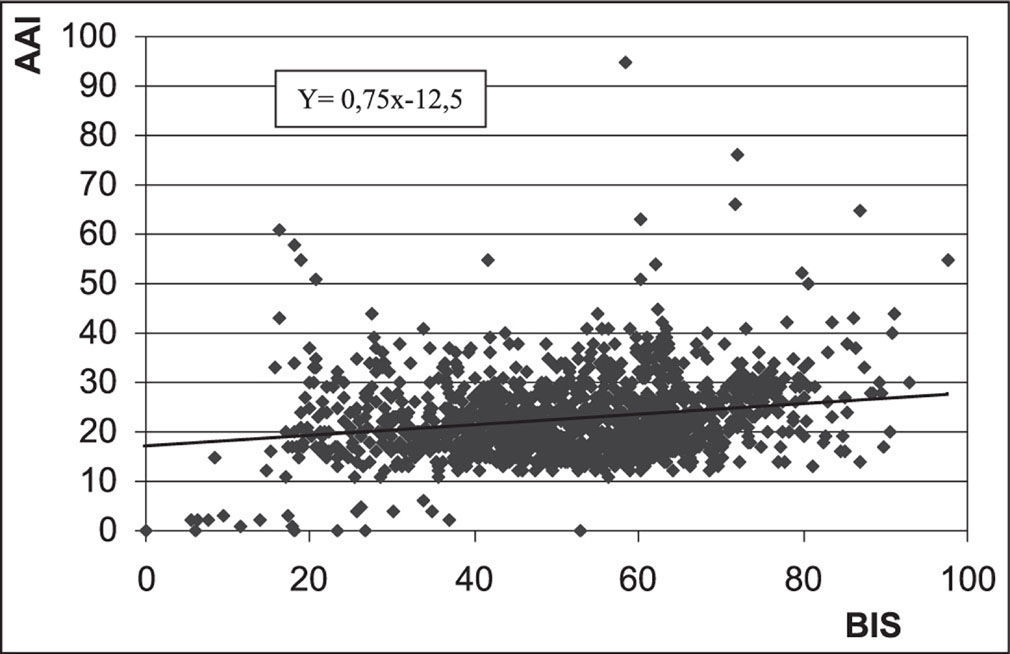
Existe una correlación positiva entre los índices proporcionados por BIS y AAI en los diferentes momentos de la anestesia, aunque ésta es débil (coeficiente de correlación de Pearson 0,207; p<0,001) (Figura 3).
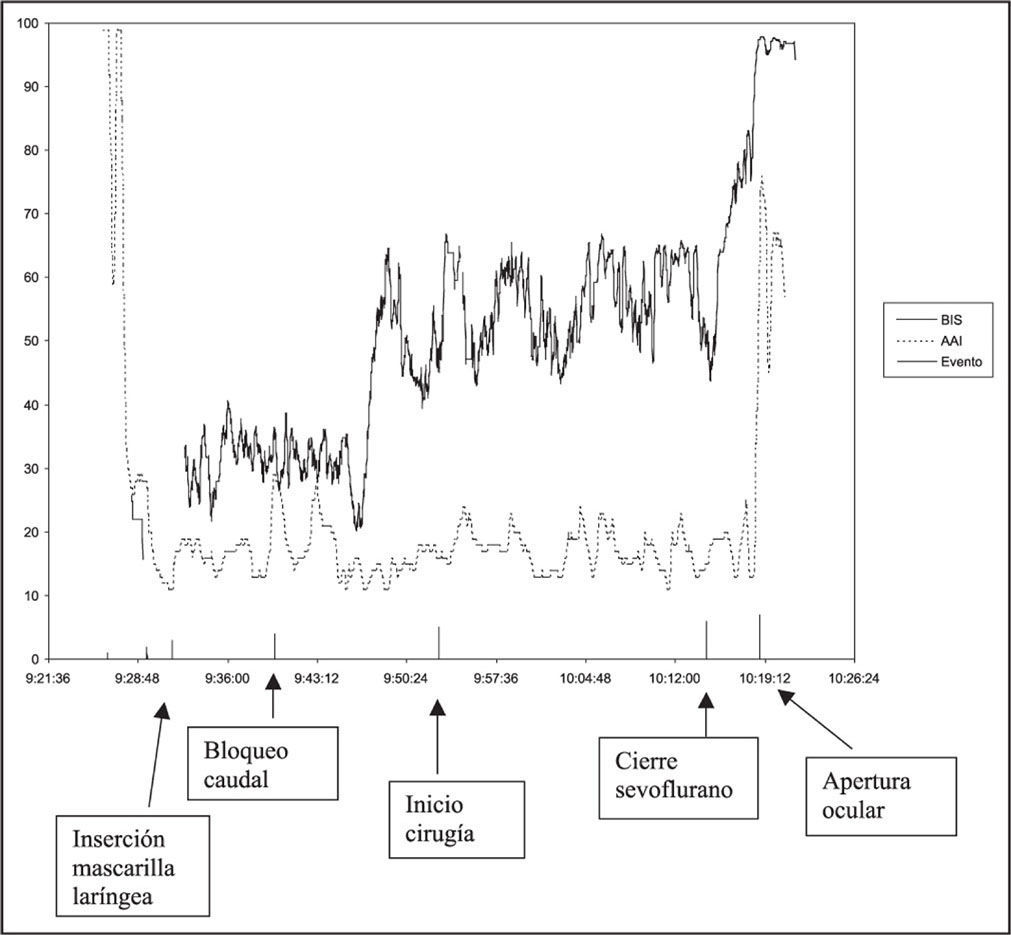
Por último, en la Figura 4 se presenta un ejemplo de evolución de los índices durante una anestesia de un paciente del grupo control.
Ejemplo de un paciente del grupo control con la evolución de los niveles de BIS y AAI durante una anestesia. Tras el evento “cierre de sevoflurano se produce una evolución diferente de los índices: mientras que el BIS aumenta progresivamente hasta el evento “apertura ocular”, el AAI se mantiene en niveles bajos (de hipnosis profunda) hasta prácticamente el momento exacto del evento que se asume como despertar.
A través de este estudio prospectivo, controlado y a ciego simple podemos concluir que comparativamente existe una correlación positiva entre los dos monitores (Figura 3). Además se pueden ver ciertas diferencias entre ellos.
En primer lugar el BIS es más estable que el AEP/Monitor, y esto se refleja en la Tabla 2, en que podemos ver que el porcentaje de veces que el paciente es mantenido dentro de un BIS 50-60 en el grupo guiado por este monitor es muy superior al porcentaje en que AAI está entre 20-25 en el grupo que utiliza este índice como guía (62,6% vs 27,2%). Lo mismo se observa de forma más intuitiva mirando los diagramas de caja de la Figura 1. Podría ser que esta variabilidad también se reflejase indirectamente en el despertar. De esta manera, como se ve en la Tabla 3, el rango de despertar en el grupo AAI y control es mucho más amplio que en el grupo BIS. Si bien es cierto que el rango en que se mantiene a los pacientes con BIS es el doble de amplio que el que se busca en el AEP/Monitor, y que ésto a priori facilitaría su mantenimiento dentro de los límites, también esto responde a las recomendaciones del fabricante. Independientemente, también se ve que los pacientes guiados con BIS no sólo se mantienen más fácilmente dentro del rango deseado, sino que también tienen una menor variación en el AAI, incluso respecto a los pacientes guiados con AEP/ Monitor.
En segundo lugar, la guía de la anestesia con BIS tiende a profundizar más la anestesia que el AEP Monitor, y esto se visualiza en la Tabla 2 en que los pacientes guiados por BIS presentan un 74% de los índices de AAI por debajo de 20, mientras que si miramos a la inversa, en el grupo guiado por AAI, el 41,4% de los pacientes presentan BIS por encima de 60. También en la Tabla 1 se ve que la media de AAI es significativamente más baja en el grupo guiado por BIS que el guiado por AEP Monitor. Como consecuencia de esto se refleja en una ligera tendencia a consumir más sevo flurano en el grupo guiado por BIS aunque sin significación estadística para la muestra de nuestro estudio. Se puede especular diciendo que los rangos elegidos de los dos monitores no son equivalentes, pero éstos son escogidos de acuerdo a las recomendaciones que hace el fabricante. En el caso del AEP/Monitor es cierto que muchos autores han utilizado valores de mantenimiento de la anestesia con límite máximo en 20, pero otros han sobrepasado este límite, estableciéndolo en 255 o incluso 356. En el trabajo de White et al. se comparaba AEP/monitor y BIS de forma similar a como lo hacemos nosotros sin obtener diferencias significativas entre ambos monitores respecto al tiempo de despertar o al consumo anestésico, aunque sí entre ellos y la práctica clínica estándar5.
El método de Bland y Altman ofreció una buena concordancia entre BIS y AAI salvo en los valores extremos, sobre todo, los inferiores. Esta peor concordancia no es tan evidente cuando se realiza la ecuación en los grupos aislados, ya que en el grupo guiado por AEP/Monitor los valores extremos se presentan dentro de los intervalos. El motivo de esta diferencia podría explicarse por una tendencia a una menor profundidad anestésica, por lo tanto con menos valores extremos inferiores.
Finalmente, el patrón evolutivo de los dos monitores para el despertar es digno de mención, y se ve claramente en la Figura 4. Mientras que desde que se cierra del gas anestésico el BIS experimenta un aumento progresivo inversamente proporcional al sevoflurano espirado, el AEP Monitor mantiene los niveles estables justo hasta el momento en que hay despertar clínico, en el que experimenta un ascenso brusco. Conceptualmente podríamos especular diciendo que para el BIS el estado de consciencia varía de forma continua desde la anestesia más profunda a la vigilia, mientras que el AEP/Monitor detecta más específicamente el despertar al experimentar el aumento brusco de los índices (algunos autores hablan de comportamiento on-off7). Se especula diciendo que en la sustancia reticular del cerebro podría haber un centro del nivel de alerta que se activaría (“on”) durante la consciencia y se inactivaría (“off”) en la inconsciencia. Si el BIS refleja el EEG global, entonces incrementaría gradualmente al final de la anestesia a medida que la concentración de anestésicos desciende en el cerebro. Sin embargo, el AAI permanecería bajo hasta que la concentración de anestésicos ha menguado lo suficiente para producir el activado del centro de nivel de alerta de la sustancia reticular (“on”): el AEP/Monitor sería superior al BIS para detectar la transición de inconsciencia a consciencia, con menos solapamiento de los valores de AAI en ambos estados. Desde el punto de vista clínico, sin embargo, es posible que esta característica haga más atractivo al BIS, puesto que en cierta manera permitiría prever y actuar de forma preventiva ante el despertar no deseado.
Como resultados secundarios, en nuestro estudio, se evidencia que no hay diferencias, ni en el consumo anestésico [m(DE); 1,71 %ET (0,37), 1,51 %ET (0,77), 1,88 %ET (0,80); respectivamente en grupo control, AAI y BIS; p=0,44], ni en el tiempo de despertar [m(DE); 419 seg (379), 411 seg (551), 396 seg (245); respectivamente en grupo control, AAI y BIS; p=0,99], entre los pacientes pediátricos en que la anestesia inhalatoria se guía por monitores de hipnosis o bien aquellos que se guían por la práctica convencional basada en parámetros clínicos. Además, no hay diferencias entre usar para ello el monitor de BIS o el AEP Monitor que utilizan algoritmos diferentes para la extracción del valor indicador de la señal del EEG. Este resultado es contrario al obtenido por otros autores que han demostrado que la utilización del BIS y los potenciales auditivos evocados de latencia media son útiles para disminuir el tiempo de despertar de la anestesia8–10, el gasto anestésico6,11,12 e incluso el tiempo de alta de la unidad de recuperación postanestésica5,13 en adultos y niños. Nuestro estudio no está diseñado para buscar diferencias en estos campos, con lo que la muestra posiblemente se quede excesivamente pequeña. Sin embargo, en un trabajo de Bannister et al.14, en el que se evidencia una reducción de los consumos anestésicos y tiempos de despertar en el grupo guiado por BIS respecto al guiado por práctica estándar en anestesias generales no combinadas, no se encuentra esta ventaja en el segmento de niños en que se realiza anestesia combinada caudal/general, de forma similar a nuestro estudio. Pensamos que la anestesia regional condiciona una reducción más efectiva de las aferencias dolorosas y por tanto podría determinar unas menores necesidades de hipnótico.
En nuestro trabajo hemos de aceptar varias limitaciones: a) No se han utilizado escalas de sedación (UMSS; Ramsay, etc,) para correlacionar estados clínicos con niveles de BIS o AAI. Esto es así porque estas escalas tienen muy poca aplicabilidad durante una anestesia general en que los pasos de dormido a despierto suelen ser bruscos y la verificación de la respuesta a órdenes verbales (como “gold standard” para sedación o sueño) no es fiable en este segmento de población. Sin ir más lejos, es muy difícil definir la pérdida de consciencia en niños. Además debemos tener en cuenta que en ellos, en ocasiones, los estadios de transición entre sueño y vigilia se pueden acompañar de agitación psicomotriz, y la estimulación en estos periodos puede desencadenar efectos adversos de tipo respiratorio derivados de una alta sensibilidad refleja (laringoespasmo o broncoespasmo). b) El estudio se inicia una vez se ha establecido la anestesia y nos encontramos en fase de mantenimiento. Esto es por una razón práctica, dada la baja tolerancia de los niños a las manipulaciones necesarias para la instauración de los sensores. Por otro lado, se ha visto que la fiabilidad del BIS durante la inducción inhalatoria en niños es muy baja y no refleja el estado de hipnosis correlacionándose con un patrón característico electroencefalográfico que artefacta las lecturas del monitor15. c) Es poco fiable la memoria del niño para valorar la presencia de despertar intraoperatorio, de manera que la única forma objetiva de evaluar este aspecto es la presencia de movimiento durante la anestesia. Es evidente que la presencia de movimiento no implica despertar, pero dadas las características de la técnica anestésica utilizada (bloqueo nervioso con anestésico local absolutamente efectivo y ausencia de relajantes musculares y opiáceos) es de esperar que no se produciría un despertar intraoperatorio sin movimiento del paciente. Nos encontramos ante un método de valoración del despertar intraoperatorio altamente sensible pero poco específico. En este sentido cabría decir que ambos monitores, y la propia práctica clínica habitual, serían satisfactorios para este objetivo, aunque posiblemente, dada la incidencia baja del despertar intraoperatorio, la muestra sería demasiado escasa para valorarlo. d) Todas las anestesias fueron llevadas a cabo por 2 investigadores. Siendo estrictos se puede decir que puede existir sesgo de aprendizaje, puesto que algunos casos de control, se realizaron con la experiencia previa de haber realizado anestesias guiadas con monitores de hipnosis. e) El tamaño de la muestra no es suficiente para valorar diferencias entre los grupos con respecto al tiempo de despertar y consumo anestésico, puesto que estos eran objetivos secundarios. Sobre los datos obtenidos en nuestro estudio, si se mantuviera la tendencia, deberíamos aumentar el tamaño de la muestra a 100 individuos para obtener diferencias significativas en el consumo de sevoflurano, sin ser estos suficientes para encontrar diferencias en el tiempo de despertar.
Como conclusión, en pacientes pediátricos sometidos a anestesia combinada inhalatoria con sevoflurano y bloqueo nervioso periférico o central, la guía de la anestesia con BIS presenta una mayor estabilidad a expensas de una mayor profundidad hipnótica con respecto al AEP/Monitor. Ambos índices tienen una buena correlación durante el mantenimiento, aunque la concordancia es peor para valores extremos. Ninguno de los monitores presenta ventajas respecto a una práctica clínica estándar con respecto a la incidencia de movimiento intraoperatorio, gasto de anestésico o tiempo de recuperación de la consciencia.