La alta transmisibilidad de la infección por SARS CoV2 ha obligado a los sistemas de salud mundiales a arbitrar medidas para evitar su expansión. En España, el consenso alcanzado entre diferentes sociedades científicas recomienda la realización de la prueba de reacción en cadena de la polimerasa (PCR) como cribado preoperatorio de portadores asintomáticos. Nos propusimos evaluar el rendimiento de la PCR preoperatoria para detectar portadores asintomáticos.
Material y métodosEstudio observacional realizado en un hospital de tercer nivel. Comparamos los resultados de la prueba de PCR en tiempo real (RT-PCR) realizada en una cohorte de pacientes quirúrgicos de nuestra área asistencial con los resultados que hubiéramos esperado asumiendo los datos epidemiológicos publicados por las oficinas gubernamentales.
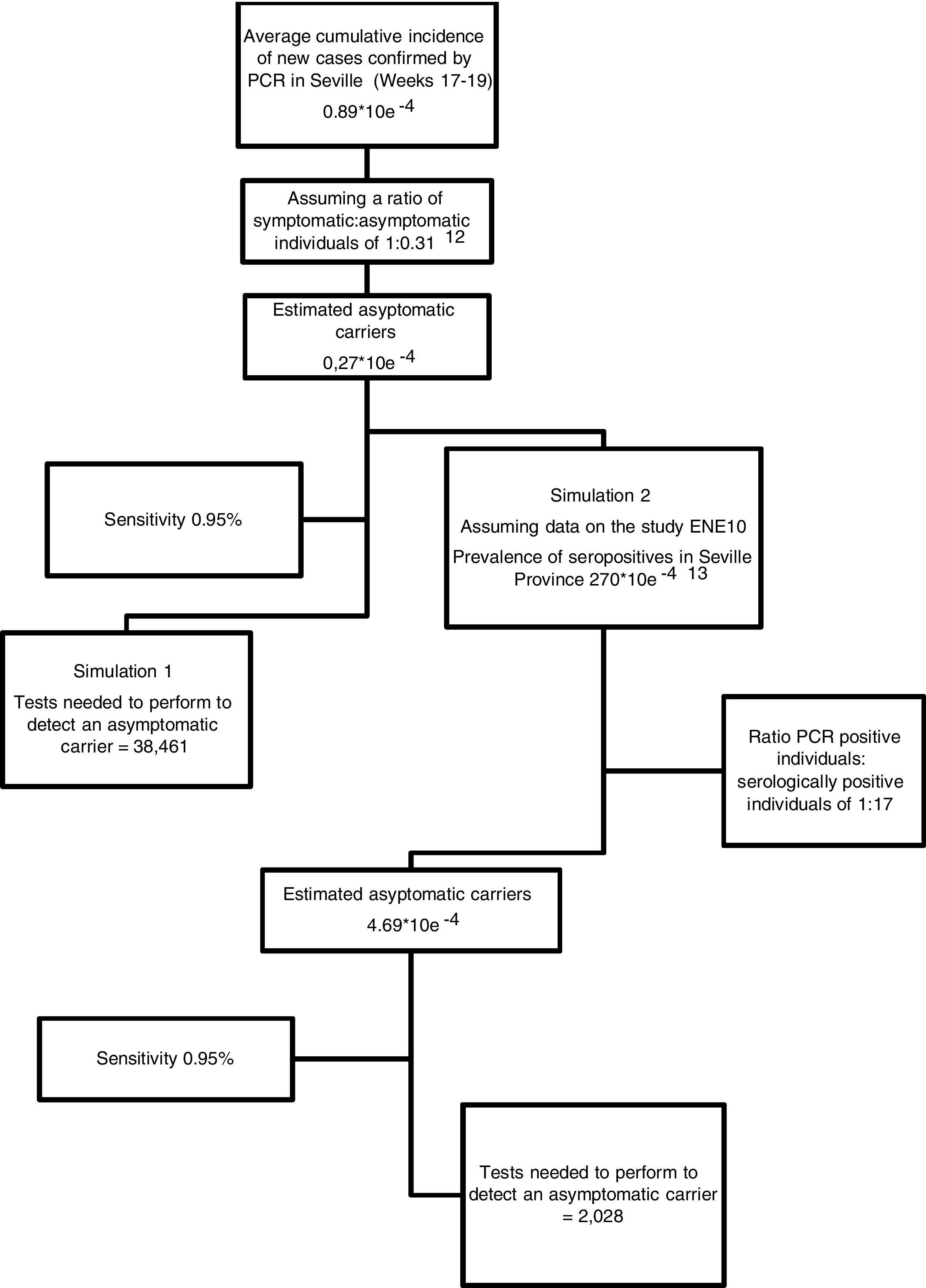
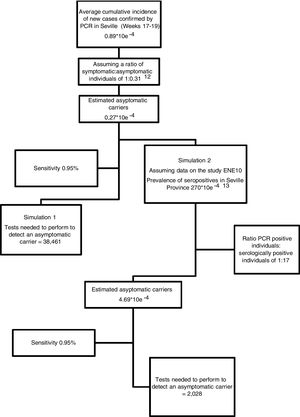
ResultadosNo registramos resultados positivos en las 2722 RT-PCR realizadas en nuestra área entre las semanas epidemiológicas 18 a 21, lo que implica una incidencia acumulada de nuevos casos tendente a cero. Asumiendo los datos epidemiológicos publicados, la proyección probabilística de individuos asintomáticos varió de 0.27 * 10e-4 (datos oficiales de nuevos casos diagnosticados por PCR) a 4.69 * 10e-4 si asumimos casos confirmados por IgG en nuestra provincia. Suponiendo una sensibilidad de RT-PCR del 95%, para obtener un resultado positivo, deberíamos realizar 38,461 y 2,028 pruebas respectivamente.
ConclusionesEn escenarios de muy baja prevalencia y a pesar de su alta sensibilidad, la detección preoperatoria de portadores asintomáticos mediante de RT-PCR es de una efectividad cuestionable. Nuestros hallazgos evidencian la dificultad de establecer modelos predictivos fiables en el contexto de epidemias de evolución rápida, como la pandemia de SARS CoV2.
Due to its high transmissibility, measures aimed at reducing the spread of SARS CoV2 have become mandatory. Different organizations have recommended performing polymerase chain reaction tests (PCR) as part of the preoperative screening of surgical patients. We aimed to determine the performance of PCR testing to detect asymptomatic carriers.
MethodsObservational study carried out at a tertiary care center. We compared the results of preoperative real-time reverse-transcription-PCR test (RT-PCR) performed on a cohort of patients pending surgery with the results we would have expected assuming the epidemiological data released by government offices.
ResultsWe registered no positives in the 2,722 preoperative RT-PCR tests performed in our health care area between epidemiological Weeks 18 to 21, meaning a cumulative incidence trending to zero. Assuming public epidemiological data, the probabilistic projection of potential asymptomatic individuals ranged from 0.27*10e -4 (according to official data of new cases diagnosed by PCR) to 4.69*10e -4 if we assumed cases confirmed by IgG test in our province. Assuming a RT-PCR sensitivity of 95%, to obtain a positive result we should perform 38,461 and 2,028 tests respectively.
ConclusionsIn scenarios of very low prevalence and despite high sensitivity scores, indiscriminate preoperative RT-PCR screening is of a questionable effectiveness for detecting asymptomatic carriers. Our findings evidence the difficulty of establishing reliable predictive models for the episodic and rapidly evolving incidence of infections such as has characterized the SARS CoV2 pandemic.
La alta transmisibilidad del SARS-CoV-2 y su importante repercusión en personas de edad avanzada constituyen un desafío para los sistemas de salud a nivel mundial que ha obligado a la imposición de medidas destinadas a reducir la propagación de la enfermedad1-3. En el ámbito quirúrgico se han adoptado diferentes propuestas orientadas a la identificación de los portadores asintomáticos, paso básico en el control de la transmisión nosocomial. Varias sociedades científicas, paneles de consenso y oficinas gubernamentales han recomendado realizar pruebas de reacción en cadena de la polimerasa (PCR) como parte del cribado preoperatorio de pacientes tratados mediante cirugía programada o urgente2,4-6.
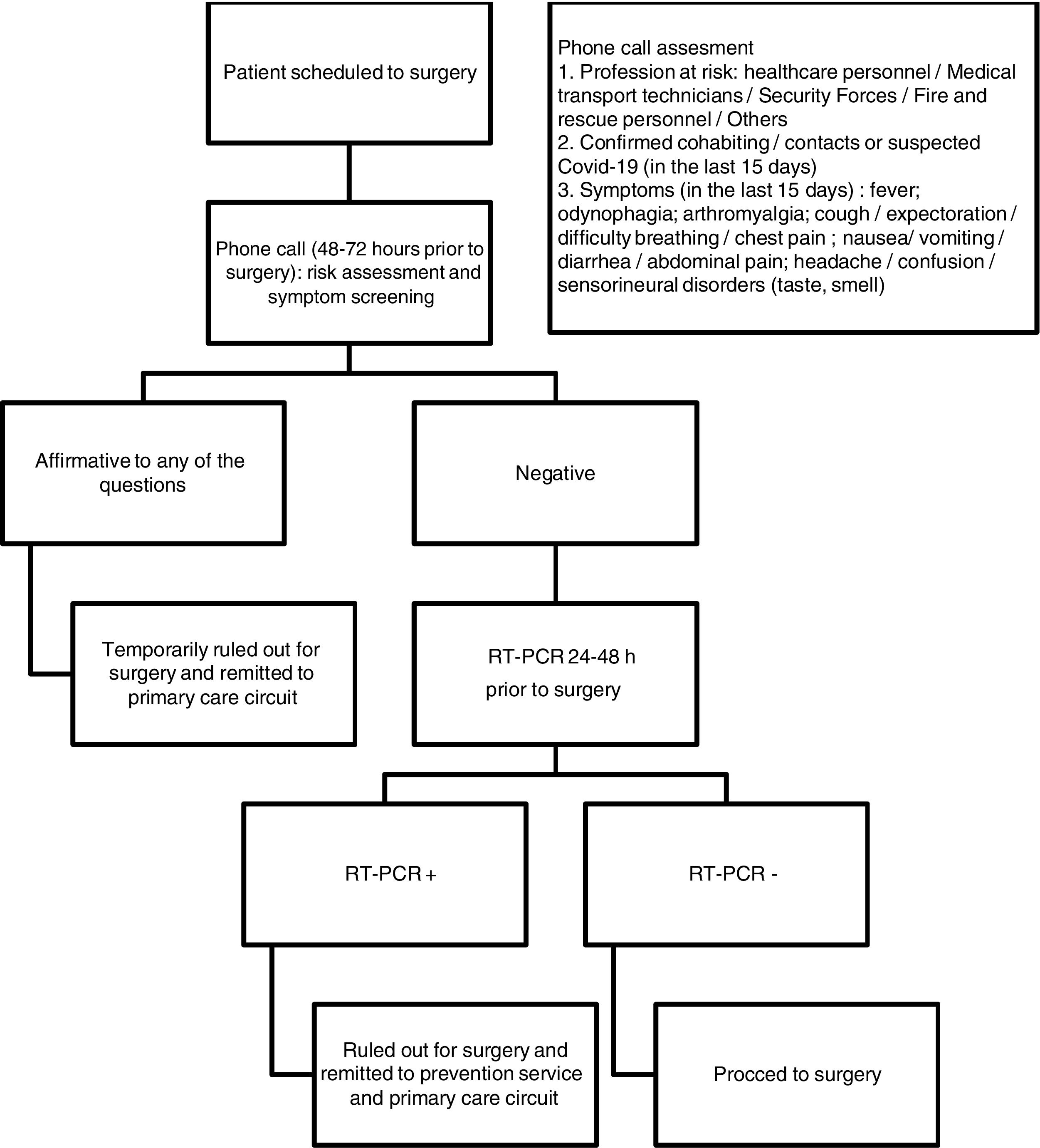
En nuestro centro, de acuerdo con las recomendaciones publicadas en el contexto de la pandemia2,4-6, se efectúa un cribado sistemático de todos los pacientes pendientes de intervención. Así, entre 48 y 72 h antes de la cirugía y mediante entrevista telefónica realizada por una enfermera, se evalúa el riesgo potencial de estar contagiado, así como la presencia de síntomas compatibles con la enfermedad. En el caso de cribado telefónico negativo (fig. 1), los pacientes son tratados mediante una prueba PCR en tiempo real (RT-PCR) 24 a 48 h antes de la cirugía. Un resultado positivo en la entrevista telefónica implica que la intervención se pospone y el paciente es remitido a los servicios de salud pública para la activación de las medidas de diagnóstico y cuarentena correspondientes (fig. 1). Un resultado positivo en la RT-PCR también conlleva el aplazamiento de la cirugía y la activación de los servicios de atención primaria.
Definimos como portadores asintomáticos a aquellos individuos que no presentan síntomas en la evaluación telefónica preliminar pero sí un resultado positivo en la prueba de RT-PCR.
En este estudio nos centramos en determinar la utilidad de realizar pruebas de RT-PCR antes de la cirugía. Pare ello, compararemos el rendimiento diagnóstico de todas las RT-PCR preoperatorias realizadas en nuestra área hospitalaria hasta el momento del envío del artículo con los resultados teóricos que deberíamos haber obtenido en caso de asumir los datos epidemiológicos publicados hasta la fecha por las oficinas gubernamentales.
MétodosEstudio observacional retrospectivo realizado en un hospital universitario de tercer nivel integrado por 5centros independientes que incluyen un hospital pediátrico y un centro para cirugía mayor ambulatoria. Empleamos como datos los resultados de todas las RT-PCR preoperatorias realizadas en pacientes programados para intervención quirúrgica en nuestra área asistencial hasta la fecha de redacción del artículo6,7. Los datos eran anónimos y fueron tratados como una variable discreta (número de RT-PCR positivas sobre el número total de RT-PCR realizadas). Obtuvimos la autorización de nuestro comité de ética con fecha 12 de junio del 2020 (secretario Dr. Carlos García Pérez).
RT-PCR preoperatoriaLa detección de ARN del SARS-CoV-2 se realizó sobre muestras obtenidas de frotis nasofaríngeo de los pacientes. Enfermeras específicamente dedicadas a esta función extrajeron todas las muestras en instalaciones destinadas a tal fin y distribuidas a lo largo de nuestra área asistencial. Todas las muestras fueron analizadas en nuestro laboratorio central.
La RT-PCR empleada en nuestro laboratorio fue el ensayo de Roche cobas® SARS-CoV-2 (Roche Molecular Diagnostics, Pleasanton, CA, EE. UU.), que realiza una detección cualitativa de muestra a resultado totalmente automatizada del ORF1 específico y parte del E-gen conservado a través de Sarbecovirus. Consideramos que las muestras eran positivas para SARS-CoV-2 cuando se detectó el gen ORF1 o los genes ORF1 y E. En el caso de positividad solo para el gen E, realizamos un segundo ensayo de RT-PCR. De forma resumida, extraemos automáticamente los ácidos nucleicos en un sistema MagNa Pure Compact (Roche Applied Science, Mannheim, Alemania) utilizando el MagNA Pure Compact Nucleic Acid Isolation Kit I, de acuerdo con las instrucciones del fabricante. Para la detección de SARS-CoV-2, utilizamos el kit de genes LightMix® Modular SARS y Wuhan CoV E-gene, RdRP-gene y N-gene kits (TIB Molbiol, Berlin, Germany) con LightCycler Multiplex RNA Virus Master (Roche, Basel, Switzerland) de acuerdo con las instrucciones del fabricante. Consideramos positiva para SARS-CoV-2 una muestra si detectamos al menos 2genes. En el caso de positividad para un solo gen, el resultado se informó como no concluyente.
Se ha comunicado que entre los días +2 y +14 desde el momento de la infección, los individuos asintomáticos o mínimamente sintomáticos excretan suficiente material genético viral a través de las vías respiratorias superiores como para ser potencialmente detectados por RT-PCR de un frotis nasofaríngeo2,7,8. Existe controversia sobre el tamaño de la carga viral necesaria para que el portador se considere infectivo. Algunos autores han informado que cargas virales menores de 105 copias genéticas por muestra nasofaríngea tienen un potencial infeccioso mínimo, siendo la carga viral dependiente del tiempo transcurrido desde la infección7,9. En ausencia de datos más definitivos, evaluamos nuestro modelo asumiendo que los pacientes con material genético viral detectable en una muestra nasofaríngea son infectivos independientemente de la cantidad de ese material viral. Si asumimos una sensibilidad del 95% y una especificidad del 100%10, los resultados de RT-PCR de muestras recogidas correctamente detectarían el 95% de los portadores asintomáticos y no generarían falsos positivos.
Estimación de portadores asintomáticos asumiendo datos epidemiológicos oficialesEn nuestro trabajo, propusimos 2proyecciones probabilísticas para estimar el número de portadores asintomáticos en nuestra área de salud. Nuestro objetivo fue determinar cuál de los 2modelos predictivos se ajustaba mejor a los datos reales obtenidos de nuestra muestra, que incluyó los resultados de todas las pruebas de RT-PCR preoperatorias realizadas en nuestro laboratorio entre el 1 y el 21 de mayo del 2020 (semanas epidémicas 18-21). Para la estimación de las tasas de incidencia acumulada se consideró una población de 1.942.389 individuos, correspondiente a los habitantes censados de la provincia de Sevilla11.
Se asumieron los datos epidemiológicos oficiales publicados por los organismos gubernamentales (Ministerio de Sanidad y Consejería de Salud de la Junta de Andalucía) sobre el número de nuevos casos (individuos con resultado positivo en una prueba de PCR) en nuestra provincia en el periodo correspondiente a los 12 días previos a la realización del frotis nasofaríngeo; es decir, para nuestra muestra, los datos de las semanas epidémicas 17 a 19. A partir de ese número, estimamos la incidencia acumulada promedio de nuevos casos durante el período de estudio, construyendo tablas de contingencia en función de la sensibilidad de la prueba y planteando 2escenarios hipotéticos: Simulación 1: asumimos que los datos oficiales de incidencia acumulada se referirían básicamente a individuos sintomáticos, en cuyo caso estimamos una razón de individuos sintomáticos frente a asintomáticos de 1:0,31 (sobre la base de trabajos publicados con anterioridad)12; simulación 2: estimamos el número de individuos asintomáticos enfrentando las cifras oficiales del total de individuos con resultado positivo en la PCR hasta el 21 de mayo del 2020, con el de individuos serológicamente positivos (presencia de IgG+ en análisis de sangre) en nuestra provincia según el estudio de prevalencia publicado por el Ministerio de Sanidad de España13. Con base en dichos datos, en la simulación 2 asumimos una razón de individuos con PCR positiva frente a individuos serológicamente positivos de 1:17 para la provincia de Sevilla (fig. 2). Estimamos una incidencia acumulada de individuos asintomáticos de 0,27×10e–4 y 4,69×10e–4 para las simulación 1 y 2, respectivamente (fig. 2).
ResultadosNo registramos positivo alguno en las 2.722 pruebas de RT-PCR preoperatorias realizadas en nuestra área de salud entre las semanas epidemiológicas 18 a 21.
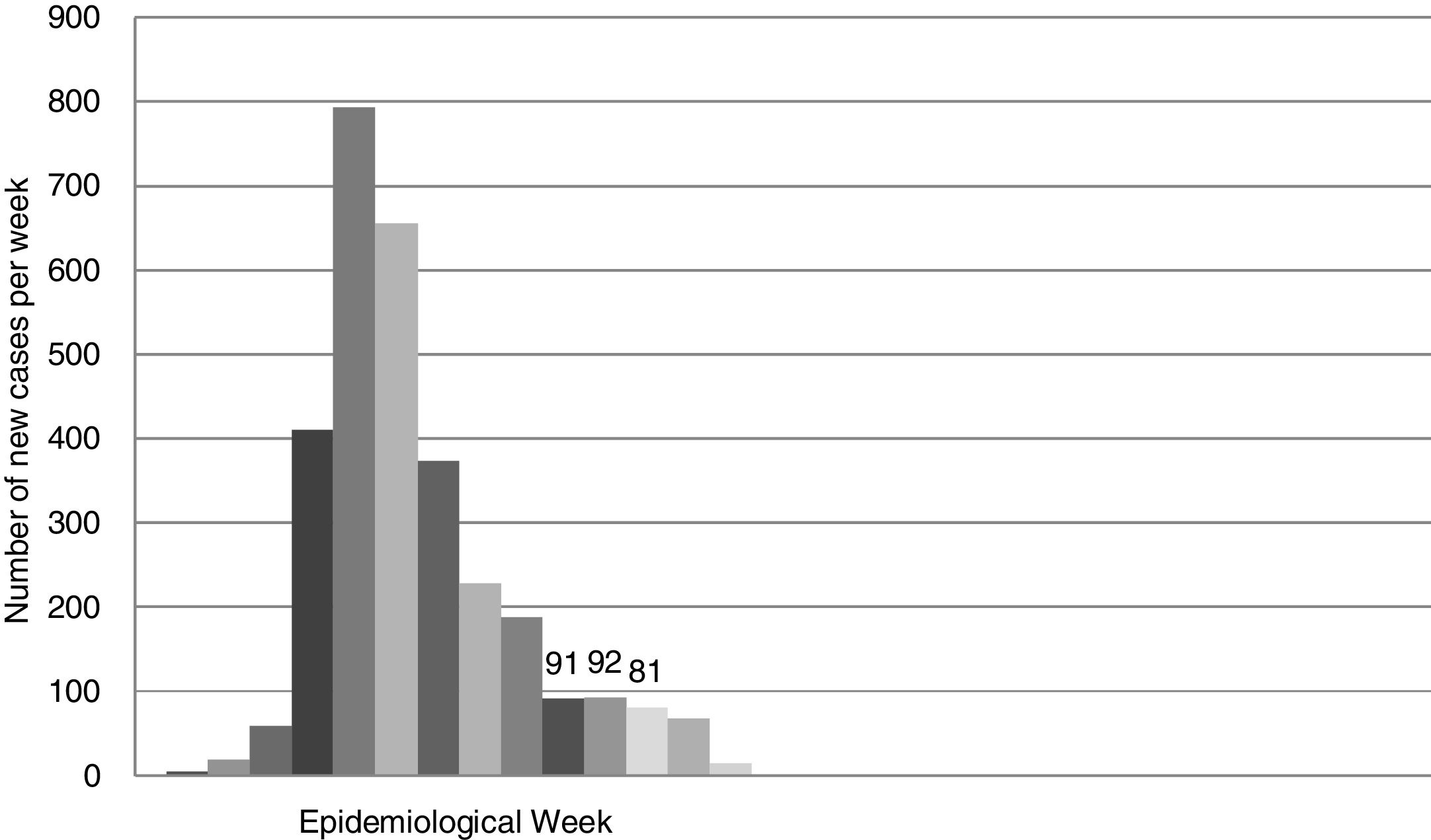
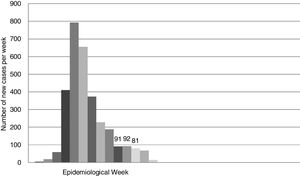
Según datos oficiales, la incidencia acumulada de nuevos casos (confirmados por PCR) en la provincia de Sevilla hasta la semana 21 fue de 3056. En la figura 3 presentamos la incidencia de nuevos casos por semana.
En la figura 2 presentamos la proyección probabilística de potenciales individuos asintomáticos (presentada como incidencia acumulada para el período de estudio) y el número de pruebas que deberíamos realizar para detectar un positivo asumiendo una sensibilidad del 95%.
DiscusiónAsumiendo la ausencia de resultados positivos en las pruebas RT-PCR realizadas en nuestro centro hasta la fecha de redacción del manuscrito, podemos inferir que la tasa de portadores asintomáticos entre los pacientes quirúrgicos en nuestra área asistencial para el período de estudio fue menor a 1/2.722, lo que significa una incidencia acumulada con tendencia a cero o, en el mejor de los casos, inferior a 3,6×10e–4 para una sensibilidad del 95%. Esto implica una estimación del número de portadores asintomáticos inferior a la calculada asumiendo los datos publicados de prevalencia serológica de los infectados en nuestra provincia13 (4,69×10e–4, simulación 2).
Es importante señalar que las estimaciones sobre incidencia acumulada que hemos empleado en nuestro modelo están basadas en los datos de prevalencia serológica recientemente publicados en nuestro país, cuyos resultados son preliminares13. El estudio de seroprevalencia realizado por el Ministerio de Sanidad español corresponde a la prueba rápida de IgG realizada en una muestra de 60.983 voluntarios, posteriormente confirmados por determinación de anticuerpos IgG por inmunoanálisis en aquellos individuos que aceptaron una segunda ronda de análisis (n=16.953), ambas pruebas mostraron un 97,3% de concordancia13.
En nuestro trabajo, para comparar el rendimiento potencial de la prueba de RT-PCR en diferentes escenarios de prevalencia epidémica, definimos valores estables de sensibilidad y especificidad. Es evidente que cuanto menor es la sensibilidad de una prueba, peor es su rendimiento diagnóstico; por lo tanto, para una incidencia acumulada constante, el número de pruebas necesarias para detectar un positivo aumenta a medida que disminuye la sensibilidad de dicha prueba.
Establecer los rangos de incidencia acumulada que indicarían el punto de corte a partir del cual reconsiderar nuestra estrategia de cribado preoperatorio no fue un objetivo de este trabajo; sin embargo, es obvio que cuanto menor sea la prevalencia (incidencia acumulada), peor será el rendimiento de dicho cribado.
Nuestros hallazgos evidencian la dificultad de establecer modelos predictivos confiables ante el comportamiento eventual y rápidamente evolutivo de epidemias como la causada por el SARS-CoV-2. A lo largo de los años se han propuesto numerosas aproximaciones para estimar el número de individuos infectivos en el contexto de epidemias emergentes14,15 y diversos autores han señalado la dificultad de establecer modelos predictivos precisos cuando algunas de las variables que permiten la construcción de dichos modelos no han sido adecuadamente estimadas15. Diferentes factores contribuirían a explicar esta dificultad. Por un lado, tendríamos la ausencia de datos fiables sobre el número real de individuos infectados (sintomáticos o no) en un momento dado, elemento fundamental para definir la probabilidad pretest de desarrollar una enfermedad a lo largo de un período, a su vez paso esencial para la construcción de tablas de contingencia fiables. Características como la virulencia de la infección, su expresividad clínica, el número y la fiabilidad de las pruebas diagnósticas realizadas o la calidad de los registros epidemiológicos empleados, también ayudarían a explicar estas inconsistencias. Por otro lado, tendríamos factores como la rápida evolución de la enfermedad y el impacto de las medidas sociales o políticas adoptadas para controlar su propagación, con su consiguiente reflejo sobre la pendiente de la curva epidémica. En cualquier caso, ante eventos epidémicos de esta envergadura, parece lógico asumir que el número de casos «reales» va a superar al de casos diagnosticados. Algunos autores sugieren que los casos no diagnosticados pueden llegar al 18-31% del total8,12,16, especialmente en las etapas iniciales de una epidemia, fase en la que se han realizado pocas pruebas diagnósticas14. Según el estudio de prevalencia serológica en nuestro país, el número de casos reales podría ser de 10 a 17 veces mayor que los casos oficiales13. A la luz de nuestros resultados, sospechamos que esta incidencia «real» se acumuló en la pendiente ascendente de la curva epidémica.
En nuestro trabajo hemos asumido altos niveles de especificidad y sensibilidad de la prueba RT-PCR. Algunos autores revisan a la baja la sensibilidad de las pruebas de PCR, asumiendo que su rendimiento depende del momento en que se realiza. Grassly et al. propusieron una sensibilidad de alrededor del 90% cuando la prueba se realiza entre los días 3 a 21 después de la infección17. Otros autores apuntan a la influencia de la técnica de muestreo en el rendimiento de la sensibilidad18. Siempre que la especificidad o la sensibilidad de la RT-PCR se reduzcan, habrá una mayor tasa de falsos positivos y falsos negativos. Dada la baja incidencia real de SARS-CoV-2, incluso pequeñas reducciones en la especificidad podrían conducir a la generación de un número considerable de falsos positivos con sus consiguientes consecuencias epidemiológicas, sanitarias y sociales.
Otra consideración racional a la hora de evaluar el rendimiento de nuestra prueba está asociada con el momento epidemiológico en el que decidimos implementar nuestras políticas de detección. Cuando se promueve el cribado mientras se está en la pendiente descendente de la curva epidémica, debemos asumir que el rendimiento de la prueba se verá afectado progresivamente a medida que la incidencia acumulada disminuya, simple pero probabilísticamente cierto. La pregunta entonces será en qué etapas de las pendientes ascendente y descendente consideraremos que la realización de nuestra prueba diagnóstica justifica su uso.
Una de las debilidades del presente estudio es que hemos incluido solo pacientes quirúrgicos o en espera de alguna prueba diagnóstica o terapéutica bajo anestesia. Aunque incluimos una amplia variedad de procedimientos que van desde cirugía mayor ambulatoria hasta procedimientos endoscópicos y cirugía pediátrica, es posible que nuestra cohorte quirúrgica no represente con precisión la población general de nuestra área asistencial. Podríamos esperar que las condiciones específicas de la muestra (pacientes de edad avanzada o con comorbilidades, riesgos relacionados con el SARS-CoV-2, etc.) pudiesen conducir a una mejor adherencia a las medidas de confinamiento y, por lo tanto, a una menor prevalencia de infección en la muestra estudiada frente al resto de la población.
Otra debilidad de este estudio es que asumimos la incidencia acumulada como una variable discreta que medimos semanal o quincenalmente. La tasa de crecimiento de un evento epidémico es en realidad una variable continua que tendemos a «discretizar» sobre una base diaria o semanal. Por tanto, la probabilidad de que un paciente que se somete a una prueba de RT-PCR en un día determinado sea portador asintomático de SARS-CoV-2 es el resultado de la probabilidad acumulada de haber sido infectado entre 2 y 14 días antes de realizar la prueba. En el presente estudio, simplificamos aún más el modelo asumiendo la incidencia acumulada media de las 3semanas previas a la toma de la muestra nasofaríngea, aunque debemos señalar, sin embargo, que la diferencia en dicha incidencia acumulada comparada quincena a quincena fue inferior al 10% (fig. 3). En definitiva, cuando nos situamos en la pendiente descendente de la curva epidemiológica probablemente sobrestimamos la incidencia real de nuevas infecciones si utilizamos los datos de incidencia acumulada de las semanas anteriores. Por el contrario, podemos subestimar dicha incidencia cuando estamos en la pendiente ascendente. En cualquier caso, la proyección de la incidencia de nuevos casos en la curva permitiría realizar los ajustes pertinentes, que evidentemente deberían contrastarse periódicamente con los datos reales.
ConclusionesHemos realizado nuestras estimaciones empíricas sobre la base de datos epidemiológicos poco consistentes y que evolucionan rápidamente; sin embargo, nuestros datos muestrales probablemente reflejan de manera más fiable que otras estimaciones la incidencia real de infecciones en nuestra área asistencial en el momento del estudio. A la vista de nuestros resultados, podemos afirmar que a pesar de la alta sensibilidad y especificidad de la prueba, y de un valor predictivo negativo cercano al 100%, la utilidad de la RT-PCR preoperatoria para detectar portadores asintomáticos es cuestionable por su dudoso rendimiento diagnóstico en escenarios de muy baja prevalencia (representada por la incidencia acumulada). Deberíamos tener en cuenta la pendiente de la curva epidémica y las tasas locales de prevalencia a la hora de planificar la incorporación de estas políticas de cribado.
Nota de los autores: en el momento del envío del manuscrito (12 de junio del 2020, semana epidémica 23), se habían realizado 4.520 test en nuestro centro. Ningún resultado positivo había sido comunicado hasta esa fecha.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a la Dra Trish Reynolds, MBBS, FRACP, del Grupo Edanz (https://en-authorservices.edanzgroup.com/) por editar un borrador del presente manuscrito.