El estesioneuroblastoma es un tumor maligno de la mucosa olfatoria localizado en el tracto nasosinusal con un manejo controvertido debido a su baja incidencia y a su origen desconocido.
La resección craneofacial, empleando un abordaje subfrontal, es uno de los abordajes de elección para el tratamiento de esta compleja entidad. Describimos un caso tratado en nuestra institución que fue resuelto favorablemente con este procedimiento, así como una revisión exhaustiva de la bibliografía con respecto a este tipo de tumor y a las ventajas de este abordaje.
Esthesioneuroblastoma is a rare malignant tumor of the olfactory mucosa located in the sinonasal tract with a controversial management due to its low incidence and unknown origin.
Craniofacial resection using a subfrontal approach is one of the techniques of choice for treating this complex entity. We describe a case treated in our institution that responded favorably to this procedure, as well as a thorough review of the literature regarding this type of tumor and the advantages of the approach.
El estesioneuroblastoma o neuroblastoma olfatorio es un tumor maligno de comportamiento agresivo, de extremada rareza y localizado en la cavidad nasal y los senos paranasales. La sintomatología es poco específica, presenta altas tasas de metástasis y su manejo y etiología son controvertidos. Las recomendaciones terapéuticas varían desde el abordaje endoscópico mínimamente invasivo hasta las resecciones en bloque craneofaciales. El abordaje subfrontal proporciona un adecuado acceso a las estructuras de la base anterior del cráneo con pocas complicaciones. El tratamiento multidisciplinario con radioterapia y quimioterapia es de elección, especialmente para estadios avanzados de la enfermedad. El pronóstico es malo pero la supervivencia se ha incrementado en los últimos años gracias al empleo de tratamientos combinados1,2.
Caso clínicoAcude a nuestras consultas una mujer de 44 años sin antecedentes de interés que refiere un cuadro de epistaxis autolimitada y de obstrucción de la fosa nasal izquierda de un mes de evolución.
En la exploración física destaca una masa de aspecto polipoide y de color rosado que se biopsia, así como una adenopatía laterocervical en el nivel ii ipsilateral sobre la que se realiza una punción aspiración con aguja fina (PAAF).
Los resultados de la biopsia son compatibles con el estesioneuroblastoma y la PAAF confirma la metástasis cervical.
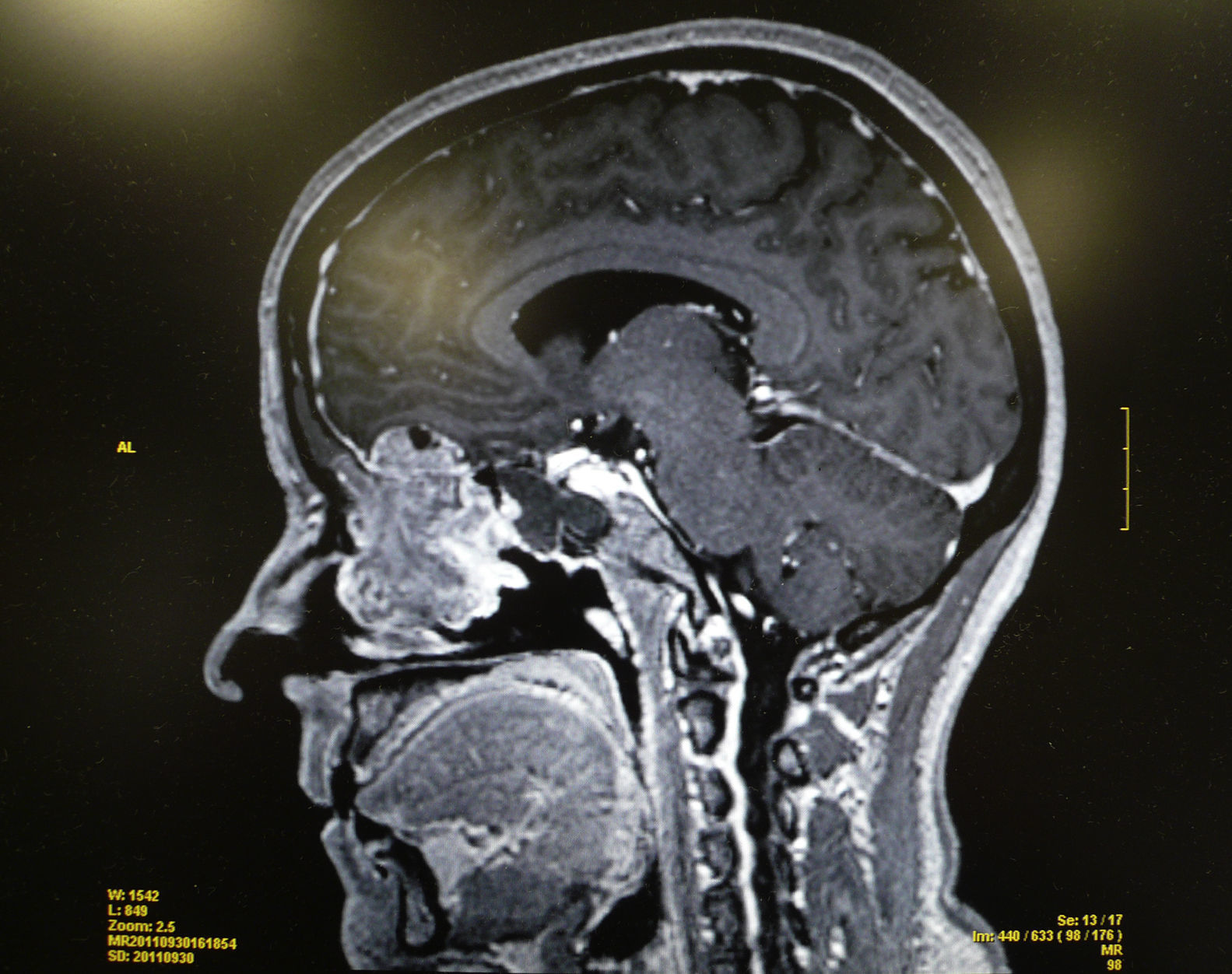
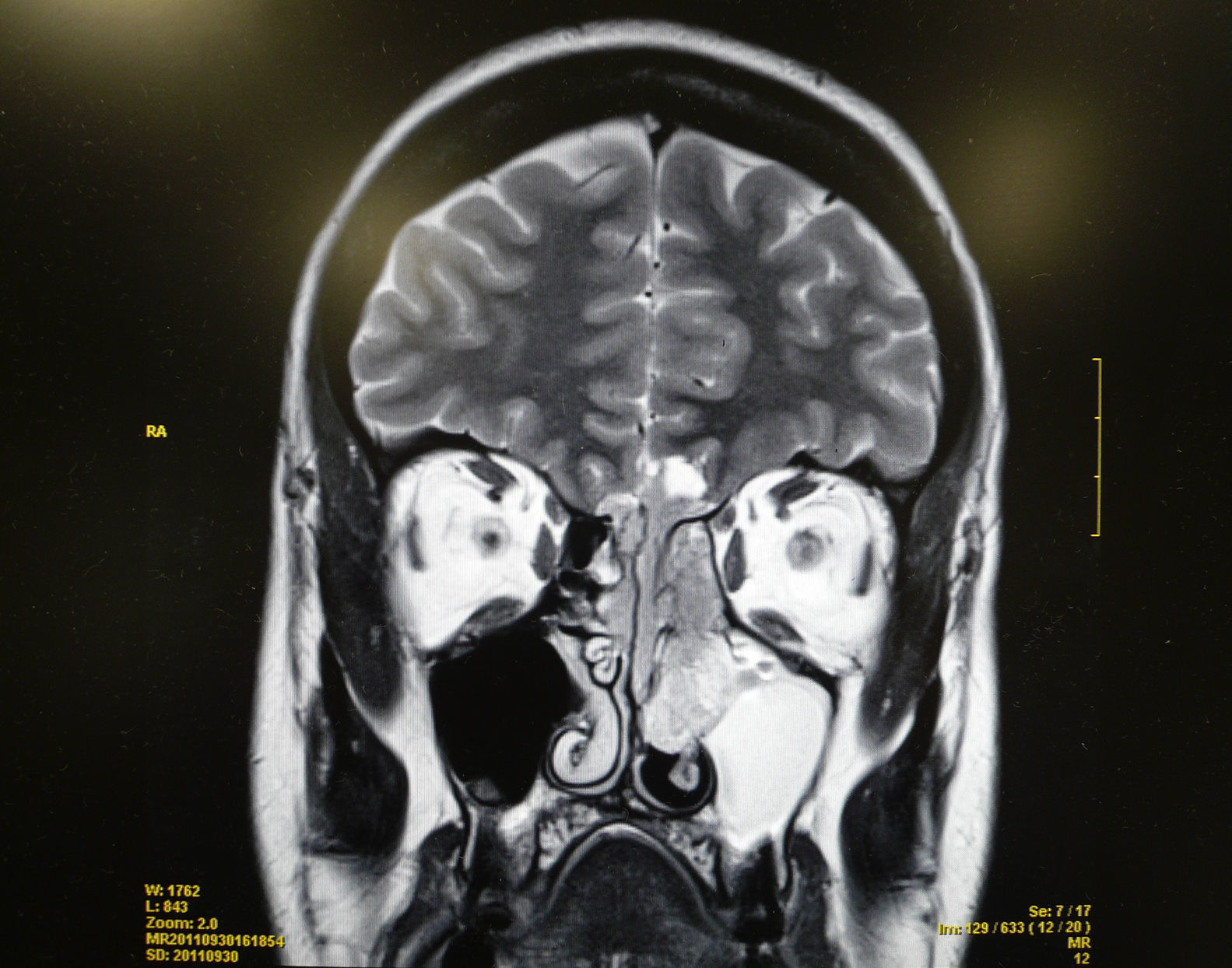
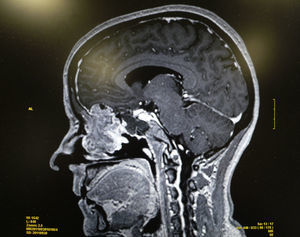
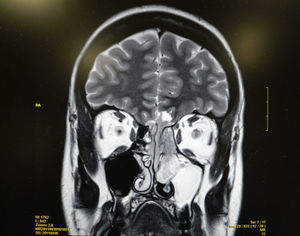
Se realiza una tomografía computarizada (TC) y una resonancia magnética (RM) que ponen de manifiesto una lesión tumoral localizada en los 2 tercios superiores del septo nasal izquierdo y que infiltra la lámina cribiforme y la base anterior del cráneo, así como adenopatías sospechosas de malignidad en el nivel ii. No se aprecia infiltración orbitaria (figs. 1 y 2).
El tumor es clasificado como un estesioneuroblastoma en estadio Kadish D y Dulgerov T4N1.
DiscusiónEl estesioneuroblastoma o neuroblastoma olfatorio es una neoplasia maligna que representa solo el 2-5% de todos los tumores del territorio nasosinusal. Fue por primera vez descrito por Berguer et al. en 19243.
Se puede desarrollar a cualquier edad pero se ha establecido una distribución bimodal en torno a la segunda y quinta década de la vida4,5.
La sintomatología es inespecífica, como la obstrucción nasal unilateral y la epistaxis.
También puede aparecer anosmia, ronquidos, dolores de cabeza, diplopía, proptosis y salivación excesiva. Los síntomas más frecuentes son la obstrucción nasal y la aparición de masas polipoides nasales. Debido a la baja especificidad de estos síntomas se suele confundir con enfermedades benignas y es por ello que hasta un 70% de los pacientes no se diagnostican hasta que la enfermedad se encuentra en estadios más avanzados6,7.
La clasificación por estadios fue propuesta por Kadish y modificada posteriormente por Morita8 (tabla 1). Algunos autores consideran más útil el empleo de la clasificación de Dulguerov basada en el TNM9. El tumor se extiende a través de la submucosa nasal y de los senos pudiendo llegar a invadir la fosa craneal anterior a través de la lámina cribiforme. La incidencia de la metástasis varía desde un 0-47%. Se puede propagar a través de la vía hemática o linfática. Las metástasis cervicales son las más frecuentes (10-30%) de acuerdo con la literatura indexada4,10. La RM y la TC son las pruebas de imagen empleadas para los estudios de localización y extensión de la lesión.
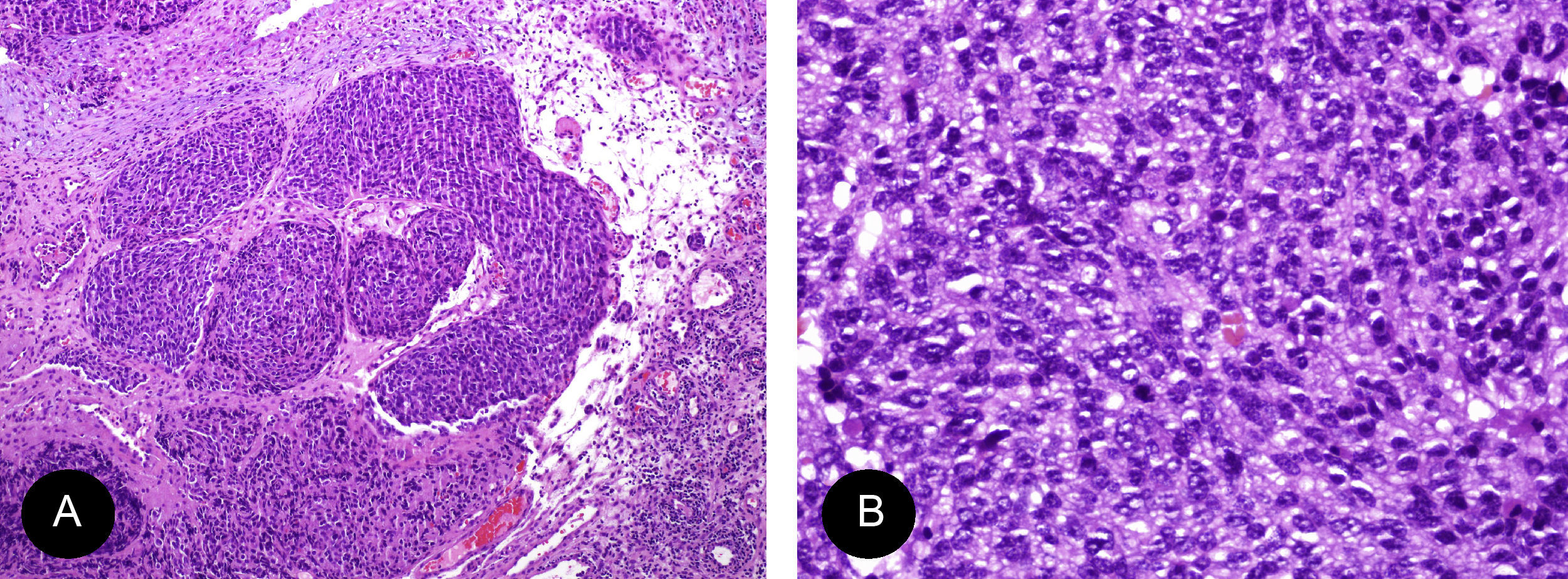
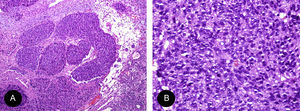
El estesioneuroblastoma es un tumor de origen neuroectodérmico que proviene de la membrana olfatoria. Las células tumorales poseen una marcada actividad mitótica y se diferencian a partir de células precursoras a células de tipo sustentacular y de tipo neuronal. Histológicamente presenta varios patrones histológicos. Más frecuentemente presenta una arquitectura lobular con formación de rosetas o pseudorosetas. Las rosetas de tipo Flexner-Wintersteiner son aquellas formadas por un anillo de céluas columnares alrededor de un espacio central circular u oval. Las pseudorosetas de Homer-Wright son caracterizadas por ser algo más discohesivas con presencia de material fibrilar en la luz. Las células tumorales son de tipo célula pequeña, mostrando un núcleo oval con presencia de cromatina en sal y pimienta, nucléolo inconspicuo y escaso citoplasma. Dicha celularidad se encuentra inmersa en una matriz fibrilar formada por procesos axonales neuronales demostrables con tinciones convencionales. En los tumores de alto grado existe pleomorfismo nuclear, figuras mitóticas (>2/cga) y necrosis. La presencia de calcificaciones es un signo de bajo grado11,12.
A veces la conformación de estas células pequeñas es variable, con presencia o ausencia de rosetas y matriz neurofibrilar. Las imprecisiones diagnósticas se deben al hecho de que el estesioneuroblastoma es histológicamente similar a otros tumores de células pequeñas (linfoma, sarcoma de Ewing, melanoma, rabdomiosarcoma, carcinoma de Merkel, neuroblastoma y carcinoma microcítico). La distinción del estesioneuroblastoma de otros tumores es de gran importancia por la respuesta variable a los diferentes tipos de tratamiento13,14.
El esquema propuesto por Hyams de graduación en 4 grupos tiene importancia diagnóstica y pronóstica. Sin embargo, la separación definitiva entre grados es arbitraria (tabla 2). A mayor grado, mayor será la dificultad diagnóstica y el requerimiento de estudios especiales para su confirmación11,12. En nuestro caso, fue clasificado como grado Hyams II (fig. 3).
Clasificación histopatológica de Hyams
| Grado | Preservación de la arquitectura lobular | Índice mitótico | Polimorfismo nuclear | Matriz fibrilar | Rosetas | Necrosis |
| i | + | Cero | No | Prominente | HW | No |
| ii | + | Bajo | Bajo | Presente | HW | No |
| iii | ± | Moderado | Moderado | Baja | FW | Rara |
| iv | ± | Elevado | Elevado | Ausente | No | Frecuente |
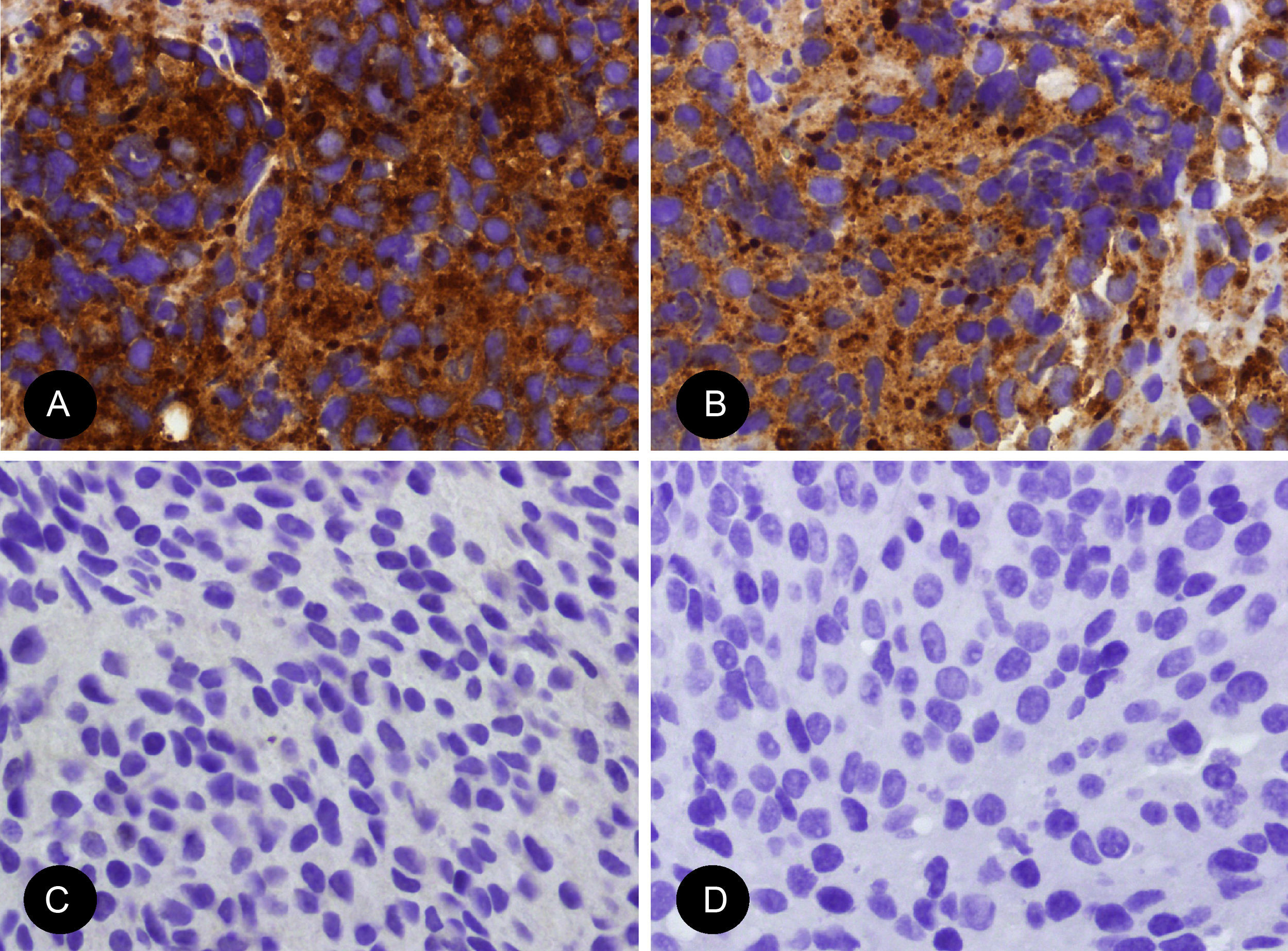
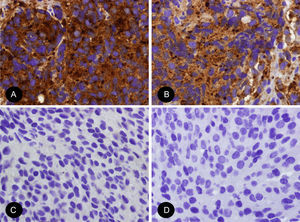
Inmunohistoquímicamente, muestra positividad difusa para NSE y sinaptofisina y con menos frecuencia para cromogranina. En tumores con patrón lobular las células sustentaculares presentan positividad para S-100 y negatividad para citoqueratinas. Los marcadores neuronales como la tinción de neurofilamentos se expresan más frecuentemente en tumores con patrón más difuso11,12.
La diferencia histológica con un tumor pobremente diferenciado de la cavidad nasal es difícil y se basa en un panel inmunohistoquímico amplio y, si es necesario, una microscopía electrónica15.
Entre otros diagnósticos diferenciales se incluyen el linfoma (antígeno leucocitario común +), el sarcoma de Ewing (CD99 +), el melanoma (UMB45 +), el carcinoma de Merkel (CK20 +) y el carcinoma microcítico. Los carcinomas microcíticos usualmente presentan células aglomeradas entre sí con moldeamiento nuclear, escaso citoplasma y ausencia de diferenciación neuroblástica. Además, presentan positividad tanto para sinaptofisina como para cromogranina, siendo la principal diferencia la ausencia de células sustentaculares y la positividad para TTF1 en un gran porcentaje de los casos (fig. 4)13,14.
El tratamiento de elección es discutido ya que es un tumor del que no se han descrito gran cantidad de casos y no se han realizado estudios prospectivos. Las cifras de supervivencia han aumentado desde el empleo del tratamiento multimodal.
La cirugía combinada con la radioterapia ha demostrado proporcionar un mayor control de la enfermedad y menos recurrencias que la cirugía o la radioterapia por separado16.
Para el tratamiento quirúrgico de tumoraciones pequeñas (estadios AB de Kadish) y tumores de bajo grado el tratamiento endoscópico ha demostrado ser eficaz. Algunas instituciones lo recomiendan incluso sin el uso de radioterapia en tumores de bajo grado y estadio A17.
Las resecciones craneofaciales se emplean para grandes tumoraciones (estadios CD de Kadish) permitiendo una resección en bloque y un mejor control de los márgenes. Constituye un método agresivo pero es responsable del aumento de las tasas de supervivencia globales18. No existen diferencias estadísticas significativas en cuento a la tasa de recurrencia, tiempo de intervención, sangrado y estancia hospitalaria entre la resección craneofacial y el tratamiento endoscópico19.
El abordaje subfrontal fue popularizado por Joram Rayeh depués de sus estudios basados en tumores de la base del cráneo y de fracturas complejas20,21. Permite un magnífico acceso a la base anterior del cráneo y una exposición de ambas órbitas, senos maxilares, el clivus y la sella. Por otra parte, se necesita una mínima retracción cerebral, no se produce invasión del tracto aerodigestivo, reduce el tiempo quirúrgico, la pérdida de sangre y la estancia en unidades de cuidados intensivos. Se emplea para lesiones de la fosa craneal anterior, seno esfenoidal y clivus hasta C1. La desventaja más evidente es la anosmia que puede llegar a producir22.
Para comenzar se realiza un drenaje lumbar controlado del líquido cefalorraquídeo que impide que se produzcan herniaciones cerebrales al realizar la craneotomía. El paciente se coloca en decúbito supino con la cabeza fijada al cabezal de Mayfield (Ohio Medical Instrument Co, Inc., Cincinnati, Oh, EE. UU.) y en posición neutra.
Previo a la incisión bicoronal se emplea anestesia local con epinefrina para evitar el excesivo sangrado del SCALP. Se debe prestar especial atención con la rama temporal del nervio facial y el nervio supraorbitario que emerge desde el techo de la órbita.
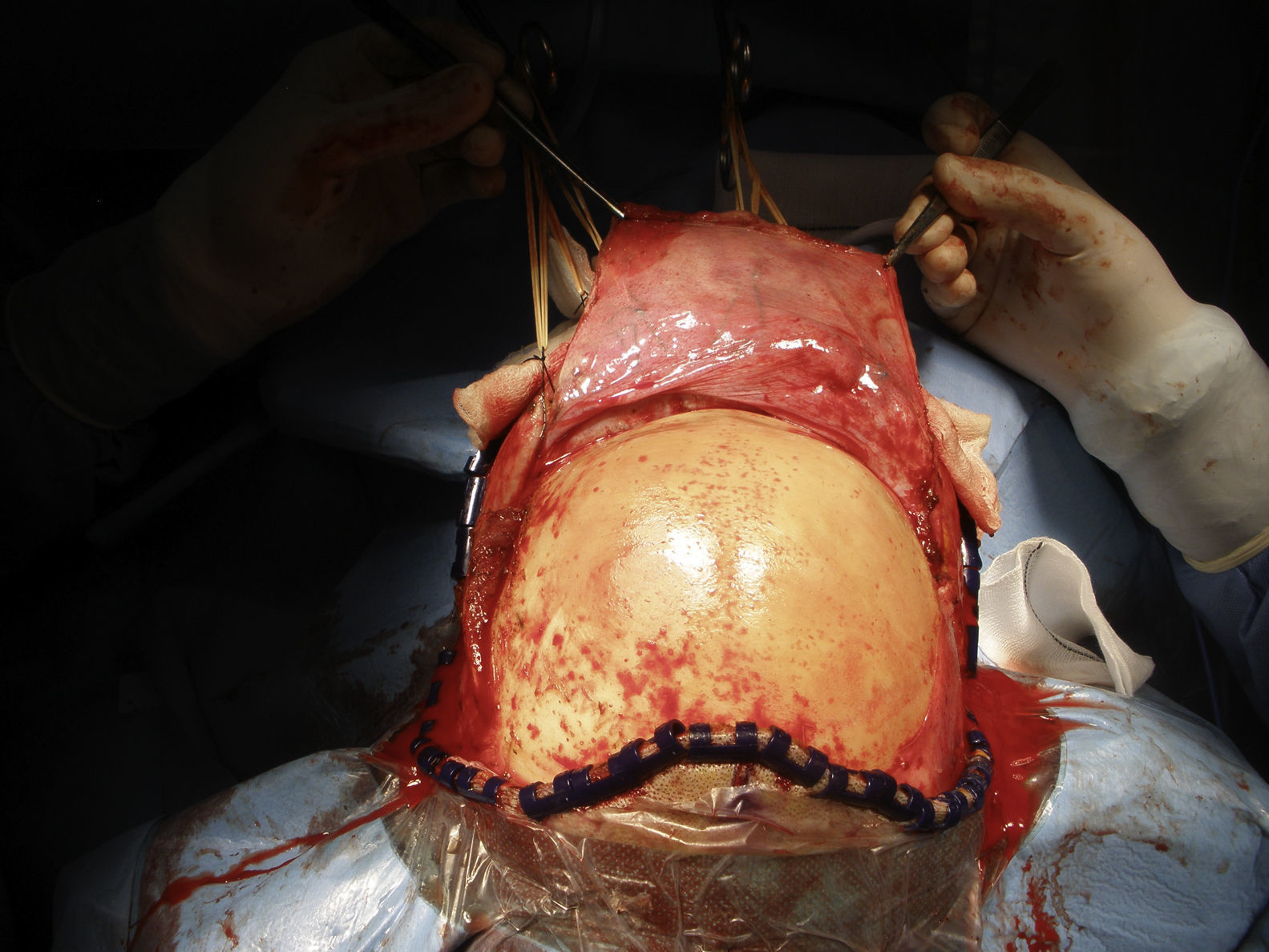
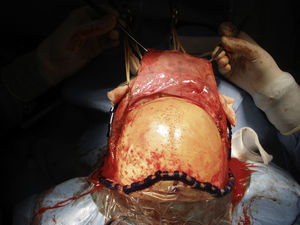
A continuación, se realiza un colgajo pericraneal mediante una disección en el plano suprapericraneal y la disección continua hasta conseguir una buena exposición de ambas órbitas, el hueso nasal y los arbotantes malares (fig. 5). Se procede a la desinserción de los ligamentos cantales mediales.
Seguidamente, se realiza una craneotomía bifrontal en 2 bloques, teniendo precaución en no lesionar el seno longitudinal superior. El sangrado del seno se puede controlar mediante el empleo de gasas de celulosa oxidada. Se preserva la duramadre intacta que se cuelga alrededor de la craneotomía con puntos de sutura al hueso23.
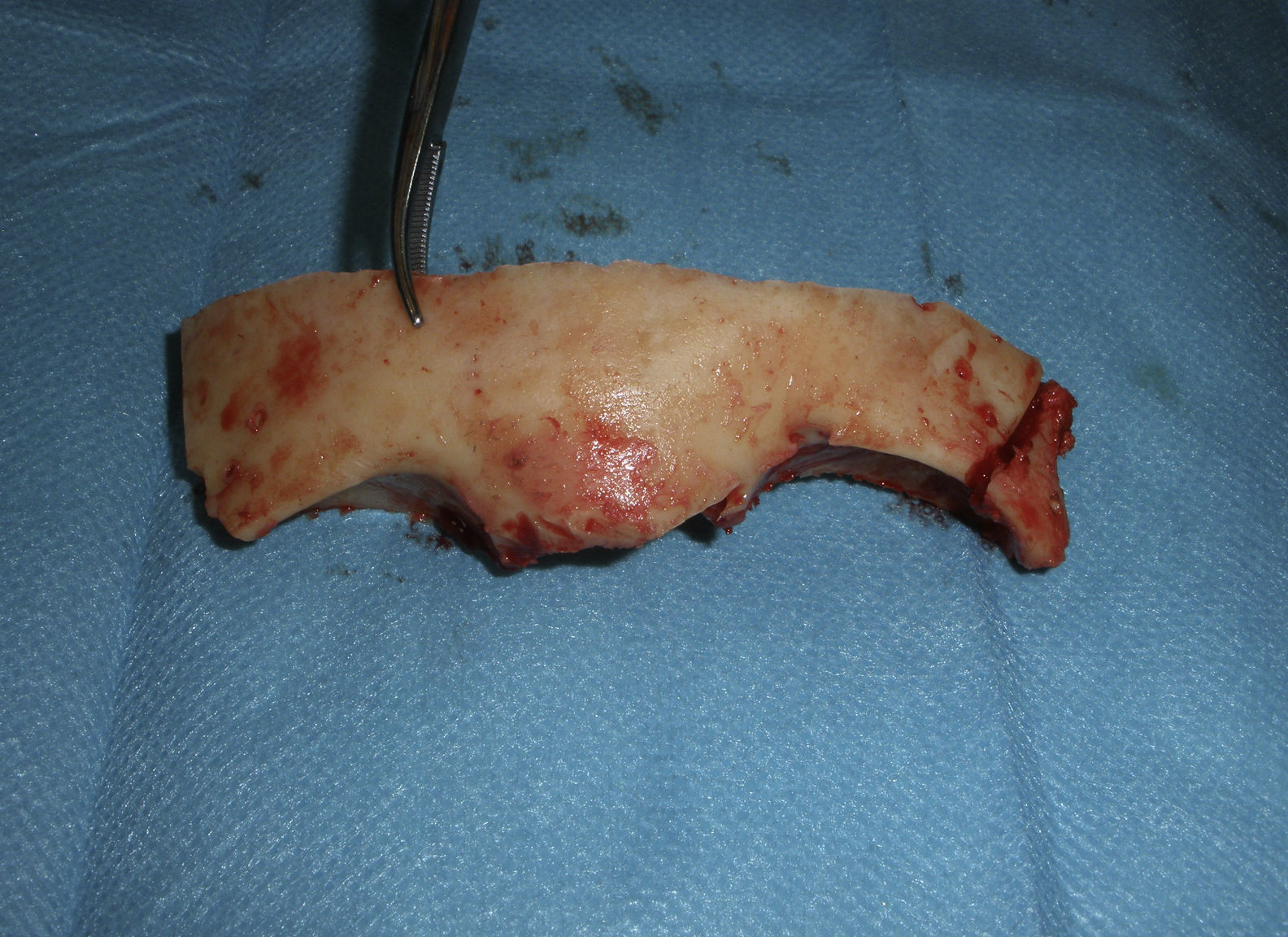
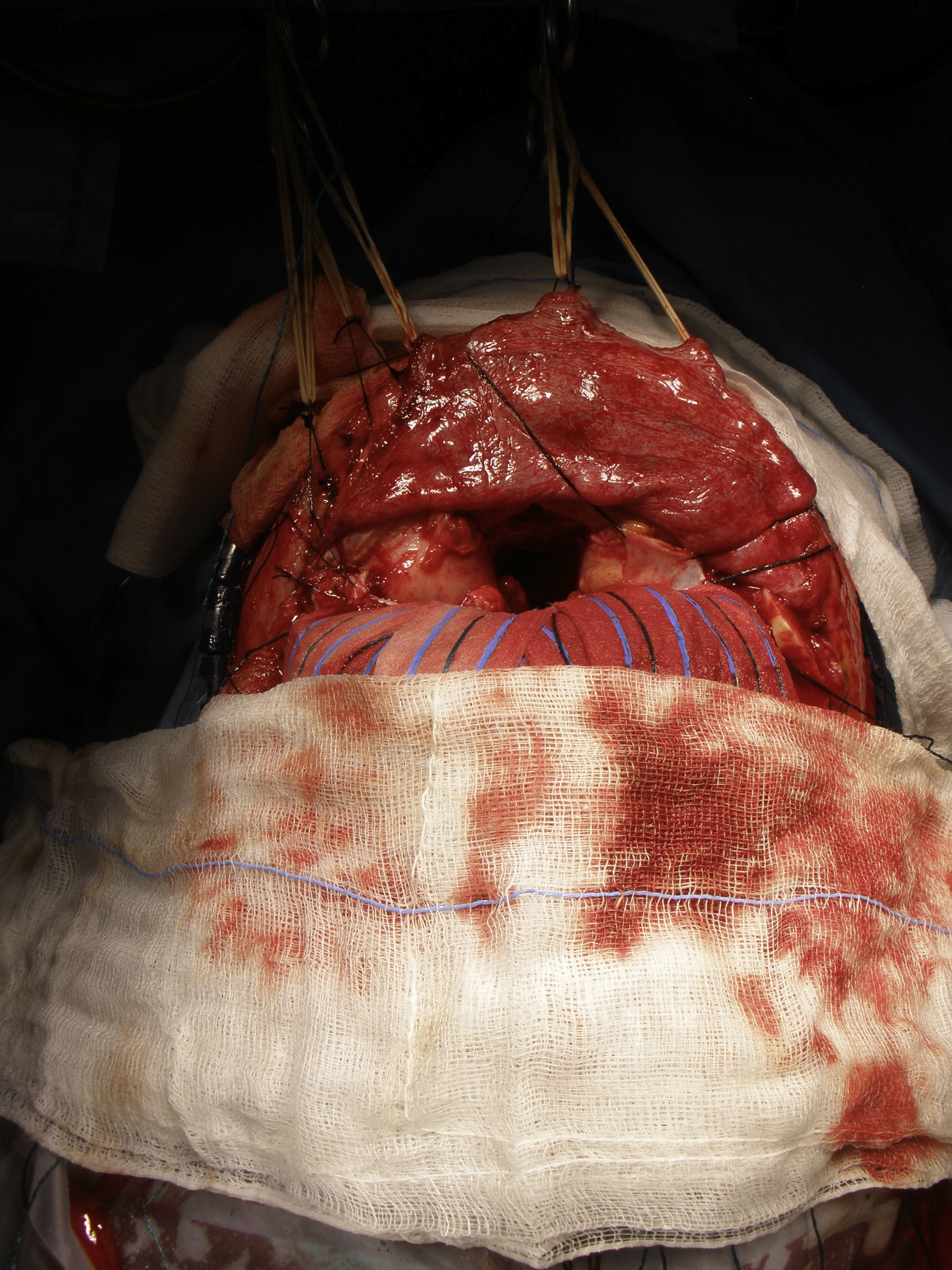
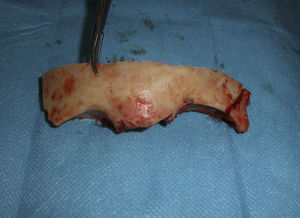
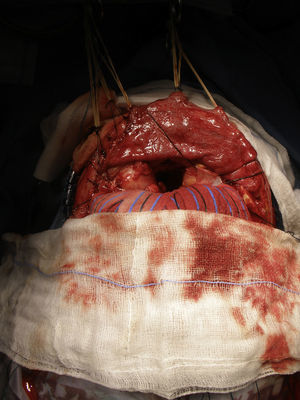
Antes de realizar las osteotomías, se moldean las placas de osteosíntesis para ayudar a la reconstrucción inmediata. Las osteotomías se extienden a lo largo de los arbotantes malares, los huesos nasales y la pared medial y el techo de la órbita (fig. 6). Ambos lóbulos frontales son rechazados y se secciona la parte anterior del seno longitudinal y la hoz. La tumoración de la paciente se halla a nivel de los surcos olfatorios, por lo que una osteotomía en el esfenoides y la resección de la lámina cribosa son los pasos previos necesarios para ampliar el acceso y realizar la resección en bloque de la tumoración que se extiende hacia la cavidad nasal, las celdillas etmoidales y el seno paranasal izquierdo (fig. 7).
Finalmente, la duramadre se reconstruye y se emplea un injerto de calota para reconstruir el defecto frontal. La osteosíntesis se consigue recolocando las miniplacas preformadas, se reposiciona el colgajo del pericráneo y finalmente se sutura el SCALP24.
La incidencia de metástasis cervicales varía del 0-30% en la literatura, en la que se recomienda la realización de vaciamiento cervical ganglionar cuando se demuestra que el cuello se encuentra afectado mediante citología. La radioterapia posquirúrgica también está indicada en estos pacientes. El cuello contralateral no se trata mientras no haya evidencias de enfermedad, aunque algunos autores recomiendan el vaciamiento cervical ganglionar bilateral de entrada25. No se ha establecido todavía si el vaciamiento profiláctico de los cuellos N0 podría mejorar el pronóstico de estos pacientes, aunque la mayoría de los centros que tienen más experiencia con el manejo de este tipo de tumoración no lo recomiendan ya que las metástasis cervicales suelen desarrollarse pasados 2 años después del diagnóstico, aunque sí que podría estar recomendado para pacientes que presenten una enfermedad localmente avanzada. La quimioterapia se añade en estados avanzados con cuellos positivos17–19. En nuestro caso nos decantamos por la realización de un vaciamiento cervical supraomohioideo del lado izquierdo. A las 3 semanas de la intervención y tras la realización de una tomografía computarizada por emisión de fotones individuales (SPECT) por aparición de una tumoración submandibular derecha se demuestra la presencia de adenopatías sospechosas a este nivel, por lo que se decide realizar un vaciamiento ganglionar supraomohioideo del lado derecho que posteriormente confirma la metástasis tumoral.
La radioterapia preoperatoria consigue una reducción del volumen tumoral, incrementando las posibilidades de preservar la órbita y facilitando la resección, pero, por otro lado, complica la determinación de los márgenes de seguridad de forma intraoperatoria, por lo que normalmente se recomienda después de la cirugía en un rango que varía de 50 a 70Gy26. En nuestro caso la paciente recibió 64Gy.
El estesioneuroblastoma es un tumor quimiosensible pero el papel de la quimioterapia continua siendo controvertido y solo se considera de utilidad en combinación con la cirugía y radioterapia en pacientes que presentan tumores de alto grado, recidiva locorregional, enfermedad metastásica y en aquellos que sean inoperables26–29.
Los factores más importantes que afectan a la supervivencia y al pronóstico son: el grado de diferenciación histopatológico (clasificación de Hyams), la extensión locorregional y las metástasis (clasificación de Kadish, Morita y Dulguerov) y el grado de resecabilidad del tumor en la cirugía primaria7. Las tasas de supervivencia a 5 años se han incrementado del 37,5 al 82% debido al empleo del tratamiento multimodal. Sin embargo, las recidivas locorregionales y las metástasis a distancia continúan siendo el mayor problema ya que pueden aparecer incluso años después del tratamiento18,26,27.
ConclusionesEl neuroblastoma olfatorio es un tumor con un tratamiento controvertido debido a su baja incidencia. La resección craneofacial, empleando un abordaje subfrontal, es uno de los tratamientos quirúrgicos de elección para tumores de mediano o gran tamaño localizados en el área nasosinusal y presenta una baja tasa de complicaciones.
Aunque las cifras de supervivencia se han incrementado en los últimos años gracias al empleo de protocolos agresivos que combinan grandes resecciones quirúrgicas, radioterapia y quimioterapia, las recidivas locorregionales y las metástasis a distancia continúan siendo un reto para el cirujano.
Es necesario realizar estudios prospectivos para establecer el algoritmo de tratamiento idóneo para esta compleja entidad.
Protección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.