Presentamos un caso de ameloblastoma desmoplásico en una mujer de 32 años que afecta a la región media del maxilar superior. Se describen las características específicas, tanto histológicas como clínicas, de esta variante de ameloblastoma, y se insiste en su imagen radiológica similar a la de una lesión fibroósea benigna. Se indica la misma conducta terapéutica que para el resto de los ameloblastomas intraóseos sólidos.
We report a case of desmoplastic ameloblastoma in a 32 year-old female patient affecting the region half of the upper jaw. We describe the specific characteristics, both histological and clinical of this variant of ameloblastoma, insisting its radiological image similar to that of a benign fibroosseous lession. We indicate the same therapeutic conduct for the rest of the solid intraosseous ameloblastomas.
El ameloblastoma es un tumor epitelial de los maxilares que comprende aproximadamente el 1% de todos los quistes y tumores odontogénicos. A pesar de sus rasgos histológicos de benignidad, se considera generalmente un tumor agresivo a nivel local, que produce destrucción ósea y altos índices de recidiva.
El ameloblastoma desmoplásico (AD) es una de las variantes histológicas que presentan los ameloblastomas, siendo esta de especial interés debido a sus peculiares características tanto radiológicas como anatomopatológicas.
Caso clínicoMujer de 32 años, japonesa, sin antecedentes médico-quirúrgicos de interés, no fumadora ni bebedora, que acude a consulta por presentar una tumoración maxilar indolora de varios meses de evolución. A la exploración se aprecia una tumoración de unos 3 cm de diámetro que hace prominencia en la zona vestibular premolar izquierda del maxilar superior, manteniéndose la integridad de la mucosa (fig. 1). No presenta alteraciones sensitivas asociadas y la exploración cervical es negativa.
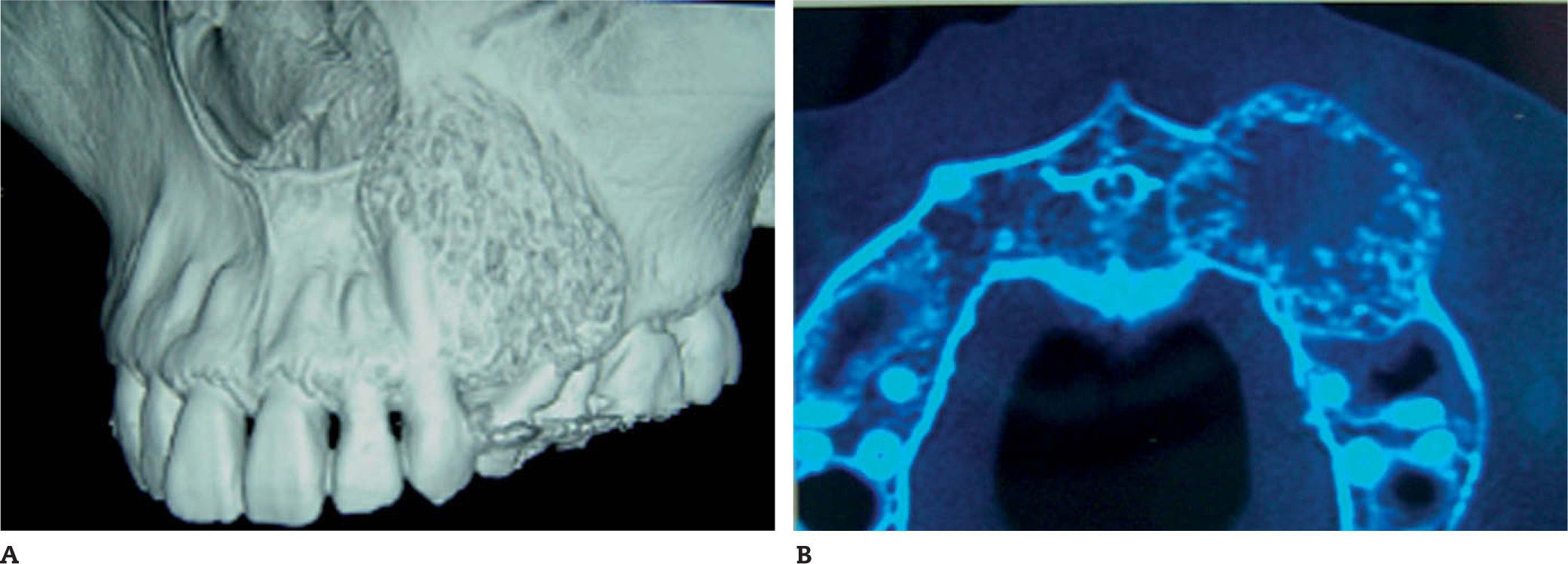
En la radiografía panorámica se observa una imagen mixta radioopaca-radiolúcida con aspecto de "panal de abejas" que se expande entre el canino y el primer bicúspide superior izquierdo y que origina una gran separación entre las raíces de esas piezas dentarias, así como un ligero desplazamiento en los límites del seno maxilar y escotadura piriforme (fig. 2). La tomografía axial computarizada (TAC) delimita con mayor precisión los bordes de esta tumoración, que se extiende por la región palatina sin llegar a la línea media; en su zona central presenta una clara imagen radiolúcida rodeada por un punteado de imágenes alternantes radiolúcidas y radioopacas que configuran el resto de la masa tumoral (fig. 3A y B).
Los diagnósticos diferenciales barajados, en espera de la confirmación histológica, fueron: lesión fibroósea benigna, sarcoma osteogénico, tumor epitelial calcificante, etc.
La primera biopsia realizada fue informada como ameloblastoma, pero la falta de concordancia clínico-radiológica con el ameloblastoma común apoyó la indicación de una segunda biopsia. En esta se podían observar con mayor claridad escasos nidos y cordones de células basaloides, sin atipia, dispuestas en un estroma fibroso densamente colagenizado, lo que se consideró característico de la variante desmoplásica del ameloblastoma.
Bajo anestesia general se realiza la disección de un colgajo mucoso palatino y vestibular en la zona peritumoral, así como la separación de la mucosa nasal y del seno maxilar, que en ningún momento se encontraban adheridas al tumor. Expuesta la zona a resecar, y siguiendo los límites macroscópicos del tumor, se practica una maxilectomía en bloque que abarca desde distal del incisivo lateral, hasta mesial del segundo molar, incluyendo en la pieza la pared lateral de la fosa nasal izquierda, el suelo del seno maxilar izquierdo y la porción palatina afectada. Una vez retirado el bloque tumoral se amplían los límites de seguridad de la resección sobre hueso clínicamente sano. En el mismo acto operatorio se procede a la reconstrucción del defecto resultante mediante interposición de un bloque de autoinjerto córtico-esponjoso libre de cadera, fijándolo con miniplacas de osteosíntesis al hueso maxilar (fig. 4).
El estudio macroscópico de la pieza de resección mostraba una tumoración que medía 3 x 3 y 5 x 2,5 cm, relativamente bien delimitada aunque infiltrante en el hueso maxilar, y que no se extendía al hueso limítrofe. Histológicamente la tumoración estaba constituida por nidos irregulares de células de aspecto basaloide, con escaso citoplasma y núcleos monomorfos carentes de atipia. Los nidos celulares estaban dispuestos de manera salpicada sobre un abundante estroma muy colagenizado (fig. 5). Se emitió un informe de ameloblastoma variante desmoplásica que respetaba los bordes óseos.
El postoperatorio inmediato cursa sin complicaciones; se procedió a la colocación de una prótesis dentaria provisional removible al cabo de unas semanas.
En el último control clínico-radiológico realizado a los 4 años no existen signos de recidiva; un año y medio después de la intervención se realizó, para mayor seguridad, un examen histológico del hueso remanente en la zona distal del incisivo lateral por hallarse la línea de resección muy próxima y el resultado fue negativo para presencia de tumor residual. Se mantienen revisiones periódicas.
DiscusiónEl ameloblastoma es uno de los tumores odontogénicos más frecuentes. Se trata de un tumor benigno, localmente agresivo, pero que no produce metástasis. El hecho de ser un tumor polimórfico le confiere un interés especial tanto para el clínico como para el patólogo. Se describen tres entidades diferentes: el ameloblastoma intraóseo sólido, el intraóseo quístico y el periférico. El ameloblastoma intraóseo sólido es el que podemos considerar como el clásico o común (AC). Afecta preferentemente a los varones en su región mandibular posterior, con imagen radiológica multicavitaria, de límites no totalmente nítidos, y que debido a su conducta infiltrante necesita una exéresis de hueso sano más allá de los límites radiológicos del tumor. Clásicamente se describen dos patrones histológicos diferentes dentro del AC: el tipo folicular (con la variante acantomatosa y de células granulares) y el tipo plexiforme. En los últimos años se han definido dos variantes de ameloblastoma menos frecuentes: el de células claras y el AD.
El AD fue descrito por primera vez por Eversole et al en 19841, si bien en la literatura japonesa, Takigawa et al en 19812 y Uji et al en 19833 ya habían hecho referencia a la existencia de un tipo poco frecuente de ameloblastoma intraóseo. Se trata, pues, de una variante bien definida de ameloblastoma intraóseo que posee unas características clínico-radiológicas e histológicas muy peculiares y diferentes del resto de los ameloblastomas, aunque, por el momento, la conducta terapéutica deba ser similar al AC.
Su incidencia oscila entre el 4 y el 14% de todos los ameloblastomas. La edad de afectación suele ser en la cuarta década de la vida, como este caso referido por nosotros, siendo algo superior la edad a la del AC, que es sobre la tercera década. Se presenta casi en la misma proporción en hombres y mujeres, tanto en mandíbula como en maxilar, y su localización es preferentemente en la región anterior de ambos maxilares4; esto lo diferencia claramente del AC que, como sabemos, tiene predilección por la mandíbula del varón en su zona posterior. En la revisión realizada por Waldron y el-Mofty en 1987, de un total de 116 ameloblastomas, el AD representa un 13% de todos los ameloblastomas intraóseos5.
El AD presenta unas imágenes radiológicas con límites relativamente bien definidos y con un patrón mixto, radiolúcido-radioopaco, que recuerda al presentado por las lesiones fibroóseas benignas, y que en nada se parece a las imágenes radiolúcidas, muchas veces multiloculadas, del AC. Kaffe et al6 estudiaron en 1993 las características radiológicas de 15 casos de AD y en todos ellos constataron este tipo de imagen mixta. El AD no suele asociarse a ninguna pieza retenida y debido a su crecimiento expansivo tiende a rechazar las piezas adyacentes. Por el contrario, el AC presenta un crecimiento invasivo y frecuentemente produce rizolisis de los dientes vecinos7
Existen numerosos estudios en la actualidad donde se pone de manifiesto la importancia de otras pruebas de imagen para el diagnóstico del AD. La resonancia magnética (RM), y más concretamente la RM con gadolinio, ha demostrado ser la prueba más útil para confirmar el presente diagnóstico8 Los hallazgos característicos consisten en una señal de intensidad intermedia en T1, señal de alta intensidad en T2 y captación de contraste en las porciones sólidas, mientras que las quísticas no presentan realce9.
La histología nos muestra un denso estroma muy colagenizado que comprime pequeños islotes o nidos celulares de epitelio odontogénico que pueden también presentar forma de cordón o de hebra. El epitelio no muestra diferenciación ameloblástica completa como en el AC. La proliferación fibroblástica y el abundante depósito de colágeno en el estroma confieren el carácter específico y el nombre al AD. Se han descrito formas híbridas en las que un patrón de AC se encuentra circunscrito en el seno de un AD. También existen otras formas híbridas de AC en las cuales se pueden observar intercaladas células basales, mucosas o de estructuras glandulares4,10,11.
Los hallazgos inmunohistoquímicos característicos del AD son la expresión variable de la desmina y de la proteina S-100. Sin embargo, la reactividad a la queratina es inconstante y no existe expresión de vimentina. El AD, en contraposición al resto de los ameloblastomas, muestra una fuerte reacción positiva para el colágeno tipo VI y marcada inmunoexpresión de factor de crecimiento transformante (TGF)-β. Algunos autores sugieren que el TGF-α producido por las células tumorales del AD desempeñan un papel importante en la formación de la prominente matriz desmoplásica4. Trabajos recientes muestran cómo el factor de necrosis tumoral (TNF)-α puede provocar tanto la apoptosis como la supervivencia o la proliferación celular en el ameloblastoma. Estudios mediante citómetro de flujo han demostrado que el TNF-α induce el proceso de supervivencia de las células ameloblásticas, pero cuando su tratamiento se prolonga hasta 24 horas el efecto es contrario, induciendo la apoptosis celular11.
Actualmente no existen los suficientes casos, ni un seguimiento prolongado de los mismos, como para asignar una agresividad mayor o menor a este tumor diferente de la del AC. Al carecer de cápsula y de límites precisos parece lógico que por el momento se mantengan los mismos criterios de radicalidad en su cirugía que los utilizados en el AC. Sin embargo, existe algún dato que pueda apuntar a un menor grado de recidiva, similar a la que presentan el ameloblastoma uniquístico o el periférico4.
ConclusionesEs importante destacar que el AD tiene de manera característica una semejanza radiológica con las lesiones fibroóseas benignas de los maxilares. El diagnóstico, por tanto, es necesariamente histológico. El presente caso ilustra de forma práctica la necesidad de realizar biopsia en este tipo de lesiones intraóseas de aspecto benigno antes de proceder a su tratamiento quirúrgico, que debe ser el mismo indicado para los ameloblastomas sólidos: extirpación por límites óseos libres de tumor.