El ameloblastoma es una neoplasia odontogénica que muestra un comportamiento agresivo local. Algunas variantes como la uniquística y la desmoplásica tienen un mejor pronóstico que la sólida/multiquística. Presentamos un caso en un varón de 76 años con una lesión radiolúcida interradicular mandibular de apariencia quística, la cual se enucleó quirúrgicamente. Histológicamente correspondió a una lesión desmoplásica con una amplia zona quística que fue diagnosticada como ameloblastoma desmoplásico con predominio quístico. Trascurridos 30 meses no se evidencia recidiva. En este artículo se discuten los principales aspectos clinicopatológicos de estas entidades.
Ameloblastoma is an odontogenic neoplasm with locally aggressive behavior. Some variants, like the unicystic or desmoplastic, have a better prognosis than solid/multicystic. The case is presented of a 76 year-old male, who suffered a mandibular interradicular radiolucent lesion of cystic appearance, which was surgically enucleated. Histologically, this was a desmoplastic lesion that exhibited a predominantly cystic area which was diagnosed as a desmoplastic ameloblastoma with cystic predominance. After 30 months of follow-up there are no signs of recurrence. The most important clinical and pathological features of these conditions are also discussed.
El ameloblastoma es una neoplasia polimórfica benigna de origen odontogénico que suele presentar un comportamiento localmente agresivo. Se han descrito diferentes tipos de ameloblastomas, siendo el tipo sólido/multiquístico (ASM) el más común y el que presenta un comportamiento más agresivo1,2. El ameloblastoma uniquístico (AU) constituye una variante clinicopatológica específica con un mejor pronóstico. Más del 90% de los AU aparecen en la mandíbula y, en los casos asociados a un diente incluido, la edad media es de 16 años, mientras que en los no asociados esta es algo mayor3,4. Existen 3 variantes histopatológicas del AU: a) luminal, b) intraluminal y c) mural4.
El ameloblastoma desmoplásico (AD) es un tipo raro y controvertido de ameloblastoma, que radiográficamente aparece frecuentemente como una lesión mixta de bordes mal definidos5,6. Aunque se considera que el AD es una lesión central, se han descrito casos de AD extraóseo7. Histopatológicamente se caracteriza por una gran cantidad de estroma colagénico denso con pequeños nidos y cordones ameloblásticos comprimidos5. Aunque en algunos casos se ha visto la presencia de áreas quísticas, no se ha descrito que el componente quístico sea predominante en este tipo de tumores6.
El tratamiento de los ameloblastomas es quirúrgico, existiendo controversia sobre la amplitud de la cirugía en algunos como el AU1–3. Bajo esquemas terapéuticos similares, el pronóstico general de los uniquísticos es mejor que el de los sólidos, con una tasa de recidiva del 10-25% frente a más del 50% en estos últimos2,4. El comportamiento biológico del AD permanece sin caracterizar, aunque parece tener un comportamiento menos agresivo e invasivo, con una tasa de recurrencia menor que el sólido7,8. Hay pocas referencias sobre el tratamiento y el pronóstico del AD, aunque en general se recomienda seguir la misma modalidad de tratamiento que para los sólidos9–11.
En este trabajo presentamos un caso clínico de AD que se presentó como una lesión radiolúcida interradicular y que histológicamente mostraba aspectos particulares con un predominio quístico. Se discuten sus principales datos clinicopatológicos así como su diagnóstico diferencial.
Caso clínicoVarón de 76 años, que acude a consulta odontológica rutinaria y refiere problemas en la inserción de su prótesis parcial inferior. El paciente padece diabetes tipo II, hipertensión arterial, cardiopatía no filiada e hipercolesterolemia y está en tratamiento con metformina, nifedipino, bisoprolol fumarato, ácido acetilsalicílico, citicolina, atorvastatina y amlopidino. A la exploración intraoral se reconoce un ligero abombamiento mandibular por lingual del área del 3.4 y 3.5, sin dolor a la palpación, ni a la percusión.
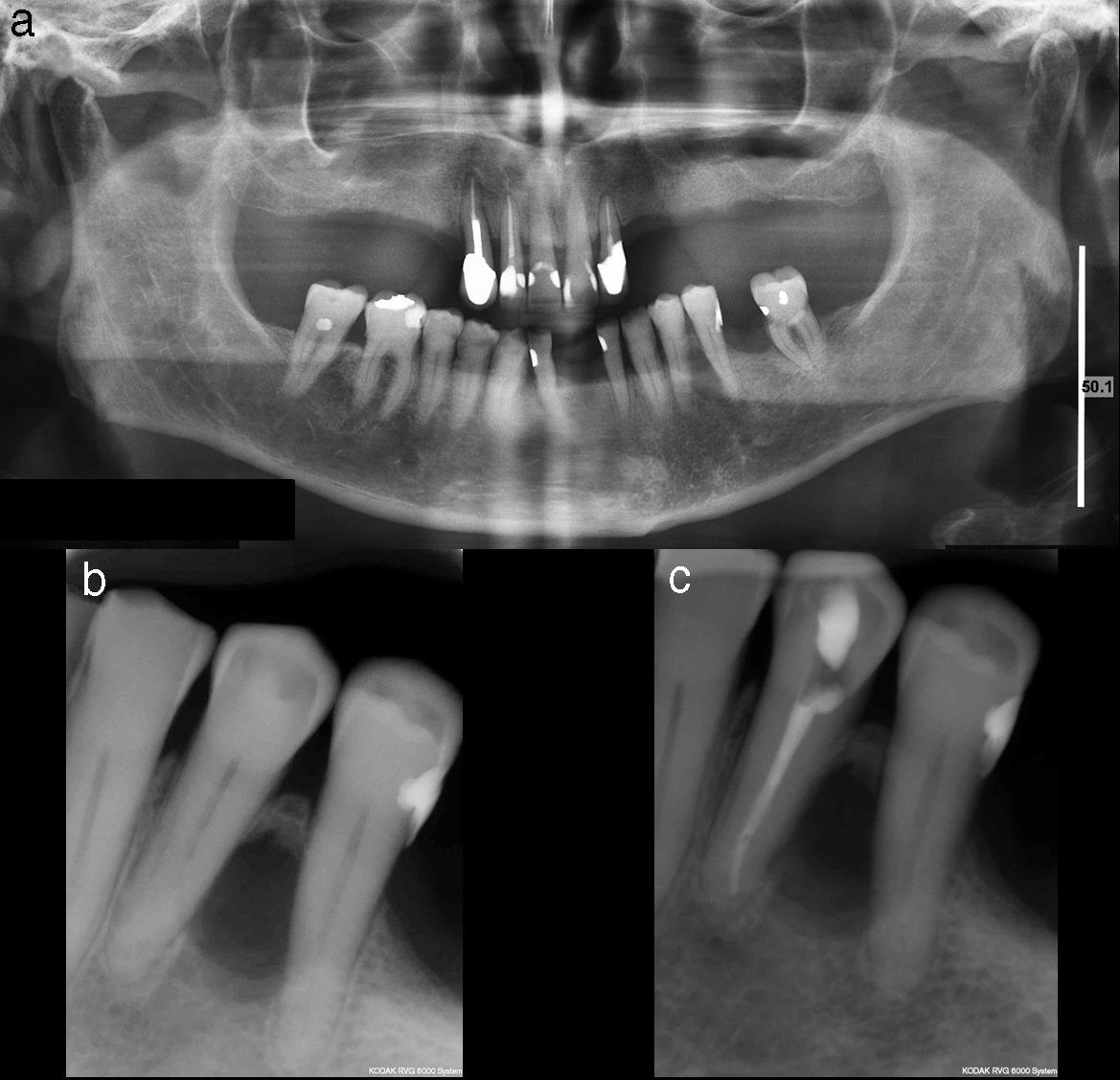
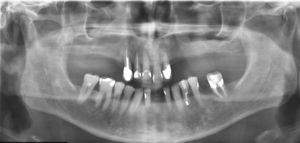
El examen radiológico muestra una lesión radiolúcida, única, ovalada de bordes bien definidos, localizada entre las raíces del 3.4 y 3.5 (fig. 1a y b). Se realiza test de vitalidad pulpar en los dientes adyacentes, siendo negativo para el 21 (3.4). Se realiza el tratamiento endodóncico de ese diente, con el diagnóstico clínico presuntivo de periodontitis periapical crónica secundaria a necrosis pulpar o quiste radicular lateral (fig. 1c).
Trascurridos 2 meses, y al no observar cambios radiológicos ni clínicos aparentes tras el tratamiento endodóncico, se decide extirpar la lesión. Bajo anestesia local se procede a la enucleación quirúrgica de una lesión de apariencia quística, complementada con un curetaje cuidadoso de la zona, apicectomía del 21 (3.4) y obturación retrógrada. En la cirugía se observó que la lesión quística había reabsorbido la cortical ósea lingual.
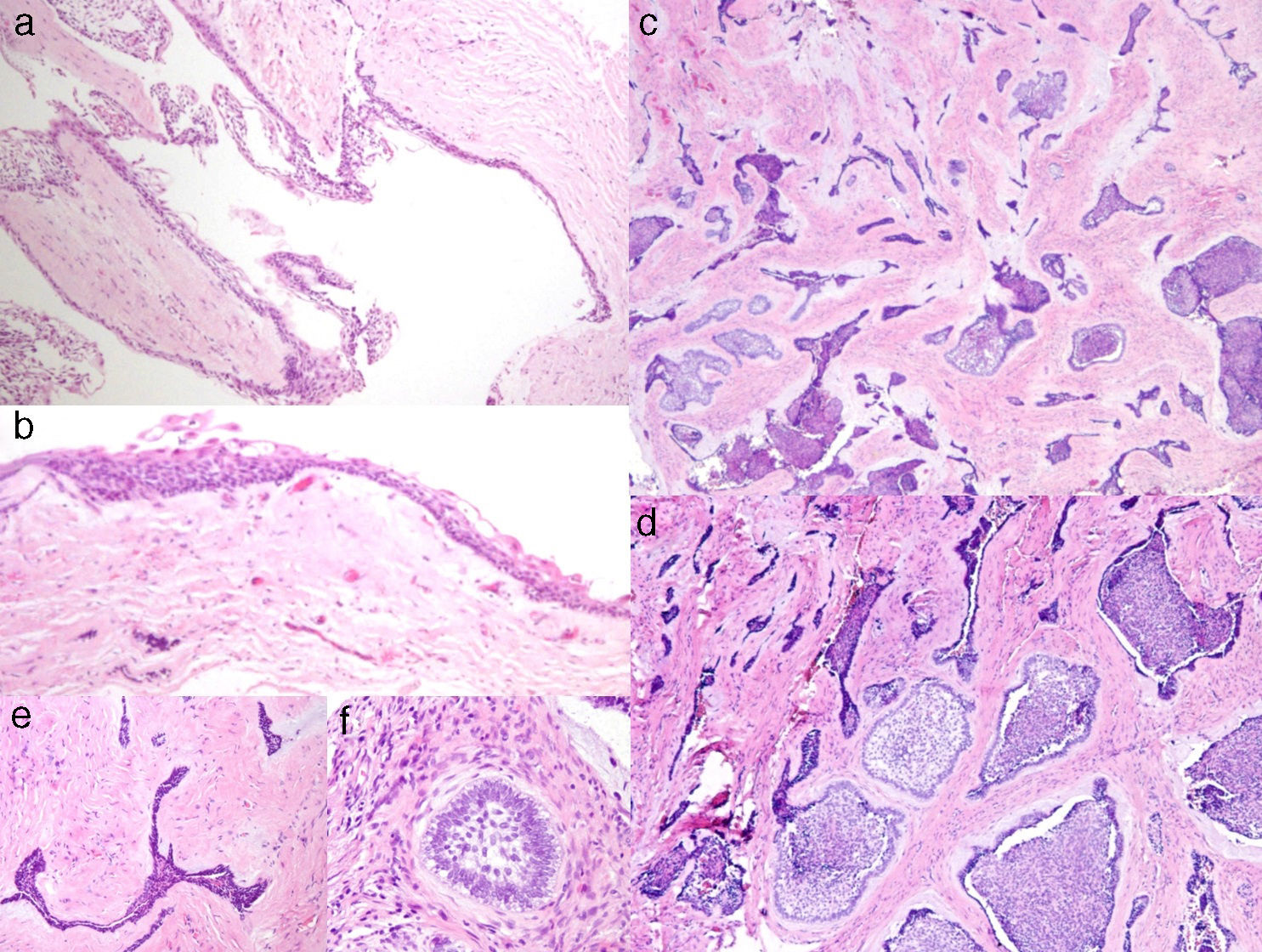
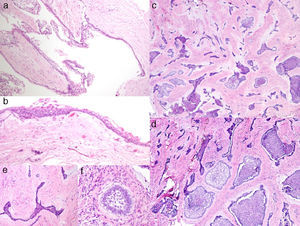
El estudio histopatológico mostró una lesión quística con una pared fibrosa densamente colagenizada, revestida por un epitelio poliestratificado no queratinizado (fig. 2a y b). Focalmente se observaba en la pared una proliferación tumoral epitelial que formaba nidos y cordones rodeados por un estroma fibroso denso (fig. 2c y 2d). En algunos nidos se identificaba una disposición ameloblástica con células cilíndricas polarizadas en la periferia y con una disposición más laxa central, semejando al retículo estrellado, mientras que en otros solo se reconoce un epitelio estrechado (fig. 2e y f). Con todo ello el diagnóstico clinicopatológico final fue de AD con predominio quístico.
a) Área quística con recubrimiento epitelial y cápsula conectiva fibrosa (H&E 10X); b) detalle del la zona quística con recubrimiento epitelial delgado no queratinizado (H&E 30X); c) islas y cordones epiteliales en un estroma conectivo fibroso (H&E 10x); d) detalle del componente epitelial ameloblástico con diferente disposición (H&E 20x); e) cordón epitelial «desmoplásico» con bordes agudos (H&E 40x); f) pequeño nido ameloblástico (H&E 40x).
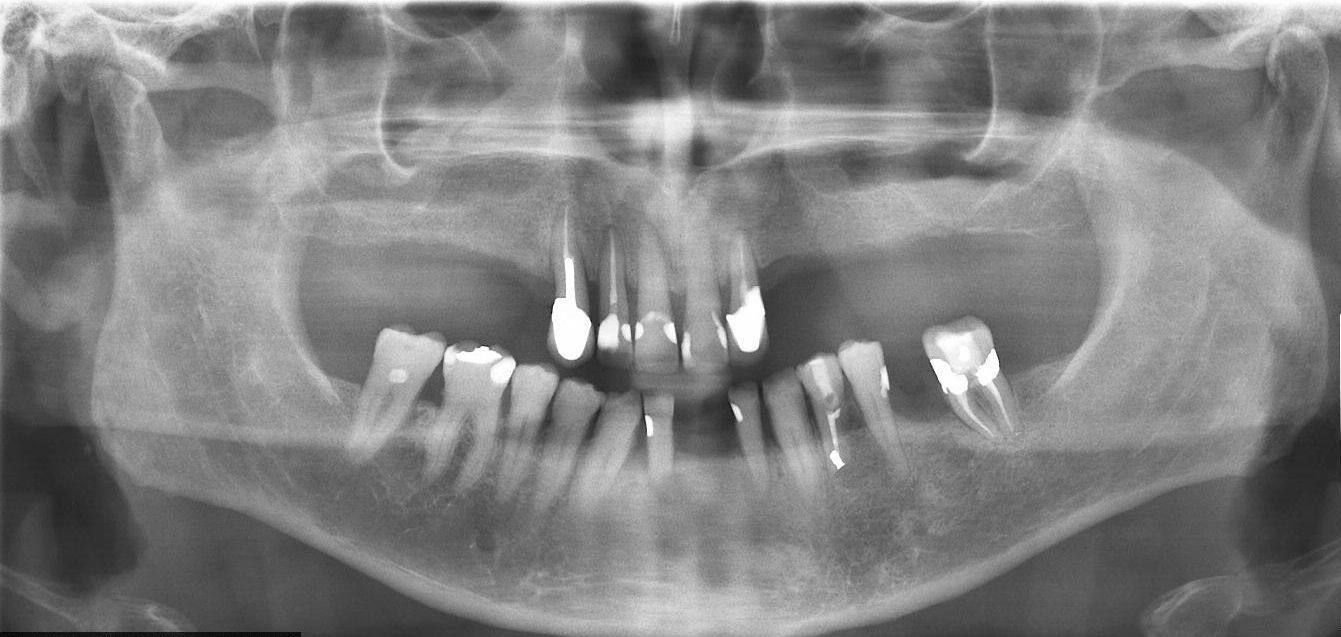
En las revisiones periódicas durante los 30 meses tras la extirpación, no se evidencian signos clínicos ni radiográficos de recidiva de la lesión (fig. 3). El paciente está siendo controlado actualmente cada 6 meses.
DiscusiónEl AD es una variante rara del ameloblastoma con características clínicas, radiológicas e histológicas específicas4. Se localiza con más frecuencia en la zona anterior mandibular y representa solo entre el 4 y el 13% del total de los ameloblastomas5. Se han identificado fibras de oxitalan en el estroma de estos tumores, lo que podría indicar que derivan de los restos epiteliales de Malassez del ligamento periodontal6,12.
El AU constituye otra variante clinicopatológica de ameloblastoma, que representa entre el 5 y el 22% del total4,9, aunque existen evidencias que sugieren que este subtipo histológico es el más frecuente en población latinoamericana13. Existe controversia respecto a su origen ya que se ha señalado que puede derivar del epitelio reducido del esmalte, del epitelio de revestimiento de algunos quistes dentígeros u otro tipo de quistes odontogénicos o incluso del ameloblastoma sólido, aunque la hipótesis más aceptada es que se trata de una neoplasia que se origina de novo y no de alguna lesión preexistente14. El AU aparece en general en pacientes jóvenes y es raro en personas de edad avanzada, como ocurre en nuestro caso. La región posterior de la mandíbula es el lugar de aparición más frecuente y generalmente está asociado a un diente retenido, sobre todo al tercer molar mandibular (50-80%)2,4.
El caso que presentamos es clínicamente atípico para ser considerado como AU, tanto por su localización como por su disposición interradicular y por la edad avanzada del paciente. En un primer momento consideramos, debido al aspecto predominantemente quístico de la lesión, que podría tratarse de un AU con un largo tiempo de evolución, y que los cambios en el estroma habían sido inducidos o acentuados por un proceso inflamatorio crónico preexistente. Sin embargo, la morfología irregular y de bordes afilados de muchas de las islas y de los cordones epiteliales presentes en el tejido conectivo colagenizado sugieren más que se trata de un AD. Característicamente las células epiteliales de la periferia de estas islas son cuboidales o aplanadas, ocasionalmente con núcleos hipercromáticos y en el centro presentan un aspecto arremolinado e hipercelular5,9. Uniendo todos los datos clínicos, radiológicos e histopatológicos de nuestro caso, consideramos que se corresponde más con un «AD con componente quístico central», que con un «AU con diferenciación mural desmoplásica», variante no descrita y que teóricamente podría presentarse de ese modo. Nuestro caso sería similar a los descritos por Kawai et al.7 y por Mahadesh et al.15. La importancia de uno u otro diagnóstico reside en el hecho que hasta ahora se ha considerado que la variante uniquística es la que presenta un mejor pronóstico, y que aunque se conoce poco sobre el pronóstico real del desmoplásico, se ha propuesto que debe ser manejado de manera similar a la forma sólida, es decir más agresivamente9–11.
Radiológicamente, nuestro caso es particular por su disposición como una lucidez interradicular, en comparación con el AD habitual que se suele presentar como una imagen mixta mal definida que puede producir reabsorción radicular e inducir formación ósea, siendo la localización de aparición más frecuente la región anterior o premolar de los maxilares, como ocurre en nuestro caso10,12.
El diagnóstico diferencial clínico, en nuestro caso, se realizó con todas las lesiones que pueden aparecer como una radiolucidez interradicular, comenzando por los quistes odontogénicos inflamatorios (quiste radicular), los de desarrollo (quiste periodontal lateral) y las neoplasias odontogénicas como el tumor odontogénico queratoquístico, el ameloblastoma o el mixoma, u otras no odontogénicas más infrecuentes16.
Se considera que el AD tiene un comportamiento biológico menos agresivo que el sólido7, y aunque se han publicado pocos casos de recurrencia de AD, la mayoría de ellos fueron tratados únicamente con enucleación y curetaje. Por ello se señala que se debería tratar el AD del mismo modo que el sólido10–12. En nuestro caso el tratamiento fue conservador con enucleación y curetaje cuidadoso de toda la lesión y trascurridos 30 meses tras la cirugía, no hemos observado recidiva. El paciente está siendo revisado cada 6 meses.
Como conclusiones de este caso clinicopatológico particular podemos señalar que el AD debe ser considerado en el diagnóstico diferencial de las lesiones radiolúcidas interradiculares junto a otras lesiones odontogénicas y que algunos casos de esta variante de ameloblastoma pueden presentar un componente quístico importante y simular un AU.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.