Los bifosfonatos constituyen una familia de medicamentos cuya acción principal es la inhibición de la reabsorción ósea, uno de cuyos efectos secundarios es la osteonecrosis maxilar (OMAB). En 2010 comenzaron a publicarse casos de osteonecrosis asociados a un nuevo fármaco, el denosumab. En 2014 se recomendó cambiar el nombre de OMAB por osteonecrosis maxilar asociada a medicamentos (OMAM). El objetivo de este trabajo es revisar una serie de casos de OMAM tratados en nuestro servicio y reflejar la experiencia adquirida con las distintas opciones terapéuticas según la clasificación clínica definida por la American Association of Oral and Maxillofacial Surgeons (AAOMS).
Materiales y métodosSe recogió retrospectivamente un grupo de 19 pacientes con diagnóstico de OMAM, manejados desde 2005 hasta 2015. Su estadio fue determinado según la clasificación de la AAOMS y Ruggiero. Las lesiones fueron tratadas según sus características clínicas y radiológicas.
ResultadosSu edad media fue de 75 años. La enfermedad de base era osteoporosis en 11 pacientes (58%), cáncer de próstata en 2 (11%), cáncer de mama en otrod 2 (11%) y mieloma múltiple en 4 pacientes (20%). En 9 pacientes el bifosfonato utilizado era intravenoso (47%); en los 4 restantes se usó la vía oral (alendronato e ibandronato, 21%) y el denosumab se administra por vía subcutánea. Los pacientes en estadio 3 fueron tratados en todos los casos con mandibulectomía segmentaria. Tres de ellos fueron reconstruidos con colgajo microquirúrgico de peroné y uno con barra mandibular más cierre directo. Fueron tratados mediante secuestrectomía 7 pacientes, de los cuales 5 tenían estadio 2 y 2 tenían estadio 1. Con desbridamiento local solo fue tratado un paciente, que presentaba estadio 1. El tratamiento conservador se aplicó al resto de los pacientes estadio 1 (4 pacientes) y a 3 pacientes del estadio 2.
ConclusionesEl tratamiento de la OMAM depende del estadio de la enfermedad; la mandibulectomía es un tratamiento efectivo en el estadio 3 y la secuestrectomía en el estadio 2; el estadio 1 suele controlarse con tratamiento conservador.
Bisphosphonates are a family of drugs used to inhibit bone resorption. One of their secondary effects is osteonecrosis of the jaws (ONJ). In 2010, scientists began to publish cases of osteonecrosis of the jaws associated with a new drug, denosumab. In 2014 it was recommended to change the name of ONJ to medication-related osteonecrosis of the jaws (MONJ). The aim of this article is to review a case series of MONJ treated in our Department, and present our experience in the different treatment options according to the clinical classification defined by the American Association of Oral Maxillofacial Surgeons (AAOMS).
Materials and methodsA retrospective review was performed on 19 patients with MONJ, who were managed between 2005 and 2015. The clinical staging was according to the classification of the AAOMS and Ruggiero. The lesions were treated according to their clinical and radiological presentation.
ResultsThe mean age was 75 years. The underlying disease was osteoporosis in 11 patients (58%), prostate cancer in 2 patients (11%), breast cancer in 2 patients (11%), and multiple myeloma in 4 patients (20%). Intravenous bisphosphonates were used in 9 (47%) patients, and oral in the remaining 4 (alendronate and ibandronate, 21%), with denosumab being administered subcutaneously. Stage 3 patients were treated in all cases with segmental mandibulectomy. Three of them were re-constructed with a microsurgical fibula flap, and onw with bar and direct closure. Sequestrectomy was used to treat 7 patients, of which 5 had stage 2, and 2 stage 1. One patient with stage 1 was treated with local debridement. Conservative treatment was applied to the rest (4) of the stage 1 patients, and 3 stage 2 patients.
DiscussionMandibulectomy is an effective treatment for stage 3, sequestrectomy for stage 2, and conservative measures for stage 1. This pathology is also associated with other drugs, such as denosumab, which is why the term had changed to medication-related osteonecrosis of the jaw.
ConclusionsMONJ treatment depends on the stage of the disease, with mandibulectomy being an effective treatment in stage 3, sequestrectomy in stage 2 and stage 1 is usually controlled with conservative treatment.
Los bifosfonatos (BF) constituyen una familia de medicamentos cuya acción principal es la inhibición de la reabsorción ósea1. Pueden ser administrados por vía oral o intravenosa. En el primer caso, la vía oral, menos del 1% de la dosis oral es absorbida en condiciones ideales2. Los BF orales se prescriben frecuentemente para el tratamiento de la osteoporosis y otras enfermedades como la de Paget. Los intravenosos se usan para el tratamiento del mieloma múltiple, la hipercalcemia maligna y las metástasis óseas3. Uno de los efectos secundarios identificados de los BF utilizados de forma prolongada es la osteonecrosis maxilar asociada a BF (OMAB), descrita por primera vez en 20034, y que aparece con mayor incidencia en los BF administrados por vía intravenosa1,5.
La incidencia de OMAB se sitúa en torno al 5-10% en pacientes oncológicos tratados con BF, aunque varía según las series y la potencia del fármaco6. Los principales factores de riesgo son la realización de procedimientos quirúrgicos en la cavidad oral, el uso de prótesis mucosoportadas, así como la presencia de periodontitis y un tiempo de tratamiento con BF prolongado7.
En 2010, al poco de su introducción en la clínica, comenzaron a publicarse casos de osteonecrosis debidos al nuevo fármaco, conocidos como inhibidores de los receptores activadores del factor nuclear kappa B ligando (RANKL): el denosumab8, que fue aprobado para el tratamiento de la osteoporosis y de las metástasis óseas del cáncer de mama y de próstata9. Es un anticuerpo monoclonal con un gran efecto antirresortivo al inhibir el RANKL de los osteoclastos y posee un efecto terapéutico similar a los BF.
Debido al aumento en la prevalencia de casos de osteonecrosis en pacientes que son tratados con otros fármacos antirresortivos y antiangiogénicos distintos a los BF, la American Association of Oral and Maxillofacial Surgeons (AAOMS) en 2014 recomendó cambiar el nombre de OMAB por osteonecrosis maxilar asociada a medicamentos (OMAM)10.
El objetivo de este trabajo es revisar una serie de casos de OMAM tratados en nuestro servicio y reflejar la experiencia adquirida con las distintas opciones terapéuticas según la clasificación clínica definida por la AAOMS10.
Material y métodosSe recogió retrospectivamente a un grupo de pacientes tratados en el Hospital Universitario de La Princesa que presentaron lesiones maxilares asociadas al uso de fármacos antirresortivos como los BF y el denosumab desde 2005 hasta 2015. Se incluyó a los pacientes que tenían en su historia clínica la información sobre sexo, edad, enfermedad de base, antecedentes de cirugía oral, estadio, la presencia de fístulas o fracturas, tipo de fármaco utilizado, su duración, vía de administración y evolución de la necrosis. Se excluyó a los que no tenían recogidas esas variables.
El diagnóstico de OMAM se estableció según la AAOMS10 en pacientes con las siguientes características:
- -
Tratamiento actual o previo con fármacos antirresortivos o antiangiogénicos.
- -
Exposición ósea o fístula intra- o extraoral en la región maxilofacial persistente más de 8 semanas.
- -
Ausencia de antecedentes de radioterapia o metástasis ósea en los maxilares.
La misma AAOMS define los siguientes grados o estadios:
- •
Grado 0. No hay exposición de hueso necrótico pero hay síntomas clínicos inespecíficos. (Dolor sin causa aparente).
- •
Grado 1. Exposición de hueso necrótico, asintomático y sin signos de infección aguda.
- •
Grado 2. Exposición de hueso necrótico asociado a dolor y signos de infección.
- •
Grado 3. Exposición de hueso necrótico asociado a dolor, signos de infección, fístula cutánea y evidencia clínica o radiográfica de secuestro óseo u otra complicación (como fracturas).
Inicialmente todos pacientes fueron tratados de forma conservadora, suprimiendo el fármaco, retirando las prótesis mucosoportadas e implementando las medidas de higiene oral con clorhexidina tópica y antibioterapia empírica en algunos casos.
Además, según la gradación de cada uno de los casos, se manejaron de la siguiente forma: en el grado 1 solo se aplicó el tratamiento básico más antibioterapia empírica (incluidos los estadios 0 con dolor sin causa aparente). En la OMAB grado 2 se toma cultivo y realizamos el mismo tratamiento que en el estadio 1, asociando ciclos de tratamiento antibiótico empírico con amoxicilina-clavulánico (875/125mg) cada 8 h durante 10-15 días hasta la desaparición de los signos agudos de infección. Además, en este estadio la exposición ósea que no mejora la tratamos mediante legrado y extirpación de los secuestros hasta obtener hueso sangrante. El estadio 3 fue tratado mediante antibioterapia de larga duración durante 3-4 semanas. Si la situación del paciente lo permite y no hay clara mejoría, se realiza resección de la necrosis con reconstrucción, ya sea mediante colgajos microquirúrgicos ya sea con barra de reconstrucción mandibular, en especial cuando se produce fractura o no se controla la clínica infecciosa del paciente. Los casos de alergia a penicilinas los tratamos con clindamicina o levofloxacino y siempre que es posible realizar cultivo y antibiograma.
Los pacientes fueron seguidos clínica y radiológicamente, mediante ortopantomografía (OPG) o tomografía computarizada cada 3 meses o ante cualquier eventualidad clínica durante 2 años. Durante el seguimiento se valoró la curación ósea (definida como la desaparición de la exposición ósea sin clínica asociada y mejoría confirmada radiológicamente), la disminución o aumento de la exposición ósea, la aparición de episodios infecciosos-inflamatorios agudos, la duración de los episodios y la presencia de otras complicaciones asociadas.
ResultadosSe recogió a un total de 19 pacientes con las variables estudiadas que presentaron OMAM desde 2005 hasta 2015. Su edad media fue de 75 años (rango 52-93), con 6 pacientes varones (32%) y 13 mujeres (68%). La enfermedad de base era osteoporosis en 11 pacientes (58%), cáncer de próstata en 2 pacientes (11%), cáncer de mama en 2 pacientes (11%) y mieloma múltiple en 4 pacientes (20%) (tabla 1). En 9 pacientes el BP utilizado era intravenoso (47%), en los 4 restantes se usó la vía oral (alendronato e ibandronato, 21%) y el denosumab se usa de forma subcutánea.
Descripción de los 19 pacientes con OMAM
| Paciente: sexo/edad | Enfermedad de base | Antecedente de cirugía oral | Estadio | Lugar de afectación | Fístula | Tipo de BF | Vía de administración | Duración de tratamiento con BF | Tratamiento médico |
|---|---|---|---|---|---|---|---|---|---|
| 1: M/83 | Osteoporosis | Sí | 1 | Mandibular posterior | No | Ibandronato | VO | 5 años | Conservador |
| 2: V/82 | Osteoporosis | Sí | 1 | Mandibular posterior | No | Ac. zoledrónico | IV | 5 años | Secuestrectomía |
| 3: M/87 | Osteoporosis | Sí | 2 | Mandibular posterior | No | Ibandronato | VO | 1 año | Secuestrectomía |
| 4: V/67 | Cáncer de próstata | No | 3 | Mandibular posterior | Sí | Ac. zoledrónico | IV | 1 año | Mandibulectomía+peroné |
| 5: M/93 | Osteoporosis | Sí | 2 | Mandibular posterior | No | Ibandronato | IV | 2 años | Secuestrectomía |
| 6: M/72 | ca de mama | No | 2 | Maxilar posterior | Sí | Ac. zoledrónico | IV | 1 año | Secuestrectomía |
| 7: V/57 | Mieloma múltiple | No | 2 | Mandibular posterior | No | Ac. zoledrónico | IV | 1 año | Secuestrectomía |
| 8: V/86 | Mieloma múltiple | Sí | 3 | Mandibular posterior | No | Ac. zoledrónico | IV | 2 años | Mandibulectomía segmentaria+barra |
| 9: M/89 | Osteoporosis | No | 2 | Maxilar anterior | No | Alendronato | VO | 2 años | Sequestrectomía |
| 10: M/60 | Mieloma múltiple | No | 1 | Maxilar posterior | No | Ac. zoledrónico | IV | 1 año | Desbridamiento |
| 11: M/67 | Osteoporosis | Sí | 1 | Mandibular posterior | No | Alendronato | VO | 2 años | Conservador |
| 12: M/57 | Cáncer de mama | Sí | 3 | Maxilar anterior | Sí | Ac. zoledrónico | IV | 2 años | Mandibulectomía+peroné |
| 13: M/52 | Mieloma múltiple | No | 3 | Mandibular posterior | Sí | Ac. zoledrónico | IV | 5 años | Mandibulectomía+peroné |
| 14: M/78 | Osteoporosis | Sí | 2 | Mandibular anterior | Sí | Denosumab | SC | 5 años | Conservador |
| 15: V/60 | Cáncer de próstata | No | 2 | Maxilar anterior | Sí | Denosumab | SC | 2 años | Conservador |
| 16: M/80 | Osteoporosis | Sí | 1 | Maxilar anterior | No | Denosumab | SC | 2 años | Conservador |
| 17: M/93 | Osteoporosis | No | 1 | Mandibular anterior | No | Denosumab | SC | 6 años | Conservador |
| 18: V/82 | Osteoporosis | Sí | 1 | Mandibular posterior | No | Denosumab | SC | 2 años | Secuestrectomía |
| 19: M/83 | Osteoporosis | No | 2 | Mandibular posterior | No | Denosumab | SC | 2 años | Conservador |
El ácido zoledrónico fue el fármaco más utilizado (8 pacientes; 42%), a continuación el denosumab en 6 casos (32%), en 3 casos (16%) el ibandronato y en 2 (11%) el alendronato. Entre los casos de denosumab, 2 de ellos habían tomado BF previamente. En cuanto a la duración del tratamiento, antes del diagnóstico de OMAM, 4 pacientes (21%) recibieron el fármaco durante 5 años, 9 (47%) durante 2 años, otros 5 (27%) durante un año y solo uno (5%) durante 6 años (tabla 1).
En 11 casos (58%) se pudo identificar un factor local desencadenante de la osteonecrosis (exodoncia, implantes) frente a 8 pacientes (42%) de aparición espontánea (5 de ellos eran portadores de prótesis removibles mucosoportadas).
En cuanto a la localización de la osteonecrosis, afectaba a la región mandibular posterior en 11 casos (58%), a la mandíbula anterior en 2 (10%), al maxilar anterior en 5 (26%) y al maxilar posterior en 1 (5%).
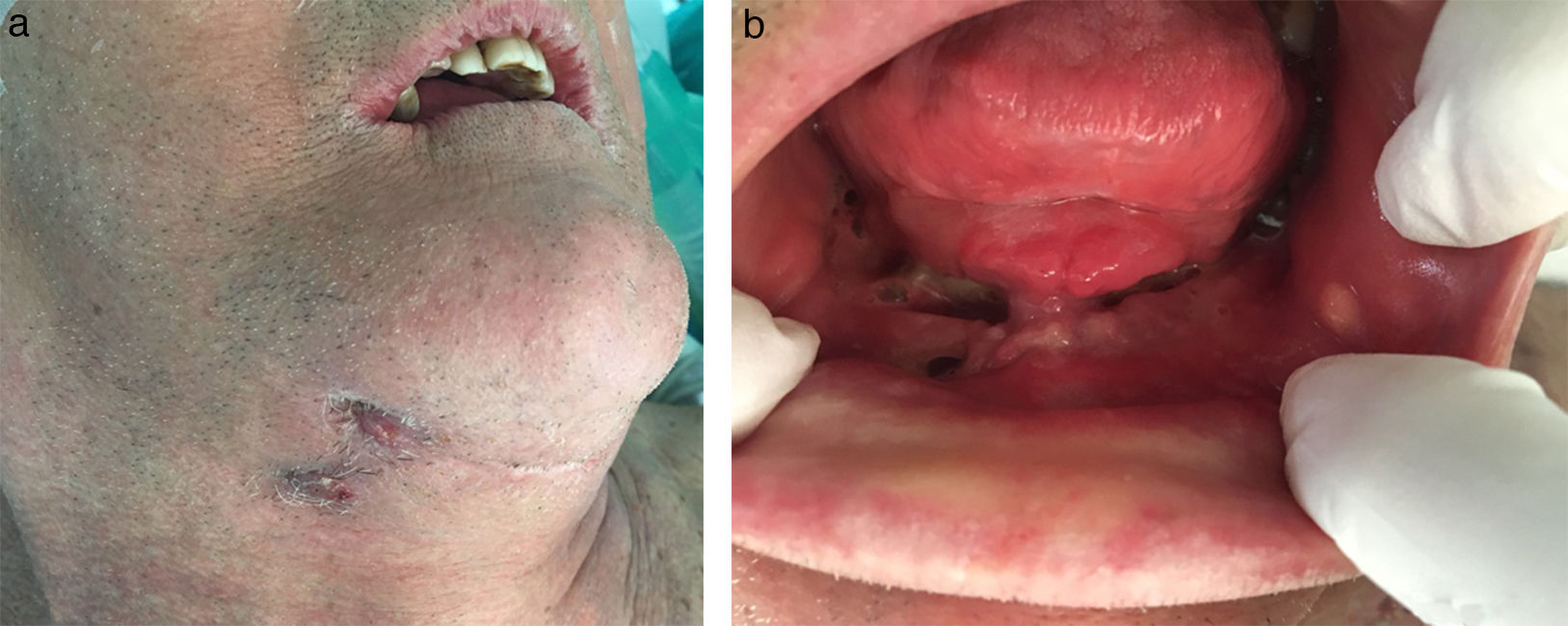
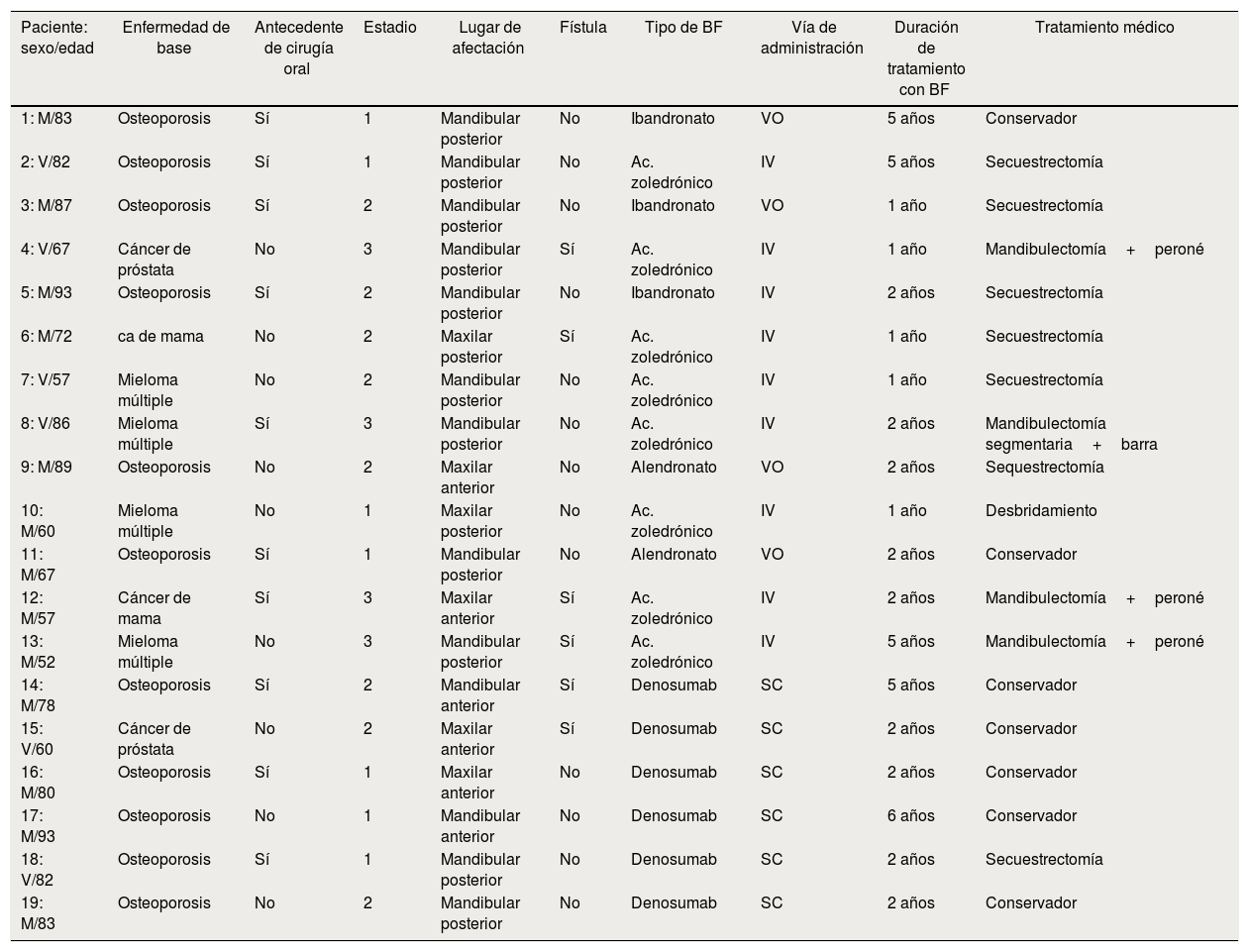
Solamente 6 pacientes tenían fístulas (32%) (fig. 3 a-b, tabla 1).
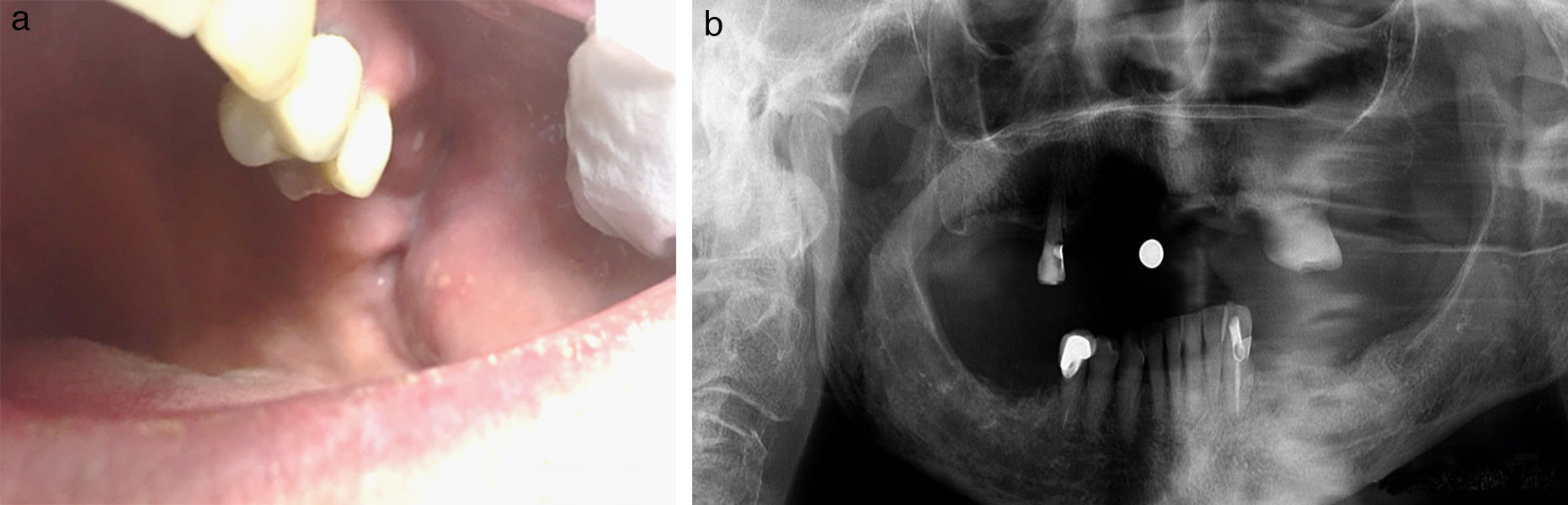
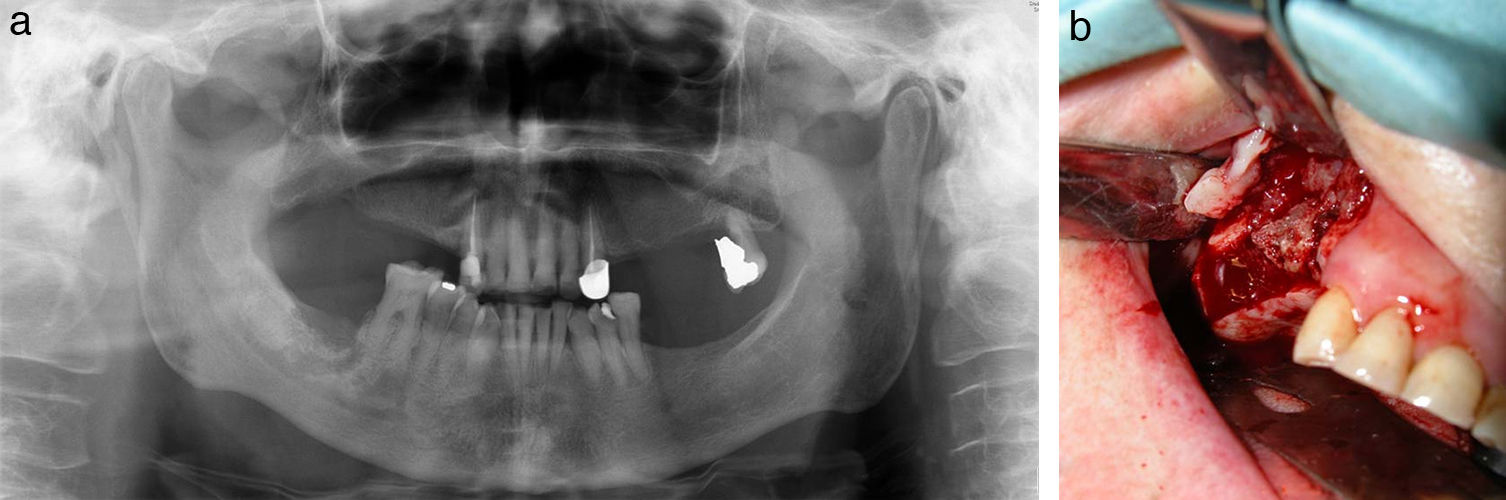
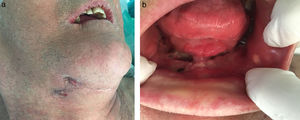
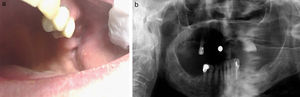
Hubo 7 pacientes en estadio 1 (37%) (fig. 1 a-b), 8 en estadio 2 (42%) (fig. 2a-b) y 4 en estadio 3 (21%) (fig. 2 c).
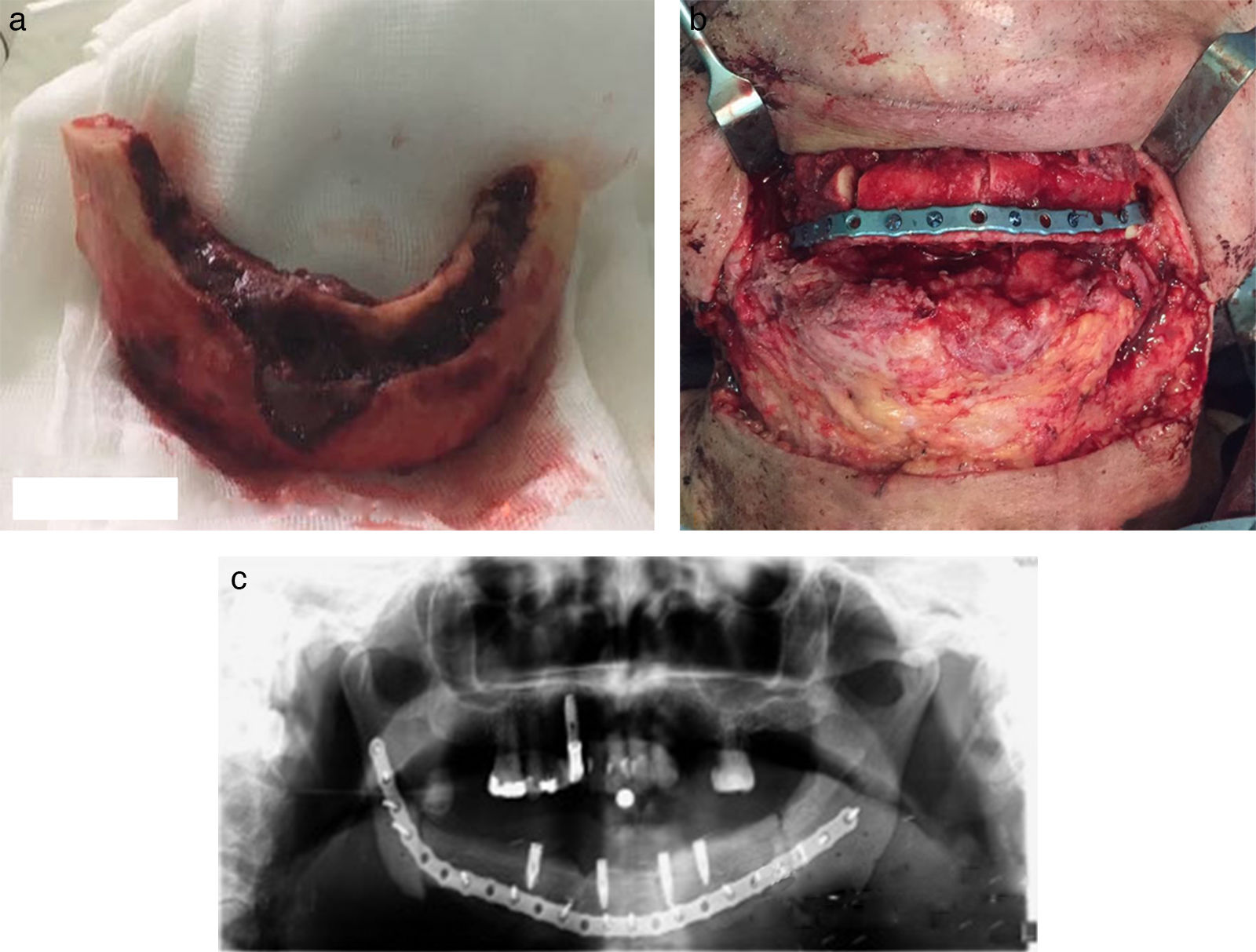
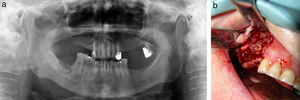
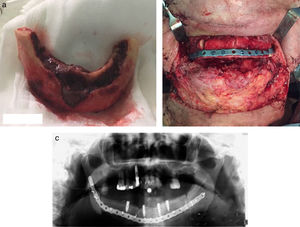
Los pacientes en estadio 3 fueron tratados en todos los casos con mandibulectomía segmentaria. Tres de ellos fueron reconstruidos con colgajo microquirúrgico de peroné (fig. 4 a-c), y uno con barra mandibular más cierre directo. Fueron tratados mediante secuestrectomía 7 pacientes, de los cuales 5 tenían estadio 2 y 2 estadio 1. Con desbridamiento local solo fue tratado un paciente que presentaba estadio 1. El tratamiento conservador se aplicó al resto de los pacientes en estadio 1 (4 pacientes) y a 3 pacientes del estadio 2.
SeguimientoEstadio 1 (7 casos). En 6 de ellos la exposición ósea desapareció antes de 12 meses con tratamiento conservador, sin presentar ninguna complicación. Un paciente evolucionó a estadio 2 al cabo de 6 meses y fue exitosamente tratado con secuestrectomía, sin presentar recidiva tras 2años.
Estadio 2 (8 casos). De ellos, 5 tratados con secuestrectomía mejoraron del dolor a las 3 semanas y persistió la exposición ósea 2 meses. Los otros 3 pacientes tratados de forma conservadora presentaron mejoría del dolor a las 6 semanas con cierre de la lesión a los 8 meses; no hubo recidiva al cabo de 20 meses de seguimiento.
Estadio 3. (4 casos). El paciente tratado con mandibulectomía segmentaria y barra de titanio presentó una infección a los 8 meses que obligó a retirarla. Tres meses después se volvió a fijar con otra barra, que no presentaba más complicaciones tras 24 meses. Los otros 3 pacientes tratados con mandibulectomía segmentaria y reconstrucción con colgajo de peroné evolucionaron satisfactoriamente. Dos de ellos fueron rehabilitados con implantes dentales 6 meses después. El otro usa prótesis removible. Ninguno ha registrado complicaciones al cabo de 12 meses.
DiscusiónDesde la primera información bibliográfica sobre la OMAB realizada y publicada por Marx en 20034, se han venido sucediendo publicaciones que recogen diferentes series de casos con información sobre patogenia, prevención, tratamiento y origen de esta entidad1,3,7,11,12. Las recomendaciones se basan fundamentalmente en consensos de expertos y en publicaciones de series de casos retrospectivos, lo que limita, por tanto, sus niveles de evidencia2,6,9,10,13,14. Las primeras pautas de tratamiento fueron expuestas por Marx15. Fueron modificadas en 2014, por consenso de la AAOMS10, cuando se propone el cambio de denominación de OMAB por OMAM, debido a los casos de osteonecrosis de los maxilares reportados con el uso de otros fármacos antirresortivos diferentes a los BF.
La patogénesis de la OMAM asociada a agentes antirresortivos no está completamente definida, a pesar de las publicaciones que tratan de explicarla. Se ha establecido la hipótesis de que una inhibición exagerada de la osteoclastogénesis así como una disminución del recambio óseo y de la angiogénesis, añadido a un daño tisular macrofágico, podrían desencadenar el desarrollo de la osteonecrosis5,16,17.
El riesgo de desarrollar OMAM por terapia oral es menor que su administración vía intravenosa11 o subcutánea en el caso de denosumab8,9, como hemos visto en nuestros resultados, en los que en el 89% de los pacientes su administración fue intravenosa (o subcutánea para el denosumab). El ácido zoledrónico (intravenoso) es el fármaco más frecuentemente asociado con OMAM, seguido del denosumab (subcutáneo) y del alendronato (oral). La potencia del ácido zoledrónico y su alto nivel de incorporación ósea cuando se administra parenteralmente justifican estos datos. En el caso del alendronato, la explicación es más controvertida13,12. Existe mucha heterogeneidad en cuanto al riesgo de aparición de la OMAM con relación a variables como la duración del tratamiento, dosis del fármaco, asociación de fármacos como corticoides6, lo que dificulta la comparación. Esto último es más evidente para el denosumab, ya que algunos pacientes habían tomado previamente BF, además de tener menor recorrido en su uso.
En el momento del diagnóstico, el estadio más frecuente en nuestra serie es el 2 al igual que los diferentes trabajos revisados14,18,19. Como en otros estudios, la mandíbula en nuestra serie se afecta más que el maxilar en una relación de 13 a 6, en especial la región posterior.
A lo largo de los últimos años ha habido diferentes actualizaciones sobre la OMAM, sin embargo, no existe un protocolo de prevención efectivo y faltan estudios prospectivos. En nuestro país, la Sociedad Española de Cirugía Oral y Maxilofacial (SECOM)19 publicó en 2008 un protocolo de actuación que no ha sido actualizado, como hizo la AAOMS en 201410. Más de la mitad de nuestros casos tienen una factor dental desencadenante. Es, por lo tanto, mandatorio, como recomienda la American Dental Association, antes de iniciar el tratamiento con agentes antirresortivos, llevar a cabo una revisión odontológica previa que elimine los factores predisponentes: enfermedad periodontal, prótesis removibles mal ajustadas, necesidad de extracciones8,9.
El tratamiento de la OMAM ha sido muy debatido en la literatura. Se pueden encontrar desde pautas muy conservadoras (higiene oral, clorhexidina tópica y antibióticos con cultivo previo, cámara hiperbárica) hasta pautas quirúrgicas que comprenden legrados hasta obtener hueso vascularizado, extirpación de fragmentos móviles o espiculados, osteotomías marginales o segmentarias que incluyen reconstrucciones óseas complejas, en función de la extensión de la necrosis10 y del estadio y evolución de la enfermedad20.
Algunos trabajos aislados proponen la utilidad de la teriparatida como tratamiento conservador tanto para osteonecrosis por BF como para denosumab21–23, con resolución completa de la osteonecrosis tras varios meses de tratamiento. Sin embargo, la teriparatida estaría contraindicada en pacientes con cáncer óseo primitivo o metastásico22,23. El papel de la cámara hiperbárica no está bien aclarado24. Nuestra experiencia con ambos procedimientos (cámara hiperbárica y teriparatida) no es, hasta el momento, positiva, aunque son pocos los casos tratados en nuestro Servicio.
Las estrategias de tratamiento y prevención de la OMAM no están basados en estudios independientes, prospectivos y aleatorizados. Cuestiones tales como cuándo intervenir y qué tipo de cirugía realizar aún permanecen abiertas. Algunos estudios prospectivos demuestran25 que el hecho de hacer tratamientos dentales «preventivos» antes del tratamiento con medicamentos antirresortivos disminuye significativamente la incidencia de OMAM, ya que la cirugía dentoalveolar es considerada el mayor factor de riesgo para desarrollar esta enfermedad, sobre todo la exodoncia, de la que se reporta un riesgo del 52 al 61%12,26; en nuestra serie es del 58%. Sin embargo, algunos estudios muestran que las exodoncias en pacientes tratados con BF pueden ser realizadas con baja incidencia de OMAM utilizando profilaxis, cierre cuidadoso o plasma rico en factores de crecimiento con y sin cierre mucoso27,28.
La AAOMS10 establece como tratamiento en el estadio 1 medidas higiénicas (clorhexidina tópica); en el estadio 2, además, añade terapia antimicrobiana y, si es necesario, desbridamiento del hueso necrótico; en el grado 3, en el que la resección del hueso necrótico suele ser más amplia, se necesitan métodos de reconstrucción inmediata (colgajo temporal, peroné microvascularizado o prótesis), tal y como hemos manejado en nuestra serie de casos y otros autores han publicado27,29. Sin embargo, hay que valorar las comorbilidades de cada paciente, ya que muchos de ellos presentan enfermedades oncológicas cronificadas.
La OMAM es una enfermedad cuya incidencia se mantiene17. Si no se trata empeora y es probable que aumente en el futuro próximo con la llegada de nuevos fármacos antiangiogénicos y antirresortivos, además de por el desconocimiento de sus efectos adversos a largo plazo y de su verdadera fisiopatología27. Por ello, las medidas preventivas y terapéuticas deben ser promovidas e investigadas por los cirujanos maxilofaciales y odontólogos.
ConclusionesEl tratamiento de la OMAM depende del estadio de la enfermedad: la mandibulectomía es un tratamiento efectivo en el estadio 3 y la secuestrectomía en el estadio 2; el estadio 1 suele controlarse con tratamiento médico.
A lo largo de los últimos años, la incidencia de OMAM se ha mantenido o aumentado como consecuencia del uso de otros fármacos antirresortivos utilizados para la osteoporosis o para lesiones óseas malignas, en concreto el denosumab.
Es necesaria una revisión odontológica antes de la administración de los fármacos antirresortivos para disminuir el riesgo de aparición de OMAM.
En pacientes no oncológicos, como la osteoporosis puede inducir que desarrollen OMAM, puede intentarse la terapia con teriparatida asociada al tratamiento conservador durante varios meses a las dosis recomendadas en la literatura.
El tratamiento de la OMAM debe ser escalonado según el estadio de la enfermedad y su evolución, así como individualizado según las comorbilidades de cada paciente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.