Recientemente Joshi Otero et al1 publican en la Rev Esp Cir Oral y Maxilofac una revisión acerca de ocho casos de OMBR, estadios I y II, analizando de forma prospectiva la evolución de los pacientes, con un seguimiento clínico de 15 meses, tras un tratamiento conservador con antibioterapia, además de legrado lesional bajo anestesia local, que en algunos pacientes con OMBR grado II permitió el control y la curación del proceso.
Al mencionarse los mecanismo patogenéticos de esta enfermedad se señala el carácter anti-angiogénico de los bisfosfonatos (BP), y la acción apoptótica de los BP sobre los osteoclastos, así como la existencia de procesos inflamatorios / infecciosos agudos asociados (presentes en los grados II y III), que justifican el tratamiento antibiótico, del que se revisa la literatura aportando la experiencia de los autores al respecto.
En relación a los mecanismos patogenéticos de esta enfermedad destructora ósea - de difícil manejo clínico y quirúrgico - desearíamos señalar un dato referido en la literatura2,3, que nosotros hemos constatado asimismo en nuestra casuística de biopsias y legrados óseos de OMBR, y que comunicamos4 en el último Congreso de Cirugía Oral e Implantología de la SECOM y que probablemente puede modular la dificultad en el tratamiento antibiótico de esta enfermedad, del que se señalan por parte de Joshi Otero et al1 las diversas pautas recogidas de la literatura y la experiencia de su propia casuística.
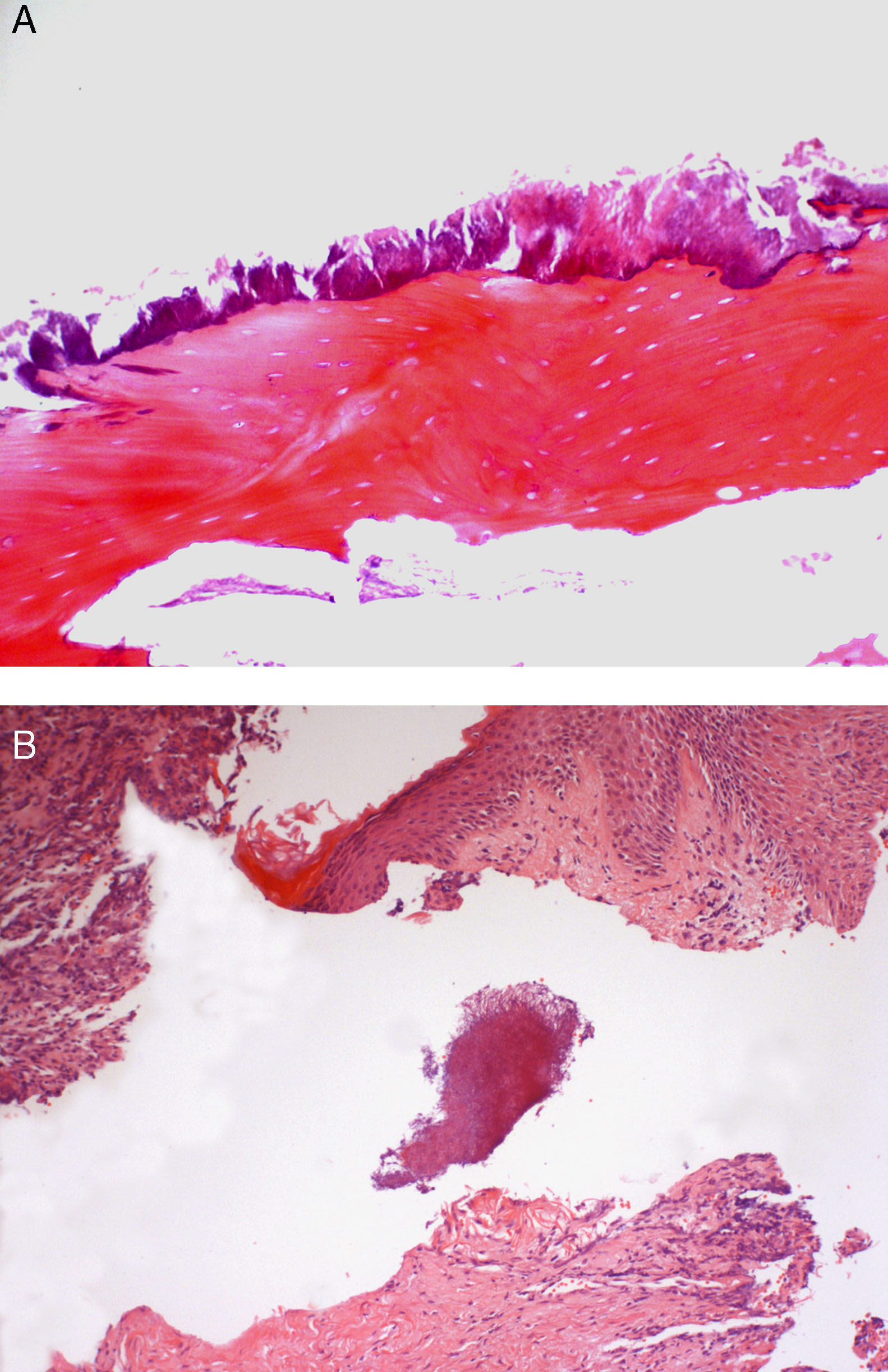
En nuestro análisis, en una serie de 10 casos de OMBR (8 mujeres y 2 varones, con enfermedad neoplásica, siete de ellos con metástasis a distancia), tratados con BP por iv (en periodos entre 18 y 54 meses), con antecedentes previos de exodoncia en el 80% de los casos, y en estadios II (7 casos) y III (3 casos), pudimos comprobar morfológicamente la presencia de colonización por Actinomyces israelii (AI) en el 80% de los casos a nivel de las biopsias óseas, afectando a los frentes de necrosis ósea y estando presentes en el drenaje de las lesiones fistulosas (fig. 1A y B). Al aplicar una metodología molecular (semi-nested PCR) tras extracción de ADN a partir de material parafinado, siguiendo un método previamente descrito3, encontramos que el 100% - es decir los 10 casos estudiados - presentaban amplificación genómica de la secuencia del gen ribosomial 16S del A. israelii.
A. Fragmento biópsico óseo, obtenido en una OMBR, en el que se aprecia una colonización por colonias basofilicas filamentosas de Actinomyces israelii cubriendo el frente de necrosis ósea (H&E, 200x). B. Colonia de Actinomyces israelii detectada en la luz de un trayecto fistuloso cutáneo en paciente afecto de OMBR (H&E, 200x).
La constante presencia de los AI, detectada en nuestra experiencia morfológicamente y con técnicas moleculares tanto en los frentes de necrosis ósea de la OMBR como en el material obtenido a través de las lesiones fistulosas, plantea el posible rol de este agente infeccioso en la patogénesis de la OMBR2, ya que como recientemente se ha indicado5, a pesar de ser muy numerosas las aportaciones sobre la OMBR, existen muchas hipótesis y demasiados pocos datos acerca de su patogénesis.
El posible papel patogenético de los AI en la OMBR se establece en concordancia con algunos datos clínicos, evolutivos y terapéuticos presentes en la OMBR, que parecen reforzar este papel. Así uno de los tratamientos propuestos en adyuvancia, al tratamiento antibiótico y a la cirugía en la OMBR, ha sido el empleo del oxigeno hiperbárico6. Los AI son bacterias filamentosas gram positivas de carácter microaerofílico que se comportan como agentes anaerobios facultativos, creciendo favorablemente en situaciones de baja tensión parcial de O2. El tratamiento con O2 hiperbárico dificulta sin duda el crecimiento de los AI, los cuales actúan como agentes comensales dentro de la cavidad oral (localizado a menudo en bolsas periodontales, lesiones cariosas, y en la placa dental) o en el interior de las criptas amigdalares, adquiriendo solo carácter patógeno cuando atraviesan la barrera mucosa e ingresan en partes blandas, aspecto que puede verse favorecido tras una exodoncia, como ocurre a menudo en los pacientes con OMBR; suscitando entonces una reacción inflamatoria supurativa con tendencia fistulízante.
De otra parte es conocido que el AI puede inducir de forma directa resorción del tejido óseo7. El AI presenta además un difícil reconocimiento en los cultivos microbiológicos convencionales, aspecto que se señala en la OMBR2, requiriendo de cultivos enriquecidos anaeróbicos o con CO2, y a su identificación a veces tan solo se puede llegar por métodos morfológicos, de análisis ultraestructural de barrido del biofilm microbiano8 o mediante técnicas moleculares3, como la realizada en nuestra serie.
El tratamiento antibiótico de los AI a menudo requiere de pautas prolongadas de antimicrobianos2, tal como se señala en la OMBR1 y probablemente, en todo este contexto de datos que apoyan el rol de los AI en la OMBR, estaría indicado llevar a cabos nuevos estudios prospectivos centrados en grupos de pacientes que estén recibiendo bisfosfonatos y que sean monitorizados de forma estrecha, en relación al desarrollo de una posible actinomicosis maxilar, tal como se ha señalado en la literatura2, aclarando así de forma certera el opcional papel patogenético de los AI en la OMBR.