El quiste óseo aneurismático sólido es una lesión ósea benigna muy infrecuente de la que no existe consenso en relación a su origen etiopatogénico. Presenta características clínicas, radiológicas e histológicas inespecíficas, por lo que los estudios ultraestructurales son fundamentales para su diagnóstico y clasificación. El diagnóstico diferencial es extenso e incluye múltiples lesiones óseas como el granuloma reparativo de células gigantes e incluso tumores malignos como el osteosarcoma. El tratamiento de elección es la cirugía conservadora. La recidiva se debe fundamentalmente a la extirpación incompleta.
Solid aneurysmal bone cyst is a rare benign bone lesion for which no consensus exists regarding its origin. It has nonspecific clinical, radiological and histological features so ultrastructural studies are essential for diagnosis and classification. The differential diagnosis is extensive and includes a variety of bone lesions, such as giant cell reparative granuloma, and even malignant tumors like osteosarcoma. The treatment of choice is conservative surgery. Recurrence is due mainly to incomplete resection.
El quiste óseo aneurismático (QOA) es una lesión ósea benigna rara por su baja frecuencia y su origen desconocido. Aunque no es una neoplasia -ya que se han descrito casos de resolución espontánea-, presenta una importante agresividad local. El QOA representa el 1-2% de los tumores óseos primarios y cursa con una amplia e inespecífica variedad de características clínicas, histológicas y radiológicas1, lo que puede dificultar su diagnóstico.
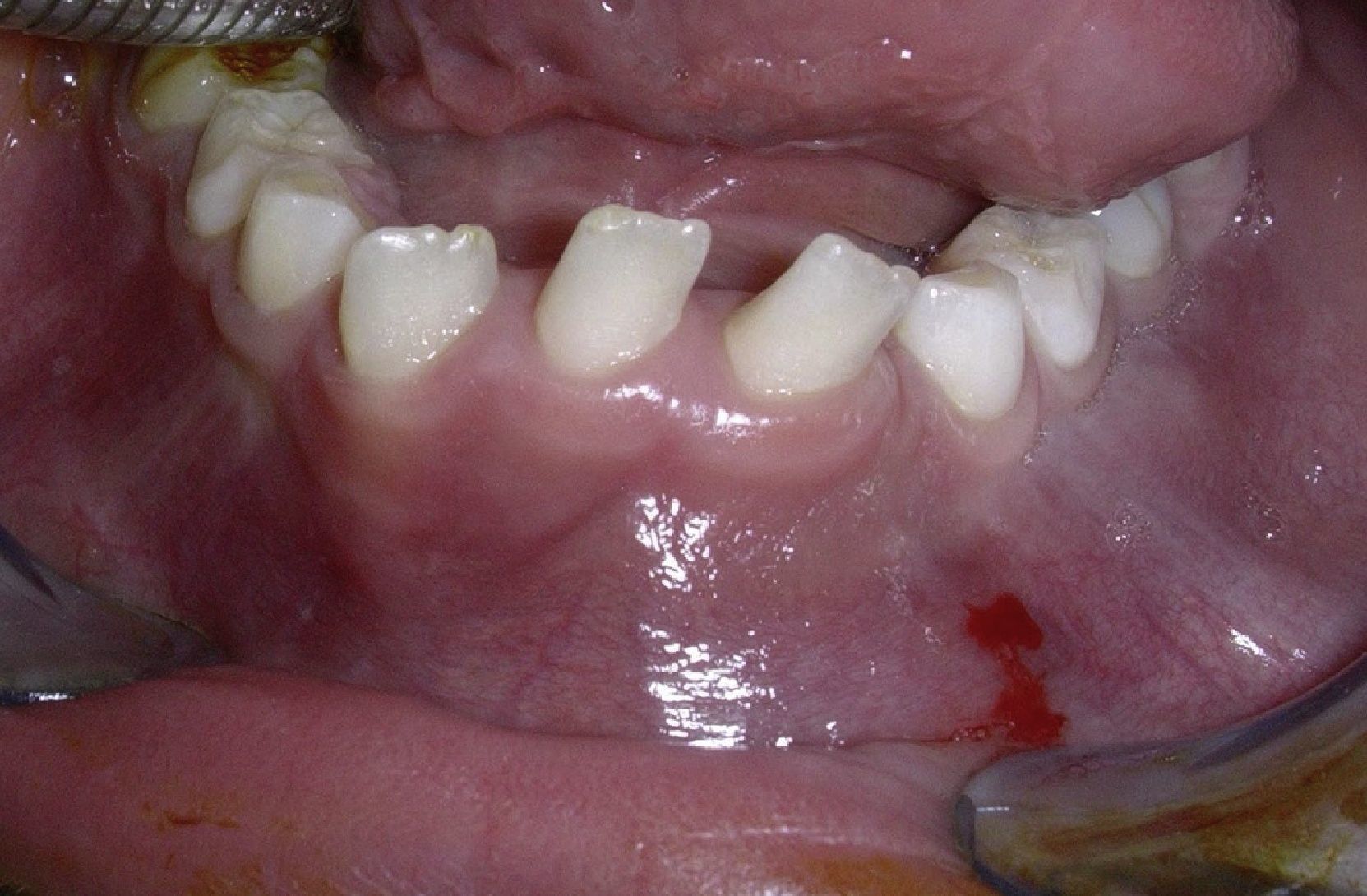
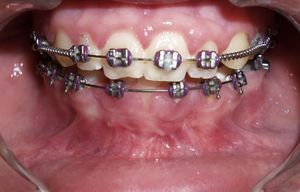
Caso clínicoPresentamos el caso de una niña de 7 años sin antecedentes médico-quirúrgicos de interés, remitida a consultas externas de Cirugía Maxilofacial del Hospital Universitario Marqués de Valdecilla en noviembre de 2004 por una masa indolora en región anterior de suelo de boca de meses de evolución. A la exploración se objetiva dentición mixta y una tumoración a nivel de sínfisis mandibular, con mucosa oral respetada y abombamiento de las corticales lingual y vestibular, y dientes deciduos estables a ese nivel (fig. 1). La paciente no presenta alteraciones neurológicas significativas.
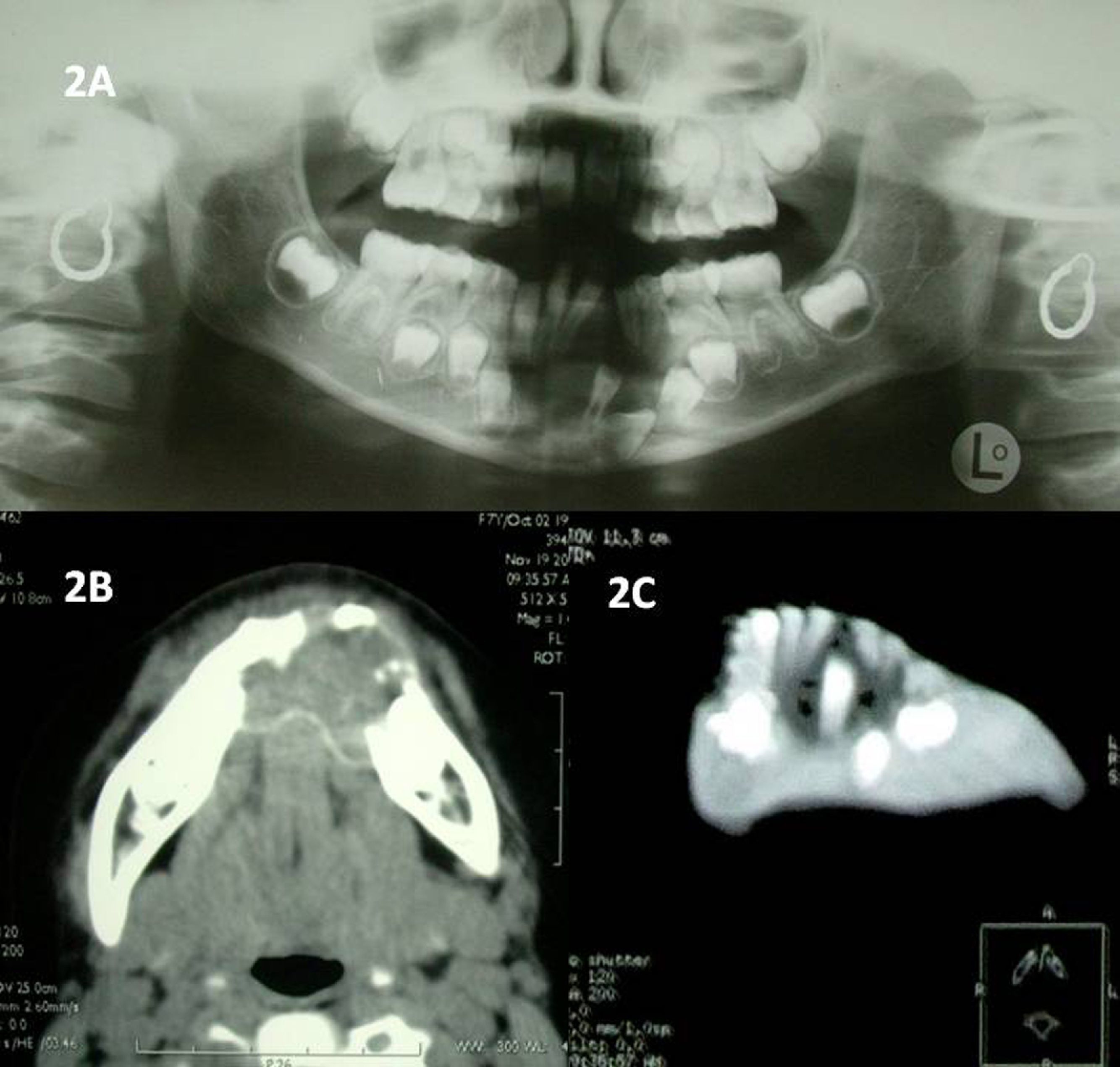
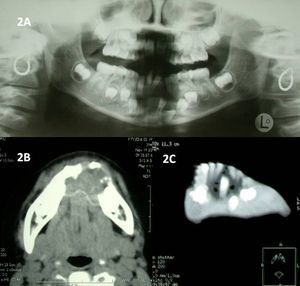
La ortopantomografía (OPG) revela una imagen radiolúcida de márgenes mal definidos en sínfisis mandibular -de 73 a 83-, con basilar desestructurada a ese nivel (fig. 2A). También se observan 3 dientes definitivos incluidos en la lesión y cierto grado de rizólisis y desplazamientos dentales. Se solicita tomografía computarizada (TC), que confirma la presencia de una tumoración osteolítica, insuflante y multilocular de 3×1,8cm, con corticales expandidas y adelgazadas, pero sin afectación de partes blandas; asimismo, se describe el interior de densidad sólida, todo ello sugestivo de quiste óseo aneurismático sólido (fig. 2B y 2 C). La punción-aspiración con aguja fina (PAAF) no es concluyente.
OPG inicial que muestra una imagen radiolúcida de márgenes mal definidos de 73 a 83, con basilar desestructurada y 3 piezas dentales definitivas incluidas en la lesión.
Figura 2B Corte axial de TC en el que se observa una tumoración osteolítica, insuflante y multilocular que afecta a todo el espesor de la sínfisis mandibular, pero mantiene las corticales íntegras.
Figura 2C TC con reconstrucción 3D que revela una lesión quística en sínfisis mandibular con piezas incluidas en su interior.
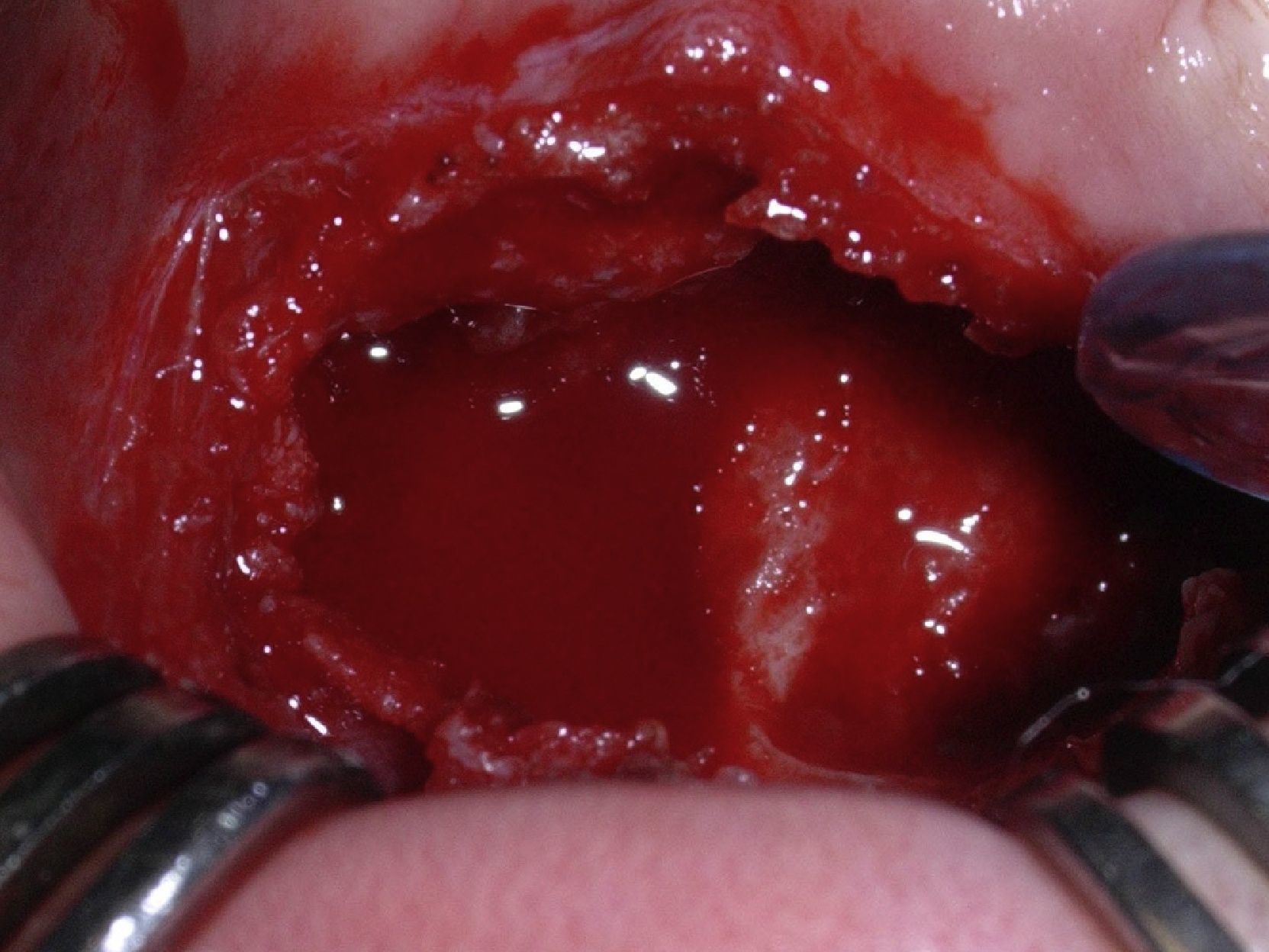
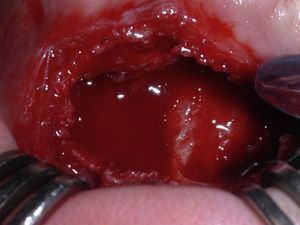
Bajo anestesia general se realiza abordaje vestibular, que permite visualizar la cortical expandida y adelgazada pero sin pérdida de continuidad, con el típico aspecto en «cáscara de huevo». Una vez expuesta la lesión, se toma una biopsia intraoperatoria que descarta patología ósea maligna. Con la firme sospecha de QOA sólido, se realiza curetaje y exodoncia de los tres dientes definitivos incluidos en la lesión (fig. 3). El defecto óseo no precisa reconstrucción, pero a fin de favorecer la remodelación ósea guiada del lecho quirúrgico se emplea una lámina de hueso desmineralizado a nivel de la cortical externa mandibular.
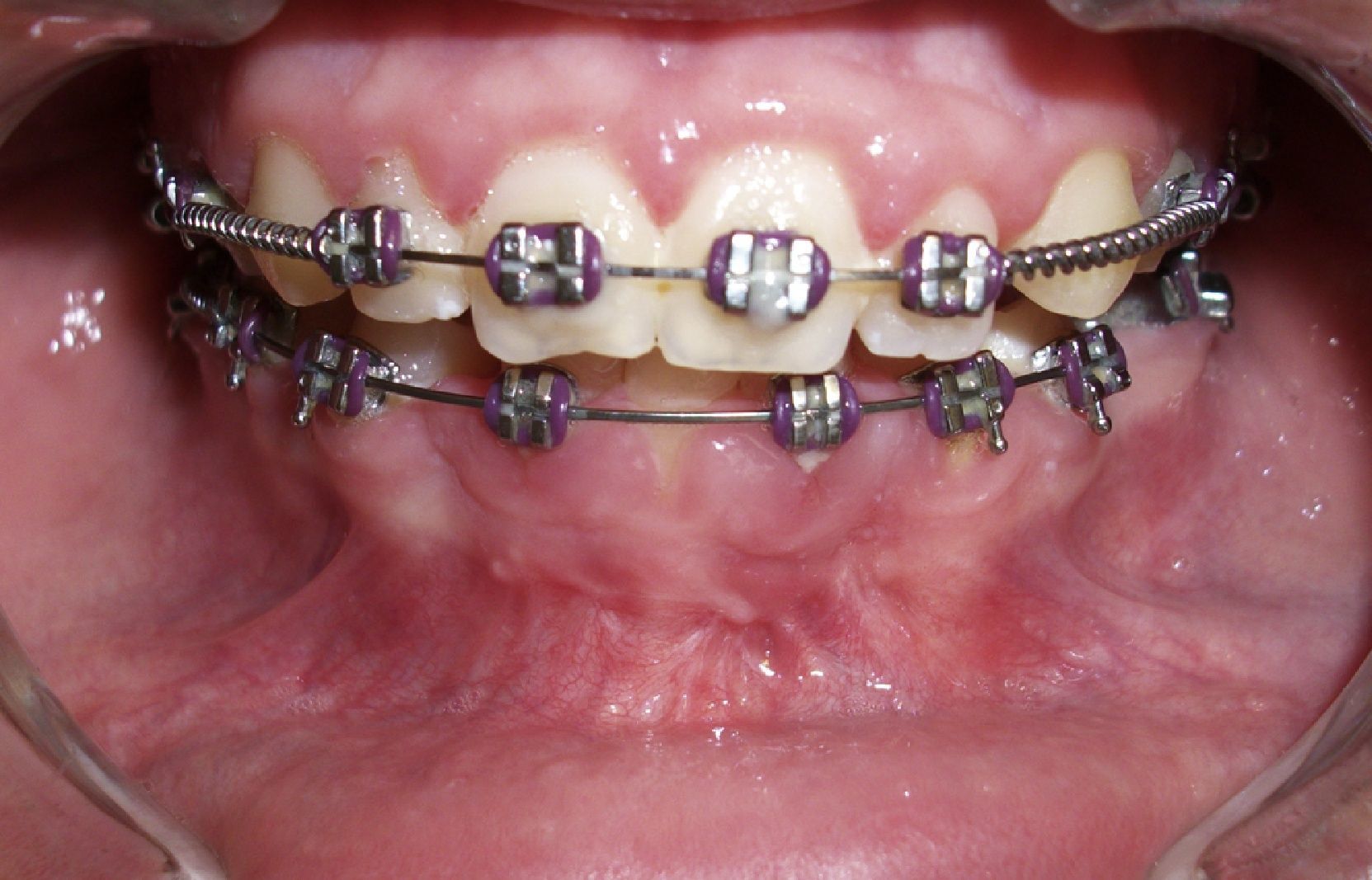
Al alta es remitida al ortodoncista para ferulización de la arcada inferior, con el objetivo de asegurar la estabilidad de la misma, dada la importante pérdida de soporte óseo a nivel crestal de sínfisis mandibular. Dicha fijación es mantenida durante 6 meses.
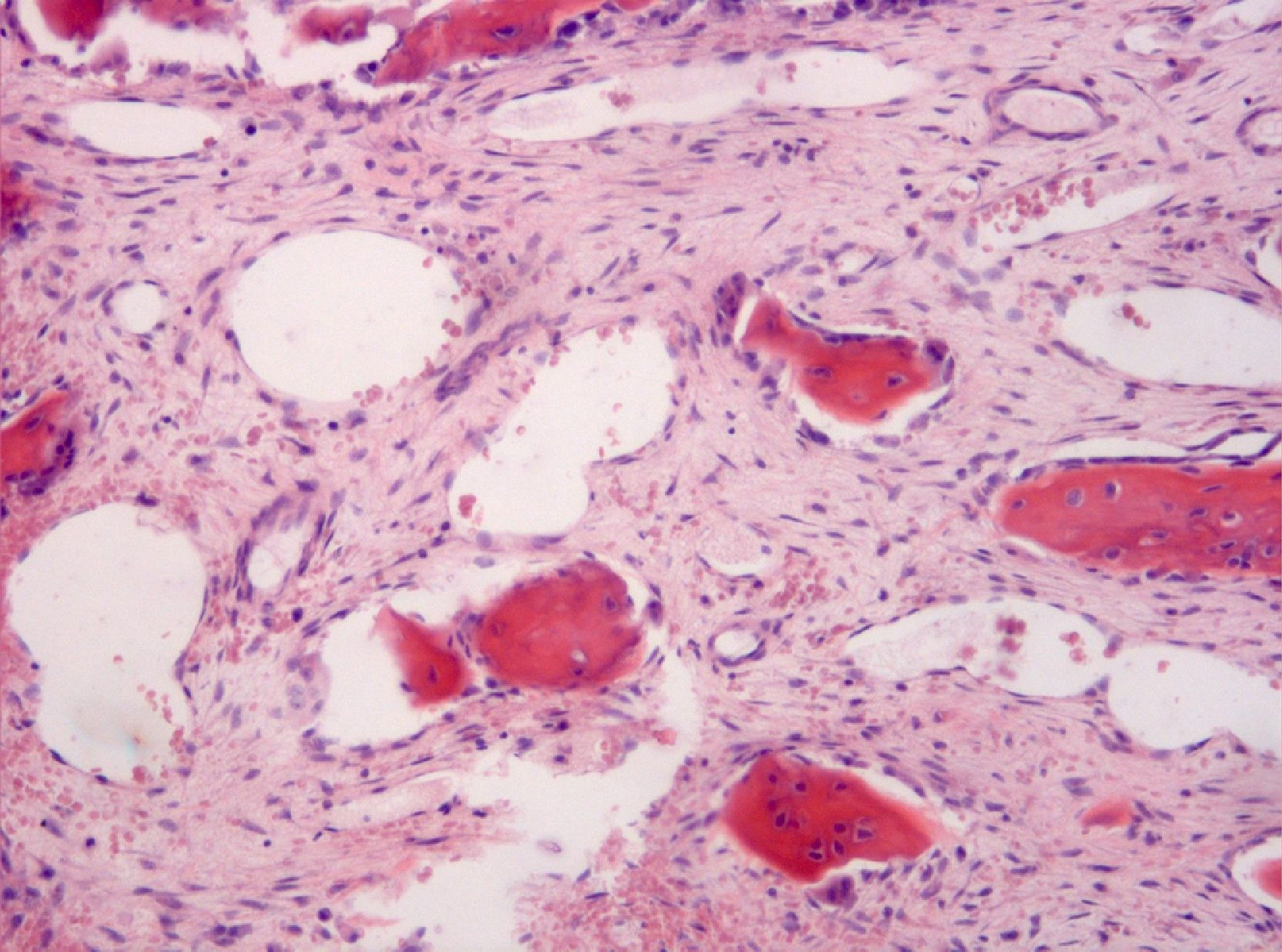
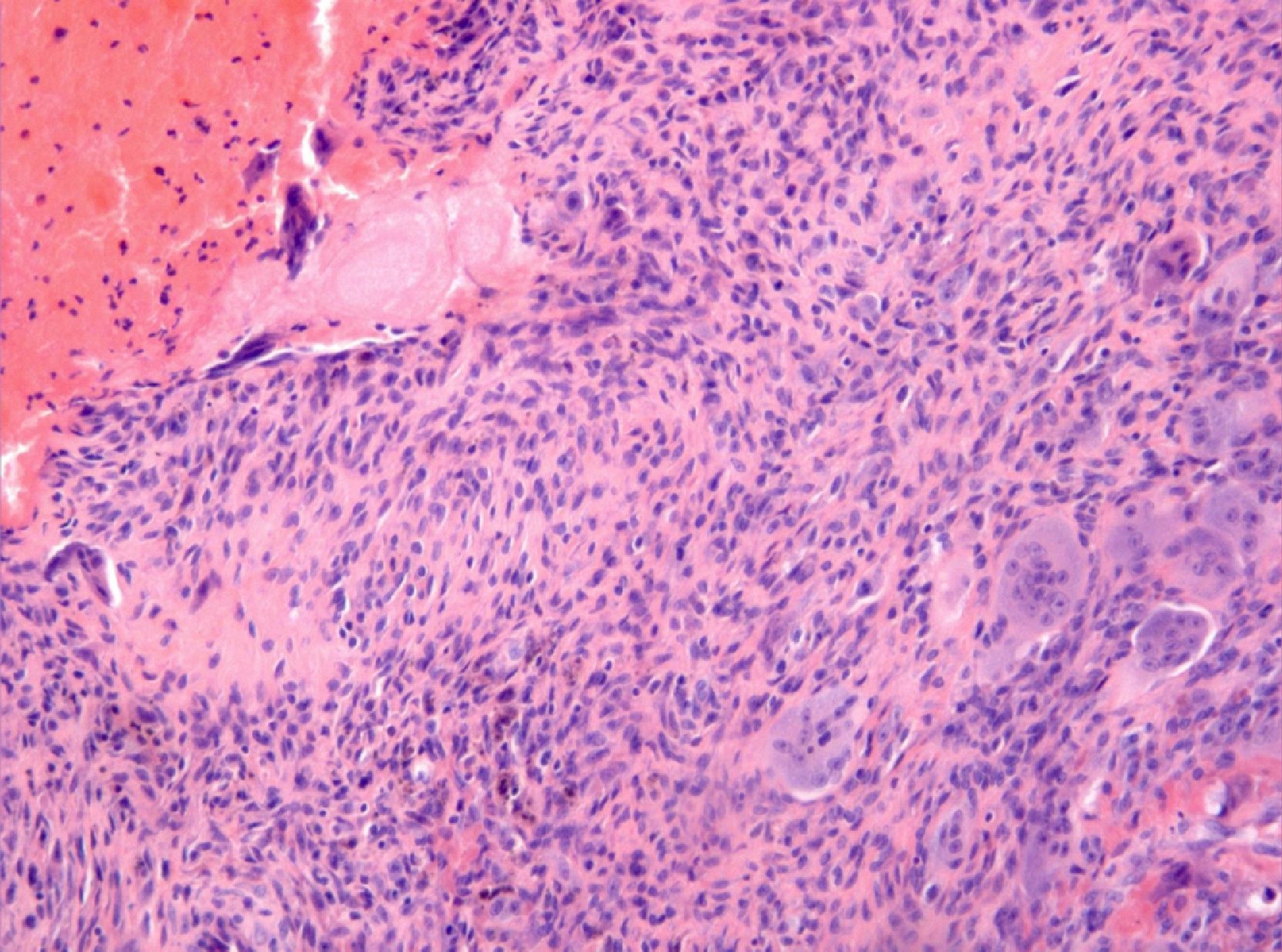
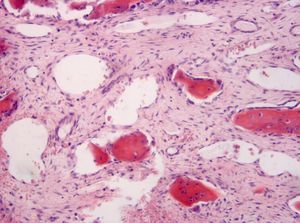
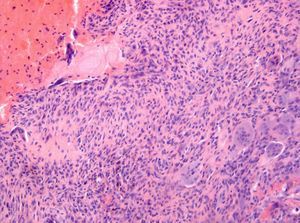
El estudio histológico definitivo confirma el diagnóstico de quiste óseo aneurismático de tipo sólido. A nivel macroscópico se identifican varios fragmentos irregulares de color pardo-negruzco y consistencia elástica y firme; mientras que a nivel microscópico, se observan pequeños espacios vasculares revestidos por tejido celular fibroso (fig. 4), células gigantes (fig. 5) y macrófagos, con mitosis ocasionales, ausencia de atipias y focos de hemosiderina.
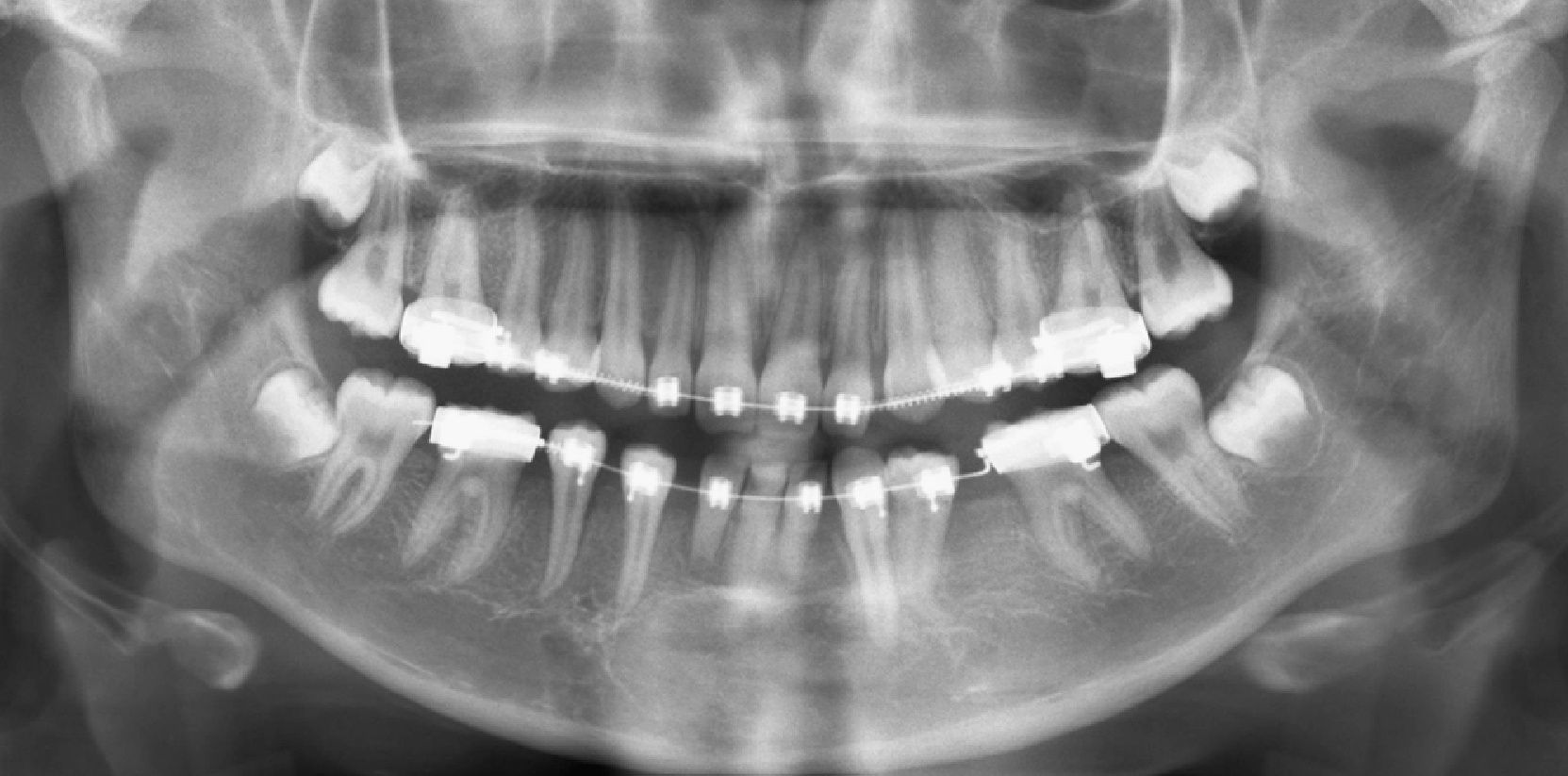
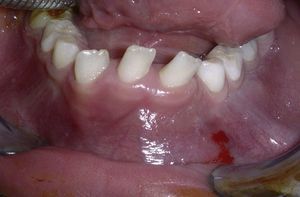
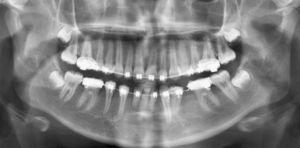
La paciente presenta una buena evolución postoperatoria, con una correcta apariencia estética y funcional. En la actualidad y tras 6 años en seguimiento, no presenta signos clínicos (fig. 6) ni radiológicos (fig. 7) de recidiva local y ha iniciado tratamiento ortodóncico para corrección de la malposición dentaria.
DiscusiónEl quiste óseo aneurismático (QOA) es una lesión ósea-fibrodisplásica reactiva, no quística ni neoplásica1 que representan el 0,5% de los quistes mandibulares y el 1,5% de los quistes no odontogénicos no-epiteliales. Asienta habitualmente en la metáfisis de huesos largos como el fémur o la tibia (50%) y la columna vertebral (12-30%)2. Su hallazgo en el macizo cráneo-facial es infrecuente (2-12%)3; siendo más habitual la afectación mandibular que la maxilar superior, en una proporción 2:1. A nivel mandibular, las zonas de riesgo son el cuerpo y la rama y, muy raramente, el cóndilo y la coronoides4.El QOA tiene un pico de incidencia durante las dos primeras décadas de la vida2, siendo poco frecuente en pacientes mayores de 20 años. Se ha descrito una ligera predilección por el sexo femenino (62%)2,5.
Aunque fue descrito por primera vez en 1893 por Van Arsdale6, no fue hasta 1942, cuando Jaffé7 acuñó el término «quiste óseo aneurismático» y hasta 1983 cuando Sanerkin et al describieron el subtipo sólido8. El origen etiopatogénico del QOA es controvertido9. Aunque algunos autores lo han descrito como una lesión congénita; otros, como Biesecker et al10, sugieren un origen vascular a partir de malformaciones arterio-venosas que provocarían un aumento de la presión venosa intralesional, con la consecuente resorción ósea y destrucción de los lechos vasculares. Struthers y Shear11 proponen un antecedente traumático (como extracciones dentales) y la formación de un hematoma subperióstico como factores desencadenantes. Otras teorías, como la de Bernier y Bhaskar12, defienden que se trata de la degeneración de una lesión ósea preexistente (como el granuloma reparativo de células gigantes).
Cursan con inflamación de los tejidos blandos debido a la expansión del hueso subyacente lo que, a su vez, puede causar notables asimetrías faciales3,11 y maloclusión. Otras manifestaciones menos frecuentes son las resorciones radiculares y disestesias y, en lesiones de maxilar superior, proptosis, diplopía u obstrucción nasal progresiva13.
Además, la clínica puede variar en función del subtipo de QOA4: mientras que el sólido suele presentarse como una pequeña lesión asintomática detectada casualmente en una radiografía de rutina o por una ligera tumefacción, el subtipo vascular se manifiesta como una lesión destructiva de rápido crecimiento expansivo que causa perforación de corticales e invasión de los tejidos blandos4,9.
El aspecto radiológico es inespecífico y muy variable1. La imagen típica en la radiografía panorámica revela una lesión quística expansiva, generalmente multilocular, con destrucción de corticales y un patrón trabeculado interior. El efecto multiloculado le dota de la característica imagen en «panal de abejas», «pompas de jabón» o «apolillada», típica también de otras lesiones como el granuloma reparativo de células gigantes, mixoma, fibroma desmoplásico, hemangioma, queratoquiste y el ameloblastoma. En ocasiones, la reacción perióstica con formación de hueso reactivo puede adquirir la imagen en «sol naciente», característica del osteosarcoma, con el que se deberá hacer el diagnóstico diferencial14.
La TC es la técnica de elección para el estudio de extensión y la planificación del tratamiento3. La resonancia magnética (RM) está indicada en algunos casos como técnica complementaria. La angiografía está indicada cuando la RM revela una lesión hipervascularizada, que debe ser distinguida del hemangioma o de una neoplasia de alto grado.La mayoría de los QOA hallados en el territorio de cabeza y cuello miden entre 1 y 10cm de diámetro. Macroscópicamente, tienen un aspecto esponjoso, formado por cavidades rellenas de sangre y separadas por finos tabiques fibrosos.
A nivel microscópico, la forma «sólida» (5% de los QOA) se caracteriza por una vascularización escasa en forma de pequeños espacios vasculares revestidos por tejido celular fibroso2 y por una prominente proliferación fibroblástica con células gigantes dispersas, que lo hacen muy similar a los GRCG, pero estos últimos carecen de cavernas llenas de sangre y de sinusoides4. Otros hallazgos típicos son la presencia de datos de diferenciación osteoblástica con formación de osteoide y focos de tejido fibromixoide; y la presencia de hemosiderina, también presente en los osteosarcomas de bajo grado2,10,14.
En el polo opuesto se encuentra la variante «clásica» o «vascular» (95%) que se caracteriza por la presencia de lagunas vasculares de tamaño variable, separadas por tabiques de tejido conectivo que incluye trabéculas óseas, tejido osteoide y células gigantes multinucleadas. A menudo, estas cavidades vasculares sufren trombosis. La ausencia de músculo liso es muy sugerente de QOA y excluye el hemangioma10.
Existe una tercera forma, o «mixta», que es considerada una fase de transición, ya que muestra características de ambos tipos1,14.
Los estudios ultraestructurales e inmunohistoquímicos confirman que los sinusoides no están revestidos por células endoteliales, sino por fibroblastos e histiocitos y la presencia variable de componente osteoide, hemosiderina y hueso de novo10.El QOA carece de hallazgos clínicos y radiológicos específicos, por lo que es importante diferenciarlo mediante el estudio histológico de otras patologías del territorio maxilofacial, dentro de las que se incluye el granuloma reparativo de células gigantes, ameloblastoma, displasia fibrosa, fibroma desmoplásico, quiste globulomaxilar, mixoma, hemangioendotelioma, hemangiopericitoma, quistes traumáticos, hemangiomas, osteosarcomas y tumores pardos4. Muy especialmente, el QOA sólido debe diferenciarse del tumor de células gigantes (TCG) que aunque también se trata de una lesión benigna con un comportamiento localmente agresivo, presenta cierto potencial metastásico15.
La histología del QOA sólido revela una alta actividad mitótica que también puede observarse en lesiones reactivas15; además, carece de atipias y es más celular y menos mitótico que el osteosarcoma. El patrón desorganizado de producción ósea y la presencia de trabéculas y hueso reactivo en todas las etapas de maduración son típicos de los QOA sólidos y claramente diferentes de los osteosarcomas de alto y bajo grado.
Los estudios citogenéticos y de genética molecular se han convertido en un elemento fundamental para el diagnóstico y clasificación de esta patología debido a las dificultades para la evaluación histológica y a la superposición de las características clínicas y radiológicas. Johnsson et al han realizado análisis citogenéticos tanto de la lesión primaria como de la recidiva local del GRCG. Mediante el empleo de bandeo cromosómico y técnicas de hibridación in situ como el FISH se ha detectado la translocación inestable (8; 22) y se ha podido demostrar que diferentes GRCG presentan diferentes cariotipos15.Existe una amplia variedad de tratamientos que incluyen el curetaje, la resección en bloque con reconstrucción y la embolización terapéutica. Actualmente el tratamiento de elección es la cirugía conservadora, ya sea enucleación o curetaje, ya que se trata de una lesión benigna y con un bajo índice de recidiva2. La extirpación suele ser sencilla en lesiones circunscritas al interior del hueso, pero puede complicarse en lesiones multilobuladas o expansivas con perforación de corticales; por otro lado, el riesgo de sangrado durante la cirugía es menor en el subtipo sólido que en el vascular, debido a la escasa vascularización del primero. La resección segmentaria está indicada en casos con múltiples recidivas o extensión a tejidos blandos. Algunos autores recomiendan la reconstrucción inmediata del defecto con injertos autólogos en caso de deformidad estética o con alto riesgo de fractura1,3. En cuanto a los tratamientos complementarios, no se recomienda el empleo de radioterapia por el elevado riesgo de tumores radioinducidos.
La tasa de recidiva oscila entre un 20 y 30% en función de las series analizadas y se presenta con mayor frecuencia en el primer año tras la cirugía3. Es atribuida a la extirpación incompleta, especialmente en casos con extensión a tejidos blandos1,3,14.