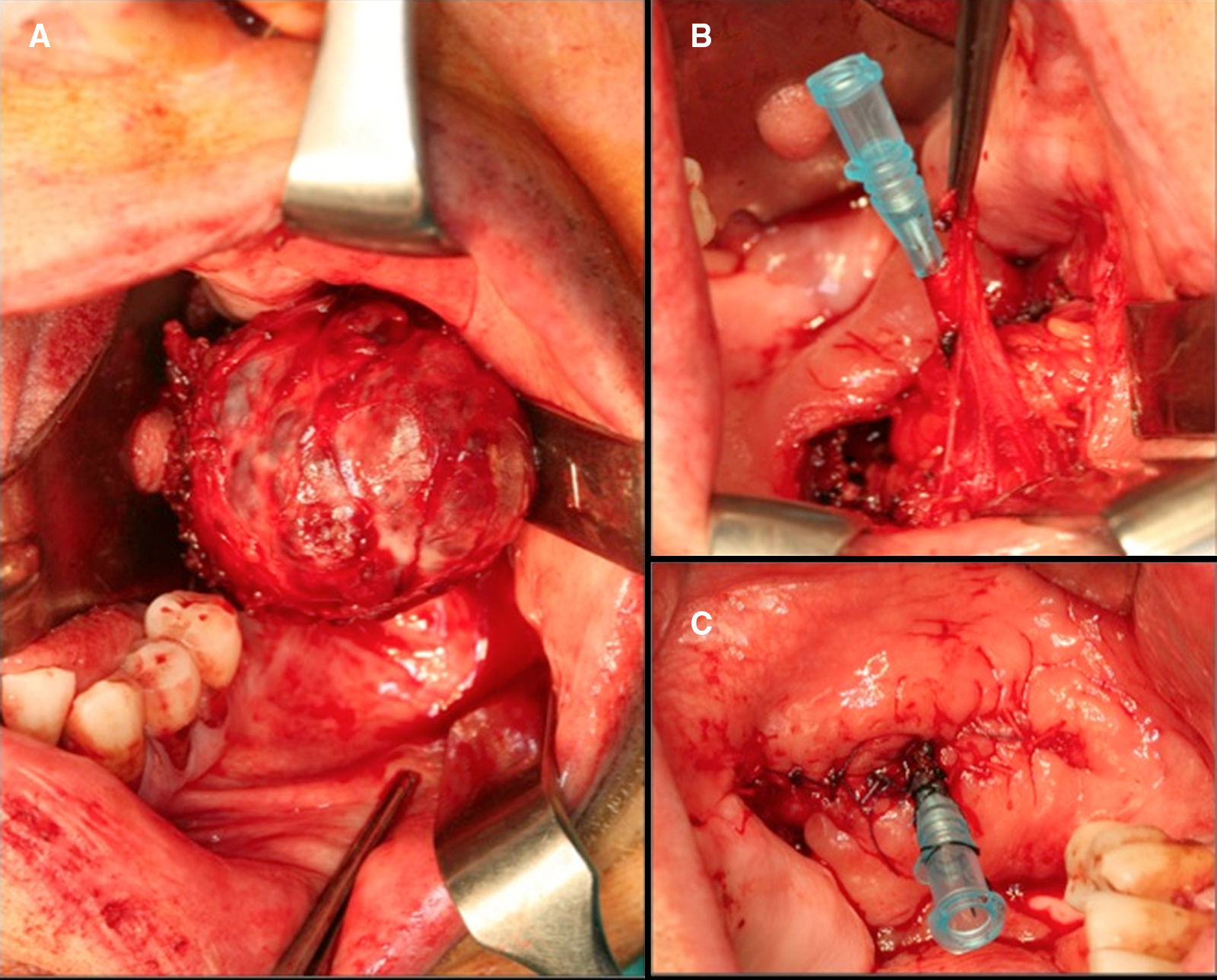
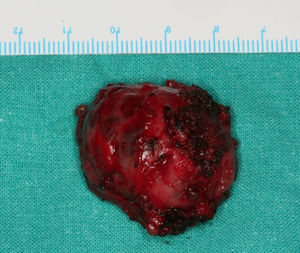
Ante la presencia de una tumoración en el espacio bucal con discrepancia histológico-radiológica (las características macroscópicas de la lesión en la toma de biopsia [de aspecto graso] y la exploración física sugieren características benignas de la lesión en contraste con los resultados obtenidos en las pruebas radiológicas), se decidió la exéresis tumoral bajo anestesia general mediante abordaje intraoral. Intraoperatoriamente se objetivó una tumoración encapsulada, de aspecto nodular, en íntima relación con el conducto de Stenon. Para conseguir una completa exéresis tumoral se realizó sección del conducto y fijación del segmento remanente a mucosa yugal manteniendo tutorización del mismo (figs. 1 y 2).
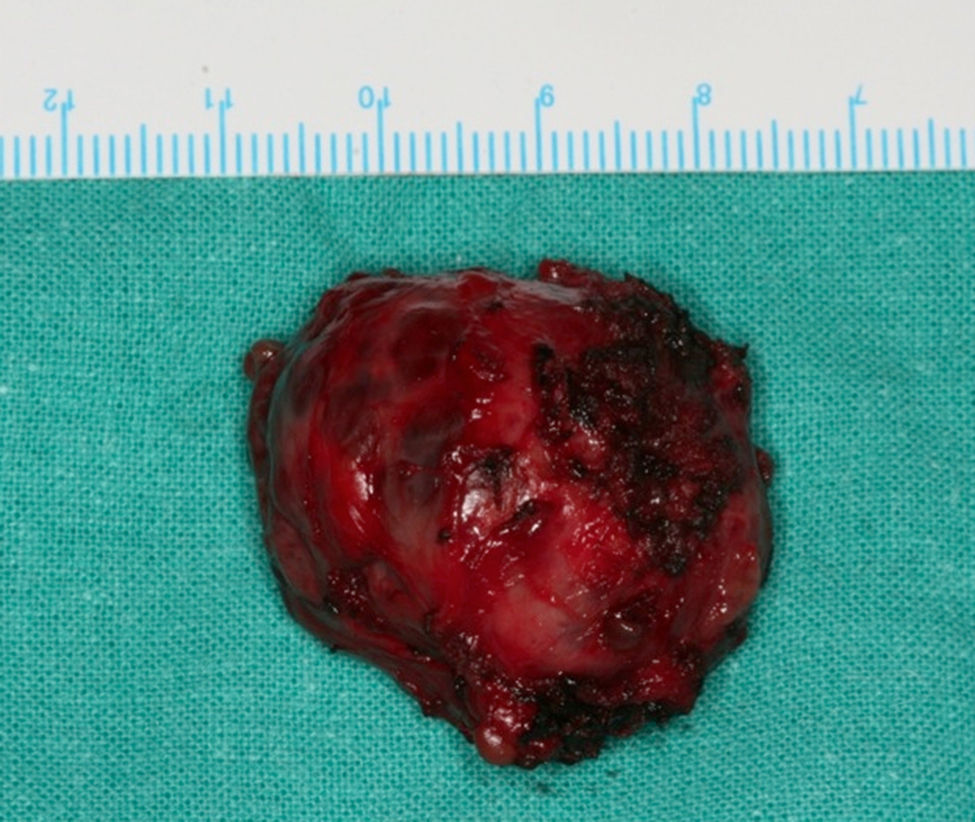
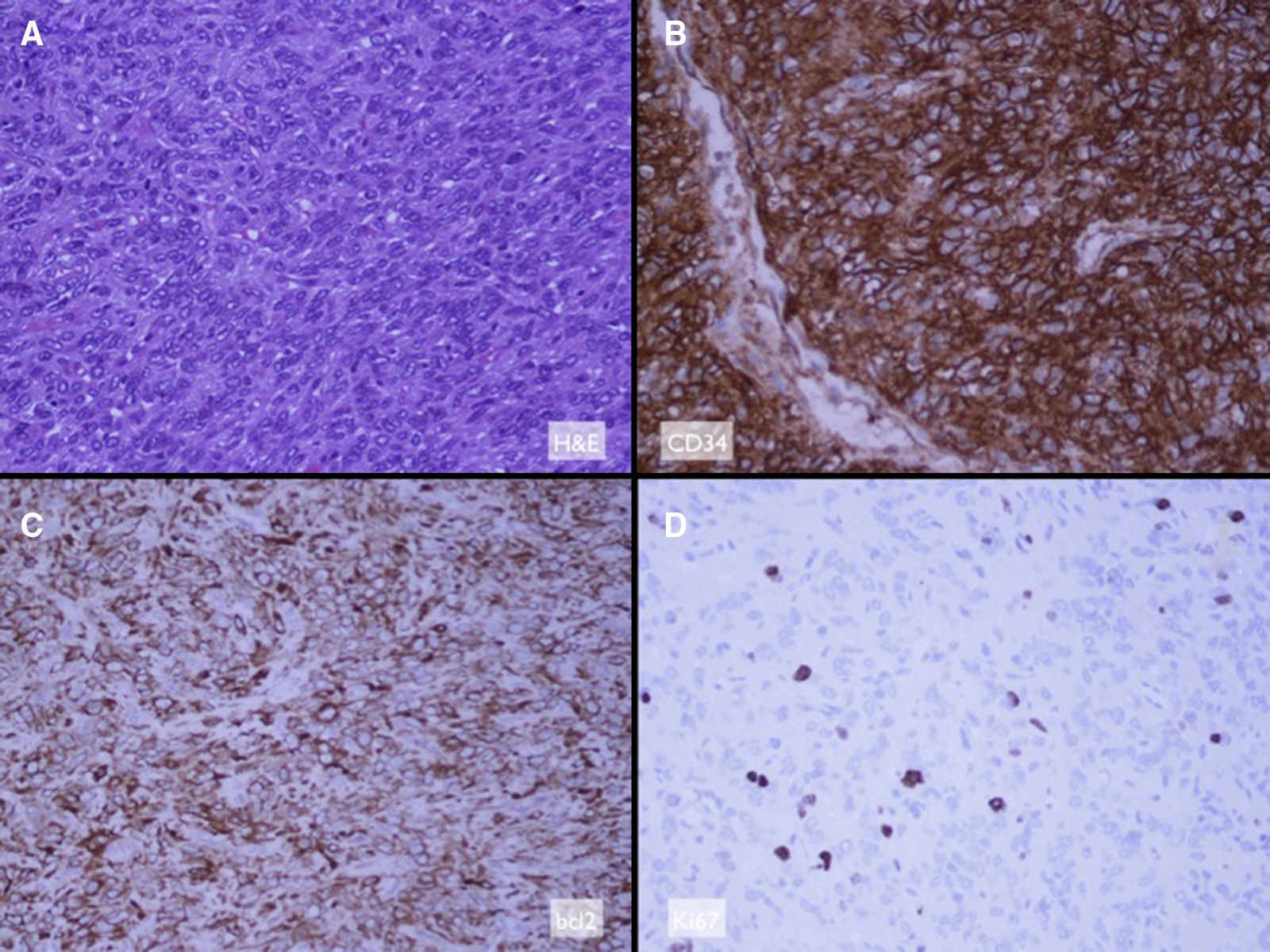
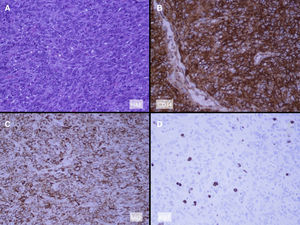
El estudio anatomopatológico final de la pieza quirúrgica reveló una tumoración de aspecto nodular de 10g y 3,5×2,5×2,5cm de diámetro, parcialmente encapsulada, de coloración violácea y tejido adiposo asociado. En el examen microscópico se pudo observar un tumor mesenquimal, bien delimitado, constituido por células fusiformes dispuestas alrededor de los vasos adoptando un patrón hemangiopericitoide. El estudio inmunohistoquímico mostró una fuerte expresión para CD34, vimentina y Bcl-2. Positividad focal para CD31, CD99, Fli-1 y CD68. El índice de proliferación celular (Ki-67) fue del 6-8%. Estas imágenes histológicas eran compatibles con el tumor fibroso solitario (TFS) (fig. 3). El paciente evolucionó favorablemente, no observándose afectación de ninguna de las ramas del nervio facial ni del conducto Stenon izquierdo. Este último presentaba un normal funcionamiento a las 4 semanas postintervención tras la retirada de la guía-tutor.
DiscusiónEl TFS fue descrito inicialmente por Klemperer y Rabin1 en 1931 como una neoplasia infrecuente de células fusiformes de origen mesotelial. Aunque su localización más común es en la pleura parietal y visceral, otras localizaciones serosas y no serosas han sido descritas en la literatura, apoyando con ello la teoría actual de un origen mesenquimal2,3. En la región de cabeza y cuello, se ha informado de su presencia en diferentes ubicaciones, como la piel, tejidos blandos cervicales profundos, tiroides, laringe, epiglotis, espacio, glándulas salivares mayores, espacio parafaríngeo, senos nasales y paranasales, orbita y meninges2. Su localización en la cavidad oral es rara siendo descritos hasta el año 2009, 58 casos en la literatura internacional4.
En general, estos tumores se presentan como una masa tumoral asintomática, de consistencia dura, crecimiento lento y sin invasión de estructuras vecinas4,5. A nivel intraoral suele desarrollarse en la 6.a década de la vida, con una incidencia similar en ambos sexos y con afectación sobre todo de la mucosa yugal, seguida en frecuencia por el labio y la región lingual3. El tamaño medio cuando se localiza en cabeza y cuello es de unos 2,6cm de diámetro5.
Aunque su presentación puede variar, las pruebas de imagen a menudo proporcionan los primeros indicios para identificar estos tumores6. Su localización en espacio masticatorio y mucosa yugal obliga a descartar otras masas en esta región como pueden ser schwannomas, sarcomas, carcinomas escamocelulares, linfomas, linfangiomas/hemangiomas o incluso abscesos6. La RMN revela una mayor isointensidad respecto al musculo en T1 e hipointensidad en T2, reflejando el componente fibroso tisular con realce heterogéneo u homogéneo6.
EL diagnóstico definitivo se establece mediante microscopía convencional y análisis inmunohistoquímico. El TFS se caracteriza por una fuerte expresión del antígeno CD34 en las células neoplásicas, tanto a nivel pleural como extrapleural. Otras tinciones útiles para su diagnóstico son vimentina, y en menor cuantía CD99 y bcl-23,7. En el diagnóstico diferencial de neoplasias con células fusiformes y sobreexpresión de CD34 debemos tener en cuenta, sobre todo, el dermatofibroma, el dermatofibrosarcoma protuberans, el neurofibroma, el schwannoma y el hemangiopericitoma5.
Histológicamente, el tumor está bien circunscrito, a menudo como una masa parcialmente encapsulada, con una apariencia firme y multinodular a la sección2. Puede presentar un patrón histológico característico, «patrón clásico» consistente en zonas hipo o hipercelulares alternantes con áreas de fibrosis, fragmentos de colágeno y presencias de ramificaciones vasculares similares a los hemangiopericitomas. Sin embargo, otros patrones no tan convencionales pueden existir con áreas de hipercelularidad, áreas mixoides, pleomorfismos, atipias y mitosis3,4. La presencia de patrones variados obliga a realizar diagnósticos diferenciales, en el caso del primero, con leiomioma, tumor de la vaina de las células nerviosas, miofibroma, fascitis nodular, sarcomas de bajo grado, etc.; mientras que los patrones mixoides precisan descartar otras enfermedades benignas y malignas, como tumores benignos de las vainas nerviosas, mixofibrosarcoma de bajo grado, liposarcoma de bajo grado, sarcoma mixoide sinovial y lipoma mixoide de célula fusiforme3. Cuando existen adipocitos presentes, lipoma de células fusiformes y liposarcoma mixoide deben también ser tenidos en cuenta3.
Su malignización en localizaciones extrapleurales es rara, siendo descrito su desarrollo en el 23% de los casos a nivel pleural2. Entre sus características de malignidad destacan su hipercelularidad, pleomorfismo nuclear, presencia de atipias, necrosis tumoral o un incrementado numero de mitosis (>4 por 10 campos de gran aumento)8, algo que no sucedió en nuestro caso. No obstante, a pesar de presentar características malignas al microscopio, su comportamiento en cuanto a agresividad no difiere de los TFS de cabeza y cuello con características benignas, siendo habitual la ausencia de metástasis5.
El tratamiento de elección es la resección completa de todos los tumores5. La recurrencia, aunque rara, puede suceder en casos de escisión incompleta o presencia de márgenes quirúrgicos positivos, generalmente por complejidades anatómicas, pudiendo en estos casos complementarse el tratamiento con radioterapia2,5. En los casos de características atípicas o malignas, no es necesario un tratamiento adicional más allá del recomendado para los casos benignos, siendo considerado su resección completa con márgenes negativos, curativos. El período de seguimiento es variable, recomendándose períodos largos en casos de márgenes afectos o resección incompleta para evaluar posibles recurrencias o incluso metástasis5.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecimientos a Juan José Fernández de Mera, facultativo del Servicio de Anatomía Patológica del Hospital Infanta Cristina por sus consejos y colaboración.