*Premio Fundación SECOT de Investigación Básica en Cirugía Ortopédica y Traumatología, 2004.
Las actuales líneas de investigación en cirugía tendinosa están enfocadas hacia la reducción de la formación de adherencias, así como al desarrollo de técnicas de reparación más resistentes biomecánicamente, que permitan una movilización postoperatoria precoz con un riesgo de re-ruptura mínimo. La biología de la cicatrización tendinosa ha sido desde antiguo el sustrato de numerosos trabajos experimentales1-9, y siempre analizada basándose en parámetros histológicos descriptivos y escalas semicuantitativas para la evaluación de las adherencias peritendinosas10-12. Estas escalas valoran las adherencias sobre la base de criterios semicuantitativos y cualitativos. Estos últimos están condicionados por la subjetividad del investigador que realiza la evaluación, y pueden dar lugar a variabilidad intra e interobservador. Estos métodos producen evaluaciones subjetivas, poco precisas para las adherencias y no son lo suficientemente sensibles como para detectar pequeños cambios en la fibrosis y en la madurez de la cicatriz13,14.
El análisis digital de imagen ha permitido en los últimos años evaluaciones cuantitativas de la fibrosis en distintos campos de la Medicina, con altos niveles de objetividad y reproducibilidad, no alcanzados por los sistemas semicuantitativos15-18. Al mismo tiempo, ofrece una potencia estadística más grande en el análisis de los datos obtenidos. Sin embargo, no tenemos constancia de su empleo en la medición de la cicatrización tendinosa. Sólo Norris et al19 aplicaron técnicas de análisis de imagen digital a la cirugía de los tendones flexores, para estudiar el volumen producido por distintos tipos de sutura en cadáveres.
La ingeniería tisular ortopédica afecta de forma primaria a la regeneración de los tejidos conectivos, los cuales poseen un sistema de células madre definido20. Algunas de estas células son pluripotenciales, y pueden diferenciarse a hueso, cartílago, tejidos fibrosos, grasa o músculo.
El periostio contiene progenitores mesenquimales o células madre capaces de diferenciarse dependiendo del medio de cultivo21, 22. El cambium (capa interna) contiene principalmente células precursoras indiferenciadas con matriz granular. Como el periostio, se puede trasplantar como un tejido completo, puede servir como su propio andamio o una matriz sobre la que se pueden adherir otras células y/o factores de crecimiento23.
El periostio reúne tres requisitos primarios para la ingeniería tisular: una fuente de células, un andamio para la liberación y retención de éstas y una fuente de factores de crecimiento24.
La aplicación de periostio en el tratamiento de defectos cartilaginosos está produciendo buenos resultados24-26, pues se observa una diferenciación y proliferación hacia cartílago en el defecto que cubre. Esta circunstancia hace pensar que el periostio puede diferenciarse en diferentes sentidos, según el ambiente tisular en el que se implante.
El propósito de este trabajo ha sido estudiar las adherencias producidas tras la tenorrafia de los tendones flexores, puesto que sigue siendo uno de los problemas de más difícil solución en la cirugía de la mano. Se han probado sustancias biológicas (peritoneo, membrana sinovial, fascia, vena, etc.) y materiales sintéticos (celofán, polietileno, silastic, politetrafluoroetileno [PTFE], etc.) para disminuir su formación.
El periostio contiene progenitores mesenquimales o células madre con capacidad de diferenciación pluripotencial, dependiendo del medio en que se cultiven. Dado que se puede trasplantar como un todo, el propósito de este trabajo consiste en comprobar que el periostio, por su condición de barrera mecánica, puede aislar la herida tendinosa de la reacción fibrosa peritendinosa y, a la vez, contribuir como andamio a una cicatrización más sólida y precoz del tendón lesionado, mediante la aportación de células precursoras indiferenciadas y fibroblastos.
MATERIAL Y MÉTODO
Realizamos un estudio experimental de tipo aleatorio controlado, para analizar la calidad de la cicatriz en la sutura tendinosa del tendón de Aquiles del conejo, y su modificación con la aplicación de periostio autógeno. Utilizamos un control intrínseco constituido por la pata contralateral del animal, en la que se realizó el mismo procedimiento quirúrgico sin la aplicación de material o sustancia de refuerzo, y controles extrínsecos formados por animales de las mismas características en los que aplicamos sustancias ya conocidas y evaluadas como el ácido hialurónico y el PTFE.
La calidad de la cicatriz tendinosa se valoró mediante la graduación macroscópica de las adherencias, análisis histológico mediante microscopia óptica, análisis de resistencia a la ruptura mediante dinamómetro analógico y estudio del colágeno por análisis digital de imagen (morfometría).
La serie definitiva estaba constituida por 72 conejos, distribuidos en grupos de 4 animales para el análisis histológico y morfométrico, y 4 para el análisis biomecánico por cada período de sacrificio y para cada grupo de tratamiento. Los períodos de sacrificio de los conejos fueron: a la semana, a las 3 semanas y a las 6 semanas (tabla 1).
Se utilizaron conejos blancos machos de la raza Nueva Zelanda, con un peso comprendido entre 2,3-3,6 kg. Los animales fueron acondicionados 2 semanas antes de ser operados en jaulas individuales de 65x50x40 cm, y se les permitió comer y beber ad libitum.
Los conejos fueron tratados de acuerdo con las recomendaciones recogidas en las disposiciones legales del Consejo de Europa (Directiva 86/609/CEE) y Real Decreto 223/1988 de 14 de marzo.
Los animales fueron anestesiados con atropina (0,1 mg/kg), diacepam (0,5 mg/kg), ketamina (50 mg/kg) y mepivacaína (2%). Se aplicó profilaxis antiinfecciosa preoperatoria con cefuroxima (30 mg/kg). Una vez conseguida la anestesia se rasuraron las 2 patas traseras del conejo. Para el sacrificio de los conejos se empleó suxametonio (succinilcolina) a dosis letal.
Rasuradas las patas posteriores del conejo, se prepararon de forma estéril aplicando povidona yodada y paños estériles, y se realizó una incisión transversal en bloque que incluyó la piel y el tendón a 10-15 mm de su inserción en el calcáneo. Se amplió la incisión en sentido proximal y distal, se abrió el paratendón de ambos cabos tendinosos y se identificó el tendón plantaris longus, el cual se extirpó.
Tanto para los tendones control (pata derecha) como para los problema (pata izquierda) se realizó una sutura central de tipo Kessler, modificada con propileno (Surgilene®) de 4/0 y una sutura peritendinosa continua con el mismo material de 6/0. No tratamos el paratendón. Se descargó de tensión la sutura mediante una incisión en la unión músculo-tendinosa. La piel se suturó con monofilamento de nailon de 4/0, y se vendaron las patas. Realizamos 3 grupos según los materiales que pretendíamos analizar. Grupo del ácido hialurónico: se aplicaron 0,2 ml de ácido hialurónico sobre la sutura antes del cierre cutáneo, y otros 0,2 ml de suero fisiológico en la pata control. Grupo del PTFE: la tenorrafia fue cubierta con una membrana de PTFE de 0,5 mm de grosor, y se ancló al tendón con un punto proximal y otro distal de polipropileno de 6/0 para evitar su migración. Grupo del periostio autólogo: se abordó la parte posterior de la tibia desde la misma incisión quirúrgica y extrajo una tira de periostio que se aplicó circunferencialmente a la zona de la sutura; el periostio se suturó sobre sí mismo con un punto distal y otro proximal de polipropileno de 6/0; en la pata control se extrajo otra tira de periostio de similares características para asemejar la agresión quirúrgica.
Tras el sacrificio de los conejos se extrajeron los tendones, abordándolos por la cicatriz quirúrgica, y se desinsertó el tendón de Aquiles de la unión músculo-tendinosa con el uso de un bisturí y del calcáneo.
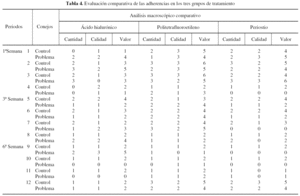
El análisis de las muestras se hizo mediante la graduación macroscópica de las adherencias con la aplicación de la escala de Tang et al9, que evalúa parámetros semicuantitativos de tamaño y calidad de la adherencia (tablas 2 y 3). El análisis biomecánico se realizó de la siguiente forma: los tendones fueron atravesados con alambre del nº 2 a 0,7-1 cm del sitio de la sutura. El extremo proximal se unió a un dinamómetro analógico, y en el distal se colocó una pinza de Köcher para transmitir la tensión. Se determinó la fuerza en kg a la que se produjo la ruptura de la sutura (fig. 1). El análisis histológico se llevó a cabo de modo siguiente: tras la evaluación macroscópica, los tendones fueron sumergidos inmediatamente en una solución de formol tamponado al 4% durante 48 horas, y luego se colocaron en una solución de alcohol de 80° para su conservación hasta el procesamiento que a continuación se describe.
Figura 1. Análisis biomecánico de la fuerza de ruptura de la sutura tendinosa.
Cada muestra fue dividida longitudinalmente en dos partes. Una de ellas se destinó para el análisis de la cicatrización tendinosa en los cortes longitudinales del tendón. De la otra mitad se tomó un bloque transversal que incluía la zona de sutura, y dos bloques proximal y distal a dicha zona para el examen transversal de la cicatriz tendinosa. Luego se incluyeron en parafina.
De los bloques del material incluido en parafina se tomaron 4 secciones histológicas de 4 µm, una para tinción de hematoxilina y eosina (microscopia óptica), una para tinción de rojo sirio (análisis digital de imagen) y las dos restantes quedaban como reserva. De los cortes teñidos con hematoxilina-eosina se hizo un análisis descriptivo histológico de cada muestra por un anatomopatólogo experimentado, y se calificaron de forma semicuantitativa de 0 a 3 los siguientes parámetros: madurez del tejido conjuntivo cicatricial, hiperplasia del epitendón, vascularización de la cicatriz, presencia de infiltrados inflamatorios y obliteración del espacio sinovial como traducción histológica de las adherencias.
Morfometría y análisis de imagen
El estudio de morfometría se realizó mediante el análisis digital de imagen sobre cortes longitudinales teñidos con rojo sirio, estudiando 10 campos tomados al azar de la zona de sutura, mediante el programa Visilog 4.1, que evaluó: superficie o área de la cicatriz ocupada por colágeno, perímetro del colágeno en la cicatriz y dispersión del colágeno o número Euler, como estimadores de la calidad de la cicatriz tendinosa. No se analizaron las adherencias.
El procedimiento de análisis de imagen consta de: a) Captura y preelaboración de imagen. Se captura en blanco y negro por la videocámara y se depura de las influencias inherentes al sistema de captura y de iluminación (fig. 2). b) Normalización de la imagen. Elimina la falta de uniformidad de iluminación presente en la imagen digital y normaliza los niveles de gris (fig. 3). c) Segmentación. Se aíslan los elementos de interés presentes en la imagen, que en nuestro caso son representados por las áreas de tejido fuertemente teñidas por el rojo sirio. El resultado final es una imagen binaria en dos tonos (fig. 4).
Figura 2. Morfometría: captura de la imagen digital.
Figura 3. Morfometría: imagen normalizada.
Figura 4. Morfometría: segmentación (imagen binaria).
Una vez procesada la imagen se mide automáticamente el área de colágeno eventualmente presente en la imagen, y se almacenan en ficheros de datos que permiten una fácil clasificación y utilización de los datos. El análisis estadístico de los resultados se realizó con el programa informático SPSS para Windows, versión 11.0.1 (SPSS Inc., Chicago, Illinois).
Para valorar la normalidad de las variables se aplicó la prueba de Kolmogorov-Smirnov. Para las comparaciones múltiples de medias de variables normales, o en su defecto de las transformadas por medio de la función logaritmo decimal de esas mismas variables, tras la realización del análisis de la varianza de dos vías (ANOVA), se utilizó el método de Student-Newman-Keuls. Para la comparación de variables cualitativas se utilizó la prueba χ2; para las muestras apareadas se usó la prueba de McNemar.
Para la comparación de los resultados del análisis de imagen para muestras pareadas se realizó el análisis de la varianza para muestras repetidas (ANOVA). El estudio de la correlación entre variables cuantitativas se hizo mediante el coeficiente de correlación de Pearson, y con análisis univariante para variables cualitativas y cuantitativas. En general se asumió como máximo error alfa en todas las pruebas anteriores el 5% (p < 0,05).
RESULTADOS
Resultados quirúrgicos
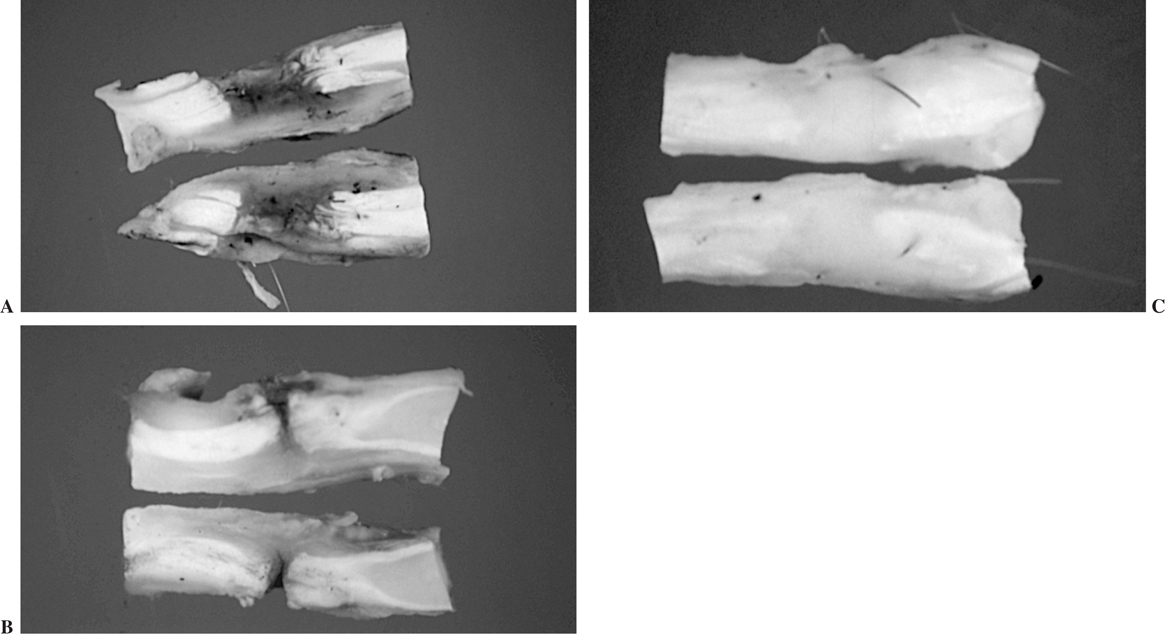
En el grupo del ácido hialurónico se produjo la muerte de un conejo a la semana de la operación. Se observó infección macroscópica con presencia de exudado purulento en la pata experimental de un conejo perteneciente al período de sacrificio de las 6 semanas. Ambos conejos fueron excluidos de los análisis y se reemplazaron por otros dos animales. En todos los casos en los que fue aplicado el ácido hialurónico, se observó una solución de continuidad en la sutura, de longitud variable y ocupada por un tejido fibroso (figs. 5A, B y C).
Figura 5. Solución de continuidad en la sutura de tendones tratados con ácido hialurónico. (A) 1 semana. (B) 3 semanas. (C) 6 semanas.
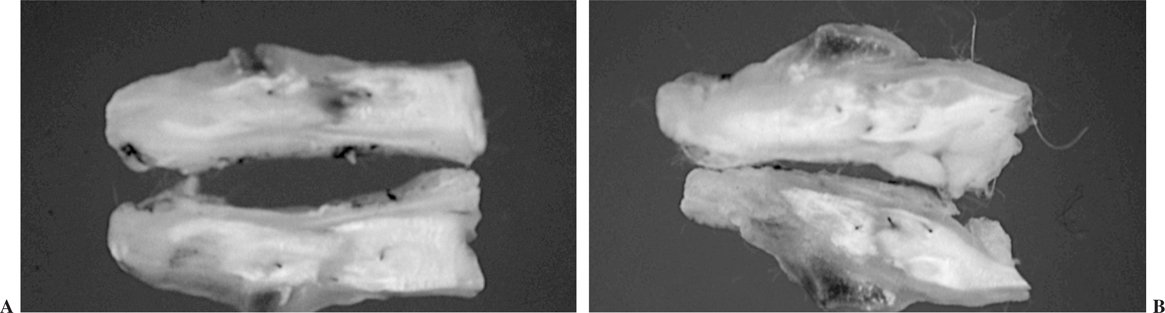
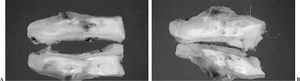
En el grupo del PTFE se produjo la muerte de un animal a las 2 semanas de la operación por causas ajenas a la cirugía. Se sustituyó por otro animal que fue sacrificado a las 3 semanas. En el grupo del periostio se apreció la presencia de calcificaciones macroscópicas en la zona de la sutura en 2 de los 4 animales del período de las 3 semanas y en uno perteneciente al período de las 6 semanas (figs. 6A y B).
Figura 6. Calcificaciones macroscópicas en tendones tratados con periostio. (A) 3 semanas. (B) 6 semanas.
Resultados y descripción macroscópica (tabla 4)
Grupo del ácido hialurónico
En la mayoría de los casos y los períodos, los tendones problema habían sufrido una dehiscencia al nivel de la sutura en diferente cuantía. No encontramos diferencias en la cantidad, calidad o valor total de adherencias entre los tendones control y problema según los criterios de Tang et al pasadas 1, 3 y 6 semanas (χ2; p=0,625). Aunque durante la primera semana el 75% de las adherencias eran >5 mm, después de la tercera semana el porcentaje de adherencias >5 mm baja al 25% de los casos.
Grupo del PTFE
Los tendones cuya zona de sutura había sido cubierta con PTFE mostraban un mayor número de adherencias y más densas. No encontramos diferencias en la cantidad, calidad o valor total de adherencias entre los tendones control y problema en los 3 períodos de sacrificio (χ2; p=1.000). De nuevo, las adherencias >5 mm predominaban en la primera semana (75% de los controles y problema) y disminuían su incidencia conforme se prolongaba el seguimiento (25% a las 6 semanas para controles y tendones tratados).
Grupo del periostio
En los tendones tratados con periostio se advirtió la presencia de calcificaciones macroscópicas en la zona donde se depositó la membrana de periostio. No encontramos diferencias estadísticamente significativas en la cantidad, calidad y puntuación global de las adherencias en los tendones control y problema para los períodos de seguimiento estudiados (χ2; p=0,625).
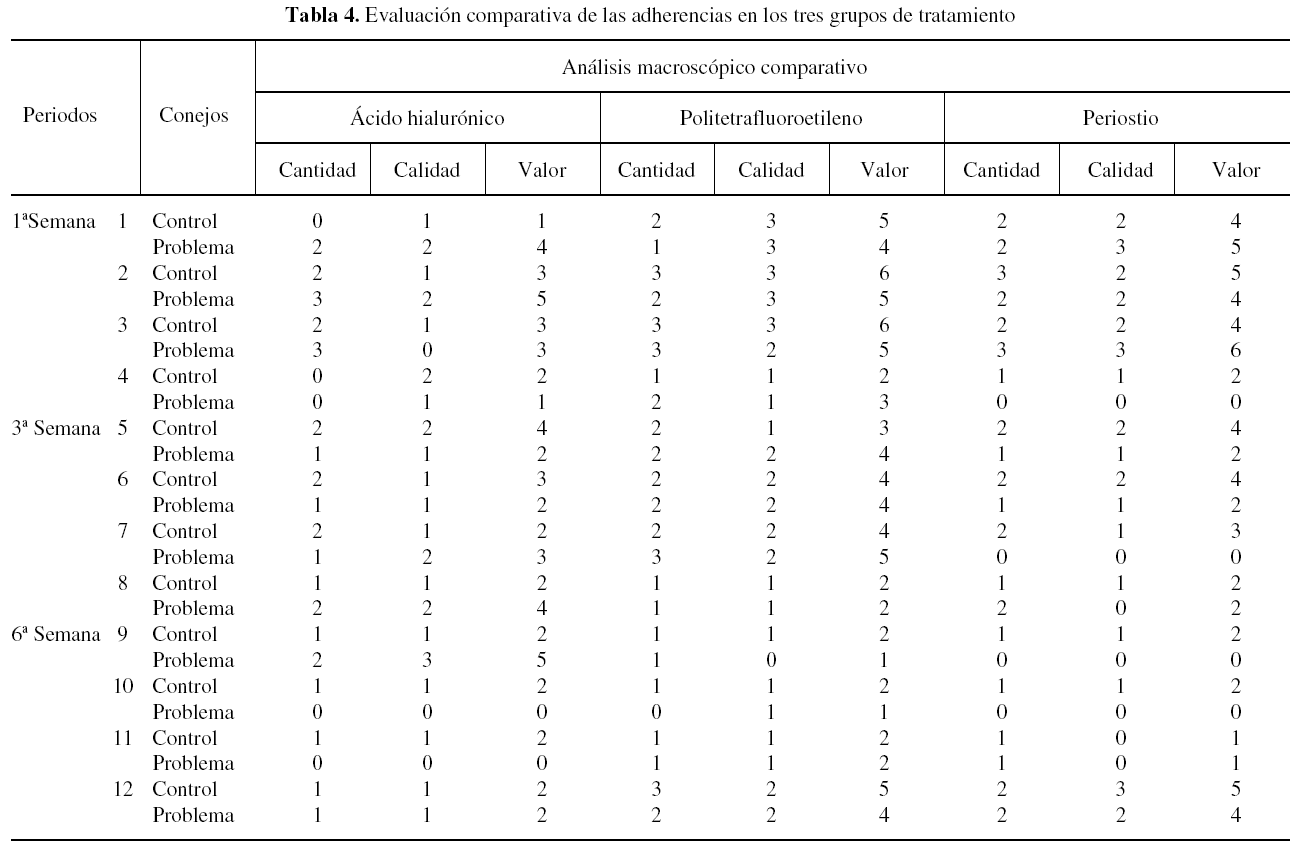
Resultados macroscópicos comparativos
El grupo problema, que en su conjunto desarrolló una menor reacción adherencial, fue el grupo al que se interpuso periostio sobre la sutura. La mayor reacción adherencial correspondió al grupo de la vaina de PTFE. Las diferencias fueron estadísticamente significativas (χ2; p < 0,05), y las observamos entre los distintos grupos de tratamiento y no dentro del mismo grupo (tabla 4).
Resultados biomecánicos (fig. 7)
Figura 7. Resultados biomecánicos comparativos. PTFE: politetrafluoroetileno.
Grupo del ácido hialurónico
Se realizó análisis de la varianza de 2 vías para comparar los tendones control con los problema y a través de los 3 períodos de sacrificio, constatándose diferencias estadísticamente significativas (ANOVA; p < 0,001) a favor de los tendones tratados con ácido hialurónico con respecto a los controles. Hubo diferencias entre los períodos de seguimiento, siendo las cicatrices tendinosas más fuertes las que correspondían al período de las 6 semanas.
Grupo del PTFE
El análisis estadístico (ANOVA) mostró diferencias significativas (p < 0,001) tanto entre los períodos de seguimiento como entre los controles y los problemas. En esta última comparación, las diferencias se obtuvieron a favor de los tendones control en la semana 1, y a favor de los tendones tratados en las semanas 3 y 6.
Grupo del periostio
La realización del ANOVA para muestras repetidas mostró diferencias significativas (p < 0,001) a favor de los tendones tratados con periostio y en los distintos períodos de sacrificio.
Comparación de los resultados del análisis biomecánico de los tres grupos experimentales
La aplicación de la prueba del análisis de la varianza de 2 vías mostró diferencias estadísticamente significativas (p < 0,001) tanto entre los distintos tipos de tratamiento, como entre los períodos de sacrificio y entre los tendones problema, a favor de los tratados con ácido hialurónico y periostio, pero sin que hubiera diferencias significativas entre estos dos últimos.
Resultados histológicos descriptivos
Grupo del ácido hialurónico
Controles.Semana 1. Los cambios más relevantes a la semana de la operación fueron la presencia de invasión del tejido conjuntivo de la vaina tendinosa con fusión con el paratendón, a expensas de abundante tejido conjuntivo laxo, con presencia de células mononucleadas inflamatorias dispersas junto a ocasionales granulocitos y marcada hiperplasia capilar. En las zonas más proximales se advirtió hiperplasia de la sinovial de revestimiento e incluso poliestratificación del mismo.
Semana 3. El infiltrado inflamatorio tendía a estar constituido por células mononucleadas, predominantemente histiocitos y células plasmáticas y, en algún caso, granulocitos eosinófilos.
Semana 6. A las 6 semanas, se observaron quistes epiteliales en torno a los trayectos del hilo de sutura en los cortes transversales. Se advirtió maduración casi total del tejido conjuntivo cicatricial hacia tejido conjuntivo denso, con tendencia a la fasciculación, aunque por zonas se identificó fasciculación transversal en relación con los puntos de sutura. Hubo disminución de la celularidad inflamatoria y de la proliferación vascular. Se seguían observando zonas de obliteración del espacio sinovial como traducción histológica de las adherencias peritendinosas. En algunos animales, junto a proliferación del tejido conjuntivo denso en fase de reorientación fibrilar, se observó depósito intenso de colágeno, prácticamente acelular, dispuesto concéntricamente en torno al hilo de sutura.
Casos.Semana 1. Se observó un retraso en la cicatrización con respecto al control a la semana de la operación. Se presenciaron cúmulos de fibrina en el seno de una red fibrinosa laxa que estaba siendo invadida por tejido conjuntivo inmaduro. En la zona central del tendón se apreció persistencia de fibrina con tejido conjuntivo inmaduro que la invadía desde la periferia. Este aspecto inmaduro del tejido conjuntivo lo identificó como tejido de granulación.
En algunos casos, se presentó dehiscencia de la sutura, asociada a la presencia de abscesos microscópicos. En aquellos conejos que presentaron este tipo de complicación se realizó el estudio histológico, demostrándose la presencia de fascículos tendinosos y tejido conjuntivo con fenómenos de necrosis, infiltración masiva por granulocitos neutrófilos, los cuales se transformaban por piocitos y constituían microabcesos. La capa de revestimiento de la vaina tendinosa mostró hiperplasia focal asociada a infiltración granulocítica, así como ulceración.
En la zona de sutura se observó sustitución de los fascículos tendinosos de tejido conjuntivo denso por tejido conjuntivo más inmaduro, con mayor celularidad y desorganización de su patrón fascicular. Ocasionalmente, se advirtió la presencia de células gigantes multinucleadas, así como espacios artefactuales vacíos que previamente al corte eran ocupados por el hilo de sutura. En la vecindad de estos espacios se observaron extensas áreas de calcificación distrófica en algunos conejos.
Se distinguieron dos grupos de cicatrización entre los tendones: aquellos con cicatrización similar a los controles, y aquellos con una cicatrización deficiente constituida por tejido de granulación más laxo y que se extendía hasta la tercera semana.
Semanas 3 y 6. A las 3 semanas de la cirugía, se aprecia, en general, una maduración progresiva del tejido cicatricial que comienza a recuperar la estructura fascicular. Al igual que en los controles, conforme aumentaba el tiempo de evolución disminuía la vascularización y desaparecían los infiltrados inflamatorios. La obliteración del espacio sinovial en la zona de la sección tendinosa era la norma, siendo casi imposible distinguir aquella capa de células aplanadas, dispuestas en pocos estratos, y que limitaban el paratendón.
No encontramos diferencias estadísticamente significativas en cuanto a la madurez del tejido conjuntivo y disposición de las fibras del colágeno, hiperplasia del epitendón, vascularización, presencia de infiltrados inflamatorios y obliteración del espacio sinovial entre la pata problema y la pata control por cada uno de los períodos de sacrificio.
Grupo del PTFE
Controles. Los resultados histológicos fueron similares a los descritos para los tendones control del grupo del ácido hialurónico.
Casos.Semana 1. Una semana después de la operación, se identifica perfectamente la estructura de la membrana interpuesta, la cual es colonizada por capilares y células inflamatorias de tipo macrofágico procedentes del huésped. En contacto con ella, se aprecia tejido de granulación con fibrosis incipiente y rico en vasos capilares. Se aprecian también áreas de hemorragia y áreas de tejido conjuntivo mixoide inmaduro. Existen cúmulos de granulocitos neutrófilos por zonas. Exteriormente a la membrana, hay macrófagos fagocitando hilo de sutura y material procedente de la membrana.
En algunos, a diferencia de lo descrito anteriormente, no se observó persistencia de la estructura del PTFE, sino que donde ésta se ubicaba se apreciaba infiltración masiva granulomatosa, con presencia de macrófagos que fagocitan el material extraño. Restos de este material se encontraban dispersos entre el infiltrado inflamatorio, aunque se identificaba una apariencia vagamente laminar.
En un conejo, los cambios eran más evidentes. En los 2 tendones se apreció una marcada hiperplasia de la íntima con proliferación conjuntiva subintimal que sugería la presencia de una sinovitis serosa. Los animales con mayor respuesta cicatricial mostraron una degradación casi total del PTFE, cuyos restos estaban delimitados por células histiocitarias. Se acompañaban de proliferación fibrosa marcada y mayor respuesta inflamatoria.
Semana 3. A la tercera semana de la intervención, se apreciaba la progresión de la maduración del tejido conjuntivo. Persistía la inflamación y la infiltración granulomatosa en torno al PTFE mostraba una mayor proporción de células multinucleadas de cuerpo extraño. La calidad de la cicatrización intrínseca era buena. Por fuera de la membrana persistía una intensa reacción inflamatoria. La mayoría mostraban una sinovitis fibrosa.
Semana 6. El cambio más llamativo y constante era la presencia de una sinovitis proliferativa de intensidad media de la superficie del tendón en contacto con la vaina de PTFE. No encontramos diferencias estadísticamente significativas en la madurez, hiperplasia del epitendón, vascularización, infiltrados inflamatorios y obliteración del espacio sinovial entre los tendones control y problema en los distintos períodos de seguimientos de los conejos tratados con vaina de PTFE.
Grupo del periostio
Controles. Los hallazgos histológicos fueron análogos a los descritos para los tendones control del grupo del ácido hialurónico.
Casos.Semana 1. En algunos casos, se observaba menor maduración del tejido conjuntivo denso, con presencia de calcificaciones masivas acompañadas de osificación. Otros tendones mostraban distintos estadios madurativos de esta osificación condroide. En un caso había tejido óseo maduro.
Semana 3. Los hallazgos más constantes y llamativos en este período eran la presencia de hiperplasia sinovial y formación de hueso maduro en las zonas cubiertas por el periostio.
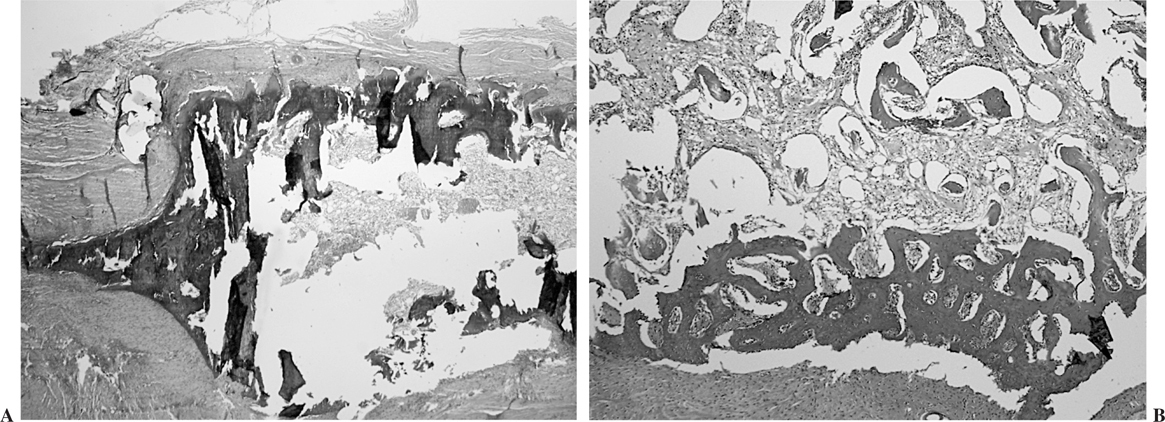
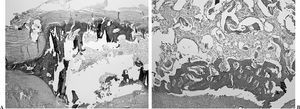
Semana 6. El tejido óseo maduro era constante y exuberante, pudiéndose apreciar médula ósea en el interior del mismo (fig. 8). La reorientación de las fibras de colágeno y la ocupación del espacio sinovial por tejido conjuntivo era similar a las descripciones previas. No encontramos diferencias estadísticamente significativas en la madurez, hiperplasia del epitendón, vascularización, infiltrados inflamatorios y obliteración del espacio sinovial entre los tendones control y problema en los distintos períodos de seguimientos de los conejos tratados con vaina de periostio.
Figura 8. Sección longitudinal de un tendón tratado con periostio a las 6 semanas de seguimiento. Se observa osificación (A), y en algunos casos presencia de médula ósea (B).
Resultados microscópicos comparativos
Se realizó la prueba de χ2 para la comparación de la madurez del tejido conjuntivo, hiperplasia del epitendón, vascularización, presencia de infiltrados inflamatorios y obliteración del espacio sinovial entre los tres grupos de tratamiento, y no observamos diferencias estadísticamente significativas entre ellos (ácido hialurónico, PTFE y periostio) en ninguno de los tres períodos de sacrificio.
Resultados morfométricos: análisis de imagen
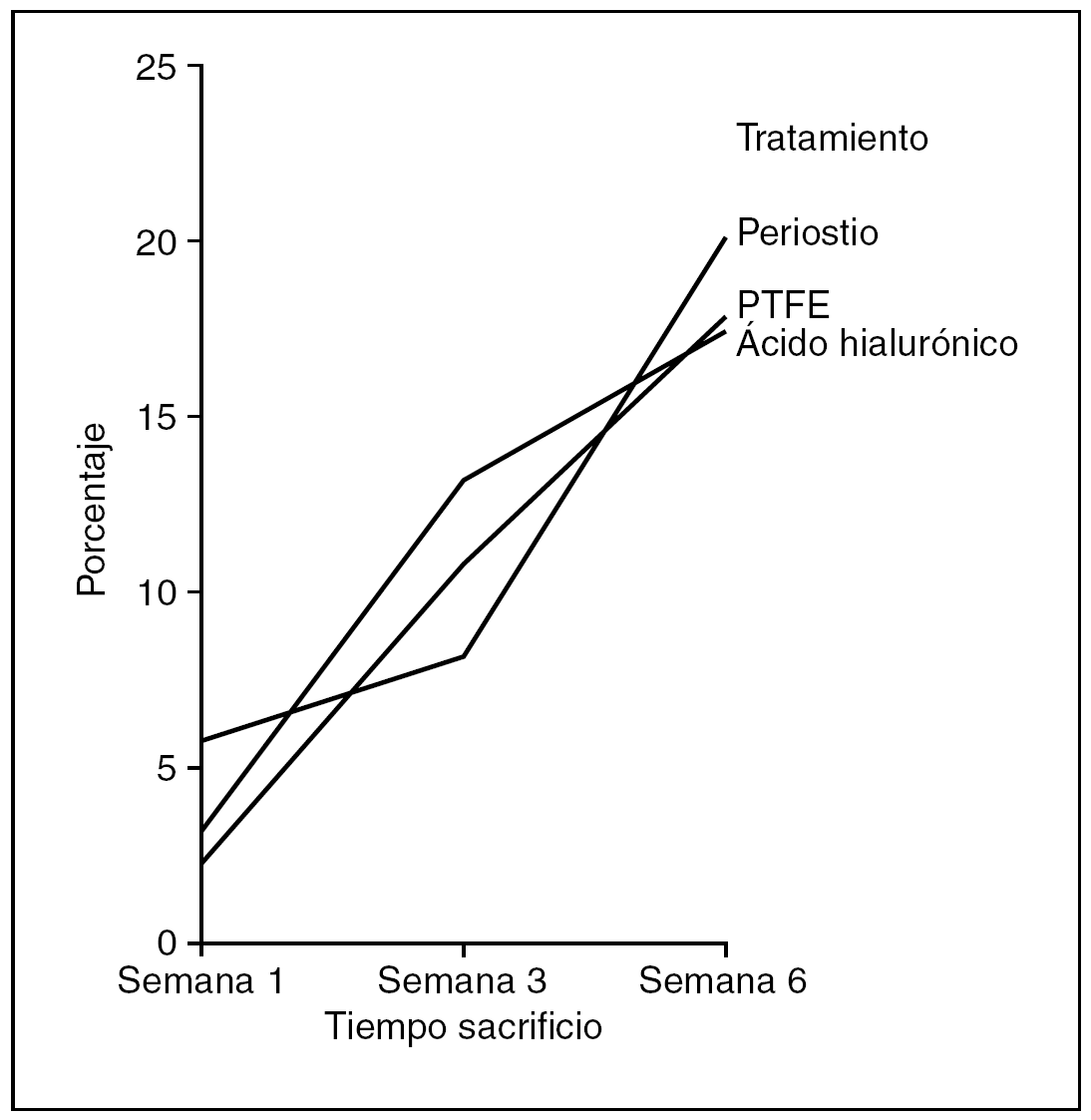
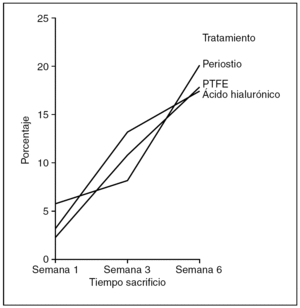
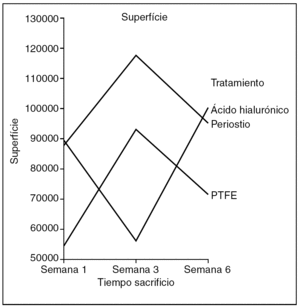
Superficie (fig. 9). No encontramos diferencias estadísticamente significativas en el área ocupada por el colágeno entre tendones control y problema de cada grupo de tratamiento (p=0,520), pero sí hubo diferencias estadísticamente significativas (p < 0,05) entre los tendones problema de los grupos de tratamiento.
Figura 9. Resultados morfométricos: superficie de la cicatriz tendinosa ocupada por colágeno. PTFE: politetrafluoreetileno.
El grupo de tendones tratados con periostio presentaba la mayor área de colagenización y el del ácido hialurónico la menor.
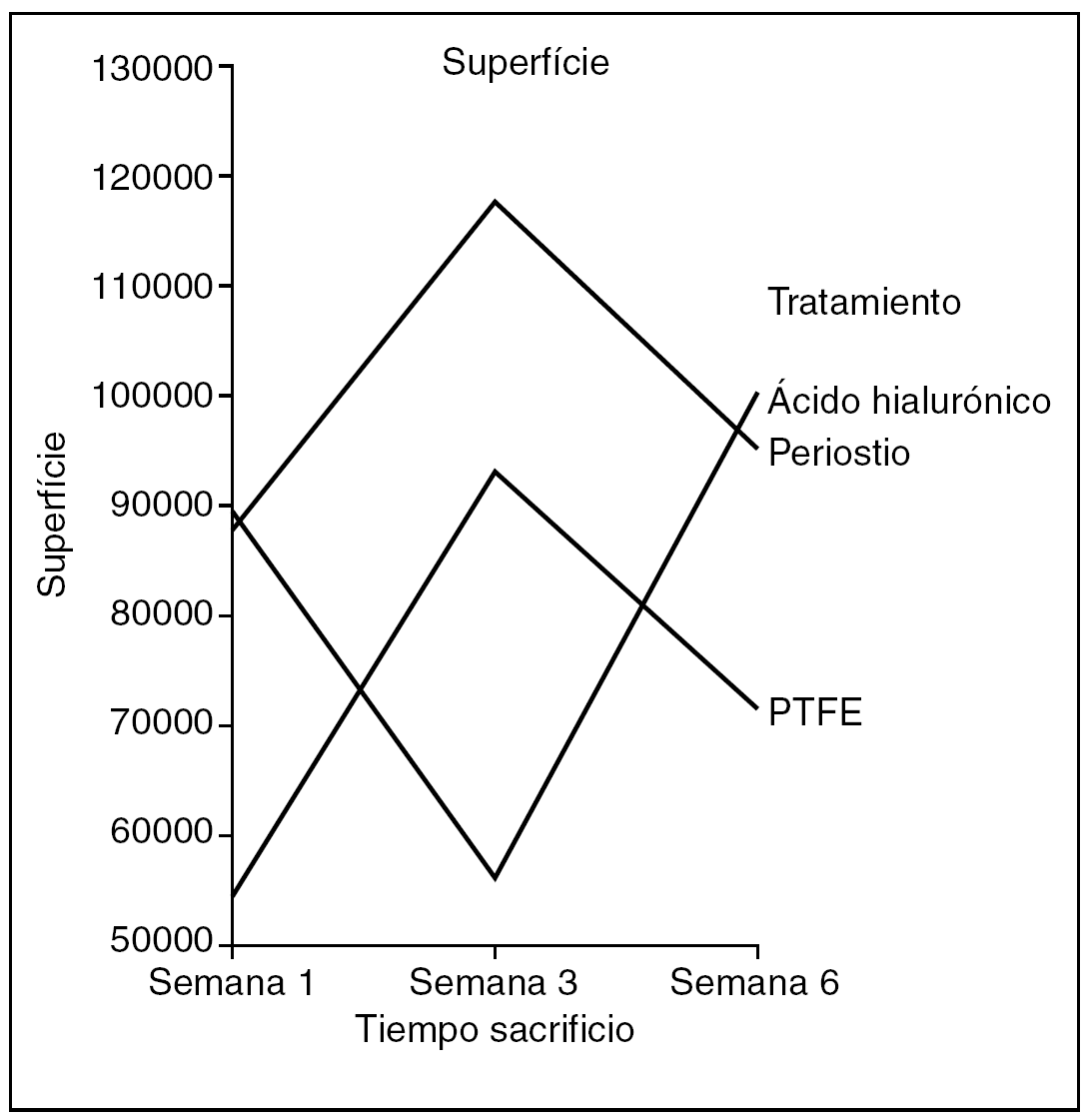
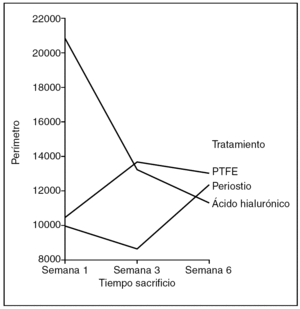
Perímetro (fig. 10). No hubo diferencias en el perímetro de la cicatriz entre tendones control y problema del mismo animal, ni entre distintos animales del mismo grupo de tratamiento, ni tan siquiera para el tiempo de evolución de la cicatriz
Figura 10. Resultados morfométricos: perímetro del colágeno en la cicatriz tendinosa. PTFE: politetrafluoroetileno.
Hubo diferencias estadísticamente significativas en el perímetro de la cicatriz entre los tendones problema de los distintos grupos de tratamiento, siendo la cicatriz de menor perímetro la que corresponde al grupo tratado con PTFE (ANOVA; p < 0,01).
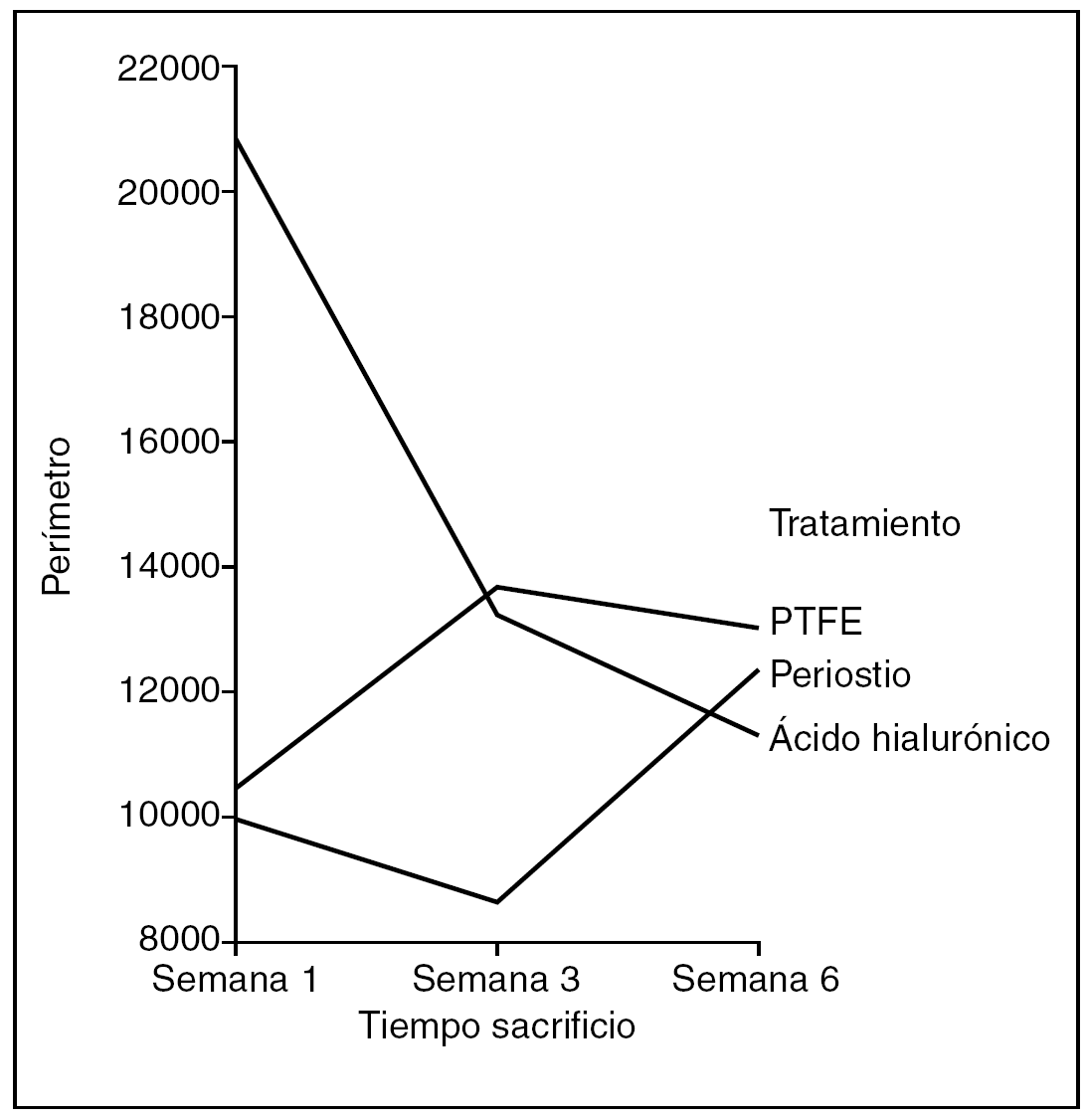
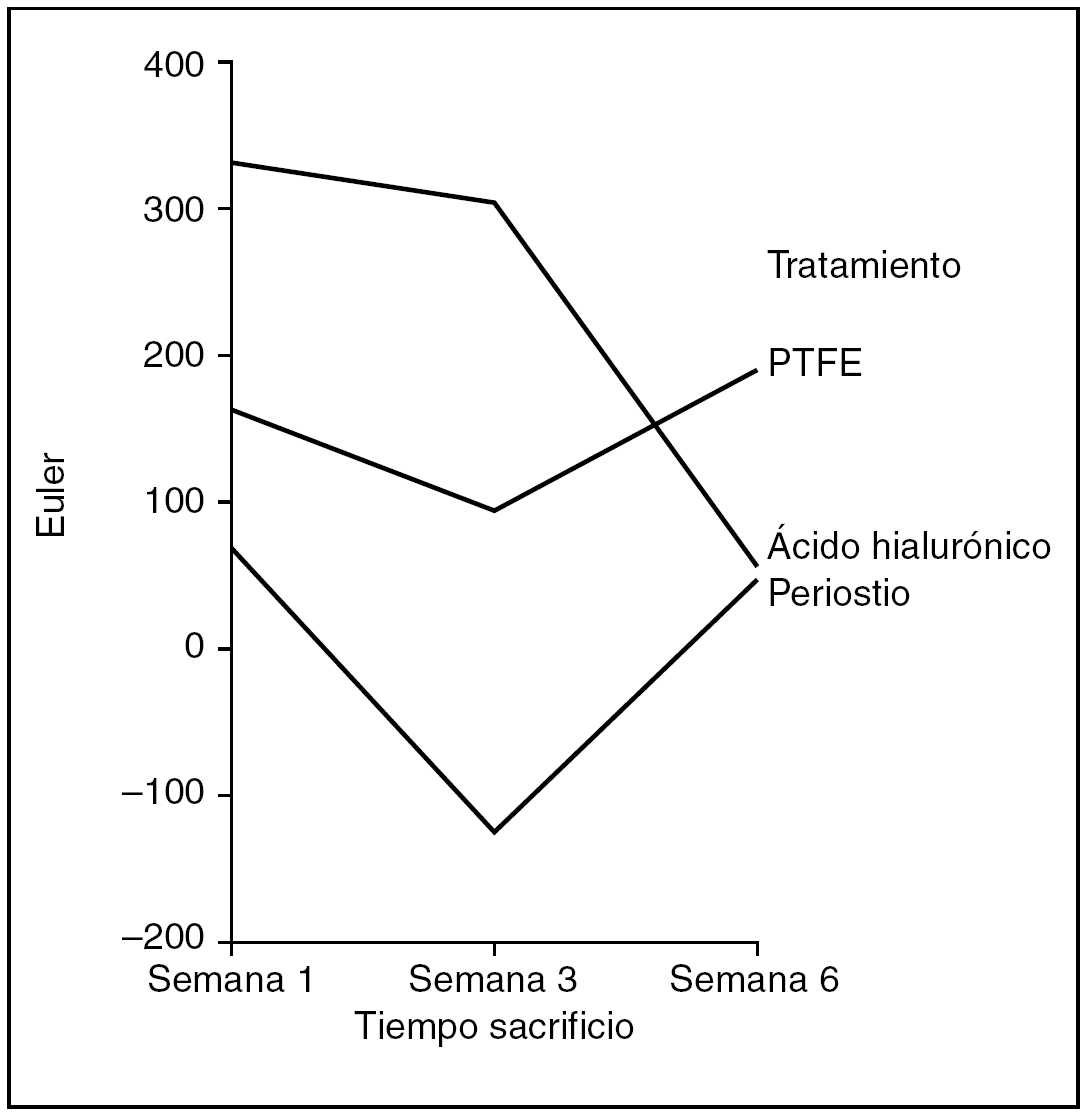
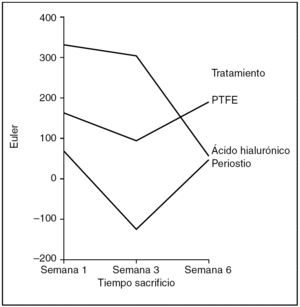
Número Euler (fig. 11). Como medida de mayor o menor dispersión del colágeno en la cicatriz utilizamos el parámetro número Euler. A mayor número Euler, mayor dispersión del colágeno y falta de madurez en la cicatriz, y viceversa.
Figura 11. Resultados morfométricos: número Euler en la cicatriz tendinosa. PTFE: politetrafluoroetileno.
Hubo diferencias estadísticamente significativas en el número Euler de la cicatriz entre los tendones problema de los distintos grupos de tratamiento, siendo las cicatrices con mayor número de Euler las que corresponden al grupo tratado con ácido hialurónico, y las de menor número y, por tanto, con un colágeno más compacto las tratadas con periostio (ANOVA; p < 0,01). También observamos diferencias estadísticamente significativas en el número de Euler según la antigüedad de la cicatriz, siendo las de mayor número Euler las que se observan en la primera semana de seguimiento, mostrando un menor número y, por tanto, una mayor compactación del colágeno la cicatriz de los tendones tratados con periostio (ANOVA; p < 0,05).
DISCUSIÓN
Los modelos animales experimentales empleados en el estudio de la cicatrización y formación de adherencias tendinosas desde los años sesenta han sido el conejo27-31, el perro32-35 y el pollo o gallina36-38. Existen una serie de trabajos en la literatura revisada28, 39-42 que avalan la bondad del tendón de Aquiles como modelo experimental de lesiones y reparación tendinosa43-46. Hemos preferido experimentar sobre secciones completas y sutura mediante técnicas habituales por pensar que la lesión y la reacción biológica a la misma presentarían mayores similitudes con las lesiones clínicas que habitualmente tratamos en seres humanos. Además, existe un apoyo bibliográfico sólido que sostiene que la sección completa se sigue de una reacción adherencial mucho más intensa que las secciones parciales30,39,40,42,47. El corte lo realizamos imitando las lesiones clínicas más frecuentes, en un solo plano desde la piel, e interesando la vaina sinovial. En nuestro modelo, no suturamos la vaina sinovial para que se produjeran más adherencias, y ver si la aplicación de las sustancias del estudio disminuía la formación de éstas y aceleraban el proceso de cicatrización.
Se ha empleado el periostio como sustrato en ingenieria tisular. El periostio contiene células madre mesenquimales pluripotenciales e indiferenciadas. Al poder ser trasplantado en su totalidad, puede servir como andamiaje o matriz sobre las que otras células y/o factores de crecimiento se puedan adherir. La aplicación de periostio en el tratamiento de defectos cartilaginosos es ya clásica24-26. Se podría pensar que el periostio puede diferenciarse en diferentes sentidos, según el ambiente tisular en el que se implante. Sin embargo, su aplicación sobre el tendón no modifica su diferenciación y sigue produciendo hueso.
Los estudios de análisis macroscópico de adherencias en tendones de conejo revisados son muy heterogéneos, en cuanto al tiempo de sacrificio y obtención de las muestras48-50, como para establecer comparaciones en cuanto al proceso cicatricial macroscópico en las 6 primeras semanas. En estas circunstancias la evolución descrita para los tendones control la tomamos como referencia para analizar la interferencia del ácido hialurónico, vaina de PTFE y periostio en la reacción adherencial. La evaluación macroscópica de las adherencias en los tendones problema sigue un comportamiento análogo al descrito en los tendones control para cada grupo de tratamiento. Estos resultados nos parecen de difícil interpretación, y nos hacen pensar en un patrón de cicatrización constitucional e individual de cada conejo o la posibilidad de la influencia de la reacción cicatricial de una pata en el proceso reparativo de la pata contralateral. Esta posibilidad se debería tener en consideración a la hora de realizar estudios experimentales sobre cirugía tendinosa.
La aplicación de técnicas de análisis digital de imagen en nuestro estudio ha demostrado diferencias no constatadas por los métodos de evaluación histológica clásicos de la cicatrización. La madurez de la cicatriz no mostraba diferencias estadísticamente significativas entre los distintos tendones problema en la evaluación microscópica.
El estudio histológico del proceso de reparación de los tendones utilizados como control en cada grupo de tratamiento no ha diferido en esencia de las observaciones publicada por autores previos33,51-55. El tejido de granulación que invade la zona de sutura desde la periferia ya fue descrito por Potenza51 y es la principal manifestación histológica del mecanismo de cicatrización extrínseco. El estudio de la cicatrización de diferentes tipos de injertos tendinosos autógenos intra y extrasinoviales en perro56-58 revela que la cicatrización de los tendones intrasinoviales es posible sin la formación de adherencias fibrovasculares. En nuestro modelo, la sección tendinosa se practicó en bloque desde la piel al tendón, interesando la vaina sinovial, y basándose en las experiencias citadas, podríamos responsabilizar a la lesión sinovial de gran parte de la proliferación conjuntiva periférica. El mecanismo de cicatrización extrínseca podría ser meramente una respuesta inflamatoria a la lesión tendinosa, lesión de la vaina e inmovilización, o podría ser un mecanismo esencial de la cicatrización del tendón. La evidencia científica actual tiende a apoyar lo primitivo que el mecanismo extrínseco es una respuesta inflamatoria a la lesión que participa en la cicatrización del tendón, pero no es esencial al proceso59. En cualquier caso, en la clínica habitual es imposible aislar la lesión de la vaina sinovial de la del tendón.
En nuestra experiencia y a diferencia de otros autores60-66 el ácido hialurónico no se ha mostrado eficaz en la prevención de adherencias, y sin embargo eran frecuentes las dehiscencias en la zona de sutura, a pesar de no estar sometida a tensión, y fue en el único grupo en el que observamos complicaciones sépticas. La presencia de estos microabcesos pudiera deberse a la inhibición de la actividad de los fagocitos mononucleares y otras células inflamatorias que esta sustancia parece producir66,67. Özgenel et al50 apreciaron que el ácido hialurónico inhibía la migración, proliferación y quimiotaxis de los linfocitos, la degranulación y fagocitosis de los granulocitos y la movilidad de los macrófagos. Por este mecanismo se produciría una disminución o inhibición de la respuesta inflamatoria inicial observada en los tendones tratados con ácido hialurónico. Así, la presencia de infecciones subclínicas demostradas por el estudio histológico podrían achacarse a la inhibición de la función de defensa que produce la aplicación del ácido hialurónico.
La interposición de PTFE sobre la sutura tendinosa en nuestro estudio no se ha mostrado eficaz en la prevención de adherencias en contraposición a otros estudios68-71 y se asocia con la menor densidad de colágeno en la cicatriz.
No tenemos constancia del empleo de periostio como cobertura de la sutura tendinosa en trabajos experimentales ni clínicos, y su asociación a la mejor colagenización de la cicatriz podrían hacer atractiva su aplicación en la clínica humana, pero no se ha mostrado significativamente útil en la prevención de adherencias con respecto a los controles, y su sistemática inducción de osificaciones heterotópicas interferiría con el deslizamiento del sistema tendinoso.
Nuestras principales conclusiones son que la interposición de periostio, ácido hialurónico y PTFE sobre la sutura tendinosa no reduce de forma significativa la formación de adherencias tras la cirugía reparadora del tendón con respecto a los controles. Entre ellos, el periostio conduce a una menor formación de adherencias que el ácido hialurónico y el PTFE.
El empleo de ácido hialurónico se asocia a la formación de abscesos macroscópicos o microscópicos en la primera semana postoperatoria. Es razonable apoyar la tesis de la alteración de la fagocitosis y/o de las defensas locales y que debe justificar su limitación en clínica humana.
La aplicación de técnicas de análisis digital de imagen en nuestro estudio ha demostrado diferencias no constatadas por los métodos de evaluación histológica clásicos de la cicatrización. La madurez de la cicatriz no mostraba diferencias estadísticamente significativas entre los distintos tendones problema en la evaluación microscópica.
La morfometría pone de manifiesto una mayor colagenización en la cicatriz de los tendones en los que se aplicó periostio, con respecto a los tratados con ácido hialurónico y PTFE.
No aconsejamos el uso de ácido hialurónico en cirugía tendinosa en seres humanos. En nuestra experiencia no se ha mostrado eficaz en la prevención de adherencias y, sin embargo, eran frecuentes las dehiscencias en la zona de sutura, a pesar de no estar sometida a tensión, y fue en el único grupo en el que observamos complicaciones sépticas.
Tampoco aconsejamos la interposición de PTFE sobre la sutura tendinosa en clínica humana, en nuestro estudio no se ha mostrado eficaz en la prevención de adherencias y se asocia con la menor densidad de colágeno en la cicatriz y resistencia a la ruptura de nuestra serie, ni el empleo de periostio como cobertura de la sutura tendinosa en seres humanos, pues no se ha mostrado significativamente útil en la prevención de adherencias, y a pesar de garantizar una buena fuerza tensil y la mejor colagenización de la cicatriz, su sistemática inducción de osificaciones heterotópicas interferiría con el deslizamiento del sistema tendinoso.
Conflicto de intereses. Los autores no hemos recibido ayuda económica alguna para la realización de este trabajo. Tampoco hemos firmado ningún acuerdo por el que vayamos a recibir beneficios u honorarios por parte de alguna entidad comercial. Por otra parte, ninguna entidad comercial ha pagado ni pagará a fundaciones, instituciones educativas u otras organizaciones sin ánimo de lucro a las que estemos afiliados.