Los bifosfonatos son compuestos químicos cuya principal acción sobre el metabolismo óseo es la inhibición de la reabsorción ósea. Su principal indicación médica, actualmente, es el tratamiento de la osteoporosis postmenopáusica, pero también puede administrarse en otras patologías que cursan con aumento de la reabsorción ósea.
Dentro de las patologías pediátricas han demostrado ser beneficiosos en la osteogénesis imperfecta (OI), especialmente, en las formas más graves, displasia fibrosa poliostótica, pacientes con grave afectación neuromuscular, osteoporosis secundaria al tratamiento con corticoides y también de forma experimental se están estudiando nuevas indicaciones como en la enfermedad de Perthes o en los alargamientos por distracción-osteogénesis.
La experiencia con estos fármacos en este tipo de patología aún es pequeña y existe todavía poco consenso en cuanto al tipo de bifosfonato, dosis, forma de administración más adecuada y duración del tratamiento.
Los efectos secundarios a largo plazo aún no son totalmente conocidos, por lo que debemos ser cautos a la hora de utilizarlos en este tipo de pacientes en crecimiento y sobre todo en las niñas al llegar a la edad fértil.
Bisphosphonates are chemical compounds which mainly act on bone metabolism by inhibiting bone resorption. Their main indication is currently the treatment of post-menopausal osteoporosis, but they can also be used in other diseases that involve an increase in bone resorption.
They have been shown to be beneficial in some paediatric diseases, such as osteogenesis imperfecta, particularly in the more severe forms, polyostotic fibrous dysplasia, patients with severe neuromuscular involvement, and corticosteroid-induced osteoporosis. New indications are also being studied experimentally, such as in Perthes disease or bone lengthening by distraction osteogenesis.
Although experience with bisphosphonates in these diseases is limited, and there is also little consensus as regards the most suitable type of bisphosphonate, the dose to use, the form of administration and on the duration of treatment.
The long-term secondary effects are still not well known, so caution must be used when using them in growing patients and particularly in girls when reaching fertile age.
Los bifosfonatos son compuestos químicos que han sido utilizados con diversos fines en la industria. El primer bifosfonato utilizado en humanos fue el etidronato, el cual fue sintetizado hace más de 100 años1,2.
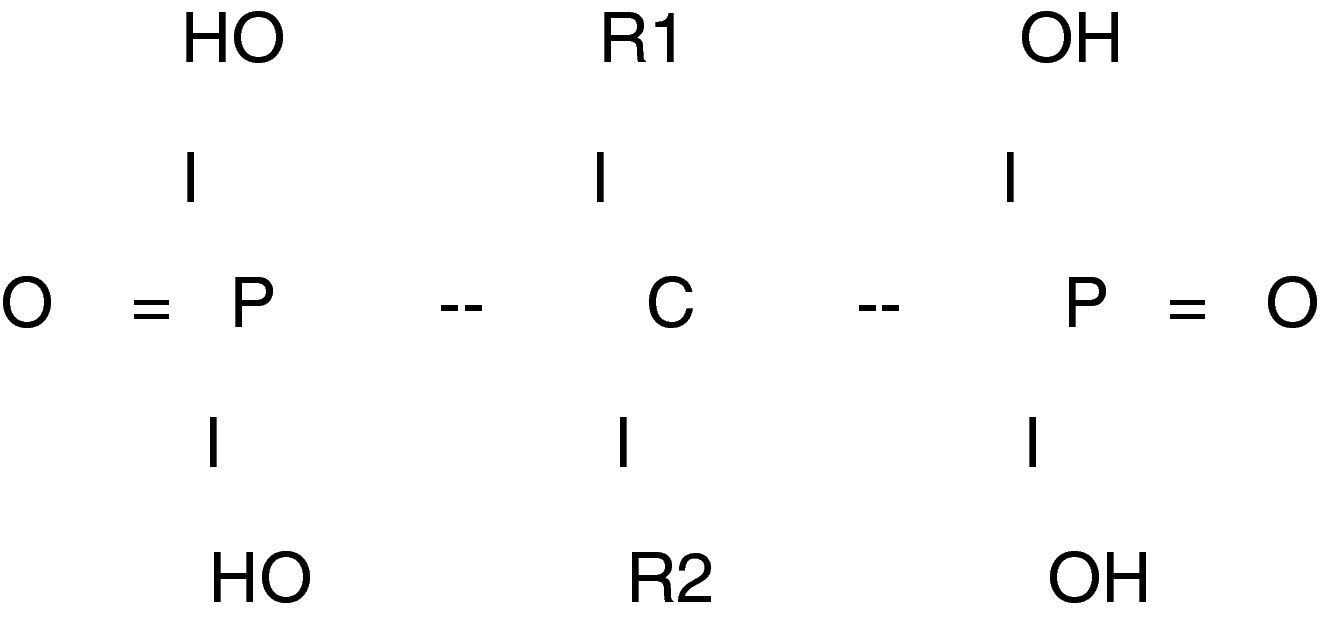
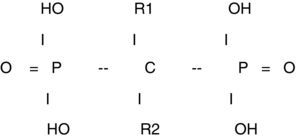
Químicamente son compuestos caracterizados por dos cadenas carbono-fosfato (P-C-P) localizadas en el mismo átomo de carbono. Además los bifosfonatos tienen dos grupos radicales en sus moléculas que se denominan R1y R2 y que están unidas al átomo de carbono (fig. 1). La presencia de estos grupos R permiten la introducción de numerosas sustituciones que conducen a la síntesis de un gran número de compuestos con diferentes propiedades, lo que hace que cada bifosfonato tenga sus propias características químicas, fisicoquímicas y biológicas y ello implica que sea difícil extrapolar los resultados de sus acciones de un compuesto a los otros3–5.
Sus efectos in vivo son la inhibición de la mineralización y la inhibición de la reabsorción ósea. Los grupos químicos en la posición R1 determinan la afinidad por el mineral óseo y los de la posición R2 la potencia de la acción antireabsortiva5.
Los primeros bifosfonatos utilizados en humanos fueron el etidronato y el clodronato, que tenían la misma potencia de inhibición de la mineralización y de inhibición de la reabsorción ósea. Por el contrario, los nuevos bifosfonatos (tiludronato, alendronato, pamidronato, risedronato, ibandronato y zoledronato), tienen un grupo hidroxilo (OH) en la posición R1, lo que da a la molécula una mayor afinidad para el hueso y un grupo amino en la cadena R2, lo que les confiere una mayor actividad antireabsortiva hasta 1.000 veces más potente pero sin gran inhibición de la mineralización ósea. A este grupo se les denomina aminobifosfonatos4.
Sus principales propiedades farmacológicas son su incorporación por el esqueleto, su fuerte unión a los cristales de hidroxiapatita, su acción supresora de la reabsorción ósea mediada por los osteoclastos, su permanencia durante mucho tiempo en el esqueleto y su eliminación por la orina sin metabolizar5.
El mecanismo de acción de los primeros bifosfonatos consistía en su metabolización en análogos no hidrolizables de adenosin trifosfato (ATP) citotóxicos que se acumulaban intracelularmente, inhibiendo la función de los osteoclastos e induciendo su apoptosis4,5. Los aminobifosfonatos, sin embargo, tienen un efecto directo sobre los osteoclastos al interferir en la vía metabólica intracelular del mevalonato, induciendo la apoptosis de los osteoclastos. Además, también tienen un efecto sobre otras células óseas, al impedir la formación de osteoclastos mediante la regulación de sus precursores, y al inhibir la reabsorción ósea vía osteoblastos al estimularlos para que produzcan un factor inhibidor de los osteoclastos5.
Debido a su mecanismo de acción, los bifosfonatos pueden ser utilizados en cualquier patología ósea donde los osteoclastos tengan un papel predominante. Dentro de las enfermedades metabólicas óseas, su primera indicación fue la enfermedad de Paget, que se caracteriza por áreas focales de recambio óseo aumentado. La administración de bifosfonatos se traduce en una rápida supresión de la reabsorción ósea seguida de una disminución de la formación ósea, de forma que el recambio óseo se aproxima más a la normalidad1.
Su indicación más importante por la alta prevalencia de la misma, es la osteoporosis postmeopáusica en la que son el tratamiento de elección. Se ha probado su eficacia para reducir el número de fracturas vertebrales y no vertebrales y para aumentar la densidad mineral ósea6. Debido a los buenos resultados de éstos fármacos en este tipo de patologías, las indicaciones se han ampliado para el tratamiento de la osteoporosis secundaria a corticoides y al trasplante de órganos, y también son los fármacos de elección en el tratamiento de la osteoporosis en hombres4.
Además, los bifosfonatos, también se utilizan en la mayoría de los procesos tumorales malignos con metástasis óseas y en la hipercalcemia maligna4.
En los últimos años, también se está estudiando el efecto de estos fármacos en otras patologías que cursan con un aumento de la reabsorción ósea, como en la necrosis avascular de la cabeza femoral7, aflojamiento aséptico de prótesis8 o tumor de células gigantes9.
Dentro de la patología pediátrica, vamos a ver la utilidad de los bifosfonatos en la osteogénesis imperfecta (OI), displasia fibrosa, osteoporosis secundaria a inmovilización en enfermedades neuromusculares, osteoporosis inducida por corticoides, y de forma experimental, en otras patologías. También discutiremos sus posibles efectos secundarios y las precauciones que deberemos tener en cuenta antes de utilizar estos fármacos en los niños.
Diagnóstico de osteoporosis en los niñosAntes de comenzar con las indicaciones de los bifosfonatos en la edad pediátrica, tenemos que hablar del diagnóstico de la osteoporosis en la edad pediátrica.
En la población adulta, la osteoporosis, se define como una densidad mineral ósea (DMO) baja con alteraciones de la microarquitectura del hueso que producen un aumento de la fragilidad ósea y un riesgo aumentado de fracturas10. La única forma objetiva que tenemos hoy en día de medir una DMO baja es mediante la densitometría, y hablamos de osteoporosis cuando los valores de T-score están por debajo de -2,5 desviaciones estándar11.
Pero estos criterios no son fácilmente aplicables a la edad pediátrica, porque la DMO cambia constantemente durante el crecimiento, según la masa corporal, masa ósea, sexo, edad puberal, maduración esquelética y raza12,13.
Las radiografías simples, aunque son las primeras pruebas que obtenemos en los niños con sospecha de osteoporosis, no nos proporcionan una determinación cuantitativa precisa de la DMO. Es necesaria una disminución del 30-40% de mineral para que sea evidente en una radiografía14. La densitometría, es hoy en día, la prueba más utilizada para cuantificar la masa esquelética por ser segura, precisa y relativamente económica12–14. Internacionalmente se ha llegado a un acuerdo sobre la definición de osteoporosis en la edad pediátrica (fig. 2), pero hemos de tener en cuenta que lo mejor es personalizar cada caso teniendo en cuenta las grandes variables que ya hemos comentado15.
Definición de osteoporosis en la edad pediátrica15.
La OI es un desorden genético producido por una mutación en uno de los genes del colágeno del tejido óseo, produciéndose un desarrollo óseo inadecuado que aumenta la fragilidad ósea y resulta en una masa ósea baja. La gravedad varía en un rango muy amplio desde fracturas intrauterinas y mortalidad perinatal hasta formas leves sin fracturas16–22.
La clasificación más utilizada es la de Sillence et al descrita en 1979 a la que se han añadido tres nuevos grupos16,20,23. La severidad de los distintos tipos es en orden de más a menos severa: tipo II > tipo III > tipos IV, V, VI, VII > tipo I (tabla 1). La OI tipo I comprende pacientes con la enfermedad leve y ausencia de deformidades graves, sin embargo, las fracturas vertebrales son frecuentes y pueden producir una escoliosis moderada. El tipo II es letal, generalmente por fallo respiratorio debido a múltiples fracturas costales. Los del tipo III tienen una estatura extremadamente corta, así como deformidades de las extremidades y raquis secundarias a múltiples fracturas. Los pacientes del tipo IV tienen deformidades óseas moderadas y una estatura corta variable.
Clasificación de la osteogénesis imperfecta de Sillence
| Tipo | Gravedad | Características | Mutaciones |
| I | Leve | Estatura normal o algo corta. Esclera azul. No DI | Stop prematuro codón COL1A1 |
| II | Letal perinatal | Múltiples fracturas de costillas y huesos largos al nacimiento. Grandes deformidades. Huesos largos ensanchados. Esclera oscura | Sustitución glicina en COL1A1 o COL1A2 |
| III | Muy deformante | Estatura muy corta. Cara triangular. Escoliosis severa. Esclera grisácea. DI | Sustitución glicina en COL1A1 o COL1A2 |
| IV | Moderadamente deformante | Estatura corta. Escoliosis de moderada a grave. Esclera grisácea o blanca. DI | Sustitución glicina en COL1A1 o COL1A2 |
| V | Moderadamente deformante | Estatura media o corta. Luxación cabeza radial. Membrana interósea mineralizada. Callos hiperplásicos. Esclera blanca. No DI | Desconocida |
| VI | De moderado a muy deformante | Estatura media. Escoliosis. Acumulación de osteoide en el tejido óseo. Esclera blanca. No DI | Desconocida |
| VII | Moderadamente deformante | Estatura algo corta. Húmero y fémur cortos. Coxa vara. Esclera blanca No DI. | Desconocida |
Tomada y modificada de Rauch F et al16.
DI: dentinogénesis imperfecta.
Dentro de los nuevos tipos de OI tenemos el tipo V, que es un desorden autonómico dominante con fragilidad ósea de moderada a severa. Se produce una osificación de la membrana interósea del antebrazo y predisposición a desarrollar callos hipertróficos. El tipo VI también es una forma de moderada a severa que se diagnostica en base al estudio anatomopatológico del hueso con un aumento de la cantidad de osteoide y un patrón anormal del hueso. El tipo VII es un desorden recesivo y sólo se ha observado en una comunidad de nativos americanos del norte de Québec. Además de fragilidad ósea presentan rizomielia y coxa vara a edades tempranas16,20.
Los objetivos del tratamiento de la OI son conseguir la mayor movilidad y capacidades funcionales posibles evitando las fracturas y deformidades óseas. Para ello disponemos de los programas de rehabilitación física que están encaminados a prevenir contracturas y pérdida de masa ósea por inmovilización, sin aumentar el riesgo de fracturas y la cirugía para corregir y prevenir deformidades mediante osteotomías y fijaciones intramedulares para conseguir la bipedestación y la deambulación16,21. Pero esto no mejora la extrema fragilidad ósea. Por eso se han buscado tratamientos médicos que aumenten la cantidad y la calidad ósea.
Durante muchos años se intentaron distintos tratamientos médicos con calcitonina, hormona de crecimiento, hormonas esteroideas, vitaminas C y D y distintos minerales, pero los resultados no fueron muy alentadores16,17,19,21–23.
En 1998, el grupo de Glorieux fue el primero en publicar una serie importante de niños con OI tratados con bifosfonatos y con buenos resultados17. En este trabajo, los autores recogen 30 niños con una edad entre 3 y 16 años de edad, con OI tipos III, IV y V graves con osteopenia importante tratados con pamidronato iv a dosis de 1,5-3mg/kg cada 4-6 meses durante 1,3-5 años, y observan un aumento de la DMO lumbar, ausencia de nuevos colapsos vertebrales, incluso recuperación de la altura de algunos de ellos y aumento del grosor de la cortical de los huesos largos. La respuesta más temprana fue la reducción del dolor óseo crónico con aumento del estatus funcional en 16 de los 30 pacientes. La incidencia de fracturas, disminuyó del 2,3/año al 0,6/año. No encontraron retrasos de la consolidación de las fracturas17.
A partir de este trabajo, muchos otros han aparecido en la literatura médica y hoy en día el uso de bifosfonatos en estos pacientes es una práctica habitual en los centros donde se trata esta patología. Los resultados observados por la mayoría de los autores son la disminución rápida e importante del dolor de espalda crónico con un aumento de la sensación de bienestar, la disminución del número de fracturas con un aumento rápido de la DMO lumbar y recuperación de la morfología y del tamaño normal de los cuerpos vertebrales colapsados16,19,21,23–26. Las dos series más largas, además demuestran un aumento de la movilidad en más del 50% de los pacientes tratados17,18. No se sabe aún si el tratamiento con bifosfonatos previene las deformidades de los huesos largos o la progresión de la escoliosis. Este tratamiento médico se debe combinar con el tratamiento fisioterápico y quirúrgico para obtener los mejores resultados.
En los pacientes en los que se ha realizado biopsia de hueso ilíaco, los estudios histomorfométricos demuestran que el principal efecto es el aumento del grosor de las corticales y también aumenta la cantidad de hueso trabecular al aumentar el número de trábeculas, pero no su grosor16,21,23,27.
Se han publicado dos meta-análisis respecto a la evidencia del tratamiento con BF en niños con OI. Este tipo de estudios es difícil porque aunque se publica mucho sobre el efecto de los BF en los niños con OI, suelen ser estudios descriptivos de casos con poco poder de evidencia y múltiples factores a tener en cuenta como edad, tipo de BF, dosis y duración del tratamiento, actuaciones quirúrgicas, fisioterapia y utilización de ortesis. Phillipi publica una revisión de Cochrane que recoge 8 estudios randomizados incluyendo 403 pacientes, de ellos, sólo un trabajo consigue una reducción significativa del riesgo de fracturas y del número de fracturas, aunque todos consiguen un aumento de la DMO28. Castillo y Samson-Fang, sólo encuentran 8 estudios con el suficiente nivel de evidencia. En todos ellos se confirma la mejoría de la densidad ósea y una reducción del 30-60% del riesgo de fractura22.
No existe un protocolo claro en cuanto al bifosfonato que se debe utilizar22, aunque la mayoría de autores utilizan el pamidronato intravenoso a dosis de 1mg/kg en tres días consecutivos cada 4 meses, siguiendo las directrices del grupo de Glorieux16,17,19,24,29.
También se han utilizado otros BF intravenosos como el zoledronato, de administración anual30,31, y el neridronato, similar al pamidronato, que se ha utiizado en adultos consiguiéndose un aumento significativo de la DMO16 y en niños con OI tipo III al nacimiento y a los 6 meses de edad, con buenos resultados23. El alendronato vía oral también ha demostrado su capacidad de aumentar la DMO, disminuir la frecuencia de fracturas, restablecer la morfología de los cuerpos vertebrales, y mejorar la movilidad de pacientes en edad escolar16,25,32. El olpadronato, también vía oral, se ha utilizado en un estudio controlado con placebo, tras dos años hubo un aumento de la DMO lumbar y una disminución de la incidencia de fracturas de huesos largos, sin observarse diferencias respecto a la movilidad o fuerza muscular33.
No hay suficiente evidencia para recomendar un BF concreto porque no hay estudios contra placebo que comparen distintas dosis, régimen de dosis o intervalos, aunque parece que el pamidronato iv es el que tiene un efecto más marcado en el dolor óseo16,18,19,23. Parece además que en niños los BF orales son difíciles de cumplimentar.
Tampoco existe una respuesta clara sobre qué tipo de pacientes se deben tratar. En la mayoría de las series se tratan pacientes con afectación grave, es decir, con deformidades de huesos largos, fracturas vertebrales por compresión y fracturas frecuentes, independientemente del tipo de OI, alteraciones genéticas o DMO, aunque generalmente se trata de pacientes con OI tipo III, IV, V y VI16,19,23,26.
Está en discusión el tratamiento con BF de las formas moderadas, es decir, con dos o menos fracturas por año, sin fracturas vertebrales por compresión y sin deformidades de huesos largos16,21. Todos los autores defienden que los valores de DMO aislados no deben de ser el único criterio para tratar un paciente16.
En cuanto a la edad en la que se debe comenzar el tratamiento, tampoco existe un acuerdo general, pero parece que al tratase de una enfermedad congénita, cuanto antes mejor. De hecho, los niños pequeños se benefician más del tratamiento que los adultos16,18,19,21,24.
Quizás el punto más controvertido es determinar cuándo se debe interrumpir el tratamiento. En ausencia de un consenso definitivo, el tratamiento generalmente se interrumpe cuando los valores de la DMO alcanzan la normalidad16,29. Land et al y Shapiro et al, sugieren que parece no haber mucho más beneficio en términos de reducción del número de fracturas y calidad de vida cuando se prolonga el tratamiento con pamidronato más allá de los 4 años23,34. Sin embargo, Ward29 presenta un caso de OI tipo IV que tras recibir tratamiento con pamidronato durante 2,5 años, los valores de DMO se normalizaron sin sufrir nuevas fracturas, por lo que se interrumpió el tratamiento. Al año de interrumpir el tratamiento, el paciente sufrió nuevas fracturas y un descenso importante en los valores de DMO a nivel del radio distal. Por ello, estos autores utilizan un protocolo de mantenimiento de 1mg/kg 1 día cada tres meses hasta el final del crecimiento. Glorieux, también recomienda el tratamiento intermitente hasta la maduración esquelética35. Otra alternativa pueden ser los bifosfonatos orales.
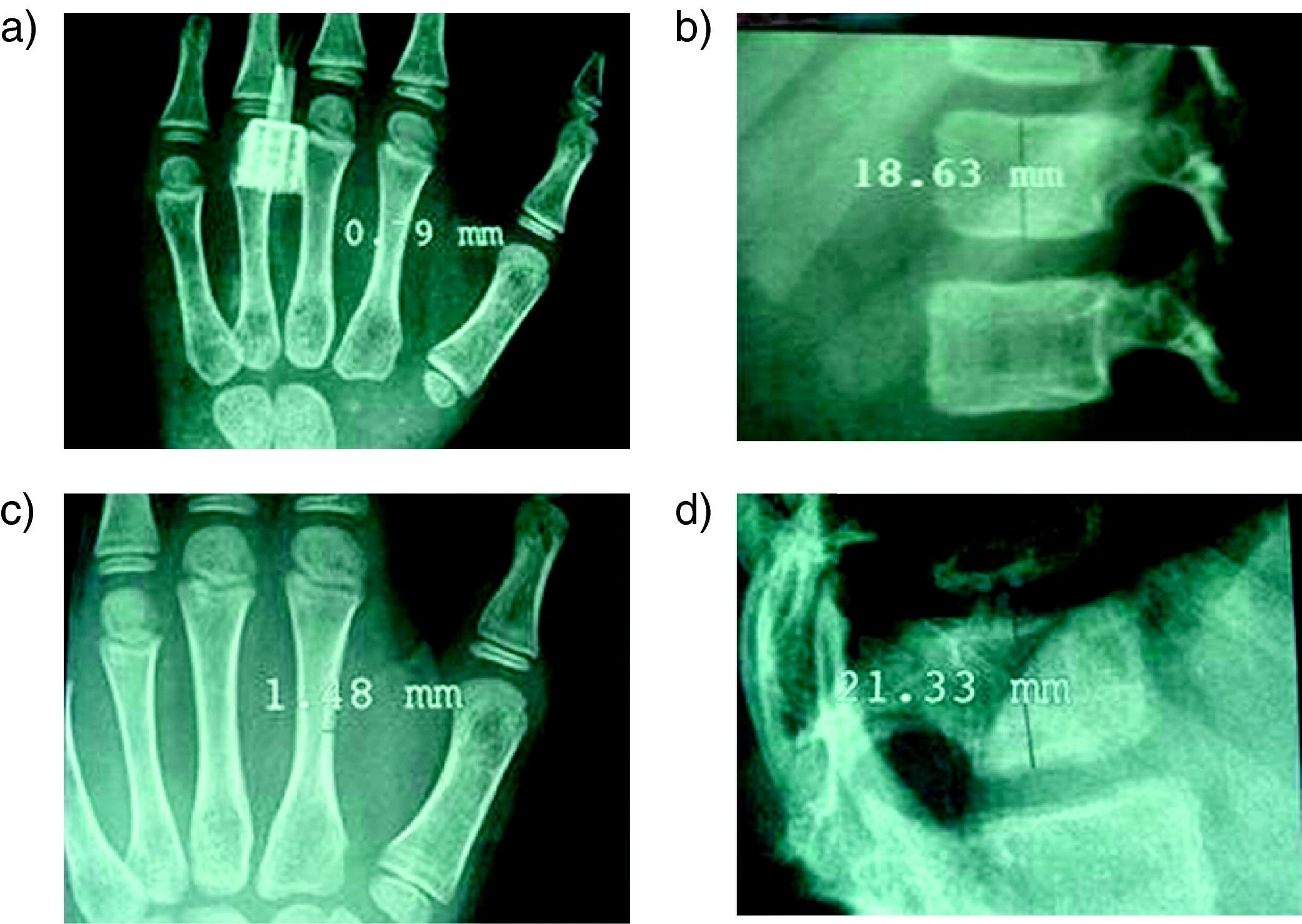
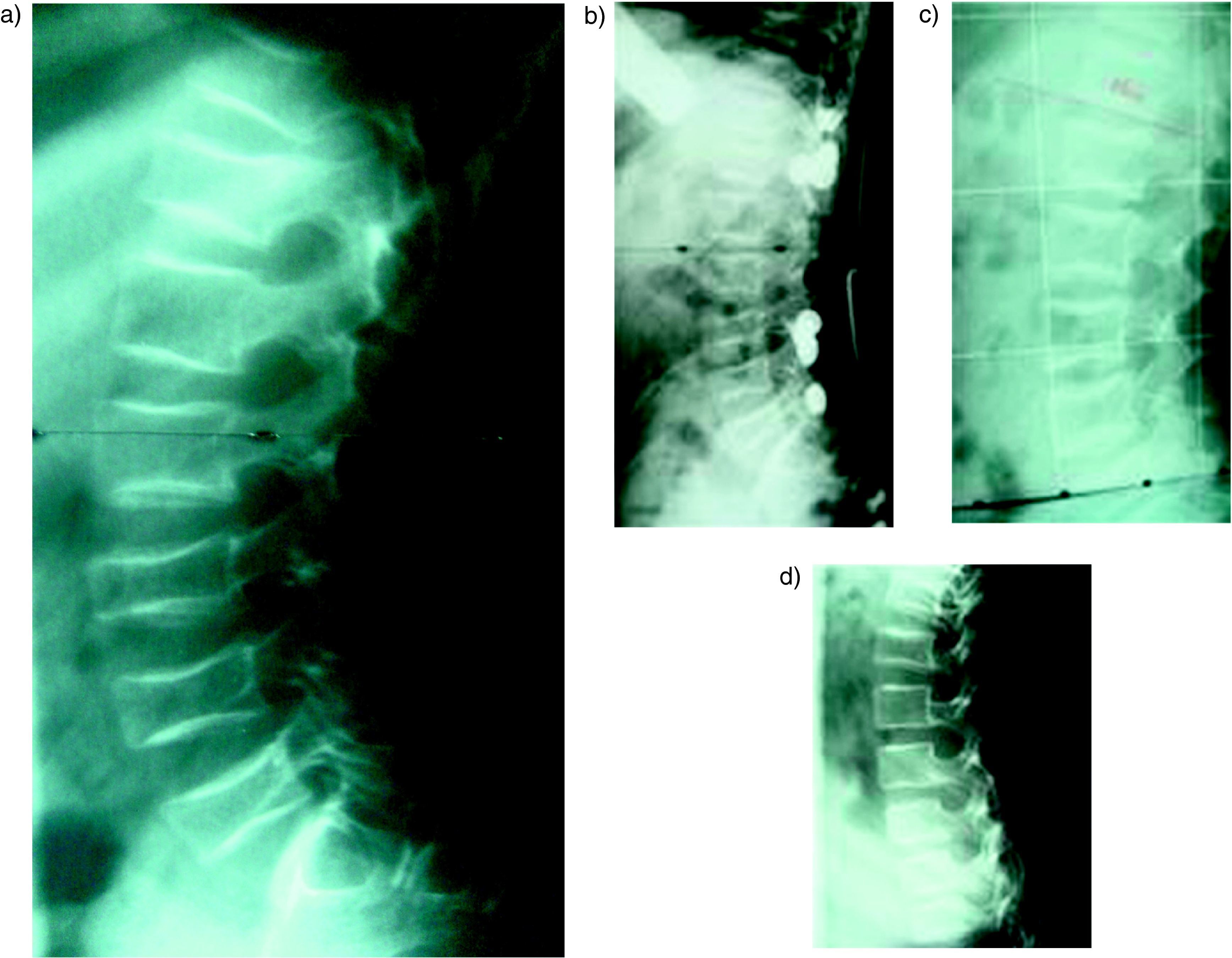
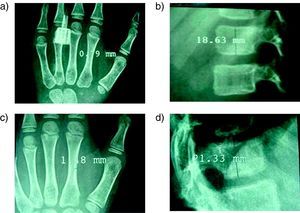
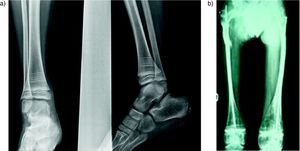
Nosotros hemos tratado 20 casos, todos ellos con afectación moderada o grave tipos I, III, y IV. Utilizamos el pamidronato intravenoso a las dosis descritas por Glorieux16. En todos los casos obtuvimos una disminución del número de fracturas y del dolor lumbar. En las densitometrías de control se observó un aumento de los valores de la DMO en raquis lumbar. En los controles radiográficos también encontramos resultados positivos realizando mediciones de la cortical del 2° metacarpiano de la mano izquierda y de la altura de la primera vértebra lumbar (fig. 3). En los pacientes que presentaban colapsos vertebrales, estos mejoraron radiográficamente con el tratamiento (fig. 4).
Imágenes radiográficas de la medición del efecto de los bifosfonatos en niños con OI tratados con pamidronato; a y b: radiografía de la mano izquierda con la medición del grosor de la cortical del 2° metacarpiano (a) y de la primera vértebra lumbar con medición de su altura (b) antes del tratamiento con bifosfonatos; c y d: mismas mediciones tras el tratamiento dónde se observa un aumento del grosor de la cortical (d) y de la altura de la primera vértebra lumbar (e).
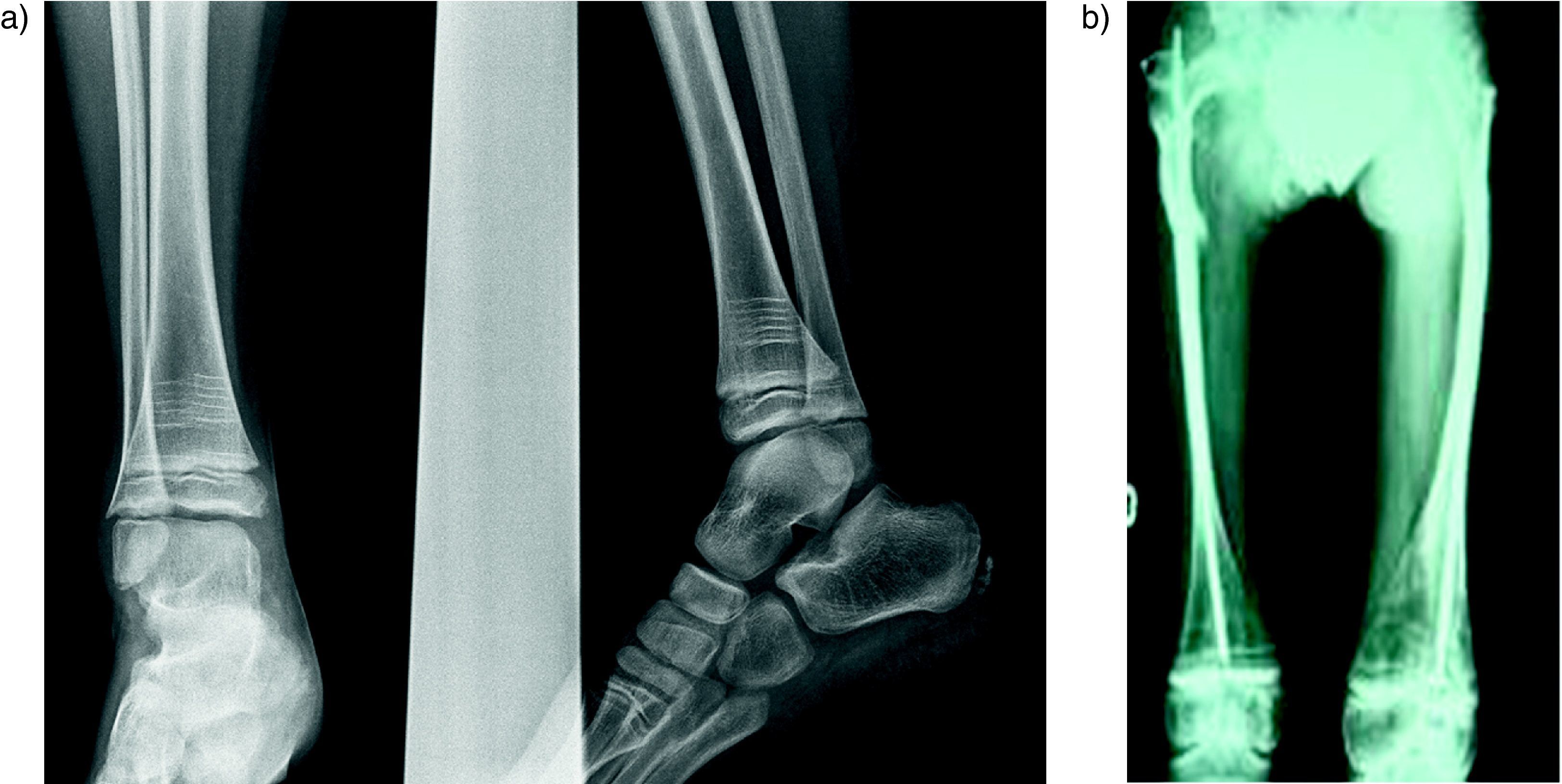
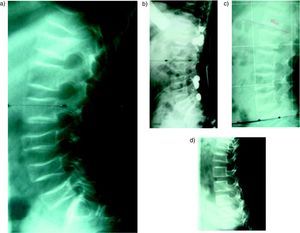
En los controles radiográficos de los niños tratados se pueden observar las líneas cebras, que corresponden a líneas densas metafisarias paralelas a la placa de crecimiento (fig. 5). Cada línea corresponde a un ciclo de tratamiento. Se forman a partir del cartílago calcificado que no se reabsorbe por la acción de los BF y hueso calcificado21. Estas líneas se van alejando de la placa de crecimiento con el tiempo, demostrando que el crecimiento de los huesos no se detiene a pesar del tratamiento.
Displasia fibrosaLa displasia fibrosa es una lesión ósea benigna, poco frecuente con un amplio espectro de afectación, en la que la médula ósea normal está reemplazada por tejido fibroso, conduciendo a una mayor fragilidad ósea36.
Si la lesión es única se denomina displasia fibrosa monostótica, si afecta a varios huesos se denomina poliostótica, y si además se une a la presencia de manchas cutáneas café con leche y alguna alteración endocrina como pubertad precoz, hipertiroidismo, exceso de hormona de crecimientou osteomalacia, entonces se conoce como síndrome de Mc-Cune-Albright36.
Su etiología es una mutación de la activación somática de la subunidad α de la proteína GS (GSα). El gen que codifica esta proteína se localiza en el cromosoma 20q1337.
La clínica comprende dolor, fracturas patológicas y deformidades, por lo tanto, los objetivos del tratamiento son la prevención de las deformidades y la prevención de las fracturas patológicas. Para ello utilizamos la cirugía, siendo los implantes intramedulares los de elección36.
Dentro del tratamiento médico, se han utilizando los bifosfonatos con resultados variables. Las series más largas son las publicadas por el grupo de Chapulart et al38 y el de Plotkin et al39. Chapulart et al publican una serie de 58 pacientes, de los que 17 eran menores de 18 años, con displasia fibrosa y tratados con pamidronato intravenoso y obtienen una disminución significativa del dolor en todos los casos que estaba presente, una disminución significativa de los marcadores bioquímicos de recambio óseo y en el 50% de los pacientes se observó una mejoría radiológica de las lesiones óseas con un aumento de la cortical y del relleno de las áreas líticas38. El grupo de Chapulart et al recoge 18 niños con displasia fibrosa poliostótica, también tratados con pamidronato iv a las mismas dosis. Estos autores también observan una disminución significativa del dolor óseo y de los marcadores bioquímicos, pero no encuentran mejorías radiológicas39.
Por lo tanto, parece que el alivio del dolor es el beneficio más obvio de este tratamiento y la mayoría de los autores justifican esta indicación37. La disminución de los marcadores bioquímicos que se observa es difícil de interpretar, y hay algunos autores que piensan que se produce a expensas del hueso sano que también se ve afectado por los bifosfonatos37.
Nuestra experiencia en esta patología es pequeña. Hemos tratado dos niños afectos de displasia fibrosa poliostótica. En todos ellos se observó una disminución subjetiva del dolor y una disminución de los marcadores bioquímicos de reabsorción. A nivel radiográfico, sólo en un caso pudimos observar un engrosamiento de la cortical.
Osteoporosis secundaria a inmovilización en enfermedades neuromuscularesSabemos que la incidencia de fracturas patológicas en los niños afectos de enfermedades neuromusculares es de un 5-40%40. La localización más frecuente de estas fracturas es a nivel de los huesos largos, sobre todo en el fémur40,41.
Estas se producen ante mínimos traumatismos o por estrés debido a una sobrecarga mecánica asociada a alteraciones de la marcha, que presentan estos pacientes. Pero además existen otros factores asociados como la tendencia a la caída, un pobre equilibrio, rigidez articular, alteraciones de la marcha y las manipulaciones durante la fisioterapia, aseo personal e incluso por maltrato40.
Existen muchos factores que colaboran a la baja DMO que presentan estos pacientes como factores mecánicos debido a que muchos de ellos no caminan y a las inmovilizaciones a las que se les somete tras procedimientos quirúrgicos, nutricionales, ya que estos pacientes suelen presentar dificultad para alimentarse, muchos de ellos reciben nutrición parenteral, presentan reflujo gastro-esofágico, problemas de inapetencia, insuficiente aporte de calcio y vitamina D en la dieta, y otros como el sobrepeso.
Pero además, también existen factores intrínsecos que favorecen la baja DMO como trastornos hormonales, suelen ser niños con bajo peso al nacimiento, que además experimentan menor crecimiento y muchos presentan factores genéticos asociados a la enfermedad neurológica que presenta. Otros factores como la baja exposición solar o tratamiento médicos con antiepilépticos y corticoides también colaboran a la osteoporosis de estos pacientes14,41.
Nuestra actitud como cirujanos ortopédicos será corregir aquellos factores que dependen de nosotros como los desequilibrios, en un solo acto quirúrgico, inmovilizar el tiempo imprescindible, recomendar actividad física regular y especialmente ejercicios en carga, y favorecer la carga precoz post-cirugía. Además, deberemos recomendar la corrección de los problemas nutricionales, asegurando que estos niños tengan una ingesta adecuada de Ca (1.200-1.500mg/día) y vitamina D (400 U), que se favorezca la exposición solar y que se utilicen antiepilépticos con menor impacto en DMO41.
Hoy en día sólo existen dos tratamientos que hayan demostrado, de forma significativa, un aumento de la DMO en este tipo de pacientes y son la fisioterapia con ejercicios de carga42 y el uso de bifosfonatos43.
Como ocurre en el resto de indicaciones que estamos repasando, el BF de elección, dosis, frecuencia, forma de administración y efectos a largo plazo siguen siendo desconocidos41,44.
Nuestra experiencia es limitada, habiendo tratado 5 casos de niños con afectación grave, no deambulantes GMFCS (Gross Motor Function Classification System) tipos IV y V con resultados muy buenos, al disminuir el número de fracturas y facilitando la fisioterapia y el manejo diario de estos pacientes. En todos ellos se consiguió un aumento de la DMO, del grosor de la cortical del 2° metacarpiano de la mano izquierda y de la altura de la primera vértebra lumbar.
Osteoporosis secundaria a corticoidesDurante los últimos años ha aumentado la supervivencia de niños con enfermedades crónicas cuyo tratamiento se basa en gran medida en la utilización de corticoides como son las enfermedades autoinmunes (artritis reumatoide juvenil), pulmonares, renales y procesos neoplásicos como la leucemia linfocítica aguda13,14.
En estos pacientes, la causa de la osteoporosis no sólo es la utilización de los corticoides en su tratamiento, si no que es un mecanismo multifactorial; suelen ser procesos crónicos que cursan con una disminución de la formación y un aumento de la reabsorción ósea. Además, estos niños tienen una disminución de la movilidad, mala nutrición y anormalidades hormonales13. También se ha descrito que las citocinas inflamatorias que se producen en muchos de estos procesos favorecen la disminución de la DMO13.
En estos pacientes las fracturas más frecuentes son las vertebrales13,14.
Las indicaciones para la utilización del tratamiento con BF suelen ser el colapso vertebral o el dolor óseo crónico en pacientes con DMO baja13.
Otras patologíasEnfermedad de PerthesDe forma experimental se están utilizando el tratamiento con BF para mantener la morfología de la cabeza femoral. El grupo de Little ha creado modelos de necrosis avascular en cabezas femoral de ratas y han observado como el tratamiento con zolendronato durante 6 semanas es capaz de conservar la arquitectura de la cabeza femoral en comparación con el grupo no tratado45. Kim et al, han creado un modelo experimental en cabeza de fémur de cerdos con fisis abiertas y han observado que tras producir una necrosis isquémica la arquitectura de la cabeza femoral se conseguía mantener con el tratamiento con ibandronato46.
Alargamientos óseos por distracción-osteogénesisLa distracción osteogénesis es una técnica efectiva utilizada para el tratamiento de dismetrías congénitas y postraumáticas. En esta técnica un hueso largo se separa por corticotomía y se somete a distracción lenta utilizando un fijador externo. El gap de distracción se va rellenando por nuevo hueso formado durante la distracción y después éste se remodela formándose la cortical. Se han intentado distintos procedimientos para aumentar el proceso anabólico como factores de crecimiento y proteína morfogenética. Pero también se pueden utilizar agentes catabólicos como los BF para alterar el recambio óseo a favor de la formación ósea.
Varios grupos de trabajo han estudiado el efecto de distintos BF, como el alendronato47,48, pamidronato49 y zoledronato50 en modelos de alargamiento por distracción osteogénesis en conejos inmaduros esqueléticamente.
Little et al examinan el efecto del pamidronato iv en la distracción ostegénesis de conejos inmaduros, observan que se produce un aumento de la DMO en el hueso formado. El estudio histológico demuestra un aumento en la formación de hueso y una disminución de la reabsorción49. Omi et al estudian el efecto del alendronato en un modelo de distracción osteogénesis en conejos, y parece que al aumentar la DMO mejora la formación ósea48.
Estos autores demuestran que durante la distracción ostegénesis se produce un aumento del recambio óseo, tanto de la formación como de la reabsorción ósea. Los BF disminuyen la reabsorción, aumentando la mineralización y las propiedades mecánicas, consiguiendo con ello acortar el proceso de alargamiento47–50.
Efectos secundariosHay que tener en cuenta, que hoy en día no existe ninguna indicación aprobada para la utilización de los BF en niños para ninguna de las patologías anteriormente citadas, por ello siempre deberemos obtener un consentimiento para la utilización de medicación de uso compasivo y deberemos informar a los padres de esta circunstancia.
Como efectos secundarios de los BF en los niños a corto plazo se ha descrito la reacción de fase aguda que se produce tras la primera administración intravenosa del fármaco y que se parece a un cuadro gripal. El cuadro es autolimitado, no es necesario interrumpir el tratamiento y se trata con antitérmicos16–24,26,27,30.
Más difícil es hablar de los efectos secundarios a largo plazo, ya que la experiencia de estos fármacos no es muy larga en el tiempo. Aunque es conocido que los bifosfonatos tienen un efecto acumulativo y permanecen fuertemente unidos al hueso durante mucho tiempo tras la interrupción del tratamiento, parece que tras 10 años de utilización de estos fármacos, podemos afirmar que los BF no alteran la consolidación de las fracturas, no afectan a las fisis, no disminuyen la tasa de crecimiento, ni afectan al inicio de la pubertad13. Los estudios histológicos no han revelado alteraciones de la estructura ni de la celularidad del hueso, sólo una disminución de la reabsorción16,21,23,27.
En animales se ha observado el paso a través de la placenta51. Los BF tiene un peso molecular bajo, por lo que pasan fácilmente a través de la placenta. En el feto en desarrollo, el recambio óseo es muy rápido, por lo que cualquier agente que interfiera en la formación ósea puede interferir en la reabsorción o mineralización. Se han realizado estudios en ratas y se ha observado que el alendronato atraviesa la placenta y se acumula en el esqueleto del feto aumentando la masa ósea, probablemente al disminuir la reabsorción ósea, afectando al crecimiento óseo y disminuyendo el crecimiento global del feto. Algunos autores llaman la atención sobre el riesgo de dar estas drogas en las mujeres en edad fértil y que deben interrumpir el tratamiento mucho tiempo antes de planificar un embarazo, porque los BF permanecen durante mucho tiempo en el hueso13,51.
Por el contrario, en la literatura han ido apareciendo descripción de casos de niñas en tratamiento con BF afectas de OI o displasia fibrosa que al llegar a la edad fértil han dado a luz y los niños nacidos no han tenido complicaciones e incluso en los casos de OI ha sido beneficioso para ellos52,53. Pero hay que tener en cuenta, que estos sólo son casos anecdóticos y aún deberemos esperar algunos años para conocer mejor la seguridad de estos fármacos.
Otro efecto secundario a largo plazo descrito es la aparición de un cuadro parecido a la osteopetrosis por el exceso de supresión de la reabsorción ósea. Whyte describe el caso de un niño, que tras ser tratado con pamidronato, a una dosis 4 veces la recomendada, durante tres años desarrolló un cuadro de osteopetrosis inducida por BF, pero la indicación de este fármaco en este paciente no está muy clara, parece que el niño no tenía una alteración del metabolismo óseo y que las dosis administradas eran mucho mayores que las utilizadas normalmente, y probablemente se produjo una supresión de la reabsorción mucho mayor que en los casos bien tratados y a las dosis correctas54. Estos autores están estudiando si hay algún factor predisponente para sufrir complicaciones por una excesiva supresión de la reabsorción causada por el tratamiento con BF, como lo ocurrido en el caso del niño que describen, para ello utilizan biopsias óseas, micro TC y marcadores óseos.
Aunque se ha descrito, la necrosis mandibular asociada por BF en adultos, no se ha publicado ningún caso en niños. Hay autores que han realizado revisiones para evaluar esta posible complicación y no han encontrado ningún caso en niños tratados con pamidronato y zoledronato intravenoso durante una media de 6 años e incluso en aquellos que han recibido tratamientos dentales invasivos55.
ConclusionesLos bifosfonatos son fármacos capaces de modificar el metabolismo óseo y los podemos emplear cuando hay un aumento de la reabsorción. Son fármacos seguros en los niños a corto plazo, pero habrá que esperar a conocer su repercusión a largo plazo. Son útiles en patologías pediátricas que cursan con un aumento de la fragilidad ósea, obteniéndose los mejores resultados en la OI grave. Se recomienda su uso en centros especializados con experiencia en la utilización de este tipo de fármacos.
Protección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosTodos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en el mismo. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Nivel de evidenciaNivel de evidencia V.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.