La artropatía de Charcot en el raquis es una afectación neuropática de la columna, es considerada una coindición inusual, tiene una evolución destructiva y progresiva. Habitualmente suele ser debida a una lesión traumática previa, pero también se ha descrito secundaria a otros procesos infecciosos, tumorales. Inicialmente siempre se ha planteado un tratamiento quirúgico para las posibles complicaciones como son el control del dolor y la inestabilidad del tronco. Se presenta una serie de 13 casos diagnosticados de artropatía de Charcot en el Institut Guttmann, donde se describen como variables: la etiología (traumática, infecciosa, iatrogénica), la clínica (dolor, pérdida de control de tronco, vegetatismo, espasticidad), el intervalo de aparición de la clínica, la localización (L2-L3), el tratamiento (quirúrgico o conservador) y la evolución que presentaron, y se pretende valorar el tratamiento conservador como primera opción, en lugar de la opción quirúrgica. En nuestra muestra, el 61,5% (8/13) fueron tratados quirúrgicamente con instrumentación posterior (7/8), salvo un caso que fue anterior y posterior; el 38,5% (5/13) fueron tratados de manera conservadora y ninguno necesito una cirugía posterior. En conclusión, nuestra línea de actuación sería inicialmente contemplar un tratamiento conservador, y utilizar la cirugía para casos en los que la evolución de la clínica no fuera la esperada, bien por un mal control del dolor y/o la limitación de la movilidad secundaria a la deformidad del tronco, o cuando la afectación raquídea o la clínica que presenta el paciente no fuera tolerada y necesitara de una solución más rápida y agresiva.
Charcot arthropathy of the spine is a neuropathic affectation of the spine, it is considered rare, has a destructive and progressive evolution. It is usually due to a previous traumatic injury, but it has also been described as secondary to other infectious or tumoural processes. Initially, surgical treatment has always been considered for possible complications such as pain control and trunk instability. We present a series of 13 cases diagnosed with Charcot arthropathy at the Institut Guttmann, in which the following variables are described: aetiology (traumatic, infectious, iatrogenic), clinical features (pain, loss of trunk control, vegetatism, spasticity), interval of onset of the clinical features, location (L2-L3), treatment (surgical or conservative) and the evolution they presented, with the aim of evaluating conservative treatment as the first option, instead of surgery. In our sample, 61.5% (8/13) were treated surgically with posterior instrumentation (7/8), except for one case which was anterior and posterior; 38.5% (5/13) were treated conservatively and none required subsequent surgery. In conclusion, our line of action would initially be to consider conservative treatment, and to use surgery for cases in which the clinical evolution was not as expected, either due to poor pain control and/or limitation of mobility secondary to the deformity limitation of mobility secondary to the deformity of the trunk, or when the spinal involvement or the patient's symptoms are not tolerated and require a quicker and more aggressive solution.
La artropatía de Charcot en el raquis, también conocida como la artropatía neuropática de columna, es una patología inusual que evoluciona de manera progresiva y destructiva. Afecta al cuerpo vertebral, al disco intervertebral y el complejo ligamentoso posterior.
Se debe a la pérdida de sensibilidad profunda, por la destrucción de las fibras sensitivas aferentes que permiten que pequeños traumatismos pasen desapercibidos, produciendo una degeneración mecánica de la articulación facetaria1.
Puede estar asociada etiopatológicamente con enfermedades como la neuropatía diabética, sífilis terciaria, siringomielia, el síndrome congénito de ausencia de dolor (CIPA), enfermedad infecciosa, tumores, post-radioterapia y más comúnmente con la lesión de la médula espinal2.
Inicialmente estudiada en 1868 por Jean-Martin Charcot quien refirió una relación causal entre daño neurológico y lesión del hueso y la articulación. En este caso relacionada con pacientes con sífilis terciaria y destrucción de articulaciones periféricas3.
Fue ya en 1884 cuando Kronig describe por primera vez en un paciente diabético la aparición de lesión en la columna; pero no fue hasta 1978 cuando Slabaugh et al. describen el primer caso secundario a la lesión de la médula espinal3–5.
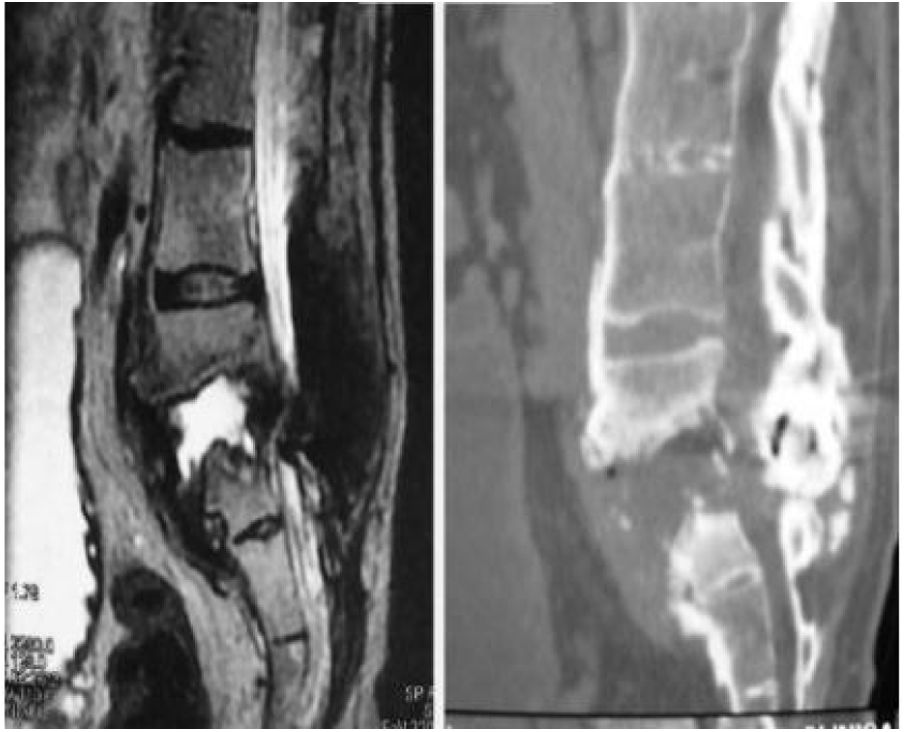
Actualmente se ha visto que la causa principal de la artropatía de Charcot es la lesión traumática de la médula espinal. El área mayormente afectada es la unión toracolumbar3–5. Se produce una degeneración vertebral y del disco, osteopenia y colapso vertebral, sobre todo con lesiones destructivas en las articulaciones vertebrales posteriores en asociación con la formación de fibrosis del tejido perivertebral que puede suceder durante el proceso degenerativo. Esta lesión de las tres columnas del raquis vertebral pueden causar finalmente la inestabilidad vertebral, la subluxación o incluso la dislocación vertebral que conlleva a una deformidad de tipo cifosis, escoliosis o de ambas. La deformidad de tipo cifosis es la más predominante e incapacitante. También se suele asociar con dolor de espalda, cambios neurológicos como son la espasticidad, la pérdida de sensibilidad, el control de tronco, pérdida de control de esfínteres, disreflexia y los síntomas vegetativos como la hiperhidrosis, la hipotensión, náuseas, vómitos, mareos; además de crujidos audibles con los cambios de posición3–5 (fig. 1).
El Charcot en el raquis está probablemente infradiagnosticado, y además suele hacerse de manera tardía, debido a la clínica inespecífica que presenta y la necesidad de tener que hacer diagnóstico diferencial con patologías como las infecciones crónicas (espondilodiscitis) o procesos tumorales. Sin embargo, es muy importante saber reconocer dicha patología por sus consecuencias invalidantes en pacientes con lesión medular3–5.
Material y métodosEstudio observacional retrospectivo de una serie de 13 casos diagnosticados de artropatía de Charcot de raquis desde 2004 a 2016 en el Institut Guttmann de Badalona (Barcelona).
Se incluyeron pacientes adultos de ambos géneros, con diagnóstico de Charcot, con un seguimiento de, al menos dos años (rango: dos a 11 años).
Como variables se recogieron datos sociodemográficos (edad y sexo), diagnósticos (origen de la lesión neuropática [traumática, médica como mielitis o abcesos, y iatrogénica por la colocación de un sistema electroestimulador de raíces sacras para el control esfinteriano [SARS], intervalo entre el diagnóstico de Charcot y la cirugía inicial, localización del Charcot y estatus neurológico valorado mediante la escala ASIA]), clínicos (dolor, inestabilidad de tronco, vegetatismo y espasticidad) y relacionados con el tratamiento (tipo de tratamiento [quirúrgico o conservador] y tipo de instrumentación quirúrgica [anterior o anterior/posterior]).
El diagnóstico del Charcot de raquis se basó en los cambios radiológicos en la radiografía simple, TAC y RMN que incluían la destrucción del disco intervertebral, osteofitos, erosiones o crecimientos de las articulaciones facetarías, espondilolistesis, hipercifosis, además de pseudoartrosis. Resultados compatibles con espondilodiscitis destructiva. Para completar el diagnostico diferencial con patología infecciosa, inflamatoria y tumoral, también se debían objetivar una gammagrafía con galio y una punción-cultivo negativos, así como parámetros analíticos de actividad infecciosa, PCR, VSG y HLA B27 negativos6,7.
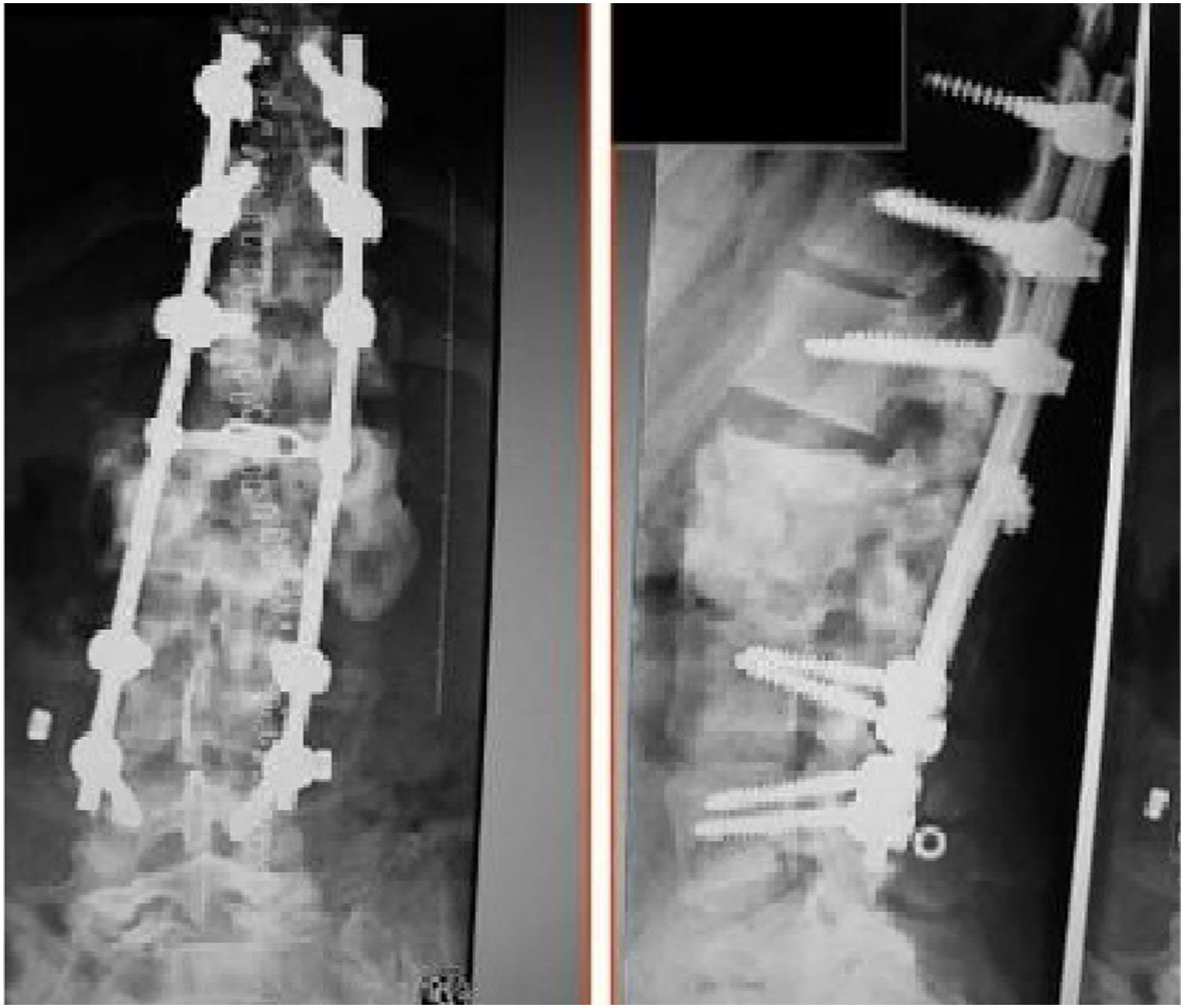
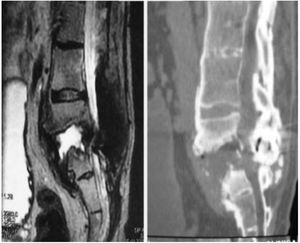
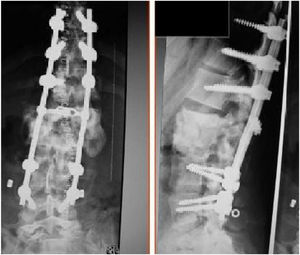
Los pacientes en función de su situación clínica, recibieron tratamiento quirúrgico o conservador. El tratamiento quirúrgico se planteó inicialmente en aquellos pacientes que presentaron una importante inestabilidad de tronco, dolor mal controlado y clínica neurológica avanzada, consistía en siete pacientes, en una estabilización posterior y reducción de la deformidad mediante artrodesis porterolateral con tornillos pediculares de tres segmentos proximal y dos o tres distal, con osteotomía de cierre posterior para perseguir la fusión de los somas afectos, y utilización de dispositivo de tracción lateral o cross-link, para evitar la complicación de efecto bisagra. En un caso se realizó un abordaje anterior con colocación de injerto intersomático, lo que aumenta la estabilidad de la construcción pero también incrementa la morbilidad de la cirugía (figs. 2 y 3), a diferencia del tratamiento conservador basado en el seguimiento, sin ningún tipo de intervención agresiva, únicamente la utilización de corsés.
Análisis estadístico: El análisis de datos se realizó mediante el programa estadístico STATA.
Las variables cuantitativas fueron expresadas con su medida de tendencia central y desviación. Las variables cualitativas fueron expresadas en forma de frecuencia y porcentaje.
ResultadosDe los 13 pacientes incluidos de nuestra serie, un 23% (3/13) de los pacientes presentaron como enfermedad de base, una escoliosis secundaria a una mielitis en dos de los casos, una de ellas durante el primer año de vida y la otra con la edad de seis años, la del 3° paciente se debió a un absceso vertebral, compatible con una espondilodiscitis por Staphylococcus aureus. Un 77% (10/13) presentaron como antecedente una fractura previa de raquis. El 69% (9/13) del total de los pacientes había sufrido una cirugía de estabilización previa, se incluían el paciente con el absceso vertebral y ocho de los pacientes que habían sufrido una fractura previa, los otros dos con fractura previa no fueron intervenidos quirúrgicamente en el momento de la lesión inicial.
El origen de las lesiones se agruparon dentro de tres grupos, de las cuales se contempló en un 54% la patología traumática, en un 31% una escoliosis paralítica y finalmente un 15% iatrogénica en relación con laminectomía amplia L1-L2 para colocación de SARS. (tablas 1 y 2).
Demografía de los pacientes
| Paciente | Diagnóstico | Estatus | Edad de | Intervalo | Localización | Cirugía |
|---|---|---|---|---|---|---|
| inicial | neurológico | presentación | Charcot | |||
| 1 | Absceso | Paraplejia | 48 | 33 | L5-S1 | No |
| Vertebral | Incompleta | |||||
| T8-T10 | T8-T10 | |||||
| ASIA B | ||||||
| 2 | FXC1 + FX | Paraplejia | 40 | 16 | T12-L1 | Anterior y |
| T12-L1 | Completa | posterior | ||||
| T4 | ||||||
| ASIA A | ||||||
| 3 | Síndrome | Paraplejia | 39 | 30 | T11-T12 | No |
| transverso | Completa | |||||
| completo | T11 | |||||
| por mielitis | ASIA A | |||||
| 4 | FX T6-T7- | Paraplejia | 22 | 5 | L1-L2 | Posterior |
| T8 | Completa | |||||
| D5 ASIA A | ||||||
| 5 | FX C4-C5 | Paraplejia | 57 | 27 | L2-L3 | No |
| Incompleta | ||||||
| C5 ASIA B | ||||||
| 6 | FX T6-T7 | Paraplejia | 44 | 5 | T11-T12 | Posterior |
| Completa | ||||||
| T4 ASIA A | ||||||
| 7 | FX T5-T6 | Paraplejia | 25 | 11 | T12-L1 | Posterior |
| Completa | ||||||
| T4 ASIA A | ||||||
| 8 | FX T3-T4- | Paraplejia | 43 | 19 | L2-L3 | Posterior |
| T5 | Completa | |||||
| T6 ASIA A | ||||||
| 9 | FX T7-T10 | Paraplejia | 21 | 2 | L4-L5 | Posterior |
| Completa | ||||||
| T9 ASIA A | ||||||
| 10 | FX T12 | Paraplejia | 68 | 6 | Posterior | |
| Completa | ||||||
| T10 ASIA A | ||||||
| 11 | FX T6-T7 | Paraplejia | 46 | 24 | L2-L5 | Posterior |
| Completa | ||||||
| T7 ASIA A | ||||||
| 12 | FX T4 | Paraplejia | 57 | 34 | L5-S1 | No |
| Completa | ||||||
| T4 ASIA A | ||||||
| 13 | Síndrome | Paraplejia | 51 | 37 | L1-L2 | No |
| transverso | Completa | |||||
| completo | T6 | |||||
| por mielitis | ASIA A |
Clínica y seguimiento de los pacientes
| Paciente | Pérdida | Control de Tronco | Dolor | Vegetatismo | Espasticidad | SARS | Seguimiento (años) |
|---|---|---|---|---|---|---|---|
| 1 | SÍ | SÍ | NO | NO | NO | 11 | |
| 2 | SÍ | SÍ | NO | SÍ | NO | 9 | |
| 3 | SÍ | SÍ | NO | NO | NO | 9 | |
| 4 | SÍ | SÍ | SÍ | NO | NO | 10 | |
| 5 | SÍ | SÍ | NO | SÍ | NO | 5 | |
| 6 | SÍ | SÍ | NO | SÍ | SÍ | 5 | |
| 7 | SÍ | SÍ | NO | NO | SÍ | 5 | |
| 8 | SÍ | SÍ | SÍ | SÍ | SÍ | 4 | |
| 9 | SÍ | SÍ | NO | NO | NO | 2 | |
| 10 | NO | SÍ | NO | NO | NO | 3 | |
| 11 | SÍ | NO | SÍ | NO | NO | 3 | |
| 12 | SÍ | SÍ | NO | NO | NO | 6 | |
| 13 | NO | NO | NO | NO | NO | 2 |
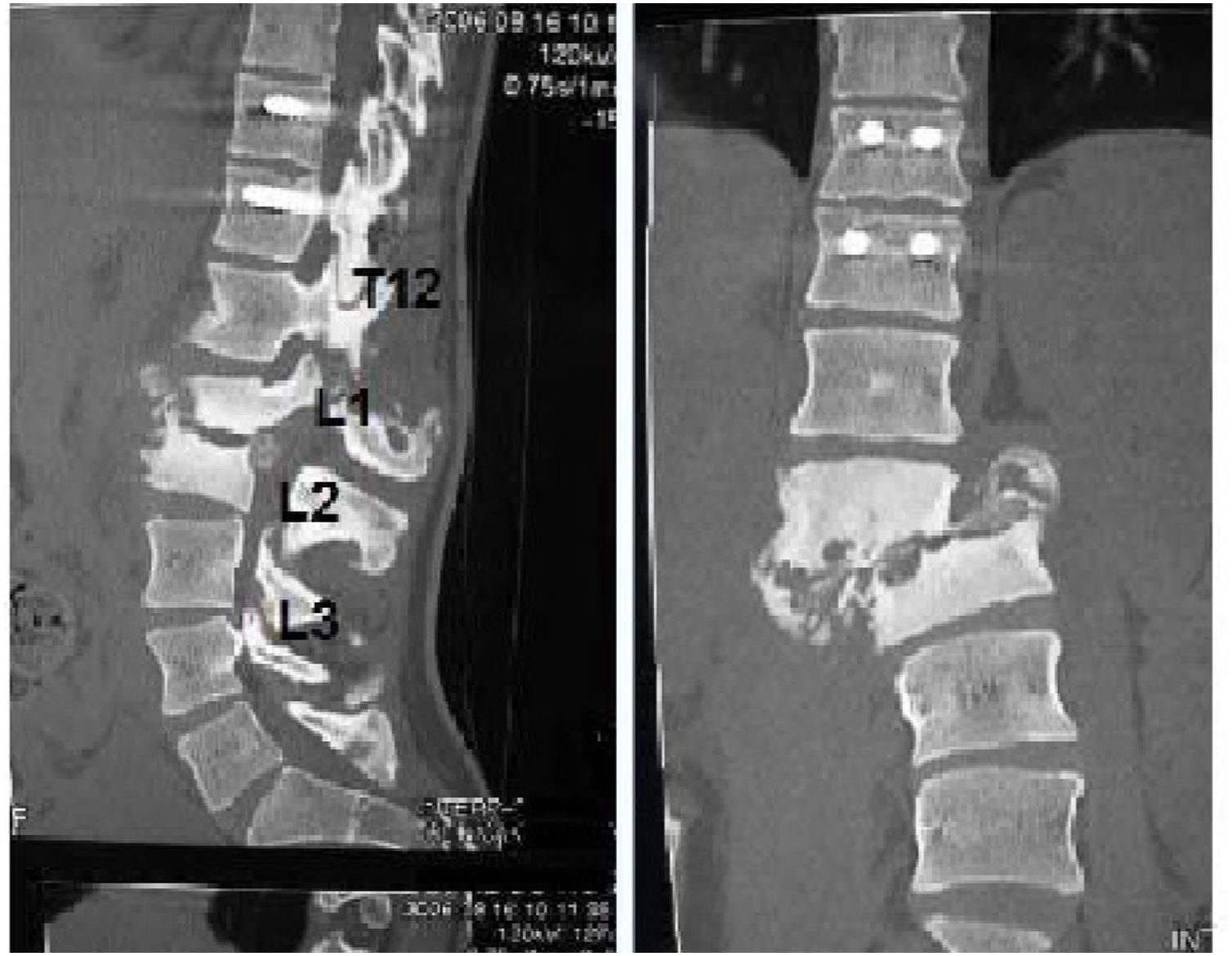
La localización del Charcot fue distal a la lesión inicial/instrumentación en el 69% (9/13) de los casos. El 23% (3/13) más concretamente en un nivel L2-L3; y el 84,5% (11/13) se localizó la lesión de una a tres niveles por debajo de la instrumentación.
Las localizaciones del Charcot fueron muy variadas en la serie de pacientes, encontrándose en mayor cuantía en un nivel L2-L3 en un 23%, otras localizaciones frecuentes fueron la charnela toracolumbar y los niveles adyacentes a las ya mencionadas.
Respecto a la clínica secundaria a la propia patología de la artropatía de Charcot se evidenció que el 92% (12/13) de los casos presentó algún tipo de clínica compatible con aumento de la espasticidad 31% (4/13), de la disreflexia y vegetatismo (hiperhidrosis, hipotensión, mareo, náuseas o vómitos) 23% (3/13), del dolor 85% (11/13) y el disconfort y la pérdida del control de tronco 85% (11/13) (tabla 2).
Como indicaciones para el tratamiento, se planteó el dolor y la limitación de la movilidad secundaria a la deformidad. El 38,5% (5/13) fueron tratados de manera conservadora con el uso de corsés y el 61,5% (8/13) con tratamiento quirúrgico, en estos últimos la estabilización de la columna se realizó con una instrumentación posterior (7/8), excepto en un caso que la instrumentación fue anterior y posterior. Los objetivos del tratamiento quirúrgico fueron principalmente corregir la cifosis, mejorar el dolor y conseguir una fijación vertebral sólida (tabla 1). Ninguno de los pacientes tratados de manera conservadora necesitó un tratamiento quirúrgico posterior.
El 50% (4/8) de los intervenidos presentó complicaciones secundarias a la cirugía, entre las que encontramos fallo de la instrumentación 50% (2/4) e infección 25% (1/4), que podríamos considerar como graves, y las úlceras por presión 25% (1/4), consideradas como moderado. Los pacientes tratados de manera conservadora no presentaron este tipo de complicaciones.
DiscusiónLa artropatía de Charcot del raquis es una enfermedad de evolución lenta. Se debe a la combinación de la degeneración de la vértebra y del disco intervertebral con la formación masiva de hueso secundaria la dislocación de la columna vertebral. El mecanismo principal de lesión es el daño en la inervación de la articulación con la perdida de la propiocepción y la sensibilidad al dolor/temperatura. La pérdida de dicha sensibilidad favorece la falta de mecanismos de defensa por parte de la articulación que de otra manera ayudaría a evitar la tensión excesiva de los ligamentos y del disco y provocaría una distribución homogénea de las cargas. Normalmente, la tensión sufrida por estos ligamentos provoca una contracción refleja de los músculos y de esta manera se estabilizaría la articulación. Este fallo conlleva repetidos microtraumas en el cartílago de la articulación sinovial llevando posteriormente a la propia destrucción de la cápsula articular. Provoca cambios hiperplásicos e hipertróficos en la membrana y la cápsula con derrame sinovial y una progresiva subluxación de la articulación1–8.
También se ha sugerido que la pérdida de inervación simpática es un factor trófico que promueve la hiperemia y la hiperactividad osteoclástica.
Algunos casos han sido descritos en pacientes con insensibilidad crónica al dolor y la temperatura, una enfermedad autosómica caracterizada por la ausencia de fibras pequeñas desmielinizadas3,9,10.
En términos de neuroartropatía espinal, los factores mecánicos van a ser críticos. En pacientes parapléjicos, el estrés mecánico que provoca las posiciones mantenidas en la silla y las propias transferencias, que repetidamente exponen la parte de la columna móvil por debajo del área fusionada a un área de estrés, es muy relevante, y el riesgo de aparición de Charcot en el raquis es mayor en pacientes con una mayor actividad1–5,8. La zona intervertebral suele ser el área que más sufre estrés y que además es la más frágil, típicamente en la charnela toracolumbar y la zona de transición lumbosacra1–5,8.
En pacientes operados previamente, la localización típica del Charcot es en la propia zona intervenida o por debajo de la zona de instrumentación. Según nuestra serie, la localización del Charcot fue distal a la lesión inicial, de uno a tres niveles por debajo de la instrumentación y la zona que más se afectó fue el nivel L2-L3. Barrey et al., en la revisión realizada en 2010, objetivaba que los niveles más afectados eran L2-L3, L1-L2, T12-L1 y L4-L5, por ese orden3.
De acuerdo con varios autores, la laminectomía aparece como un factor agravante para la aparición de la lesión3,11–14. La pérdida de estabilidad de los elementos posteriores (el ligamento interespinoso, la espinosa, la lámina y la cápsula articular) y el posible daño de la musculatura paravertebral, aumentan el estrés y la carga en el resto de los elementos articulares como son el propio disco intervertebral y las articulaciones facetarias. Según Sobel et al., en cuatro de sus cinco laminectomías se encontraron el desarrollo de Charcot11. Vialle et al., según su serie, fue de seis de sus siete pacientes tratados. En nuestra serie de 13 pacientes, tres de ellos fueron sometidos a una laminectomía para la colocación de un SARS14.
La progresión de la clínica suele ser muy larvada, manteniéndose en situación subclínica durante meses o años, hasta fases evolucionadas. Barrey et al.
hablan de una media de 17,3 años; en las series de Delvin fue de 19 años. Según nuestra serie, el tiempo medio de aparición fue también de 19 años. Finalmente el paciente puede presentar sintomatología poco específica y variable, pero sí se tiene un alto nivel de sospecha, se puede orientar satisfactoriamente. Como síntomas habituales encontramos: el dolor local, la pérdida de control del tronco, deformidad progresiva (aumento de cifosis habitualmente) y clínica vegetativa (hiperhidrosis, aumento de la espasticidad, mareos, hipotensión, náuseas y/o vómitos). En pacientes parapléjicos con lesión neurológica completa el síntoma más frecuente es la sensación de inestabilidad en la posición de sentado y la deformidad. También es frecuente la presencia de dolor y de crujidos. En pacientes con lesión neurológica incompleta, la lesión de Charcot suele agravar el estado neurológico previo, asociándose con aumento de la espasticidad, y en lesiones por encima de T6 o grandes parapléjicos puede dar la cara como un síndrome disautonómico que combina hipertensión, bradicardia, hiperhidrosis y dolor de cabeza, también conocido como disreflexia. Este síndrome puede ser provocado por ciertos movimientos del tronco o con los posicionamientos en la silla3–8.
La evolución de la enfermedad puede tener dos posibles caminos; uno hacia la curación, aunque la lesión en sí no desaparezca pero se puede producir anquilosis de los arcos posteriores, proporcionando cierta estabilidad que resulta suficiente y duradera. Es en casos como éste, en los que el paciente mejora su clínica. Otra posibilidad es la evolución hacia la inestabilidad mecánica y la persistencia de la sintomatología y el riesgo de un empeoramiento del estado neurológico previo del paciente.
Tenemos varias opciones terapéuticas que consisten en el control clínico, la inmovilización con corsés y la cirugía.
En la artropatía de Charcot existe un patrón destructivo y progresivo, por lo que inicialmente podríamos pensar en un tratamiento quirúrgico como primera opción en estos pacientes1–8. El objetivo principal de la cirugía consiste en estabilizar el segmento espinal afecto, la corrección del balance sagital y eliminar el dolor1–15. Para estabilizar el segmento se debe obtener una fusión de calidad, para ello se realizará un desbridamiento de los tejidos inflamados y/o necróticos. El mejor abordaje según algunos autores es por vía anterior. Todos los autores insisten en fijar la columna anterior vía anterior o posterolateral (50% de los casos según las series quirúrgicas de Vialle et al.). La elección del tipo exacto de cirugía se basará en el entrenamiento del cirujano y las preferencias personales.
Un único abordaje anterior no es suficiente en términos de estabilización y conlleva el riesgo de complicaciones. Arnold y Mohit et al. nos describen un abordaje posterolateral con descompresión y una fijación intervertebral con una caja y fijación posterior instrumentada15. Sin embargo, muchos autores defienden un abordaje en dos tiempos. Vialle et al. en su serie de nueve casos intervenidos, realizó un abordaje combinado en ocho de ellos consiguiendo la fusión ósea, la mejora del dolor, la espasticidad y la funcionalidad14. Suda et al. en 2007, en cuatro casos realizaron un abordaje anterior y posterior con injerto de hueso autólogo y estabilización posterior con osteosíntesis, encontrando resultados satisfactorios en la fusión ósea y sin complicaciones16.
Aebli et al. en 2013, de una serie de 28 pacientes, siete de ellos tratados de manera conservadora y 21 de manera quirúrgica, observó que el tratamiento quirúrgico que incluía desbridamiento extenso, instrumentación posterior y espondilodesis circunferencial era la opción de tratamiento actual7.
En el caso de querer reducir la cifosis, algunos autores sugerían realizar una pequeña osteotomía posterior17, y en casos en los que la destrucción ósea es limitada, una única fase posterior con una fusión intersomática podría ser suficiente. Morita et al. recomendaban esta opción en aquellos pacientes con una lesión neurológica sensitivomotora completa. En su serie de nueve casos, la fusión ósea ocurría en todos sus pacientes a los seis meses8.
Los límites de la zona de instrumentación, particularmente los límites inferiores, son causa de debate según los autores, ya que después de la fusión ósea existe un riesgo de desarrollar lesión por debajo del segmento fijado. Brown et al. en 1992, de su serie de ocho pacientes, dos presentaron complicaciones mecánicas y otros dos nuevas lesiones de Charcot por debajo de la zona intervenida. Algunos autores recomiendan de una manera sistemática la extensión hasta la pelvis, pero esto conlleva una serie de desventajas, ya que por un lado aumenta la complejidad de la cirugía y por otro va a limitar la movilidad del paciente18. Por ejemplo, Morita et al. encontraron en uno de los casos de su serie, la imposibilidad del paciente para realizar autocateterismos tras la cirugía, en este aspecto es importante también valorar cómo se encuentran las caderas, ya que una anquilosis de estas conlleva una tensión excesiva en la zona lumbar y puede conllevar problemas mecánicos postoperatorios8. Haus et al., en su serie de nueve casos, sugirió que se debería realizar una fijación a sacro o pelvis para prevenir el desarrollo secundario de una nueva articulación de Charcot, aunque supusiera una importante pérdida de movilidad del paciente6.
Iure et al., en 2015 comentaban que para conseguir una correción en el balance del eje sagittal, la ampliación a sacro o a pelvis debía ser valorada en algunos casos, aún sabiendo que reduciría la capacidad de los pacientes a alcanzar la zona genital para sus autocuidados1.
En conclusion, la literatura nos habla que la fusión ósea se debe idealmente conseguir mediante una fijación posterolateral y una fijación anterior utilizando ambos abordajes o un abordaje posterior extenso únicamente, y que la extensión de la instrumentación a pelvis o sacro va a conllevar un aumento de las limitaciones de la movilidad para cuidados diarios de los pacientes, y que por ello se debería seleccionar el tipo de pacientes en los que se realizara.
En nuestra serie, ocho de los pacientes fueron tratados quirúrgicamente con un abordaje posterior amplio, salvo en un caso donde además se practicó un abordaje anterior. En ninguno de ellos se llevó a cabo una instrumentación amplia a pelvis. Encontrando mejoría en la estabilidad y en la clínica neurovegetativa. Aún así, propició la aparición de complicaciones propias como el fracaso de la instrumentación, la infección y úlceras por presión en varios casos.
Como posibles complicaciones encontramos el fracaso de la instrumentación, las infecciones, las úlceras por presión, la pérdida de la autonomía y/o empeoramiento del estado neurológico del paciente1–20. Con la intervención, el paciente recuperará la postura erguida pero perderá parte de la movilidad y funcionalismo que tenía previos a la intervención y al corregir la postura probablemente requiera readaptación de la silla e incluso puede repercutir en la forma de sentarse, con el riesgo de producir úlceras por presión a nivel isquiático o trocánteres.
Otra opción es el tratamiento conservador, no sólo para casos en los que esté desestimada la cirugía por patología asociada o cuando el paciente rechaza la cirugía. Consiste en la utilización de corsés para conseguir una correcta inmovilización, seguimiento clínico y radiológico y no intervenciones agresivas. Autores como Moreau et al. en 2014 plantearon inicialmente un tratamiento conservador y la cirugía sólo se reservaba para aquellos pacientes con persistencia de los síntomas o en aquellos casos muy inestables. De su serie de 12 casos, de diferentes etiologías, como ocurre en nuestra serie, cinco de los pacientes fueron tratados quirúrgicamente y siete de ellos con tratamiento conservador con corsé durante al menos tres meses en tres de ellos, y reposo estricto en cama para dos de los pacientes, y observó que en cinco de ellos los síntomas se habían controlado, incluso en uno de sus pacientes se produjo una regresión completa del dolor secundaria a la fusión ósea espontánea. Concluyeron que en pacientes en silla de ruedas o parapléjicos, la pérdida de autonomía debía ser considerada, y recomendaban intentar el uso del corsé previo a plantearse una cirugía, de esa manera podían valorar la funcionalidad si se conseguía la fusión ósea. Además, aquellos pacientes que conseguían una fusión espontánea o estable de la columna raramente se iban a beneficiar de una cirugía.
Haus et al. en 2010, en una seria de nueve pacientes, ocho tratados de manera quirúrgica y uno de manera conservadora, objetivó que el 75% de los pacientes tratados de manera quirúrgica no había eliminado la gran inestabilidad ni el dolor a largo plazo e incluso estos pacientes necesitaron una revisión quirúrgica en un periodo de 14,3 años. También el 38,3% presentaron una recurrencia de Charcot en otra articulación. Concluían que, como cirugía elección, se deberían estabilizar los tres planos de la columna por vía anteroposterior o posterior amplia, pero que la fusión ósea secundaria a esta estabilización no nos garantizaba que no fallara la instrumentación o que se produjera otra articulación de Charcot en otra localización y que algunos pacientes se beneficiarían temporalmente del uso de corsés estabilizadores, aunque posiblemente estuvieran abocados en un futuro a una cirugía6.
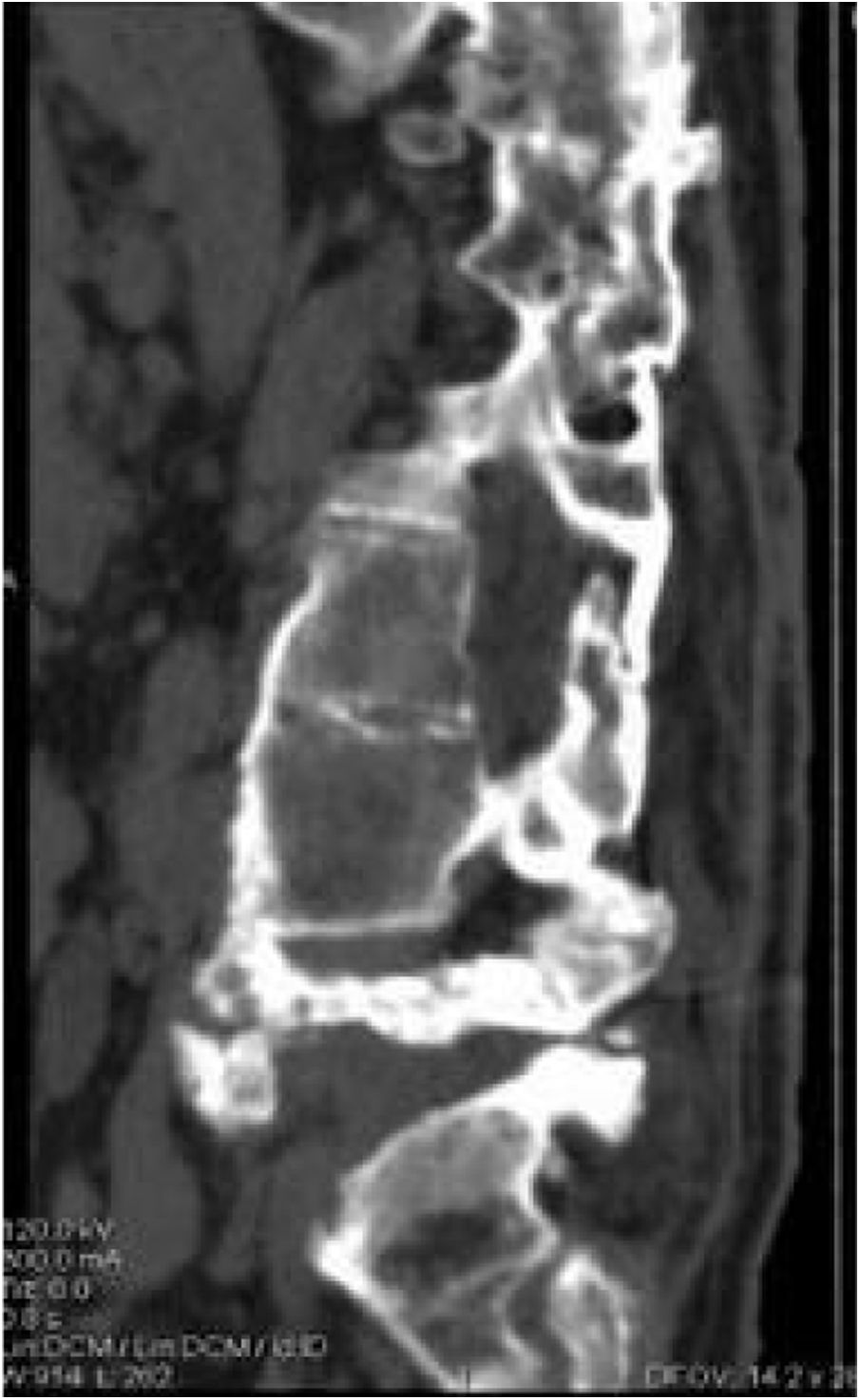
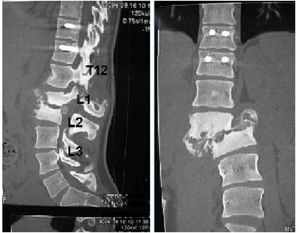
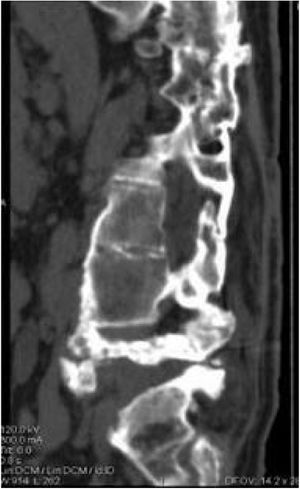
En nuestra serie, cinco de los casos fueron tratados de manera conservadora, utilizando corsé al menos durante tres meses, seguimiento radiográfico y en consultas, donde se objetivó la estabilización de la enfermedad (fig. 4) y la mejora de la clínica. Se consiguió la desaparición del dolor, de la espasticidad, de la hipersudoración, una mejor estabilidad y control de tronco. Además, que nuestros pacientes no presentaron complicaciones secundarias al manejo como había ocurrido con el tratamiento quirúrgico.
Es por ello que proponemos la opción conservadora como una línea de actuación que debe ser tomada en cuenta desde un primer momento. Hoppenfeld et al. en 1990 y Moreau et al. en 2014 se plantearon si todos los Charcot de raquis requerían cirugía como tratamiento inicial, viendo que, utilizando un tratamiento conservador, se conseguía un efecto positivo en la inestabilidad y el dolor de espalda4,19. También se objetivó que este tratamiento no se relaciona con la aparición de otras localizaciones de Charcot en un segundo tiempo4 y que el paciente medular suele beneficiarse de ese plus de movilidad a nivel del foco de lesión, proporcionada por una especie de pseudoartrosis funcional, para realizar sus actividades cotidianas: transferencias, higiene, sondaje vesical, enemas. Además, el paciente no suele tener la sensación de presentar un grave problema de estabilidad en su columna.
En conclusión, nuestra línea de actuación sería inicialmente contemplar un tratamiento conservador, y reservar la cirugía para casos en los que la evolución de la clínica no fuera la esperada, bien por un mal control del dolor y/o la limitación de la movilidad secundaria a la deformidad del tronco, o cuando la afectación raquídea o la clínica que presenta el paciente no fuera tolerada y necesitara de una solución más rápida y agresiva.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Referencias no citadas