El tercio central del tendón rotuliano (TR) es probablemente el injerto más utilizado en nuestros días para reconstruir el ligamento cruzado anterior (LCA) de la rodilla, debido a: su solidez mecánica1-3, la posibilidad de una fijación primaria estable4,5, la integración posterior mediante fusión hueso-hueso6,7 y la capacidad de regeneración del defecto creado en el tendón1,7,8-12. Sin embargo, en los últimos años una serie de complicaciones de las reconstrucciones del LCA que utilizan el TR se han atribuido directamente a la morbilidad que provoca la toma del injerto. Así, se han constatado fracturas de rótula13, crepitaciones y dolores femoropatelares6,14 y roturas13,15-17, tendinitis5,7 y alteraciones postoperatorias de la longitud del TR6,18.
Se ha publicado que el defecto creado en el TR se regenera, o cicatriza, por formación de un tejido colágeno que madura progresivamente hasta ser histológicamente idéntico al tendón original a los 2 años de la extracción1,8,9,12. Sin embargo, recientes estudios sugieren que el proceso de maduración de la cicatriz tendinosa evoluciona de forma más lenta que lo previamente estimado, lo que podría contribuir a explicar algunas de las complicaciones y fracasos mecánicos observados en el TR tras la extracción de un tercio de su masa3,17-20. El propósito de este trabajo es estudiar la evolución biomecánica e histológica de la cicatrización de defectos creados quirúrgicamente en el TR del conejo.
MATERIAL Y MÉTODO
Se utilizaron 16 conejos (Oryctolagus cuniculus) de raza albina de Nueva Zelanda, esqueléticamente maduros, con un peso entre 4.000 y 4.500 g. Se escogió el conejo como modelo debido a su bajo coste, facilidad de manejo y buena tolerancia a la cirugía18. También se tuvo en cuenta la analogía de su aparato extensor comparado con el humano21. En todo momento se siguieron las recomendaciones del Comité Ético local de investigación animal. Los animales fueron anestesiados con una mezcla intramuscular de ketamina (0,1 mg/kg de peso) y xylazina (5 mg/kg de peso). Con técnica rigurosamente estéril se realizó una incisión parapatelar de 3 cm, se disecó el paratenon y se extrajo el tercio central del TR sin incluir la parte ósea correspondiente a rótula y tuberosidad tibial, puesto que el objetivo de nuestro experimento era averiguar únicamente las propiedades biomecánicas del tendón regenerado.
Seguidamente se procedió a suturar el paratenon con puntos de Vicryl 4-0, dejando sin reparar el defecto creado en el tendón. La piel se cerró con puntos sueltos de Vicryl 3/0. En el postoperatorio inmediato se administró una sola dosis intramuscular de 200 mg de dipirona magnésica. Los animales fueron estabulados en jaulas de laboratorio estándar, dentro de las cuales gozaron de libre movilidad. Se realizaron reconocimientos diarios para comprobar el estado clínico y la evolución de la herida quirúrgica. El sacrificio se realizó a las 12 semanas en 8 conejos escogidos al azar, y al año en otros 8. Inmediatamente después se extrajo el sistema rótula --TR-- tuberosidad anterior de la tibia (probeta) de la rodilla operada y de la contralateral, que sirvió como control, y se congeló a 20°C hasta el momento del estudio, puesto que se ha demostrado que este método de conservación no altera las propiedades mecánicas del TR4.
Estudio biomecánico
Se realizó un estudio biomecánico en 6 especímenes en cada intervalo de tiempo. Para ello se sumergieron en suero salino a 37°C hasta que estuvieron totalmente descongelados. Inmediatamente después se determinó el área de sección transversal de cada TR mediante la fórmula de cálculo de una elipse [π 1/2 (anchura x grosor)]18,22. Con objeto de minimizar errores se realizaron 10 mediciones de la anchura y grosor del TR en toda su longitud, con un calibre de precisión de 0,5 mm. El estudio biomecánico consistió en ensayos de tracción en dirección longitudinal, hasta producir la rotura de la probeta.
En cada ensayo se determinaron la fuerza máxima de rotura, la rigidez y el módulo de elasticidad o de Young. Las pruebas se realizaron con una máquina universal para ensayo de materiales Instron® 4507 (Canton, Massachusetts) controlada por ordenador, en la que se ajustó la velocidad de desplazamiento de las mordazas a 3 mm/minuto y la adquisición de datos a 10 puntos/segundo. Con objeto de evitar que los extremos óseos de las probetas patinaran de sus sujeciones o se provocaran fracturas en las áreas de prensión de las mordazas neumáticas, se definió previamente una presión óptima de sujeción de 6 bares18.
El análisis estadístico se realizó con la prueba de la «t» de Student para datos apareados, tras comprobar el supuesto de normalidad con la prueba de Kolmogorov-Smirnov. El nivel de significación estadística se estableció en p ≤ 0,05.
Estudio histológico
Se realizó un estudio descriptivo en 2 animales de cada grupo escogidos al azar. Una vez limpias las probetas de ambas rodillas, la intervenida y su control, se fijaron en solución de formaldehído al 10% durante 24 horas, para su posterior procesamiento e inclusión en parafina. Se tomaron 3 secciones seriadas de 5 μde cada uno de los bloques de parafina, que se tiñeron con hematoxilina-eosina, tricrómico de Masson (para evidenciar las fibras de colágeno) y azul alcián (para mucopolisacáridos ácidos). Se estudiaron la celularidad, características de la matriz extracelular, orientación de las fibras de colágeno y vascularización, tomando siempre como patrón y referencia el tendón contralateral no intervenido.
RESULTADOS
Inspección macroscópica
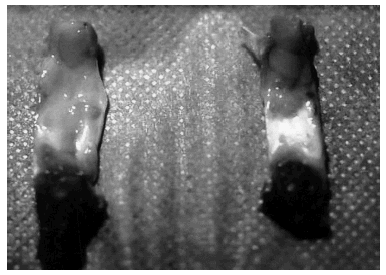
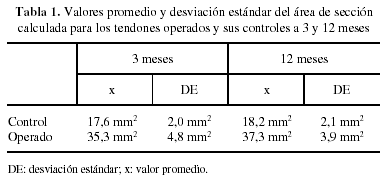
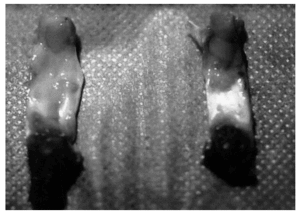
En algunos casos, los exámenes macroscópicos de los tendones estudiados no mostraron rasgos diferenciales entre los operados y sus controles respectivos, excepto la «huella» de la intervención quirúrgica practicada. Sin embargo, en la mayoría de ocasiones el proceso cicatrizal incluía todo el tendón, dificultando la exacta identificación de sus límites respecto de los tejidos retinaculares circundantes y aumentando su grosor (fig. 1). El área de sección media de los tendones operados en ambos intervalos de tiempo fue más del doble que la de sus controles, con una diferencia significativa (p < 0,008) desde el punto de vista estadístico (tabla 1).
Figura 1. Imagen macroscópica posteutanasia de ambos tendones rotulianos por su cara posterior. A la izquierda el tendón intervenido, que destaca por el mayor tamaño, consecuencia del proceso de cicatrización; a la derecha su control sano.
Biomecánica
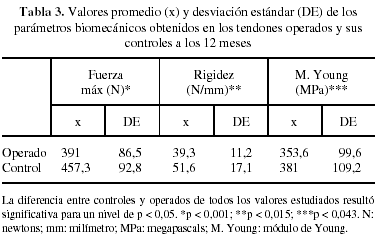
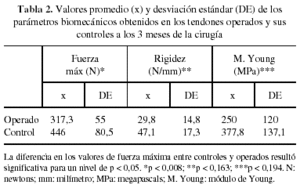
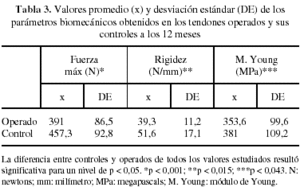
En los ensayos de tracción se consideraron los resultados del grupo control como patrón o 100%. A los 3 meses de evolución, los valores de fuerza máxima de los tendones operados fueron un 71% del control (p < 0,008). Sin embargo, en el mismo intervalo los valores de rigidez y módulo de Young representaban un 63,2% (p < 0,163) y 66,1% (p < 0,194) respectivamente, no observándose diferencias significativas respecto a sus controles (tabla 2). A los 12 meses, el análisis de los mismos parámetros mostró en los tendones operados que la fuerza máxima a rotura había mejorado alcanzando el 85,5% (p < 0,001), mientras que la rigidez llegaba al 76% (p < 0,015) y el módulo de Young al 92,8% (p < 0,043) respecto a sus controles sanos (tabla 3).
Histología
En el examen microscópico, los tendones control mostraron un patrón constante de haces homogéneos y paralelos de fibras de colágeno, longitudinalmente orientadas en el sentido de la tracción y sin apenas matriz extracelular ni estructuras vasculares. Se observaron también finos septos situados entre los fascículos, algunas terminaciones nerviosas de tipo mielínico, escasa celularidad y en general un área de sección pequeña. Características idénticas a estos controles, correspondientes a un tejido tendinoso maduro, pudieron observarse en las zonas periféricas de las secciones de los TR intervenidos.
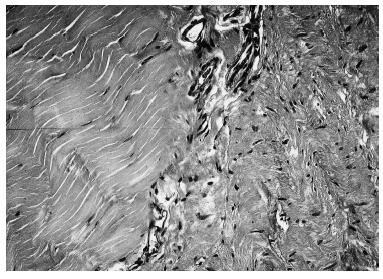
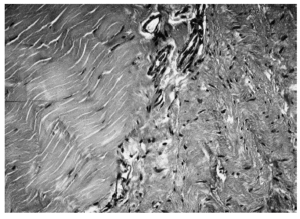
Por el contrario, el tejido regenerado en la parte central de los cortes histológicos mostró colágeno neoformado en diversos estadios de maduración y orientación, dependiendo del momento en que fuera estudiado. Entre la zona central, correspondiente al tejido regenerado, y la periférica de tejido tendinoso normal, existía una tercera «de transición» que presentaba características intermedias entre las anteriores y abundante trama vascular (fig. 2). Al año de evolución el tejido regenerado presentaba un grado de organización y orientación de sus fibras superior al observado a los 3 meses, como consecuencia de la evolución del proceso de cicatrización, aunque todavía alejado del patrón de normalidad (fig. 3).
Figura 2. Sección transversal microscópica de un tendón rotuliano a los 3 meses de la operación. A la izquierda puede observarse tejido tendinoso sano, con su microarquitectura normal. A la derecha, el tejido en fase de cicatrización, con peor orientación de las fibras de colágeno y abundante celularidad. Dividiendo ambas está la zona de transición, con elementos vasculares (hematoxilina-eosina, magnificación x400).
Figura 3. Corte histológico de un tendón rotuliano a los 12 meses de la operación. Nótese el mayor grado de organización y homogeneidad del patrón tisular, aunque todavía con alta densidad nuclear (hematoxilina-eosina, magnificaciónx 400).
DISCUSION
Los mecanismos de cicatrización y la morbilidad generada en la zona dadora del injerto del TR han despertado gran interés en los últimos años7,23. Se acepta, en general, que la cicatrización de los defectos creados en el TR, incluso cuando no son suturados, tiene lugar a través de la neoformación de tejido colágeno, que madura progresivamente hasta rellenar toda la cavidad y ser indistinguible del tejido circundante10.
Benedetto et al8 fueron los primeros en recomendar la reutilización del TR en casos de rotura iterativa de plastias de reconstrucción del LCA, al comprobar mediante ecografía que el defecto tendinoso creado previamente estaba totalmente regenerado a los 2 años de la intervención. Nixon et al1 y Meisterling et al12 llegaron a parecidas conclusiones, tras estudiar tendones rotulianos a los que se había extraído su tercio central mediante biopsia y resonancia magnética nuclear (RMN), respectivamente. Sin embargo, más recientemente, Liu et al han cuestionado estos resultados al observar la persistencia del defecto creado en el TR en 6 de 16 rodillas intervenidas para reconstruir el LCA19.
En el terreno experimental, Burks et al10 demostraron en un modelo canino que a los 3 meses de evolución existía una disminución de la resistencia y rigidez del 70% en el TR intervenido. Resultados semejantes obtuvieron Kamps et al11 y Monllau18 en conejos, a los que la extracción del tercio central del TR produjo una disminución global de la resistencia del tendón residual al 72% del control. Por su parte, Beynnon et al9, en un modelo similar, observaron que los valores de resistencia del tendón operado oscilaban desde un 53% en el tiempo cero del experimento, hasta un 72% a los 6 meses de la operación, por lo que concluyeron que la resistencia parecía evolucionar hacia la normalidad a medida que el tiempo de curación avanzaba.
El presente estudio, al igual que los precedentes9-11,18, demuestra que en el conejo existe una disminución significativa de las propiedades biomecánicas del TR intervenido respecto del tejido original, a los 3 meses de la extracción de un tercio de su masa. Aunque es manifiesta una tendencia a la mejoría, estos parámetros siguen alterados al año de evolución, lo que demuestra que el tejido neoformado no ha adquirido todavía las cualidades estructurales previas a la cirugía. Este último dato está en la misma línea de las recientes observaciones de Proctor et al que, en un modelo caprino, determinaron específicamente las propiedades biomecánicas del tejido regenerado en el tercio central del TR a los 21 meses de la cirugía, demostrando que la resistencia del tejido neoformado sólo alcanzaba el 50% de su control6.
El proceso de reorientación o remodelación de las fibras colágenas es el responsable del incremento progresivo de las propiedades biomecánicas del tendón lesionado14. El estudio histológico realizado en este trabajo muestra un tejido cicatrizal exuberante, con un área de sección de más del doble que su control sano, con un grado de organización tisular que mejora con el tiempo, aunque persiste desorganizado al año de evolución. Los resultados de la histología parecen correlacionarse directamente con las propiedades mecánicas observadas en los diferentes intervalos.
En el momento de diseñar el presente estudio se decidió dejar abierto, sin suturar, el defecto creado en el TR aproximando únicamente los bordes del paratenon, como hacen muchos autores en clínica humana. Recientemente, se ha sugerido que la sutura directa del defecto tendinoso podría influir positivamente en el proceso de cicatrización mejorando los resultados histológicos23. Sin embargo, queda por confirmar si esta maniobra conduce también a un incremento de las cualidades biomecánicas del tendón intervenido.
Pese a que las roturas del TR secundarias a la extracción de injertos hueso-tendón-hueso (H-T-H) son raras, otros problemas directamente atribuibles a la morbilidad que se genera en la zona dadora del injerto, como son las tendinitis, cambios de la longitud del tendón y algias femoropatelares, son ciertamente frecuentes. Las alteraciones evidenciadas en las propiedades estructurales y la histología del neotendón en proceso de cicatrización en el presente modelo pueden contribuir a explicarlas. Por otra parte, estos datos sugieren que al menos durante 1 año la reutilización del TR de estos animales previamente intervenido para extraer nuevos injertos H-T-H, podría resultar en injertos más débiles que los procedentes de un tendón original inalterado.
AGRADECIMIENTOS
Al doctor Joan Vila Domenech, bioestadístico de l'Institut Municipal d'Investigació Mèdica (IMIM), por su inestimable colaboración en el procesamiento estadístico de datos.